电子传递链对阿尔兹海默病的影响分析
2024-06-23宋向虎李雪卉庞朝阳魏彦玉
宋向虎 李雪卉 庞朝阳 魏彦玉
摘要:阿尔兹海默病(Alzheimers disease,AD)是一种神经退行性疾病.临床上以记忆障碍、视空间技能损害、执行功能障碍以及人格行为改变等全面性痴呆表现为特征.AD致病源现今不明确,其中有毒物质损害使得脑内区域性能量代谢减退是AD发生的病因特征之一,而电子传递链(ETC)在能量代谢中扮演着重要角色.通过差异分析(LIMMA)及加权基因共表达网络(WGCNA)构建获得聚类基因,并对聚类后基因进行生理分析(GO)、通路分析(KEGG)后锁定ETC,以及对其进行表达量分析及相关系数矩阵的构建,并结合临床指标(MMSE)解释说明,最终验证了ETC的异常对阿尔兹海默病存在影响的事实.
关键词:差异分析; 加权基因共表达网络; 相关系数矩阵; 电子传递链
中图分类号:Q811.4 文献标志码:A 文章编号:1001-8395(2024)05-0662-08
doi:10.3969/j.issn.1001-8395.2024.
阿尔兹海默病(Alzheimers disease,AD)是一种多因素疾病[1-4],其临床表现为记忆丧失、视空间障碍、人格行为改变等全面性痴呆特征.在众多的成因中,能量代谢[5-6]一直作为研究的前沿.成年人脑中含有860亿神经元,而每个神经元都需要能量来维持人体正常生理机能的运转,因此大脑消耗的能量巨大[7].能量产生的方式有厌氧糖酵解、戊糖磷酸途径、柠檬酸循环和线粒体阶段的电子传递链(electron transport chain,ETC)等[8-10],众多途径完成了人体能量的产生及运转.
ETC在能量代谢中扮演着重要的角色[11-12],是众多产能途径中产能最多的一个途径,ETC是通过一系列的氢和电子传递效应所构成的连续反应体系,并在此过程中伴随着能量的释放和物质的转移.该体系一共包含了4个复合体[13-14]:复合体I是NADH和辅酶Q氧化还原复合体[15],完成一系列氧化还原操作后将电子传递给辅酶Q,复合体I接受NADH的电子并将其转化为泛醌;复合体II含有琥珀酸脱氢酶,将琥珀酸的电子转移为泛醌[16];复合体III是细胞色素c还原酶复合体[17],复合体III具有质子泵功能,将从复合体I和II得到的部分电子继续传递,剩余电子加入循环,复合体III含有细胞色素b和铁硫蛋白,将泛醌的电子转移到细胞色素c;复合体IV是细胞色素c氧化还原酶复合体[18],它含有细胞色素a、b和c,为合成水,将电子传递给一分子氧和两分子水,并伴随巨大能量的产生,这就是整个氧化还原[19-20]的过程.在众多阶段中,ETC处于产能后期并伴随大量能量的诞生,大量能量也将维持人脑神经元的正常生理功能[21-22].因此,可知ETC在所有产能途径中的重要性.本文的目的在于通过生物信息学手段对上万个基因进行过滤及筛选找出目标基因,并对筛选后目标基因网络进行分析并最终总结出ETC与AD之间存在的关系.
1 材料和方法
1.1 数据获取及预处理 本文使用公开的基因表达数据集(https://www.ncbi.nlm.nih.gov/geo/)中下载的GSE1297数据集.GSE1297数据集是使用GPL96平台获取的,该数据集包含了31名患者(9名正常、7名轻度、8名中度、7名重度)总共2万多个基因,以及不同的临床特征,如年龄、性别、临床病情评分数据(MMSE、BRAAK)等.
获取数据集后,对数据集进行预处理操作并保留多版本进行实验使用.第一版保留其原始数据;第二版将所有数据对数化处理,以2为基数对序列中的每个数据进行对数运算,该操作可减少噪声对于数据的影响;第三版对原始数据进行标准化处理,以ZScore归一化算法作用于序列输出标准化数据.以上处理后数据将在实验不同阶段进行使用.
1.2 研究步骤及方法
1.2.1 研究内容 在本次研究中将以双路径交集原则来寻找关键基因,该方法寻找到的目标基因将更为准确及有效.路径一使用LIMMA差异分析得到差异基因;路径二使用WGCNA构建网络筛选关键模块.最终,通过富集分析得到研究的目标基因,并锁定研究重点为ETC. 之后,对ETC以多个维度分析其与AD之间存在的关系.维度一:表达量分析可以清晰观察基因网络在AD不同阶段表达量变化情况;维度二:临床指标线性拟合图可以观察表达水平和现实临床情况的变化趋势;维度三:相关性分析可以对比正常情况与重度情况下基因网络间相关性变化水平.通过多维度分析,推断出本次研究关于ETC与AD之间存在的内在联系.
1.2.2 LIMMA差异分析 差异分析的原则是确定组间差异是否显著大于组内差异,其本质是广义线性模型,LIMMA差异分析将对每个基因的表达量拟合出一个线性方程.差异分析的目的在于判断样本间所存在的差异性,确定差异基因,所研究的目标基因便是由差异基因深入挖掘得到.
1.2.3 相关性分析 相关性分析是指分析同一位置的2个或多个变量之间相关性的统计分析方法.我们使用皮尔逊相关系数法进行相关性计算,该方法用于反映2个变量A和B的线性相关性.相关性值在-1~1之间,相关性绝对值越大,变量相关性越强.
1.2.4 加权基因共表达网络(WGCNA)分析 加权基因共表达网络分析是用来描述不同样本之间基因相关性的系统生物学方法,主要步骤包括相关系数计算、基因模块确定、共表达网络构建、模块与性状相关性筛选.方法目的在于寻找协同表达的基因模块.在本实验中,使用临床评分系数指标BRAAK、MMSE作为将模块与性状关联的指标参考值.通过模块内聚类和临床评分指标相关联程度筛选出重点研究模块.
1.2.5 富集分析(GO、KEGG) 富集分析指将基因按照已验证知识,对筛选后基因进行具体分类的过程.富集分析后的基因将表现出部分共性,通过富集分析可判断指定基因群所具有的功能特性.
GO数据库的全称是基因本体论(gene ontology,GO),它将基因分为3类:细胞成分(cellular component,CC)、分子功能(molecular function,MF)和生物过程(biological process,BP).KEGG数据库是一个用于路径(pathway)比较的数据库.GO分析和KEGG分析便是针对基于不同分类思想而储存的基因相关功能的数据库进行的富集分析.通过GO分析,可以了解基因在这3类中的作用,通过KEGG分析,可以知道各基因间路径关系.
1.2.6 临床评分指标(MMSE、BRAAK) 临床评分指标指的是迷你精神状态检查( mini-mental state examination,MMSE)评分和大脑衰老与再生动力学(brain aging and regeneration kinetics,BRAAK)的分期.其中,MMSE评分越低,痴呆程度越高;BRAAK分期越高,淀粉样斑块和神经原纤维缠结越多,神经元死亡越严重.在本文中,将样本数据与MMSE、BRAAK指标相结合来筛选和研究基因与AD的关系.
2 基因网络确认与数据分析
2.1 基因网络寻找
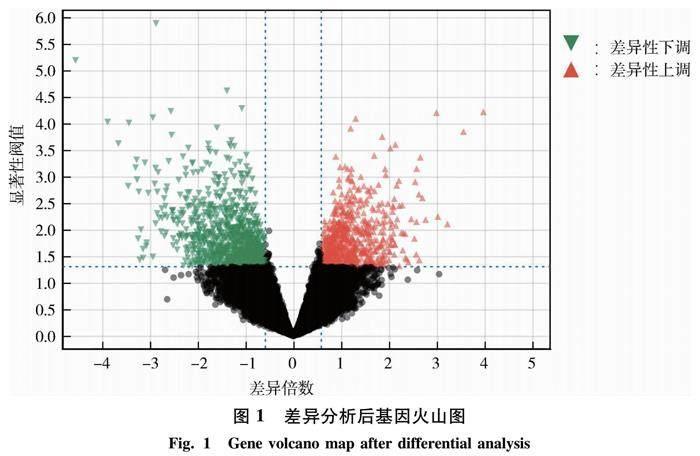
2.1.1 差异基因表达分析 输入经过对数化处理后的GSE1297数据集(样本数为31个,基因数为22 283个),并将正常情况样本(样本数为9)设置为对照组,严重情况样本(样本数为7)设置为实验组进行差异分析,选择差异倍数为1.5,显著性阈值<0.05,并以Benjamini-Hochberg作为校正方法,最终得到了1 717个差异基因(图1),其中748个基因呈现上调的趋势,969个基因呈现下降的趋势.
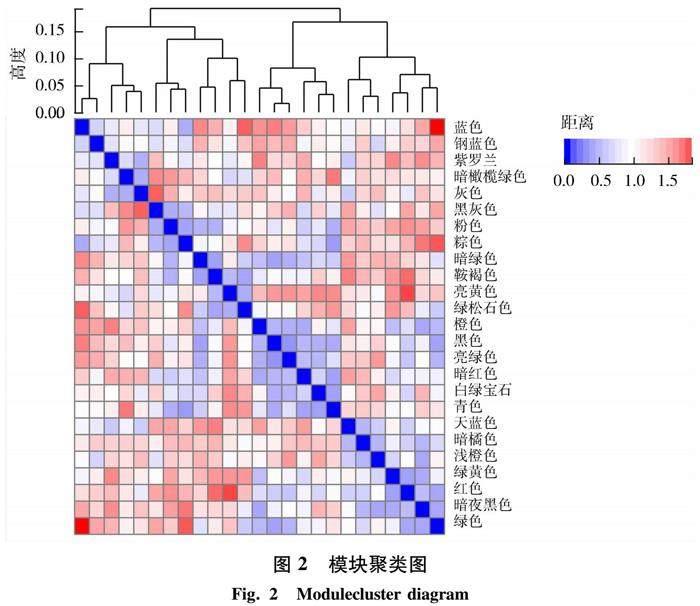
2.1.2 共表达网络构建与分析 输入经过对数化处理后的GSE1297数据集来构建共表达网络(样本数为31个,基因数为22 283个),并设置灵敏度为3,模
块合并阈值为0.25,最终聚类得到共25个模块(图2),模块间关联程度使用距离进行表示,其值的大小表示该模块与其他模块间关联的程度,值与颜色对应,颜色程度越接近表明了模块间相关性越强.
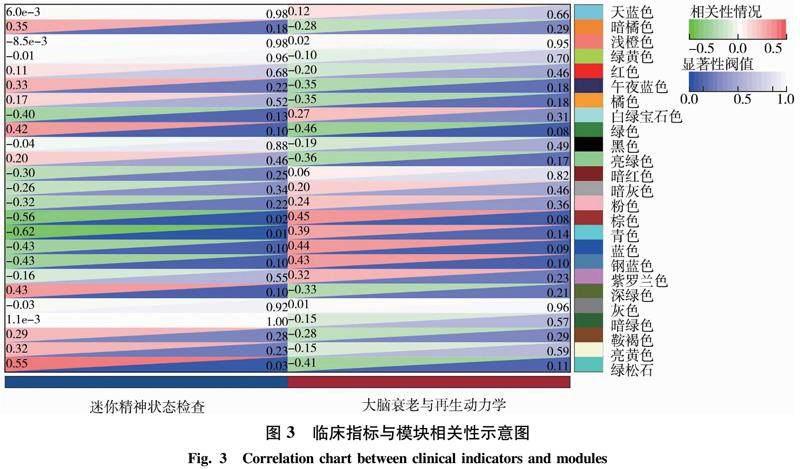
为了进一步确定重点模块,在此基础上将样本中MMSE和BRAAK临床评分作为指标,计算各模块与临床评分指标之间的相关性(图3),这样便于筛选出与疾病最有关联的模块.最终,选择了最明显的4个共表达模块(棕色、绿色、青色、绿松石),使用0.8 mm阈值、0.1 gs阈值和0.1重量阈值从4个表达模块中提取关键基因,最终棕色模块基因有57个、绿色模块基因有173个、青色模块基因有33个、绿松石模块基因有478个.而通过分析其相关性绝对值及对应目标基因,最终将目光锁定在绿松石模块作为重点研究模块.后续的研究将以绿松石模块继续深入锁定基因网络并多维度进行分析解释其生理机制.
2.1.3 GO和KEGG分析 在前面研究的基础上,对从LIMMA差异分析获得的差异基因和加权基因共表达网络(WGCNA)的绿松石模块分别进行了GO和KEGG富集分析,使用Benjamini-Hochberg作为FDR方法,以显著性阈值小于0.05进行筛选,得到了2条路径的两类GO和KEGG分析结果如图4所示,该序列图的纵坐标表示聚类后基因在生理上所属的类别,横坐标表示该类别基因占比情况.点的大小表示聚类基因数量关系.
有趣的是,差异基因与绿松石模块经过GO和KEGG分析的结果可知其与神经性疾病和能量代谢存在着高度相关,于是深入到模块内寻找,发现2种筛选结果存在着交集基因,并且分布于ETC各个复合体中.这说明ETC在神经性疾病中扮演着重要的角色,这也表明了研究的正确性,于是将相同基因提取作为研究重点,提取NDUFA5(复合体I)、NDUFB5(复合体I)、SDHB(复合体II)、UQCRC1(复合体III)和COX7C(复合体IV),并以此5个基因作为一个基因网络进行后续研究和分析.
2.2 基因网络分析
2.2.1 表达量分析 表达量分析可以直观地了解AD各个阶段表达量的变化情况,从而推断出病情在该阶段的生物活性.使用标准化后的数据集,将每个阶段的表达水平的总和与该阶段样本数量做商表示该阶段的平均样本表达水平. 通过表1可直观地发现,5个基因随着AD病情的加重其表达水平是持续递减的.表达量的递减说明各复合体随着AD病情的
加重复合体基因数量在逐渐减少,而减少的基因将影响复合体正常的生理功能,将导致ETC中各个环节传递物质的减少,也使每个阶段所转移的电子数量减少,而电子数量的减少最终也会导致整个氧化还原过程所产生能量的减少.能量供应的不足使神经元大量死亡,从而使人体受到了损害.
2.2.2 各复合体亚基表达水平与临床指标的关系将各亚基的表达水平作为横轴,临床指标MMSE作为纵轴,绘制各复合体亚基表达水平与临床指标MMSE线性拟合图(图5),可明显观察出各复合体与AD的关系.通过图5可以发现,病情与各复合体的表达水平是呈比例变化的,这可以说明各复合体基因对于评判AD病情是有依据的,当表达量逐渐减少时,患者的痴呆程度越来越严重.
2.2.3 复合体相关性分析 相关性分析是指对同一位置的2个或多个变量之间的相关性进行分析的统计分析方法.在这项研究中,使用皮尔逊相关系数方法进行相关性分析,该方法用于反映2个变量A和B之间的线性相关性,r值在-1~1之间,绝对值越大表示相关性越强.
输入GSE1297数据集的正常阶段计算正常情况下的相关系数矩阵(图6),矩阵图横纵坐标表示基因名称,颜色深浅表示相关性水平.通过图6可以观察各个基因之间存在着较高的相关性,这表明了复合体之间相互存在高度联系,这也符合客观事实,复合体I到IV之间存在着不同程度的物质交换,并将电子依次传递给后者,它们共同的运作完成了整个ETC.
接着输入GSE1297数据集的严重阶段计算严重情况下的相关系数矩阵(图7),通过图7可以发现除个别基因间相关性有减少,几乎所有基因之间相关性都在上升,复合体之间的相关性较正常情况下得到了提升,这说明了他们在疾病情况下互相间的影响是更为强烈的,因为ETC的每个复合体之间是环环相扣的,当某一部分复合体出现问题后,将会影响其他复合体的正常生理功能,所以导致病情越来越严重.
3 探讨与假说
能量代谢在AD中起着重要作用.各项研究表明,人脑含有大量的神经元细胞,当能量供应出现问题后会导致大量神经元细胞的死亡,从而影响AD的发生.本研究深入能量代谢的关键环节——ETC,通过LIMMA差异分析和WGCNA双路径寻找并锁定关键基因,构成了基因闭环(复合体I:NDUFA5,NDUFB5;复合体II:SDHB;复合体III:UQCRC1;复合体IV:COX7C).
通过表达量分析,可以知道该闭环基因群随着病情的加重其各个基因的表达水平是递减,这说明AD的发生影响着各个基因正常的生理功能,而ETC的主要作用在于物质传递与电子转移,并在结尾阶段发生氧化还原反应释放大量的能量供人体所需,表达量的减少导致产生能量的减少,从而影响人体正常生理功能.在正常情况下,基因群各基因保持较高相关性,该现象是因为ETC是一个依次传递的模式,所以在正常情况下它们各基因间存在着相互作用,但是在疾病严重阶段,它们相关性都得到提升,这能够说明随着病情的加重,当某一复合体出现问题后,它将影响其他复合体的生理功能,从而使得整个系统受到影响.
于是提出ETC与AD关系的假说,当毒性物质的累积导致线粒体损伤和能量供应减少后诱发AD的发生,AD的出现影响了ETC整个物质传递与电子转移的功能,各个复合体的表达量都减少,使得整个系统各环节物质传递及电子转移数量减少,当氧化还原反应所需物质与电子数量过少情况下,最终环节产生能量的数量过少,这直接使得大脑神经元能量供给不足,从而导致了神经元的死亡,并间接使得AD的病情越来越重.
4 结论
阿尔兹海默病(AD)是最常见的神经退行性疾病,其特征是有毒物质的损害.毒性的积累导致线粒体损伤和能量供应减少.在线粒体中,ETC是能量供应的主要环节,人体内大部分能量由ETC提供.本文提出假说随着AD病发的出现,ETC的4个复合体正常的生理功能受到了影响,活性开始下降.ETC所传递的物质与电子数量开始减少,最终使得在ETC末端产生能量数量减少,而大脑活动需要消耗巨大能量,能量供应不足导致神经元开始死亡,使整个病情越发严重,最终导致AD的病情走向严重期,甚至导致患者并发症和死亡的出现.
参考文献
[1] DUBOIS B, HAMPEL H, FELDMAN H H, et al. Preclinical Alzheimers disease: definition, natural history, and diagnostic criteria[J]. Alzheimers & Dementia,2016,12(3):292-323.
[2] HAMPEL H, VERGALLO A, AGUILAR L F, et al. Precision pharmacology for Alzheimers disease[J]. Pharmacological Research,2018,130:331-365.
[3] XIONG J, PANG X P, SONG X H, et al. The coherence between PSMC6 and α-ring in the 26S proteasome is associated with Alzheimers disease[J]. Frontiers in Molecular Neuroscience,2024,16:1330853.
[4] YANG L, PANG X P, GUO W B, et al. An exploration of the coherent effects between METTL3 and NDUFA10 on Alzheimers disease[J]. International Journal of Molecular Sciences,2023,24(12):10111.
[5] 胡钰慧,何玲. 线粒体功能障碍与阿尔兹海默病发病的相关性研究进展[J]. 药学研究,2020,39(2):101-104.
[6] SHAKIR M N, DUGGER B N. Advances in deep neuropathological phenotyping of Alzheimers disease: past, present, and future[J]. Journal of Neuropathology and Experimental Neurology,2022,81(1):2-15.
[7] 姜红升,尹博文,尹立勇,等. 神经元表达下调基因9在人脑胶质瘤中的表达[J]. 河北医科大学学报,2018,39(7):787-791.
[8] MAILLOUX R J, BRIAULT R, LEMIRE J, et al. The tricarboxylic acid cycle, an ancient metabolic network with a novel twist[J]. PLoS One,2007,2(8):e690.
[9] 邱小忠,陈瑗,周玫. 线粒体氧应激损伤的防御体系[J]. 生命的化学,2001,21(2):141-143.
[10] ZHANG X, ALSHAKHSHIR N, ZHAO L Q. Glycolytic metabolism, brain resilience, and Alzheimers disease[J]. Frontiers in Neuroscience,2021,15:662242.
[11] GUAN S T, ZHAO L, PENG R Y. Mitochondrial respiratory chain super complexes: from structure to function[J]. International Journal of Molecular Sciences,2022,23(22):13880.
[12] NESCI S, TROMBETTI F, PAGLIARANI A, et al. Molecular and supramolecular structure of the mitochondrial oxidative phosphorylation system: implications for pathology[J]. Life,2021,11(3):242.
[13] DU Z Q, ZHOU X T, LAI Y Z, et al. Structure of the human respiratory complex II[J]. Proceedings of the National Academy of Sciences of the United States of America,2023,120(18):e2216713120.
[14] IAKOVOU E, KOURTI M. A comprehensive overview of the complex role of oxidative stress in aging, the contributing environmental stressors and emerging antioxidant therapeutic interventions[J]. Frontiers in Aging Neuroscience,2022,14:827900.
[15] KAILA V R I. Long-range proton-coupled electron transfer in biological energy conversion: towards mechanistic understanding of respiratory complex I[J]. Journal of the Royal Society: Interface,2018,15(141):20170916.
[16] MARKEVICH N I, GALIMOVA M H, MARKEVICH L N. Hysteresis and bistability in the succinate-CoQ reductase activity and reactive oxygen species production in the mitochondrial respiratory complex II[J]. Redox Biology,2020,37:101630.
[17] BRZEZINSKI P, MOE A, DELROTH P. Structure and mechanism of respiratory III-IV super complexes in bioenergetic membranes[J]. Chemical Reviews,2021,121(15):9644-9673.
[18] ADAMOWICZ-SKRZYPKOWSKA A, KWASNIAK-OWCZAREK M, VAN AKEN O, et al. Joint inhibition of mitochondrial complex IV and alternative oxidase by genetic or chemical means represses chloroplast transcription in Arabidopsis[J]. Philosophical Transactions of the Royal Society of London Series B: Biological Sciences,2020,375(1801):20190409.
[19] 张艳馥,沙伟. 氧化磷酸化作用及其解偶联剂[J]. 生物学教学,2007,32(8):66-67.
[20] ADIELE R C, ADIELE C A. Mitochondrial regulatory pathways in the pathogenesis of Alzheimers disease[J]. Journal of Alzheimers Disease,2016,53(4):1257-1270.
[21] YU Y G, AKIF A, HERMAN P, et al. A 3D atlas of functional human brain energetic connectome based on neuropil distribution[J]. Cerebral Cortex,2023,33(7):3996-4012.
[22] ARDANAZ C G, RAMREZ M J, SOLAS M. Brain metabolic alterations in Alzheimers disease[J]. International Journal of Molecular Sciences,2022,23(7):3785.
Analysis of the Impact of Electronic Transport Chainson Alzheimers Disease
SONG Xianghu1, LI Xuehui2, PANG Chaoyang 1, WEI Yanyu 2
(1. School of Computer Science, Sichuan Normal University, Chengdu 610101, Sichuan;
2. National Key Laboratory of Science and Technology on Vacuum Electronics, School of Electronic Science and Engineering,University of Electronic Science and Technology of China, Chengdu 611731, Sichuan)
Abstract:Alzheimers disease is a neurodegenerative disease. In clinical manifestations, comprehensive dementia is characterized by memory impairment, impaired visual spatial skills, and executive dysfunction, as well as personality and behavioral changes. The etiology of AD is diverse and currently unclear. The damage by toxic substances leading to regional energy metabolism decline in the brain is one of the etiological features of AD. Electron transfer chain plays an important role in energy metabolism. Cluster genes were obtained through differential analysis (LIMMA) and weighted gene co expression network (WGNCA) construction, and the clustered genes were subjected to physiological analysis (GO) and pathway analysis (KEGG) before locking in ETC. The expression level analysis and construction of correlation coefficient matrix were conducted on it, and combined with clinical indicators (MMSE) explanation, so that the abnormality of ETC has an impact on Alzheimers disease was ultimately verified.
Keywords:differential analysis; weighted gene co expression network; correlation coefficient matrix; electronic transfer chain
(编辑 余 毅)
项目基金:国家自然科学基金(61988102)
*通信作者简介:庞朝阳(1970—),男,教授,主要从事算法分析设计与数据挖掘的研究,E-mail:cypang@sicnu.edu.cn
魏彦玉(1971—),男,教授,长江学者,主要从事医学相关的交叉学科的研究,E-mail:yywei@uestc.edu.cn
引用格式:宋向虎,李雪卉,庞朝阳,等. 电子传递链对阿尔兹海默病的影响分析[J]. 四川师范大学学报(自然科学版),2024,47(5):662-669.
