芽胞杆菌JZB30 1的鉴定及其对番茄灰霉病的生防作用
2024-06-08赵娟左文杰张殿朋秦文韬卢彩鸽
赵娟 左文杰 张殿朋 秦文韬 卢彩鸽


摘要
为获得对番茄灰霉病具有良好防效的生防芽胞杆菌,采用对峙培养、双层平板以及生防相关特性检测等方法筛选高活性拮抗菌株,根据形态学、生理生化特性及多基因测序进行菌株种类鉴定,通过离体果实和盆栽试验明确供试菌株的防病促生效果。结果表明,芽胞杆菌JZB301對番茄灰霉病菌等10余种植物病原真菌和细菌具有广谱抑菌活性;该菌株具有合成蛋白酶、纤维素酶、脂肽类物质,分泌铁载体、生长激素及溶磷等特性,经鉴定其为解淀粉芽胞杆菌Bacillus amyloliquefaciens;菌株JZB301无菌发酵滤液50倍液喷施处理,对番茄果实灰霉病防效为95.0%,发酵液10倍稀释液灌根,番茄株高、鲜重分别较对照增加25.7%和28.4%。相关结果为利用解淀粉芽胞杆菌JZB301进行番茄灰霉病生物防治提供理论依据。
关键词
番茄灰霉病; 解淀粉芽胞杆菌; 抑菌活性; 功能基因; 生物防治
中图分类号:
S 476
文献标识码: A
DOI: 10.16688/j.zwbh.2023160
Identification of Bacillus strain JZB301 and its biological control effect on tomato grey mould
ZHAO Juan1,2, ZUO Wenjie1,3, ZHANG Dianpeng1,2, QIN Wentao1,2, LU Caige1,2*
(1. Institute of Plant Protection, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097, China; 2. Key
Laboratory of EnvironmentFriendly Management on Fruit and Vegetable Pests in North China (Coconstruction by
Ministry and Province), Ministry of Agriculture and Rural Affairs, Beijing 100097, China; 3. College of Bioscience,
Resources and Environment, Beijing University of Agriculture, Beijing 102206, China)
Abstract
To obtain a Bacillus strain with significant control effect on tomato grey mould, antagonistic bacteria were screened by confrontation culture and twolayer plate methods, along with the detection of characteristics related to biocontrol. Its taxonomic status was identified based on morphological features, physiologicalbiochemical characteristics, and multiple gene sequences analyses. The diseaseprevention and growth promotion effects of the obtained strain were evaluated by applying the fermentation filtrate of the strain to tomato fruits and potted tomato seedlings, respectively. The results showed that Bacillus strain JZB301 exhibited an obvious inhibitory effect on Botrytis cinerea, as well as broadspectrum antifungal and antibacterial activities against more than ten plant pathogens. The strain was identified as Bacillus amyloliquefaciens, which have features of synthesizing protease, cellulase and lipopeptide
, secreting siderophore, indoleacetic acid and solubilizing phosphate. The 50fold sterile fermention filtrate of JZB301 displayed an obvious biocontrol effect on tomato fruit grey mould, with a 95.0% reduction in disease incidence compared to the control. In addition, the plant height and fresh weight increased by 25.7% and 28.4%, respectively, after rootirrigation with a 10fold dilution of the fermentation. The study provides a theoretical foundation for considering B.amyloliquefaciens strain JZB301 as a potential biocontrol strain against tomato grey mould.
Key words
tomato grey mould; Bacillus amyloliquefaciens; antagonistic activity; functional genes; biological control
由灰葡萄孢Botrytis cinerea侵染引起的灰霉病是保护地番茄栽培中常见真菌病害。灰葡萄孢可侵染番茄的茎、叶、花、果实,常导致大面积减产从而给种植户造成巨大经济损失[1]。目前化学防治仍然是生产上防控番茄灰霉病的主要措施,但容易引起病原菌抗药性、生态环境污染等一系列问题。生物防治因具有不易产生抗药性、对环境安全友好等特点,已逐渐成为番茄灰霉病等果蔬病害绿色防控的有效替代措施。目前已有木霉[2]、链霉菌[3]等生防微生物用于抑制灰葡萄孢的报道。芽胞杆菌可以产生抗高温、抗紫外线辐射的芽胞,具有抗逆性强、抑菌谱广、繁殖快、安全性高等优点,是广泛应用于农业生产的重要生防菌类群[4]。朱明明等[5]的研究表明,分离自马铃薯健康植株根际土壤的贝莱斯芽胞杆菌Bacillus velezensis对马铃薯黑痣病具有明显抑制效果。方佩等[6]筛选出一株对黄瓜灰霉病具有良好盆栽防效的海洋芽胞杆菌Jeotgalibacillus marinus,该菌株发酵上清液能够抑制灰霉病菌孢子萌发,导致菌丝畸形以及原生质体外渗。微生物生理生化特性中与植物健康生长相关的一些特性是评价其生防潜力的关键方面[78]。芽胞杆菌产生的一些胞外酶和抗菌蛋白类活性物质,在果蔬作物真菌病害生物防治方面具有巨大应用价值。潘虹余等[9]发现解淀粉芽胞杆菌B.amyloliquefaciens B15菌株产生的伊枯草菌素和芬芥素对葡萄灰霉病菌具有良好抑制效果。筛选具有优良生防活性的功能菌株是植物病害生物防治的前提和关键。作者前期从海南红树林特殊生境分离筛选到多株对番茄灰霉病菌具有拮抗作用的芽胞杆菌,本研究对其中拮抗效果明显且具有广谱抑菌活性的JZB301菌株进行生防相关特性检测、种类鉴定以及防病促生效果评价,以期为番茄等果蔬作物灰霉病生物防治提供生防菌种资源和理论依据。
1 材料与方法
1.1 材料
1.1.1 供试病原菌
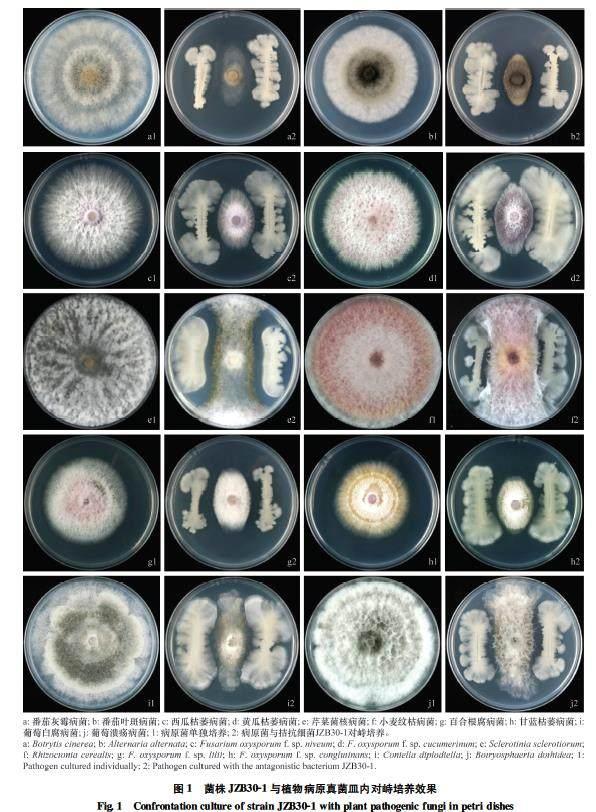
植物病原真菌包括番茄灰霉病菌Botrytis cinerea、番茄叶斑病菌Alternaria alternata、西瓜枯萎病菌Fusarium oxysporum f.sp. niveum、黄瓜枯萎病菌F.oxysporum f.sp. cucumerinum、芹菜菌核病菌Sclerotinia sclerotiorum、小麥纹枯病菌Rhizoctonia cerealis、百合根腐病菌F.oxysporum f.sp. lilii、甘蓝枯萎病菌F.oxysporum f.sp. conglutinans、葡萄白腐病菌Coniella diplodiella、葡萄溃疡病菌Botryosphaeria dothidea、韭菜灰霉病菌Botrytis squamosa、葡萄蔓枯病菌Diaporthe eres、棉铃疫病菌Phytophthora boehmeriae等13种。
植物病原细菌包括黄瓜角斑病菌Pseudomonas syringae、平菇褐斑病菌Pseudomonas tolaasii、大白菜黑腐病菌Xanthomonas campestris pv. campestris、茄子青枯病菌Ralstonia solanacearum、辣椒疮痂病菌Xanthomonas campestris pv. vesicatoria、芒果细菌性角斑病菌Xanthomonas campestris pv. mangiferaeindicae等6种。
上述供试病原菌由北京市农林科学院植物保护研究所、生物技术研究所和河北省农林科学院植物保护研究所提供。
番茄品种为‘硬粉8号,购自京研益农北京种业科技有限公司。
1.1.2 供试培养基及试剂
细菌分离培养采用LB培养基、KB培养基和NA培养基,病原真菌培养采用PDA培养基[10]。菌株蛋白酶、纤维素酶分泌活性检测采用蛋白酶检测培养基[11]、纤维素酶检测培养基[12],溶磷活性检测采用无机磷培养基[13],产铁载体活性检测采用CAS培养基[14],IAA活性检测采用DF培养基及Salkowski比色液[15]。
1.2 方法
1.2.1 土壤芽胞桿菌的分离纯化
采用稀释平板分离法[10]对采集自海南红树林土壤中的芽胞杆菌进行分离。取风干后的供试土壤10 g放入含90 mL无菌水的三角瓶中,混合均匀后将稀释液在85℃的水浴锅中水浴30 min。用无菌水稀释成10-3、10-4、10-5、10-6的土壤稀释液,吸取100 μL各稀释液均匀涂布于NA平板,置于28℃恒温培养箱中黑暗培养24 h,挑取菌落形态差异明显的单菌落划线纯化,纯化后的菌株保存于4℃冰箱备用。
1.2.2 拮抗菌株抑菌谱测定
采用琼脂块法从分离获得的芽胞杆菌中筛选对番茄灰霉病菌具有拮抗活性的菌株。选取拮抗效果显著的菌株采用对峙培养法[16]测定其对番茄叶斑病菌等13种植物病原真菌的抑制活性;采用双层平板法[17]测定其对黄瓜角斑病菌等6种植物病原细菌的抑制活性。将直径6 mm的靶标病原真菌菌饼接种在PDA培养基中央,待测菌株划线接种在病原菌两侧距离中心位置2 cm处,28℃培养4 d后测量供试菌株对靶标病原的抑菌带宽度,统计其对病原真菌的抑菌谱。将待测菌株点接于KB平板上28℃培养40 h,用3 mL氯仿熏蒸杀死细菌菌体,静置10~12 h待氯仿挥发完全后,将100 μL靶标病原细菌菌悬液(108 cfu/mL)与3 mL融化并冷却至50℃的水琼脂迅速混匀,倒入上述平板铺成均匀薄层,28℃培养36 h后观察待测菌株代谢产物对病原细菌的抑菌效果并测量抑菌圈直径。
1.2.3 拮抗菌株形态观察和生理生化特性测定
将筛选获得的芽胞杆菌菌株接种LB平板并于28℃恒温培养48 h,观察菌落形状、颜色、质地等特征,进行革兰氏染色和显微形态观察。参照《常见细菌系统鉴定手册》对菌株进行生理生化指标测定,包括碳源利用、甲基红和VP试验、硝酸盐还原、明胶液化、淀粉水解和H2S产生等[18]。
1.2.4 拮抗菌株多基因测序分析及进化树构建
挑取纯化后的芽胞杆菌单菌落至LB液体培养基中,28℃、180 r/min振荡培养24 h后收集菌体,使用细菌基因组DNA提取试剂盒(索莱宝)提取菌株基因组DNA。采用引物对27F(5′AGAGTTTGATCCTGGCTCAG3′)/1492R(5′TACGGTTACCTTGTTACGACTT3′)扩增菌株16S rDNA基因[19],通过序列比对初步确定细菌属级水平的分类地位。采用引物对gyrAF(5′CAGTCAGGAAATGCGTACGTCCTT3′)/gyrAR(5′CAAGGTAATGCTCCAGGCATTGCT3′)[20]和rpoBF(5′AGGTCAACTAGTTCAGTATGGAC3′)/rpoBR(5′AAGAACCGTAACCGGCAACTT3′)[21]分别对该菌株看家基因gyrA和rpoB进行PCR扩增从而明确待测菌株种级分类地位。
PCR反应体系总体积25 μL,包含2×Taq PCR Master Mix 12.5 μL,ddH2O 10.5 μL,正、反向引物各0.5 μL和模板DNA 1 μL。16S rDNA基因PCR反应程序:94℃预变性4 min;94℃变性30 s,50℃退火1 min,72℃延伸1 min30 s,35个循环;72℃延伸10 min。gyrA基因PCR反应程序:95℃预变性4 min;95℃变性10 s,62℃退火1 min,72℃延伸2 min,30个循环;72℃延伸8 min。rpoB基因PCR反应程序:94℃预变性2 min;94℃变性30 s,50℃退火45 s,68℃延伸40 s,30个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后,委托北京天一辉远生物科技有限公司进行序列测定。所获序列通过NCBI进行BLAST同源性搜索,并下载相关菌株对应基因序列。Clustal X 软件进行多序列比对,将菌株16S rDNA、gyrA和rpoB基因采用Bioedit软件拼接后,采用PAUP 4.0b10软件中的最大简约法(maximum parsimony,MP)进行聚类分析确定待鉴定菌株的种类归属。
1.2.5 拮抗菌株生防相关代谢产物的测定
将待测菌株分别接种于蛋白酶、纤维素酶、铁载体以及无机磷检测培养基上,每个菌株3次重复,28℃条件下培养3 d后观察菌落周围是否有透明圈及其直径大小,评价菌株产蛋白酶、纤维素酶、铁载体以及溶磷活性。配制不同浓度梯度的吲哚乙酸(IAA)标准溶液,检测其在530 nm处吸光度并绘制IAA标准曲线。将菌株接种于含500 μg/mL色氨酸或不含色氨酸的DF基本培养基中28℃培养48 h。将获得的培养液1 2000 r/min离心10 min,取2 mL上清液于试管中加入Salkowski 比色液,避光放置30 min后根据颜色变化及吸光度,检测菌株是否具有产IAA活性及IAA含量[15]。
1.2.6 拮抗菌株生防相关功能基因扩增
利用表1所示引物序列及条件[2223]对供试菌株进行脂肽类抗生素合成酶相关基因PCR扩增检测,包括抗霉枯草菌素合成相关基因(mycB)、丰原素合成相关基因(fenB)、伊枯草菌素A合成相关基因(ituA)、表面活性素合成调控基因(sfp)。采用1%琼脂糖凝胶电泳对扩增产物及其片段大小进行检测,并委托北京天一辉远生物科技有限公司进行序列测定,所获序列通过NCBI的BLAST工具進行序列比对和搜索。
1.2.7 拮抗菌株对番茄防病促生效果评价
拮抗菌株发酵液的制备:将拮抗菌株接种于LB液体培养基中,28℃、180 r/min振荡培养12 h后,按1%接种量转接于装有100 mL LB液体培养基的三角瓶中,相同条件下培养48 h。获得的发酵液12 000 r/min离心10 min,上清过0.22 μm滤膜获得菌株无菌发酵滤液。
离体防病试验:选取大小且成熟度一致的健康番茄果实,2%(m/V)次氯酸钠消毒3 min,无菌水冲洗干净。用接种针在番茄果实腰部等距离刺伤,伤口晾干后接种10 μL上述制备好的菌株无菌发酵滤液。待无菌发酵滤液完全吸收后,接种10 μL番茄灰霉病菌孢子悬浮液(106个/mL)于相同部位。以无菌水和LB液体培养基代替细菌无菌发酵滤液作为对照,50%啶酰菌胺水分散粒剂1 000倍液为化学药剂对照,10%多抗霉素可湿性粉剂1 000倍液为生物农药对照,每个处理重复3次,25℃保湿培养3 d。根据参考文献描述[24]划分病害严重度等级,统计不同处理病情指数并计算防治效果。病情指数=∑(各级病果数×对应病害严重度等级)/(调查总果数×病害最高严重度等级)×100,防治效果=(对照病情指数-处理病情指数)/对照病情指数×100%。
盆栽促生试验:将番茄种子清水冲洗干净室温浸泡24 h后,放置在铺有2层无菌水浸湿滤纸的培养皿中,25℃恒温培养箱孵育催芽至种子露白进行播种,待番茄幼苗长至两叶一心期将幼苗转移至盆中。移栽10 d后,采用上述菌株发酵液(108 cfu/mL) 10倍稀释液进行灌根处理,每株幼苗灌根10 mL,以LB培养液灌根作为对照,每处理3次重复,每个重复5盆,每盆2株苗。移栽后40 d时随机挑选15株苗,取样调查番茄株高、鲜重、根长及须根数等生物学指标。
1.2.8 数据统计分析
使用Excel 2010计算平均值和标准差,采用SPSS 19.0软件中的最小显著差异法(least significant difference, LSD)进行组间差异显著性分析,t检验(Students ttest)进行两组间差异显著性分析(P<0.05)。
2 结果与分析
2.1 拮抗芽胞杆菌筛选
从海南红树林土壤中分离纯化得到34株芽胞杆菌,通过琼脂块法筛选得到5株对番茄灰霉病菌抑菌效果显著且活性稳定的菌株,其中菌株JZB301的拮抗效果最佳。对峙培养发现JZB301对番茄灰霉病菌、番茄叶斑病菌、西瓜枯萎病菌、黄瓜枯萎病菌、芹菜菌核病菌、小麦纹枯病菌、百合根腐病菌、甘蓝枯萎病菌、葡萄白腐病菌、葡萄溃疡病菌、韭菜灰霉病菌、葡萄蔓枯病菌、棉铃疫病菌等病原真菌具有明显的抑制作用,抑菌带宽度在9.5~15.0 mm,其中对番茄灰霉病菌抑菌带宽度为15.0 mm,对番茄叶斑病菌抑菌带宽度为14.0 mm(表2,图1)。通过双层平板试验发现供试菌株对黄瓜角斑病菌、平菇褐斑病菌、大白菜黑腐病菌、茄子青枯病菌、辣椒疮痂病菌、芒果角斑病菌等具有抑制作用,抑菌圈直径为18.0~50.0 mm,其中对大白菜黑腐病菌和芒果角斑病菌抑菌圈直径分别为50.0 mm和47.0 mm(表2,图2)。
2.2 拮抗芽胞杆菌形态学和生理生化鉴定
供试菌株在NA培养基上28℃培养48 h后,菌落乳白色、圆形,不透明,表面干燥有皱褶,边缘不整齐(图3a和3b)。菌体呈杆状,大小(1.5~4.0) μm×(0.4~0.6) μm,单个或成对,革兰氏染色呈阳性(图3c)。对菌株生理生化特性测定结果表明,该菌株能分解利用葡萄糖、阿拉伯糖、甘露糖、木糖、甘露醇、山梨醇、蔗糖和柠檬酸盐,明胶液化、淀粉水解、VP试验、接触酶试验、硝酸还原反应和硫化氢产生均呈阳性,甲基红试验阴性(表3),根据菌株形态和生理生化特性,参照《常见细菌系统鉴定手册》,初步将菌株鉴定为解淀粉芽胞杆菌Bacillus amyloliquefaciens。
2.3 拮抗芽胞杆菌分子生物学鉴定
以菌株JZB301的基因组DNA为模板,扩增其16S rDNA、gyrA和rpoB基因片段,获得长度分别为1 420,1 010,1 050 bp的序列。通过对基因序列进行BLAST比对发现,菌株JZB301的16S rDNA、gyrA、rpoB基因与解淀粉芽胞杆菌Bacillus amyloliquefaciens和贝莱斯芽胞杆菌B.velezensis对应序列同源性均为100%。利用PAUP 4.0b10软件,以最大简约法(maximum parsimony,MP)构建基于菌株16S rDNA、gyrA、rpoB基因的多基因系统发育树,供试菌株JZB301与B.amyloliquefaciens聚于一起,自展值为90%(图4)。结合形态学观察结果和生理生化特性鉴定结果,确定菌株JZB301为解淀粉芽胞杆菌B.amyloliquefaciens。
2.4 拮抗芽胞杆菌生防相关特性检测
平板产胞外酶和生物活性物质检测结果表明,菌株JZB301在产蛋白酶培养基上能形成直径为(41.3±0.6) mm的透明圈;在羧甲基纤维素钠培养基上能够产生明显的水解圈,其直径为(32.7±1.5) mm;同时菌株JZB301在无机磷培养基上能产生一定的水解圈,说明其具有溶磷活性;在产铁载体活性检测培养基上,该菌株能够快速生长且产生淡橘色的水解圈,说明其具有产铁载体活性(图5)。产生长激素检测结果表明,菌株JZB301在含有500 μg/mL色氨酸的DF培养基中培养96 h时IAA含量为5.86 μg/mL,在不含有色氨酸的DF培养基中IAA产量为1.48 μg/mL。
2.5 脂肽类抗生素合成相关功能基因检测
以菌株JZB301基因组DNA为模板,分别对其抗霉枯草菌素合成相关基因(mycB)、丰原素合成相关基因(fenB)、伊枯草菌素合成相关基因(ituA)和表面活性素合成调控基因(sfp)进行PCR 扩增,1%琼脂糖凝胶电泳检测均能获得对应目标片段(图6)。扩增产物测序后进行BLAST分析,菌株JZB 301的mycB基因与B.amyloliquefaciens JT84的mycB基因(KX351426)相似性为95%;fenB基因与B.amyloliquefaciens菌株YNM3(KP967585)和6256(KP967586)中的fengycin synthetase B基因(fenB)相似性为100%和99%;ituA基因与B.amyloliquefaciens MH71菌株的ituA(KJ452560)相似性为98%;sfp基因与B.amyloliquefaciens H2O1菌株surfactin基因(MK570509)相似性为98%。推测菌株JZB301基因组中可能存在抗霉枯草菌素、丰原素、伊枯草菌素、表面活性素等脂肽类抗生素合成或调控相关基因,说明该菌株具有产生上述脂肽抗生素的潜力。
2.6 拮抗芽胞杆菌对番茄的防病促生效果
在离体条件下测定菌株JZB301发酵液对番茄果实灰霉病的防控效果,结果表明,菌株发酵液50倍稀释液处理能够明显降低番茄果实灰霉病严重程度,防控效果达95.0%,优于50%啶酰菌胺水分散粒剂1 000倍液和10%多抗霉素可湿性粉剂1 000倍液防控效果(表4,图7)。采用菌株JZB301发酵液10倍稀释液进行灌根处理,番茄幼苗株高、鲜重、根长和须根数分别较对照有所增加,其中株高和鲜重分别较对照增加了25.7%和28.4%,差异均达到显著水平(P<0.05)。菌株發酵液10倍稀释液处理,番茄幼苗平均根长由11.0 mm增加到12.7 mm,平均须根数由47条增加到60条。说明供试菌株JZB301对番茄幼苗生长具有良好促进作用(图8)。
3 结论与讨论
本研究从分离自海南红树林特殊生境土壤的芽胞杆菌中,筛选到一株对番茄灰霉病菌具有显著拮抗活性的芽胞杆菌JZB301,该菌株对多种植物病原真菌和病原细菌具有广谱抑菌活性,能够产生胞外酶和生防相关活性物质,基因组具有丰原素、表面活性素等脂肽类物质合成相关的编码基因序列,对番茄果实灰霉病具有明显防控效果且能促进番茄植株生长。芽胞杆菌在生物防治、食品发酵、药物研发和工业应用等领域发挥重要作用[25],近年来国内外利用芽胞杆菌进行植物病害生物防治的报道越来越多[2627]。本研究中解淀粉芽胞杆菌B.amyloliquefaciens JZB301对番茄灰霉病菌等13种植物病原真菌和大白菜黑腐病菌等6种植物病原细菌表现出明显拮抗作用,同时对番茄果实灰霉病表现出良好防效,相关结果为解淀粉芽胞杆菌的生防功能研究以及番茄灰霉病生物防治提供了菌株资源。
芽胞杆菌的生防机制主要包括分泌胞外酶、抗菌蛋白等活性物质,与病原菌竞争环境资源和营养,促进植物生长以及诱导植物抗病性等[9]。张霞等[28]发现暹罗芽胞杆菌 B. siamensis ZHX10菌悬液、挥发物以及发酵液均能有效抑制白绢病菌菌丝生长,该菌株产生的挥发性气体能够有效降低白绢病发病率。张琼等[29]筛选的贝莱斯芽胞杆菌B.velezensis SZAD1能产生纤维素酶和几丁质酶,对棉花黄萎病防效良好。荆卓琼等[30]筛选出一株具有产蛋白酶、果胶酶、β1,3葡聚糖酶和淀粉酶等活性的解淀粉芽胞杆菌HZ63。王海霞等[7]发现分离自燕麦的解淀粉芽胞杆菌YNJ3能够产生抗菌物质显著抑制燕麦病原菌生长;并且通过解磷、解钾、产植物生长激素等方式促进燕麦生长。本研究通过生防相关活性检测发现,菌株JZB301具有产蛋白酶、纤维素酶等胞外酶活性,以及产铁载体、生长激素和溶磷等促生相关活性。功能基因扩增检测结果表明,菌株JZB301基因组中含有抗霉枯草菌素、丰原素、表面活性素、伊枯草菌素等脂肽类物质合成相关基因编码序列。已有研究显示,mycB、ituA 和sfp基因所编码的蛋白在合成枯草菌素和表面活性素的过程中发挥重要功能,fenB基因与脂肽类物质丰原素合成密切相关[3132]。这些生防相关特性可能与菌株JZB301对番茄的抑菌防病和促生活性具有密切关系。
解淀粉芽胞杆菌和贝莱斯芽胞杆菌具有很高的同源性,通过表型特征和生理生化特征难以区分。虽然16S rDNA基因序列广泛应用于细菌种类鉴定,但亲缘关系很近的类群常由于序列间相似度太高而无法区分到种。本研究通过BLAST同源性搜索和系统进化树构建,发现JZB301菌株16S rDNA与解淀粉芽胞杆菌和贝莱斯芽胞杆菌相应序列相似性均在100%,表明16S rDNA基因序列不能有效区分二者。近年来,研究者发现以编码蛋白的基因作为系统发育鉴定标记可以弥补16S rDNA基因的不足,如gyr基因[20]、rpo基因等[21],本研究通过扩增JZB301菌株的gyrA和rpoB基因序列并构建系统进化树发现,供试菌株与解淀粉芽胞杆菌的相似性为99%,且在系统进化树中聚在同一分支上,从而将其准确鉴定为解淀粉芽胞杆菌。
参考文献
[1] 赵卫松, 鹿秀云, 郭庆港, 等. 防治番茄灰霉病的枯草芽胞杆菌BAB1粉尘剂研制[J]. 中国生物防治学报, 2018, 34(1): 99108.
[2] 尤佳琪, 李国庆. 拟康宁木霉T51菌株发酵液对灰葡萄孢的抑菌活性[J]. 植物保护, 2021, 47(1): 7478.
[3] 赵娟, 刘霆, 刘伟成, 等. 番茄灰霉病生防链霉菌筛选及鉴定[J]. 微生物学通报, 2019, 46(10): 25482558.
[4] 王惢, 王腾, 李二峰. 生防芽胞杆菌在植物病害领域的研究进展[J]. 天津农学院学报, 2021, 28(4): 7177.
[5] 朱明明, 张岱, 赵冬梅, 等. 马铃薯黑痣病生防芽胞杆菌的筛选与鉴定[J]. 江苏农业科学, 2018, 46(14): 97101.
[6] 方佩, 罗远婵, 田黎, 等. 1株海洋芽胞杆菌对黄瓜灰霉病的防治效果及防治机制研究[J]. 江苏农业科学, 2022, 50(2): 9196.
[7] 王海霞, 鄭成忠, 东保柱, 等. 燕麦内生细菌YNJ3的分离鉴定及防病促生作用研究[J]. 中国生物防治学报, 2022, 38(2): 447457.
[8] 朱録媛, 崔国兵, 孙文达, 等. 甘蔗内生解淀粉芽胞杆菌CGB15的分离、鉴定及生防活性[J]. 微生物学报, 2022, 62(5): 16981710.
[9] 潘虹余, 金玮鋆, 张晓蒙, 等. 解淀粉芽胞杆菌B15抑菌物质对葡萄灰霉病灰葡萄孢的抑菌机理[J]. 微生物学报, 2018, 58(7): 12451254.
[10]程丽娟, 薛泉宏, 来航线, 等. 微生物学实验技术[M]. 西安: 世界图书出版社, 2000.
[11]卢彩鸽, 张殿朋, 刘霆, 等. 解淀粉芽胞杆菌MH71的生防活性及脂肽类抗生素基因检测[J]. 植物保护, 2015, 41(3): 1218.
[12]TEATHER R M, WOOD P J. Use of congo redpolysaccharide interactions in enumeration and characterization of cellulolytic bacteria from the bovine rumen [J]. Applied and Environmental Microbiology, 1982, 43(4): 777780.
[13]PIKOVSKAYA R I. Mobilization of phosphorus in soil in connection with vital activity of some microbial species [J]. Microbiologiya, 1948, 17: 362370.
[14]SCHWYN B, NEILANDS J R. Universal chemical assay for the detection and determination of siderophores [J]. Analytical Biochemistry, 1987, 160(1): 4756.
[15]PATTEN C L, GLICK B R. Role of Pseudomonas putida indoleacetic acid in development of the host plant root system [J]. Applied and Environmental Microbiology, 2002, 68(8): 37953801.
[16]李扬凡, 邵美琪, 刘畅, 等. 解淀粉芽胞杆菌HMB33604的抑菌物质及对马铃薯黑痣病的防治效果[J]. 中国农业科学, 2021, 54(12): 25592569.
[17]卢彩鸽, 张殿朋, 刘伟成, 等. 一株甘蓝枯萎病拮抗细菌的筛选、鉴定及其抑菌活性测定[J]. 华北农学报, 2014, 29(1): 195202.
[18]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 6265.
[19]WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study [J]. Journal of Bacteriology, 1991, 173(2): 697703.
[20]CHUN J, BAE K S. Phylogenetic analysis of Bacillus subtilis and related taxa based on partial gyrA gene sequences [J]. Antonie van Leeuwenhoek, 2000, 78(2): 123127.
[21]CLERCK E D, VANHOUTTE T, HEBB T, et al. Isolation, characterization, and identification of bacterial contaminants in semifinal gelatin extracts [J]. Applied and Environmental Microbiology, 2004, 70(6): 36643672.
[22]HSIEH F C, LI M C, LIN T C, et al. Rapid detection and characterization of surfactin producing Bacillus subtilis and closely related species based on PCR [J]. Current Microbiology, 2004, 49(3): 186191.
[23]鄧建良. 解淀粉芽胞杆菌YN1抑制植物病原真菌活性物质研究[D]. 武汉: 华中农业大学, 2009: 1719.
[24]李素平, 袁玲, 迟少艺, 等. 一种自溶性产酶溶杆菌新菌株LE16对温室番茄灰霉病的抑制作用[J]. 微生物学报, 2022, 62(10): 38713885.
[25]邱益彬, 马艳琴, 沙媛媛, 等. 解淀粉芽胞杆菌分子遗传操作及其应用研究进展[J]. 生物技术通报, 2022, 38(2): 205217.
[26]陈哲, 黄静, 赵佳, 等. 番茄灰霉病病原菌分离鉴定及拮抗菌筛选[J]. 生物技术通报, 2017, 33(8): 8187.
[27]柴庆凯, 张斌, 常若葵, 等. 解淀粉芽胞杆菌LJ02对黄瓜抗灰霉病菌的生防效果及其诱导抗性机理的初步研究[J]. 植物病理学报, 2019, 49(6): 828835.
