3种寄主挥发物中引起旋幽夜蛾嗅觉反应的活性组分分析
2024-06-08杨安沛张航白微微丁瑞丰李广阔
杨安沛 张航 白微微 丁瑞丰 李广阔

摘要
为探究植物挥发物中引起旋幽夜蛾嗅觉电生理反应的活性组分,本研究采用动态顶空吸附法收集藜、甜菜和棉花植株的挥发物,利用气相色谱触角电位联用仪(GCEAD)和气相色谱质谱联用仪(GCMS)定性鉴定寄主挥发物中引起旋幽夜蛾嗅觉反应的活性组分。结果表明,藜挥发物中有6种活性组分,甜菜和棉花挥发物中各有5种,其中乙酸叶醇酯、1,2二乙苯、对二乙苯、壬醛、二乙二醇丁醚为3种植物共有的挥发物组分,异佛尔酮仅在藜挥发物中发现。触角电位(EAG)测定结果显示,以上6种组分都能引起旋幽夜蛾雌雄成虫的EAG反应,且随浓度增加EAG相对反应值增大。雌雄成虫对壬醛和异佛尔酮的EAG反应最强烈,其次是乙酸叶醇酯和1,2二乙苯。在相同浓度条件下,雌雄成虫对同种化合物的EAG反应无性别特异性。本研究为探明旋幽夜蛾定位寄主機制及开发行为调控产品提供基础。
关键词
旋幽夜蛾; 植物挥发物; 触角电位; GCEAD
中图分类号:
S 433.4
文献标识码: A
DOI: 10.16688/j.zwbh.2023181
Analysis of active components in three host volatiles eliciting olfactory responses in Scotogramma trifolii
YANG Anpei, ZHANG Hang, BAI Weiwei, DING Ruifeng, LI Guangkuo*
(Institute of Plant Protection, Xinjiang Academy of Agricultural Sciences, Key Laboratory of Integrated Management
on Crops in Northwestern Oasis, Ministry of Agriculture and Rural Affairs, Urumqi 830091, China)
Abstract
To investigate the active components of plant volatiles eliciting olfactory electrophysiological responses in Scotogramma trifolii, volatile compounds from Chenopodium album, Beta vulgaris, and Gossypium hirsutum. were collected using the dynamic headspace adsorption method. The active components in the host volatiles were qualitatively identified using gas chromatography electroantennography (GCEAD) and gas chromatographymass spectrometry (GCMS). The results revealed that there are six active components in the volatile emissions of C.album, and five active components each in sugar beet and cotton volatiles. Among these, five components were common across all three plant volatiles, namely trans3hexenyl acetate, 1,2diethylbenzene, 1,4diethylbenzene, nonanal, and diethylene glycol monobutyl ether. Additionally, isophorone was exclusively found in the volatiles of C.album. The antennal electrophysiological responses (EAG) of S.trifolii reveal that the six active components can all cause EAG responses in both male and female adults, and increasing with increasing concentration,and the strongest EAG responses were observed to nonanal and isophorone, followed by trans3hexenyl acetate and 1,2diethylbenzene. Furthermore, under the same concentration conditions, the EAG response of male and female adults to the same compound displayed no gender specificity. This study provides a basis for exploring the host localization mechanism of S.trifolii and for developing behavioral regulators.
Key words
Scotogramma trifolii; plant volatiles; EAG; GCEAD
旋幽夜蛾Scotogramma trifolii又名旋歧夜蛾、三叶草夜蛾,属鳞翅目Lepidoptera夜蛾科Noctuidae,在世界范围内广泛分布[1],在我国新疆、甘肃、内蒙古、吉林、河北等北方地区均有发生,对甜菜、棉花、蓖麻、向日葵、玉米均造成严重危害[210]。旋幽夜蛾以幼蟲取食寄主叶片,大龄幼虫常造成大型孔洞或食尽整张叶片的叶肉,仅剩叶柄和叶脉[11],幼虫具有多食性、暴发性和迁移为害的特点。旋幽夜蛾寄主广泛,可为害8科20多种作物、27种杂草[5],藜Chenopodium album、甜菜Beta vulgaris、白菜 Brassica chinensis为旋幽夜蛾的适宜寄主[12]。
在复杂的生态环境下,昆虫与植物长期协同进化,形成了信息化合物与昆虫行为彼此相互联系、相互作用的关系,如觅食、求偶、迁徙、聚集、产卵等各种行为活动[1315]。针对旋幽夜蛾的寄主选择性,前期研究发现,旋幽夜蛾成虫偏好在藜上产卵,其次是棉花和甜菜[1112]。但目前关于寄主植物挥发物中的哪些组分参与旋幽夜蛾的寄主选择行为尚不清楚,缺乏对寄主植物活性组分种类的系统研究。
植食性昆虫主要通过嗅觉来识别和选择寄主植物,寄主植物挥发物在昆虫行为过程中发挥着重要作用[1617],介导昆虫的吸引和趋避行为[1820]。然而植物挥发物的种类已超过了3万种[21],从植物挥发物中筛选引起昆虫嗅觉反应的活性物质是非常重要的,可为开发昆虫引诱剂和驱避剂奠定基础[2224]。目前,基于植物挥发物活性物质的食诱剂已被成功研发,对甜菜夜蛾Spodoptera exigua、斜纹夜蛾S.litura、黄地老虎Agrotis segetum、小地老虎A.ipsilon、棉铃虫Helicoverpa armigera等重要害虫具有明显的诱捕效果[2527]。昆虫在气味识别过程中会产生一系列电化学信号,因此,本研究利用气相色谱触角电位联用技术(gas chromatography electroantennographic detection,GCEAD)测试旋幽夜蛾对3种寄主植物挥发物的触角电位反应,结合气相色谱质谱联用技术(gas chromatographymass spectrometry,GCMS)分析鉴定具有嗅觉电生理反应的活性组分,同时测试旋幽夜蛾雌雄成虫对相应组分标准品的触角电生理反应(electrophysiological,EAG),以期筛选出对旋幽夜蛾行为有调控作用的潜在信息化合物。
1 材料与方法
1.1 供试昆虫与寄主植物
旋幽夜蛾于2019年4月利用频振式诱虫灯(鹤壁佳多科工贸股份有限公司)采自新疆昌吉市农业技术推广中心试验基地。待成虫产卵孵化后,在温度(26±2)℃,相对湿度(60±5)%,光周期L∥D=14 h∥10 h的光照培养箱中用人工饲料(玉米粉35 g,大豆粉30 g,酵母粉6 g,尼泊金酯1 g,复合维生素B 0.4 g,抗坏血酸1.25 g,山梨酸0.4 g,番茄酱80 g,氯化胆碱0.22 g,胆固醇0.18 g,H2O 450 mL)饲养,幼虫生长到6龄时,单头放入十二孔板中饲养至化蛹,羽化后选择活跃且触角完整的雌雄成虫(2~3日龄,未交配)作为供试用虫。
试验所用寄主植物包括:甜菜 ‘KWS9147、棉花‘中棉88号、藜(田间自然生长)。待田间甜菜植株4~8叶,盆栽棉花8~10叶,藜株高80~100 cm时进行挥发物采集(藜采用上部幼嫩枝叶)。
1.2 寄主植物挥发物收集
采用动态顶空吸附法收集寄主植物挥发物。用聚乙烯保鲜袋(40 cm×60 cm)套在植株的上部叶片部位收集挥发物,保鲜袋的上部剪去一角,插入一根出气硅胶管,用封口膜胶带缠绕封闭,下开口处插入一根进气管,用封口膜缠绕固定于植株上,进、出气硅胶管分别连接到大气采样仪(QC1B,北京劳动保护研究所)上的出口和进口,进气硅胶管的空气通过活性炭过滤后进入保鲜袋中,带有植物挥发性气体的空气流经吸附柱中的40 mg吸附剂(PoraPakTMQ80100)后回流入大气采样仪。气体流速为1 L/min,连续收集4 h(20:00-24:00)。收集完毕后,将吸附柱取下,分2次分别用200 μL CH2Cl2淋洗吸附柱,用洗耳球将淋洗液从吸附柱吹入1.5 mL玻璃瓶中,用封口膜密封置于-20℃冰箱中保存,用于气相色谱触角电位联用技术(GCEAD)和气相色谱质谱联用技术(GCMS)分析。
1.3 引起旋幽夜蛾触角电生理反应的活性组分筛选与活性物质鉴定
通过气相色谱质谱联用技术,使用单四极杆气相气质联用仪(GCMSQP2020,岛津公司,日本)对寄主植物挥发物成分进行分析。气相色谱仪工作条件设定为:进样口温度250℃;起始温度4℃保持2 min,之后以4℃/min升温至120℃,保持2 min,再以20℃/min升温至250℃,保持7 min;GC检测器温度设为300℃,载气为N2(99.999%),流速15 mL/min。MS电离方式为EI,离子源温度为250℃,电离能量为70 eV。用微量进样器吸取1 μL挥发物样品注入气相色谱仪,采用GCMS solution v4.5软件进行数据采集与再解析。
利用气相色谱触角电位联用技术(GCEAD)测定旋幽夜蛾对寄主植物挥发物的嗅觉反应。首先将触角从基部剪断,同时用手术刀切去端部1 mm,将参考电极(毛细管中浸有1%生理盐水)对准触角基部放入,然后将参考电极置于操作台上,触角端部对准记录电极插入,连接好触角的微操作台整体移动到气相色谱的L形玻璃管出样口处,保持触角在出气口位置,保持电极联通。待1~3 min触角电位信号稳定后,用10 μL手动进样针将田间收集的3 μL寄主植物挥发物样品在不分流模式下注入气相色谱仪(Agilent 7820A),GC程序同GCMS。经毛细管柱分离的样品由“Y”形分流阀按1∶1的比例分流,一部分进入FID检测器,另一部分样品通过热传导器内部的色谱柱由纯净空气(400 mL/min)带到靠近触角的玻璃管口,热传导器温度设为300℃。触角电位仪(IDAC2,Syntech)将采集得到的电信号经过放大器放大,经转换器转换后用GcEad v1.2.5软件采集数据。雌雄成虫均重复4次。最后通过比对GCEAD和GCMS图像数据,利用谱库NIST 14.0对引起旋幽夜蛾触角电生理反应的挥发物组分进行定性鉴定。
1.4 旋幽夜蛾对活性组分标准品的EAG反应
选取健康成虫的完整触角进行测试,触角处理同1.3,用导电胶连接触角于触角电位仪上。测试气体流量设定为0.4 L/min,待基线平稳后开始测定。1.3中鉴定出的活性组分的标准品用于EAG反应试验。
用液体石蜡油将标准品配制成浓度为0.1、1、10、100 μg/μL的溶液,取10 μL溶液滴于5 cm×1 cm滤纸上,挥发30 s后置于巴斯德管中。测试时,将巴斯德管接入气流控制器,出口正对触角,距离10 mm左右,由气流控制器(DGST1)提供气流,流量均设定为400 mL/min,待基线稳定后给予刺激,刺激时间设为0.5 s,刺激间隔至少30 s,以保证触角感器的感觉功能完全恢复。首先测试对照(液体石蜡油),然后按浓度从低到高测试标准品(表1),最后再测试对照(液体石蜡油),重复测试3次。每个标样测试10根触角。利用Syntech公司提供的EAG Pro 2.0软件进行数据记录与分析,触角电位相对反应值计算公式如下:
触角电位相对反应值=标准品触角电位反应值-(测试前对照触角电位反应值+测试后对照触角电位反应值)/2。
1.5 数据处理
不同浓度下不同活性组分的EAG相对反应值间的差异顯著性采用单因素方差分析(Oneway ANOVA),Duncan氏新复极差法检验差异显著性。数据统计计算采用SPSS 25.0软件进行。
2 结果与分析
2.1 3种寄主植物挥发物中引起旋幽夜蛾嗅觉电生理反应的组分鉴定
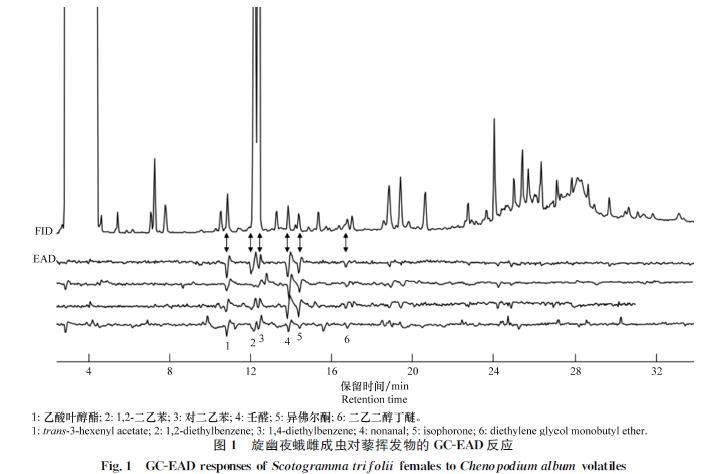
藜挥发物中能引起旋幽夜蛾雌成虫GCEAD反应的活性组分有6种,即乙酸叶醇酯、1,2二乙苯、对二乙苯、壬醛、异佛尔酮和二乙二醇丁醚,棉花和甜菜挥发物中能引起旋幽夜蛾雌成虫GCEAD反应的活性组分均为5种,即乙酸叶醇酯、1,2二乙苯、对二乙苯、壬醛、二乙二醇丁醚(图1~3,表2)。
2.2 旋幽夜蛾对活性组分标准品的EAG反应
当供试化合物标准品浓度为0.1、1、10 μg/μL时,雌成虫对异佛尔酮的EAG相对反应值最大,分别为0.40、0.96、1.87 mV,在相同浓度下显著高于其他化合物(F5,54=11.888,P<0.001;F5,54=36.424,P<0.001;F5,54=27.776,P<0.001);当浓度为100 μg/μL时,雌成虫对壬醛和异佛尔酮的EAG反应最强烈,分别为2.48、2.28 mV,显著强于其他化合物 (F4,45=11.588, P<0.001; F4,45=9.449,P<0.001)(图4)。 在供试化合物标准品浓度为1、10 μg/μL时,雄成虫对异佛尔酮的EAG相对反应值最大,分别为0.94、1.95 mV,在相同浓度下显著高于其他化合物(F5,54=12.107, P<0.001; F5,54=10.442,P<0.001);当浓度为0.1、100 μg/μL时,雄成虫对壬醛和异佛尔酮的EAG反应最大,其次是乙酸叶醇酯和1,2二乙苯(图5)。
在0.1~100 μg/μL 浓度梯度内,旋幽夜蛾对6种化合物的EAG相对反应值随浓度的增加而增大,且均在浓度100 μg/μL时EAG相对反应值最高(图4,5)。在相同浓度条件下,雌雄成虫对同种化合物的EAG反应值无明显差异,无性别特异性。
3 结论与讨论
本研究通过GCEAD和GCMS技术从藜、甜菜、棉花植株挥发物中鉴定出能引起旋幽夜蛾嗅觉反应的6种活性物质,其中乙酸叶醇酯、1,2二乙苯、对二乙苯、壬醛、二乙二醇丁醚等5种为甜菜、棉花和藜中共有组分,异佛尔酮仅在藜中发现。本试验中鉴定的引起旋幽夜蛾嗅觉反应的组分在其他鳞翅目昆虫中也有类似的报道,如壬醛能引起马铃薯块茎蛾Phthorimaea operculella[28]、草地贪夜蛾Spodoptera frugiperda[29]、亚洲玉米螟Ostrinia furnacalis[30]、黄地老虎[31]、朱红毛斑蛾Phauda flammans[32]明显的触角电生理反应。1,2二乙苯、对二乙苯能触发黄地老虎[31]、朱红毛斑蛾[32]的EAG反应,乙酸叶醇酯能引起黄地老虎[31]的嗅觉反应。
本研究通过EAG测试了旋幽夜蛾雌雄成虫对不同浓度6种活性组分的触角电生理反应,6种组分均能引起旋幽夜蛾雌雄成虫EAG反应。在同一化合物同一浓度条件下,旋幽夜蛾雌雄成虫的EAG相对反应值无明显差异,在其他昆虫中也有相似报道,入侵害虫芒果壮铗普瘿蚊Procontarinia robusta雌雄虫对α蒎烯等3种挥发物成分的EAG反应值无显著性差异[33]。棉铃虫和烟青虫Helicoverpa assulta对19种挥发物的EAG反应均无显著的性别差异[34]。但也有研究报道昆虫对同一物质的EAG反应存在性别差异,如双斑长跗萤叶甲Monolepta hieroglyphica雌雄成虫对同一浓度的同一挥发物的EAG反应存在差异[35]。本研究发现,旋幽夜蛾对相同浓度的不同化合物的EAG反应存在差异,浓度为100 μg/μL时,雌成虫对壬醛和异佛尔酮的EAG反应最强烈;浓度为0.1、100 μg/μL时,雄成虫对壬醛和异佛尔酮的EAG反应最大。在其他昆虫中也有类似报道,如当5种化合物浓度均为0.01 μg/μL时
芒果壮铗普瘿蚊雌雄成虫对α蒎烯的反应均显著高于其他4种挥发物[33],当14种化合物浓度为50 μg/μL或100 μg/μL时草地贪夜蛾雌虫对癸醛、壬醛、反2己烯醛、反2己烯醇反应最强烈,高于其他10种挥发物的响应峰值[29]。EAG结果表明,旋幽夜蛾对活性物质的EAG反应存在浓度依赖性,随着浓度的升高而升高,与其他昆虫的研究结果一致。如美国白蛾Hyphantria cunea对邻苯二甲酸二丁酯的EAG相对反应值
随着浓度的增加而增加[36],黄地老虎雌成虫对11种植物挥发物的EAG反应均随浓度的升高而升高[31],烟青虫和棉铃虫对6种植物挥发物的EAG反应随着刺激物质浓度的增大而增强[34],草地貪夜蛾对14种挥发物的EAG反应随浓度(0.1~100 μg/μL)增大而增强,但对某些活性组分的EAG反应存在饱和值[29]。本研究初步确定了引起旋幽夜蛾嗅觉反应的活性化合物,还需进一步明确旋幽夜蛾对活性化合物的嗅觉行为反应,为探明寄主植物挥发物对旋幽夜蛾的行为反应作用提供理论基础。
参考文献
[1] FEDERICI B A. A new type of insect pathogen in larvae of the clover cutworm, Scotogramma trifolii [J]. Journal of Invertebrate Pathology, 1982, 40(1): 4154.
[2] 安丽芬, 战继春. 旋幽夜蛾在白城市首次大面积暴发为害[J]. 中国植保导刊, 2005, 25(8): 38.
[3] 孙治华, 赵素珍. 旋幽夜蛾的发生及防治[J]. 内蒙古农业科技, 1995(2): 2324.
[4] 王大光, 那玛加甫, 刘淑红. 棉田旋幽夜蛾的发生特点与防治技术[J]. 中国植保导刊, 2009, 29(1): 3334.
[5] 赵占江, 陈恩祥, 张毅. 旋幽夜蛾生物学特性与防治研究[J]. 中国甜菜, 1992(4): 2730.
[6] 井双泉, 蒋丽萍, 赵生普, 等. 三叶草夜蛾的发生规律与防治[J]. 中国甜菜糖业, 2001(2): 3940.
[7] 曹慢, 吕金海. 石河子地区甜菜的新害虫[J]. 新疆农业科学, 1963(8): 324.
[8] 于江南, 鲍玉琴. 旋幽夜蛾在新疆棉区发生[J]. 新疆农业科学, 1996(11): 34.
[9] 任敏, 吴晓敏, 杨晓光. 旋幽夜蛾在通榆县大面积发生为害[J]. 中国植保导刊, 2006(3): 22.
[10]刘莉. 迁飞性害虫旋幽夜蛾在我省局地重发[N]. 河北科技报, 20190702(B04).
[11]赵琦. 旋幽夜蛾寄主选择、生殖及抗寒性的研究[D]. 重庆: 西南大学, 2011.
[12]杨安沛, 张航, 白微微, 等. 旋幽夜蛾对寄主植物选择偏好和种群适合度[J]. 新疆农业科学, 2020, 57(3): 528535.
[13]闫凤鸣. 化学生态学[M]. 北京: 科学技术出版社, 2003.
[14]SIDNEY M, BROWN K, JUDD G J R, et al. Stimuli affecting selection of oviposition sites by female peach twig borer, Anarsia lineatella Zeller (Lepidoptera: Gelechiidae) [J]. Journal of Applied Entomology, 2008, 132(7): 538544.
[15]BLANDE J D. Plant communication with herbivores [J]. Advances in Botanical Research, 2017, 82: 281304.
[16]杜家緯. 植物昆虫间的化学通讯及其行为控制[J]. 植物生理学报, 2001, 27(3): 193200.
[17]戴建青, 韩诗畴, 杜家纬. 植物挥发性信息化学物质在昆虫寄主选择行为中的作用[J]. 环境昆虫学报, 2010, 32(3): 407414.
[18]CAMPBELL C A, PETTERSSON J, PICKETT J A, et al. Spring migration of damsonhop aphid, Phorodon humuli, (Homoptera: Aphididae), and summer host plantderived semiochemicals released on feeding [J]. Journal of Chemical Ecology, 1993, 19(7): 15691576.
[19]JIAO Yaoyu, HU Xiaoyun, PENG Yufa, et al. Bt rice plants may protect neighbouring nonBt rice plants against the striped stem borer, Chilo suppressalis [J/OL]. Proceedings of the Royal Society B: Biological Sciences, 2018, 85(1883): 20181283. DOI: 10.1098/rspb.2018.1283.
[20]HERN A, DORN S. A femalespecific attractant for the codling moth, Cydia pomonella, from apple fruit volatiles [J]. Naturwissenschaften, 2005, 91(2): 7780.
[21]PEUELAS J, JOAN L. Plant VOC emissions: making use of the unavoidable [J]. Trends in Ecology and Evolution, 2004, 19(8): 402404.
[22]MOLNR B P, TTH Z, FEJESTTH A, et al. Electrophysiologicallyactive maize volatiles attract gravid female european corn borer, Ostrinia nubilalis [J]. Journal of Chemical Ecology, 2015, 41(11): 9971005.
