超高效液相色谱串联质谱法测定豇豆中新烟碱类农药残留
2024-06-08邱琦珍潘兴鲁吴小虎徐军董丰收郑永权
邱琦珍 潘兴鲁 吴小虎 徐军 董丰收 郑永权


摘要
本研究建立了超高效液相色谱串联质谱法(UPLCMS/MS)同时检测豇豆中9种新烟碱类杀虫剂的多残留分析方法。豇豆样品用QuEChERS方法前处理,用Kinetex Biphenyl色谱柱分离,以甲醇和含0.1 mmol/L甲酸铵、0.001%甲酸的水作为流动相进行梯度洗脱,使用超高效液相色谱串联质谱检测分析。定量限为0.01 mg/kg,标准工作曲线在0.001~1 mg/kg范围内表现出良好的线性关系,决定系数(R2)均大于0.99。目标杀虫剂在豇豆中的平均回收率为66.9%~109.8%,相对标准偏差为1.2%~10.0%。应用该方法对某地16个农贸市场中采集的71份豇豆样本进行检测,所有样品均符合我国所规定的豇豆(或豆类)中的最大残留限量标准要求。该方法简便、准确、灵敏度高,适用于新煙碱类杀虫剂在豇豆中的残留监测。
关键词
新烟碱类杀虫剂; 豇豆; 超高效液相色谱串联质谱; 残留检测
中图分类号:
S 481.8
文献标识码: A
DOI: 10.16688/j.zwbh.2023175
Determination of residues of neonicotinoid insecticides in cowpeas by UPLCMS/MS
QIU Qizhen1,2, PAN Xinglu2, WU Xiaohu2, XU Jun2, DONG Fengshou1,2*, ZHENG Yongquan2
(1. College of Horticulture and Landscape, Tianjin Agricultural University, Tianjin 300384, China;
2. Institute of Plant Protection, Chinese Academy of Agricultural Sciences, State Key Laboratory
for Biology of Plant Diseases and Insect Pests, Beijing 100193, China)
Abstract
A method was developed for the simultaneous determination of nine neonicotinoid insecticides in cowpea by ultrahigh performance liquid chromatographytandem mass spectrometry (UPLCMS/MS). The cowpea samples were pretreated with QuEChERS, and separation was performed by Kinetex Biphenyl column using a gradient elution of methanol and water (0.1 mmol/L ammonium formate+0.001% formic acid) as mobile phases, and then detected by UPLCMS/MS. The limit of quantification (LOQ) for neonicotinoid insecticides was 0.01 mg/kg. The method showed excellent linearity (R2>0.99) in the range of 0.001-1 mg/kg. The average recoveries of the target compounds in cowpea ranged from 66.9% to 109.8%, and the relative standard deviation (RSDs) was from 1.2% to 10.0%. This method was used for determination of 71 cowpea samples collected in 16 markets and all pesticides met the requirements of the maximum residue limit standard in cowpeas (or beans) stipulated in the National Food Safety Standard Maximum Residue Limits of Pesticides in Food (GB 27632021). This method is simple, accurate and sensitive, and suitable for the residue analysis of neonicotinoid insecticides in cowpeas.
Key words
neonicotinoid insecticide; cowpea; UPLCMS/MS; residue detection
豇豆Vigna unguiculata是世界上最重要的蔬菜作物之一,在热带和亚热带地区广泛种植[12]。在我国,豇豆已成为海南、广东、广西、福建和云南等省份的重要经济作物[3],总种植面积超过67万 hm2,年产量约150万 t[45]。但作为一种花果同期作物,豇豆在花期极易受到病虫害的侵袭[6],为保证豇豆产量,菜农常常使用农药来控制病虫害,给同在收获期的果实带来残留风险[79]。由于豇豆屡被检测出农药残留,受到广大消费者的关注[10]。因此,豇豆被纳入了国家农业农村部等七部委联合启动的《食用农产品“治违禁 控药残 促提升”三年行动方案》的重点治理蔬菜品种“三棵菜”范畴。
新烟碱类杀虫剂是继拟除虫菊酯类杀虫剂之后的第四代杀虫剂[11],是防治蚜虫、蓟马等刺吸式害虫的有效杀虫剂,吡虫啉、啶虫脒、噻虫嗪等已被登记并广泛应用于豇豆中蚜虫、蓟马等虫害的防治[1213]。国内外许多学者开展了关于豇豆农药残留风险的研究[1417]。2014年抽检的海南省豇豆样品中有多种农药残留,啶虫脒、噻虫嗪检出率较高[18]。而2018年-2021年重庆市市场的豇豆样品中啶虫脒检出次数为35次,且超标现象仍旧存在[19]。同时有研究表明新烟碱类杀虫剂对人体健康有潜在风险,可能会对人体的神经系统、生殖系统、肝肾功能造成伤害[2022],世界上多个国家及组织开始对其限制使用[2326]。
目前,高效液相色谱串联质谱法因其高灵敏度已成为新烟碱类农药残留检测的主要方法[27]。近年来已有不少关于新烟碱类农药在蔬菜水果中的残留检测报道[2830],但鲜有涉及豇豆中多种新烟碱类农药同时检测的研究[9,3132]。因此,本研究采用QuEChERS前处理技术结合高效液相色谱串联质谱法建立了豇豆中9种新烟碱类农药的残留检测方法,并监测了某地市场豇豆样品的新烟碱类农药残留情况,以期为豇豆质量安全监控提供基础数据和方法工具。
1 材料与方法
1.1 药剂与试剂
99.0%吡虫啉(CAS: 138261413)、98.1%啶虫脒(CAS: 135410207)、99.0%噻虫嗪(CAS: 105843365)、99.9%噻虫胺(CAS: 210880925)、98.6%呋虫胺(CAS: 165252700)、98.5%噻虫啉(CAS: 111988499)、98.6%烯啶虫胺(CAS: 150824478)、96.0%氯噻啉(CAS: 105843365)、99.1%氟啶虫胺腈(CAS: 946578003)等9种新烟碱类杀虫剂标准品均购于Dr. Ehrenstorfer GmbH(Augsburg,德国);色谱纯甲醇、乙腈、甲酸均购于SigmaAldrich公司(Steinheim,德国);N丙基乙二胺(PSA)、石墨炭黑(GCB)购于天津艾杰尔公司;分析纯甲酸购于湖北湖试化学试剂有限公司;分析纯甲醇、乙腈、甲酸铵、乙酸铵、甲酸、氯化钠、无水硫酸镁均购自北京北化精细化工有限公司。
1.2 仪器与设备
超高效液相色谱串联质谱仪UPLCMS/MS(Exion LC,日本岛津公司;AB SCIEX Triple Quad 5500+,美国AB SCIEX公司);0.000 1 g电子天平(AA160,杭州Dever仪器公司);0.01 g电子天平(ME204E,上海梅特勒托利多仪器有限公司);涡旋混合仪(XW80A,美国Scientific Industries公司);多管涡旋混匀仪(MS200,杭州瑞诚仪器有限公司);台式高速离心机(MULTIFUGE 1SR,美国Thermo公司;Centrifuge 5424,Eppendorf公司,德国);小型离心机(AQBD,台湾瑞基海洋生物科技股份有限公司);超纯水制备系统(IQ7003,美国Millipore公司)。
1.3 试验方法
1.3.1 样品采集
于5月上、中、下旬在广西某县不同村镇的不同农贸市场上(n=16)各采集1次豇豆样品,每处采集不少于3份豇豆样品(共完成采集71份),每份不少于500 g。获得样品后在当地完成缩分,并尽快加冰袋运输到实验室-20℃冷冻保存。
1.3.2 前处理方法
本试验用QuEChERS方法对豇豆样品进行预处理。具体步骤如下:准确称取粉碎的豇豆样品10 g于50 mL离心管中,加入10 mL乙腈,振荡10 min;加入4 g氯化钠和1 g无水硫酸镁,振荡5 min,离心5 min;取上清1.5 mL,加入盛有净化剂150 mg MgSO4+40 mg PSA+10 mg GCB的2 mL離心管中,涡旋1 min,5 000 r/min离心5 min。取上清过0.22 μm有机膜入进样小瓶,待测。
1.3.3 色谱和质谱检测条件
色谱条件:色谱柱采用Kinetex Biphenyl Column(100 mm×2.1 mm,2.6 μm,100);色谱柱温度为40 ℃;样品室温度:15℃;进样量2 μL;流动相为A水(0.1 mmol/L甲酸铵+0.001%甲酸),B甲醇;运行时间:6 min。优化后的流动相洗脱梯度如表1所示:
质谱条件:目标化合物的定性定量分析在三重四极杆质谱仪(SCIEX Triple QuadTM 5500+系统)电喷雾正离子与负离子模式(ESI+/ESI-)下进行。多反应监测(multiple reaction monitoring, MRM)模式,每一离子对的驻留时间为20 ms。电喷雾离子源,正负离子扫描兼有;离子化电压5 500/-4 500 V,鞘气温度600℃,喷雾气(GS1)60 psi,辅助加热气(GS2)60 psi,气帘气35 psi。目标物优化后的MRM参数见表2。
1.3.4 标准溶液的配制及标准曲线的制作
用万分之一电子天平分别称取各目标化合物:吡虫啉、噻虫嗪、烯啶虫胺、氟啶虫胺腈(各0.010 1 g),啶虫脒、呋虫胺、噻虫啉(各0.010 2 g),噻虫胺(0.010 0 g)和氯噻啉(0.010 4 g),溶于色谱纯甲醇,用100 mL容量瓶定容,由此可得濃度为100 mg/L的9种目标物的混合标准母液。移取1 mL混合标准母液,用色谱纯甲醇定容至100 mL,可得到1 mg/L的混合标准溶液,用色谱纯甲醇逐级稀释,依次得到浓度为0.5、0.1、0.05、0.01、0.005、0.001 mg/L的混合标准工作溶液。以上标准溶液均密封且避光存于-20℃备用。混合基质标准溶液的配制:把豇豆空白样品(未检测出目标物的样品)按照1.3.2中的方法处理后配制成空白基质溶液,再用空白基质溶液将上述标准母液逐级稀释,依次得到浓度为1、0.5、0.1、0.05、0.01、0.005、0.001 mg/L的混合基质标液,现配现用。按照1.3.3节的条件测定。以峰面积为纵坐标,质量浓度为横坐标绘制标准曲线。
1.3.5 添加回收试验
在空白豇豆样本中添加适量标准品储备液,使得3个添加水平分别为0.01、0.1、1 mg/kg,每个水平设置5个重复。按照1.3.2节的方法处理,1.3.3节的条件测定,计算平均回收率和相对标准偏差(RSD)。本研究还考察了基质效应(matrix effect, ME),其中,ME=100%表明基质效应不存在;ME<100%,目标物受基质抑制效应;ME>100%,目标物受基质增强效应;80%≤ME≤120%,受较低程度基质干扰;ME<50%或ME>150%表明目标物受到强烈干扰。
2 结果与分析
2.1 检测条件的优化
液相色谱质谱联用仪器的条件对方法的灵敏度有很大的影响。本研究中,质谱仪采用电喷雾的电离方式下,正负离子模式共用时目标物的响应值更高。通过质谱直接进样的方式获得9种目标物的碎片离子质谱图。研究发现,通过对串联四极杆质谱的参数如离子对、锥孔电压、碰撞能量等条件的优化,可对目标物进行准确定性。
在质谱条件优化后,本试验对超高效液相色谱的条件也进行了优化。本研究选用了较为常用的反相双苯基色谱柱(100 mm×2.1mm,2.6 μm,100)进行9种新烟碱类农药的分离。该色谱柱对于9种目标物具有较好的分离效果,可获得良好的峰形且出峰时间短。流动相最初选择乙腈/水和甲醇/水,结果表明大部分化合物在以上2种条件下均有很好的保留和分离,但鉴于大部分化合物是在电喷雾正离子被扫描监测,通过在流动相中加入一定量的酸以提高质谱效率。当采用甲酸水溶液代替水作为流动相时,大多数目标物的响应增强,鉴于同时有在电喷雾负离子被扫描监测的目标物,最终选取了最低的酸浓度(0.001%)。选用甲酸时大多数化合物峰形更好些。但胺类化合物(呋虫胺、烯啶虫胺、噻虫胺)峰形不好且杂峰较多,通过加入铵盐调整,发现甲酸铵结果较好,并且浓度为0.1 mmol/L时,基本不影响其他化合物的响应。此外,甲醇作为流动相时,比乙腈的响应值更高一些,可获得峰形更好的色谱图。综合以上多种因素考虑,最终选取甲醇/(0.1 mmol/L甲酸铵+0.001%甲酸)水溶液作为流动相,质谱仪电喷雾正离子与负离子模式(ESI+/ESI-)下进行目标物的分离分析。
2.2 方法学验证
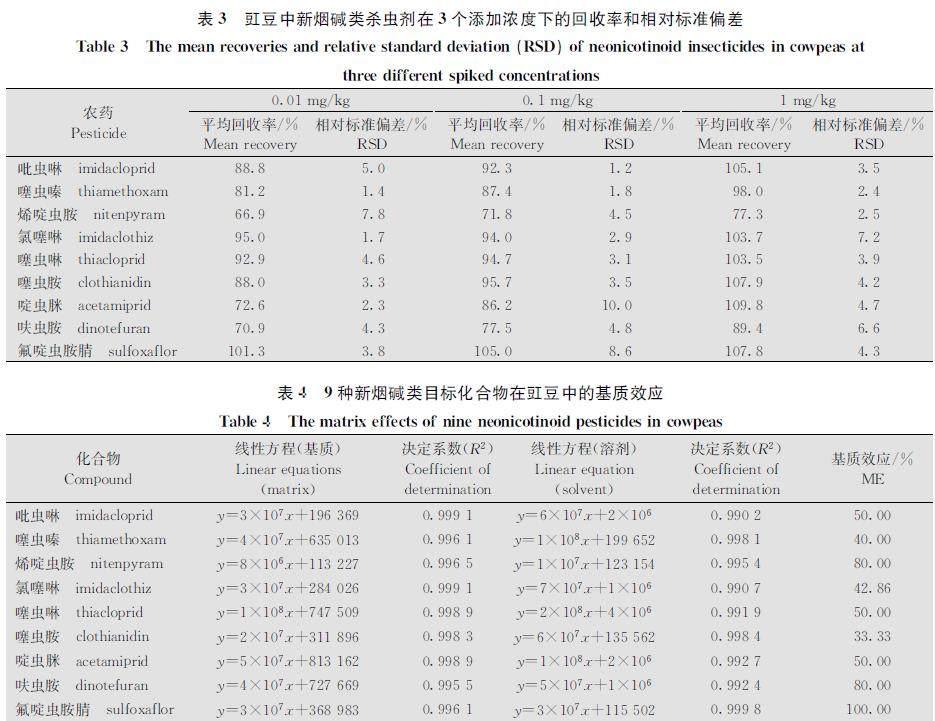
为了验证该方法的可靠性和有效性,分别向空白豇豆样本中添加了3个浓度(0.01、 0.1、 1 mg/kg)的目标物(5个重复),进行添加回收试验。定量限(limit of quantitation, LOQ)为最低添加回收浓度(0.01 mg/kg),这比先前报道的液相色谱法的定量限(0.1 mg/kg)[31]更低。回收率结果见表3,所有化合物的平均回收率范围为66.9%~109.8%,相对标准偏差(RSD)均≤10%,可满足定量分析要求,符合残留分析标准。
按照1.3.4所述配制的7个浓度梯度的混合基质标液在1.3.3的检测条件下的线性方程见表4。结果表明,在0.001~1 mg/kg范围内,相关系数R2均大于0.99,峰面积与浓度的线性关系良好。由表4可以看出,除了氟啶虫胺腈不受豇豆基质影响外,其余8种农药都表现出了不同程度的基质抑制效应,其中只有呋虫胺和烯啶虫胺受较低程度基质干扰,本研究采用基质匹配标准溶液法来消除基质干扰。
2.3 实际样品检测
对采集的某地16个农贸市场中的样本,应用上述方法对71份豇豆样本进行检测。结果显示每个农贸市场的样品中均有农药检出,其中3个市场样品中的新烟碱类杀虫剂检出率较高,有6份样品检出了3种以上新烟碱农药。在所有样品中,啶虫脒、氯噻啉和烯啶虫胺的检出率较高,分别为29.41%,39.71%和11.76%。其中,啶虫脒和烯啶虫胺的残留量较高,浓度为<0.01~0.38 mg/kg和<0.01~0.17 mg/kg。同时,氯噻啉作为中国自主研发的新烟碱类农药,其检出率虽高,残留浓度却较低(<0.01~0.02 mg/kg)。而氟啶虫胺腈、噻虫啉、噻虫胺均未检出。所有农药均符合《食品安全国家标准 食品中农药最大残留限量》(GB 27632021)中所规定的在豇豆(或豆类)中的最大残留限量标准要求。
3 结论与讨论
本研究建立的9种新烟碱类杀虫剂在豇豆中的多残留分析方法具有良好的特异性,样品前处理操作简单,方法的线性范围、平均添加回收率及其相对标准偏差等性能指标均满足农药残留分析要求,平均回收率在66.9%~109.8%之间,相对标准偏差为1.2%~10.0%,定量限为0.01 mg/kg。本方法適用于新烟碱类杀虫剂在豇豆中的残留检测,为新烟碱类杀虫剂在豇豆中的安全风险评估提供了技术方法和数据支持。
通过对某地16个市场上采集的豇豆样品进行9种新烟碱类农药的残留分析,发现每个市场中均有农药检出。其中啶虫脒、氯噻啉和烯啶虫胺的检出率较高,分别为29.41%,39.71%和11.76%。啶虫脒和烯啶虫胺的残留量较高,最高值分别为0.38 mg/kg和0.17 mg/kg。而氟啶虫胺腈、噻虫啉、噻虫胺均未检出。所有样品均符合《食品安全国家标准 食品中农药最大残留限量》(GB 27632021)中所规定的豇豆(或豆类)中的最大残留限量标准要求。本研究在农贸市场上采集的豇豆样本中,有56.3%含有至少1种新烟碱类杀虫剂,26.8%含有多种,这一结果与之前的研究结果相似[3334],而检出浓度更高。例如,阳辛凤等[9]于2017年对海南产区的豇豆样品进行检测,发现295份样品中啶虫脒检出率为64.4%,残留浓度0.015~1.71 mg/kg。Zhang等[33]于2018年-2020年在浙江省采集的1 588份蔬菜样本,约80%蔬菜至少含有1种新烟碱农药,约18%含有2种以上;73个豇豆样本中,吡虫啉含量最高,为0.655 mg/kg。Cui等[34]采集的13种果蔬的3 406个样本中,62.2%含有至少1种新烟碱农药,37.6%含有多种。而这些报道中,新烟碱类杀虫剂的综合风险评价结果均在安全范围内。
目前我国在豇豆上已登记的仅有吡虫啉、噻虫嗪和啶虫脒3种新烟碱农药,而未登记烯啶虫胺、氯噻啉、呋虫胺等也均有检出,表明实际生产中仍存在非登乱用的情况。因此,为保障豇豆产业健康发展,农药使用的监管也有待加强[35],使农民能够更加合理合法地科学使用农药。
参考文献
[1] LEONNARD O O, YANG Liyi, LINDA D, et al. Proanthocynidin profile of cowpea (Vigna unguiculata) reveals catechinOglucoside as the dominant compound [J]. Food Chemistry, 2013, 139: 3543.
[2] MACHADO N, OPPOLZER D, RAMOS A, et al. Evaluating the freezing impact on the proximate composition of immature cowpea (Vigna unguiculata L.) pods: classical versus spectroscopic approaches [J]. Journal of the Science of Food and Agriculture, 2017, 97(13): 42954305.
[3] 吴圣勇, 谢文, 刘万才, 等. 我国豇豆蓟马研究进展及综合防控措施[J]. 植物保护, 2024, 50(2): 1018.
[4] HUAN Zhibo, LUO Jinhui, XU Zhi, et al. Residue, dissipation, and risk assessment of spinosad in cowpea under open field conditions [J]. Environmental Monitoring & Assessment, 2015, 187(11): 706713.
[5] XU Zhi, HUAN Zhibo, LUO Jinhui, et al. Simultaneous determination of eight pesticide residues in cowpeas by GCECD [J]. Journal of Chromatographic Science, 2017, 55(1): 16.
[6] AKOTO O, ANDOH H, DARKO G, et al. Health risk assessment of pesticides residue in maize and cowpea from Ejura, Ghana [J]. Chemosphere, 2013, 92(1): 6773.
[7] 盛桂林, 沈迎春. 韭菜、豇豆和芹菜的农药登记现状和病虫防控对策研究[J]. 现代农药, 2021, 20(6): 1215.
[8] 周鹏, 康小斐, 蒋雄武, 等. 豇豆、韭菜和芹菜农药残留限量标准比对研究[J]. 农产品质量与安全, 2022(5): 8388.
[9] 阳辛凤, 李萍萍, 刘春华, 等. 海南豇豆多菌灵、啶虫脒和阿维菌素残留及其膳食风险评估[J]. 南方农业学报, 2017, 48(11): 20102015.
[10]金国藩, 蒋士强, 王静, 等. 从“海南毒豇豆”事件看农产品食品安全监管与农残检测[J]. 食品安全导刊, 2010(4): 2325.
[11]SIMONDELSO N, AMARALROGERS V, BELZUNCES L P, et al. Systemic insecticides (neonicotinoids and fipronil): trends, uses, mode of action and metabolites [J]. Environmental Science and Pollution Research, 2015, 22(1): 534.
[12]刘刚, 黃晓伟, 杨传新, 等. 我国豇豆病虫害防治用药登记应用现状及对策建议[J]. 农药科学与管理, 2017, 38(3): 1522.
[13]毛连纲, 徐冬梅, 袁善奎, 等. 基于推荐用量分析我国新烟碱类杀虫剂的登记现状[J]. 植物保护, 2020, 46(5): 200210.
[14]李强, 邱海燕, 乐渊, 等. 超高效液相色谱串联质谱法测定豇豆中8种农药残留[J]. 植物保护, 2018, 44(1): 127131.
[15]李维, 孙俏俏. QuEChERSLCMS/MS法检测豇豆中的灭蝇胺残留量[J]. 山东化工, 2021, 50(20): 8183.
[16]WANG Ruifei, LIU Benju, ZHENG Qun, et al. Residue and dissipation of two formulations of emamectin benzoate in tender cowpea and old cowpea and a risk assessment of dietary intake [J/OL]. Food Chemistry, 2021, 361: 130043. DOI: 10.1016/j.foodchem.2021.130043.
[17]LI Jianming, LAN Tingting, YANG Guangqian, et al. Enantioselective evaluation of the chiral fungicide mandipropamid: dissipation, distribution and potential dietary intake risk in tomato, cucumber, Chinese cabbage and cowpea [J/OL]. Ecotoxicology and Environmental Safety, 2022, 232: 113260. DOI: 10.1016/j.ecoenv.2022.113260.
[18]方宗壮, 谢艳丽, 王萌, 等. 不同加工方法对豇豆中4种农药残留的影响[J]. 保鲜与加工, 2016, 16(3): 8086.
[19]龚久平, 杨晓霞, 余鸿燕, 等. 重庆市2018-2021年豇豆质量安全状况调查分析[J]. 南方农业, 2022, 16(13): 144148.
[20]TOOKER J F, PEARSONS K A. Newer characters, same story: Neonicotinoid insecticides disrupt food webs through direct and indirect effects [J]. Current Opinion in Insect Science, 2021, 46: 5056.
[21]ZHAO Yuanyuan, YANG Jiawen, REN Jinbo, et al. Exposure level of neonicotinoid insecticides in the food chain and the evaluation of their human health impact and environmental risk: An overview [J/OL]. Sustainability, 2020, 12(18): 7523. DOI: 10.3390/su12187523.
[22]余晉霞, 吕铖, 汪子夏, 等. 新烟碱类杀虫剂暴露对美国儿童青少年性激素水平的影响[J]. 环境与职业医学, 2021, 38(3): 223230.
[23]PRMA Health Canada. Reevaluation update for neonicotinoid insecticides [EB/OL]. (20131230) [20230227]. Http:∥www.hcsc.gc.ca/cpsspc/pubs/pest/_decisions/rev201315/indexeng.php.
[24]世界农化网. 法国将全面禁止新烟碱类农药[J]. 农药, 2016, 55(4): 249.
[25]EURLEX. Amending Implementing Regulation(EU) No 540/2011: as regards the conditions of approval of the active substances clothianidin, thiamethoxam and imidacloprid, and prohibiting the use and sale of seeds treated with plant protection products containing those active substances [EB/OL]. (20181219) [20230227]. Https:∥eurlex.europa.eu/eli/reg_impl/2013/485.
[26]THOMPSON D A, LEHMLER H J, KOLPIN D W, et al. A critical review on the potential impacts of neonicotinoid insecticide use: Current knowledge of environmental fate, toxicity, and implications for human health [J]. Environmental Scienceprocesses & Impacts, 2020, 22(6): 13151346.
[27]王霞, 张小刚, 丰东升, 等. 产品中新烟碱类农药前处理和检测技术研究进展[J]. 食品安全质量检测学报, 2020, 11(8): 24622468.
[28]劉佚玲, 曹云. 遵义市蔬菜质量安全风险评估[J]. 农技服务, 2019, 36(10): 4849.
[29]邱莉萍, 陈盼盼, 刘秀群, 等. 草莓中氟啶虫酰胺残留消解动态及膳食风险评估[J]. 农产品质量与安全, 2019(6): 5356.
[30]CRADDOCK H A, HUANG Dina, TURNER P C, et al. Trends in neonicotinoid pesticide residues in food and water in the United States, 1999-2015 [J]. Environmental Health, 2019, 18(1): 710.
