胡黄连苷Ⅱ调节cAMP/PKA信号轴对脊髓损伤大鼠神经功能恢复的影响
2024-05-23范雁东王佳明马木提江木尔提扎罗坤
范雁东 王佳明 马木提江·木尔提扎 罗坤
脊髓损伤(spinal cord injury,SCI)是指交通事故、战时、自然灾害等造成的脊柱骨折,合并脊髓和神经根损伤,是一种破坏性的神经和病理状态,可导致主要的运动、感觉和自主神经功能障碍[1]。全球范围内SCI的发病率为10.4~83.0例/百万/年,是社会发病负担的重要来源。对于急性SCI的管理策略包括早期手术减压和固定、使用血管加压药物增加平均动脉血压、使用皮质类固醇等,最近使用去甲肾上腺素作为神经重症监护策略,但对神经保护和再生的作用有限[2],因此,需要探索新型治疗制剂。有研究发现,胡黄连苷Ⅱ(picroside Ⅱ,PⅡ)是从胡黄连提取的环烯醚萜类化合物,具有抗氧化、抗炎、抗凋亡活性,能够抑制脊髓反应性星形胶质细胞介导的神经炎症,减轻慢性缩窄性损伤诱导的大鼠神经性疼痛[3],但对SCI神经功能的研究较少。此外,激活环磷酸腺苷(cyclic adenosine monophosphate,cAMP)-蛋白激酶A(protein kinase A,PKA)信号可以改善SCI后炎症[4],PⅡ是否能通过调节cAMP/PKA通路改善SCI神经功能尚不清楚,因此,本研究借助SCI大鼠模型,探究PⅡ对其神经功能的影响及相关cAMP/PKA通路的调节作用,以期为临床治疗提供更多参考。
1 材料与方法
1.1 实验动物 SD雄性大鼠(220~240 g),购自河南省实验动物中心[SCXK(豫)-2022-0001]。饲养环境为12 h/12 h光暗循环,温度(25±1)℃,湿度(50±5)%,实验操作遵守相关规定。
1.2 试剂 PⅡ(纯度≥98%,G0174),购自美国Merck公司;PKA抑制剂H-89(HY-15979),购自美国MCE公司;劳克坚牢蓝(LuxolFastBlue, LFB)染液,购自南京信帆生物技术有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、cAMP ELISA试剂盒,购自北京四正柏有限公司;一抗磷酸化(p)-PKA、PKA、p-环磷酸腺苷反应成分结合蛋白(CREB)、CREB,购自美国Abcam公司。
1.3 方法
1.3.1 造模与分组:①造模:大鼠吸入乙醚至完全麻醉后,俯位固定,背部剃毛并消毒,计数肋骨以确定(第10胸椎)T10水平,以T10水平为中心作3 cm长纵向切口,剥离椎旁肌,去除棘突和椎板,暴露(第9胸椎)T9~T10节段脊髓;在3 cm高度使10 g NYU打击器自由下落击打T9~T10节段脊髓,随后脊髓充血、水肿,大鼠后肢和尾部抽搐,表示SCI大鼠模型建立成功[5]。为预防感染,建模大鼠伤口缝合后连续3 d皮下注射105U·kg-1·d-1青霉素G。②分组:大鼠适应1周,将其分为正常组(CT组)、SCI模型组(SCI组)、PⅡ低剂量组(PⅡ L组)、PⅡ高剂量组(PⅡ H组)和PⅡ高剂量组+H-89组(PⅡ H+H-89组),每组18只。除CT组外的所有大鼠按上述方法建立SCI模型并注射青霉素G,CT组大鼠仅暴露T9~T10节段脊髓不损伤脊髓;PⅡ溶于1×PBS获得2 mg/mL PⅡ溶液,PⅡ L组、PⅡ H组分别腹腔注射5 mg·kg-1·d-1、20 mg·kg-1·d-1PⅡ[3];PⅡ H+H-89组腹腔注射20 mg·kg-1·d-1PⅡ+5 mg·kg-1·d-1H-89[6];CT组和SCI组大鼠腹腔注射适量0.9%氯化钠溶液,给药时间从造模后第3天开始持续2周。
1.3.2 运动功能评分:使用Basso-Beattie-Bresnahan(BBB)评分评价大鼠的运动功能恢复情况[7]。观察大鼠行走时臀、膝、踝关节及躯干运动及协调情况,以0~21分做等级评估,0代表完全不能运动,21代表正常运动,每增加1分代表运动功能逐渐恢复,分别在给药期0、7、14 d做BBB评分。
1.3.3 脊髓组织病理学特征检测:给药结束后每组选取6只大鼠,吸入乙醚麻醉,打开大鼠胸腔暴露心脏,剪开右心耳,在心尖处注入4℃ PBS至内脏变白,将PBS换成4%多聚甲醛,注射至组织变硬,分离脊柱,去除肌肉及椎骨,以损伤部位为中心取1 cm长的脊髓组织,固定于4%多聚甲醛中12 h,脱水,石蜡包埋并做横向切片,HE染液染色,二甲苯做透明处理,封片,使用低、高倍显微镜观察组织病理学特征。
1.3.4 脱髓鞘情况检测:取1.3.3脊髓组织石蜡切片行LFB染色。切片用蒸馏水清洗,加入0.1%LFB溶液60℃下密封浸染8 h;蒸馏水清洗,加入95%乙醇分色;0.05%碳酸锂水溶液分色10 s;再加入70%乙醇继续分色,直至显微镜下观察灰、白质区分清晰为止;滴加0.25%焦油紫与冰醋酸染液复染10 min,再次使用70%乙醇将复染颜色分至细胞核及尼氏体呈红色;使用滤纸沾尽多余液体,加入正丁醇脱水2次,每次脱水5 min;二甲苯透明,封片,显微镜下观察,髓鞘呈鲜蓝色,核呈深蓝色,统计LFB阳性组织比例。
1.3.5 星形胶质细胞、小胶质细胞活化增生情况检测:每组选择6只大鼠,麻醉,打开胸腔,使用钝器分离出损伤部位处1 cm长的脊髓组织,PBS清洗,立即放入4%多聚甲醛过夜,乙醇梯度脱水,包埋剂包埋,切制5 μm切片。将切片置于抗原修复液内煮沸3次修复抗原,冷却,使用胎牛血清封闭30 min,胶质纤维酸性蛋白(GFAP)、离子钙结合适配器分子-1(IBA-1)一抗稀释液封闭过夜,FITC标记二抗稀释液孵育1 h,DAPI染液孵育5 min,清洗切片,封片,荧光显微镜下观察视野下GFAP、IBA-1阳性细胞。
1.3.6 MDA、SOD、cAMP含量检测:将每组剩余6只大鼠麻醉,取损伤处脊髓组织,剪碎、匀浆,一半匀浆液-80℃储存,剩余匀浆液离心取上清,根据ELISA试剂盒操作要求检测MDA、SOD、cAMP含量。
1.3.7 p-PKA、PKA、p-CREB、CREB蛋白表达检测:取1.3.6匀浆液,定量蛋白浓度,配制PAGE凝胶,点样,电泳、转膜后,封闭含样品PVDF膜,置于p-PKA、PKA、p-CREB、CREB稀释液中过夜,二抗孵育2 h,加入发光液, Tanon 1600拍照,分析蛋白表达水平。
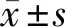
2 结果
2.1 5组大鼠BBB评分比较 给药0.7、14 d,与CT组比较,SCI组大鼠BBB评分降低(P<0.05);给药7.14 d与SCI组比较,PⅡ L组、PⅡ H组BBB评分剂量依赖性升高(P<0.05);与PⅡ H组比较,PⅡ H+H-89组BBB评分降低(P<0.05)。见表1。
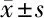
表1 5组大鼠BBB评分比较 n=18,分,
2.2 5组大鼠脊髓组织病理学特征
2.2.1 低倍镜:CT组大鼠组织完整;SCI组大鼠组织缺损较严重,空腔多见;与SCI组大鼠比较,PⅡ L组、PⅡ H组大鼠的组织损伤情况有所改善,空腔减少;PⅡ H+H-89组大鼠组织缺损,与SCI组大鼠情况类似。见图1。

图1 5组大鼠脊髓组织HE染色情况(×100)
2.2.2 高倍镜:CT组组织及细胞生长状态良好;SCI组损伤局部出现大量炎性细胞浸润;与SCI组比较,PⅡ L组、PⅡ H组炎性细胞数量减少;与PⅡ H组比较,PⅡ H+H-89组炎性细胞浸润增加。见图2。

图2 5组大鼠脊髓组织HE染色情况(×400)
2.3 5组大鼠脊髓组织脱髓鞘比较
2.3.1 LFB染色结果:与CT组比较,SCI组大鼠脱髓鞘增加,LFB染色阳性比例显著减少(P<0.05);与SCI组比较,PⅡ L组、PⅡ H组脱髓鞘呈剂量依赖性降低,LFB染色阳性比例显著增加,差异有统计学意义(P<0.05);与PⅡ H组比较,PⅡ H+H-89组脱髓鞘增加,LFB染色阳性比例显著减少,差异有统计学意义(P<0.05)。见表2。
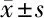
表2 5组大鼠脊髓组织LFB染色阳性比较 n=6,%,
2.3.2 高倍镜:CT组髓鞘排列紧密、完整;SCI组可见大量髓鞘空泡,呈严重的脱髓鞘现象;PⅡ L组、PⅡ H组较SCI组空泡显著减少,排列更加紧密;PⅡ H+H-89组呈现脱髓鞘现象。见图3、4。

图3 5组大鼠脊髓组织LFB染色(×100)
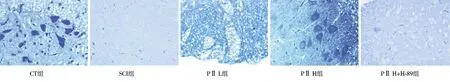
图4 5组大鼠脊髓组织LFB染色(×400)
2.4 5组大鼠脊髓组织星形胶质细胞、小胶质细胞活化增生比较 与CT组比较,SCI组大鼠的脊髓组织GFAP阳性细胞数、IBA-1阳性细胞数增加,差异均有统计学意义(P<0.05);与SCI组比较,PⅡ L组、PⅡ H组GFAP阳性细胞数、IBA-1阳性细胞数呈剂量依赖性降低,差异有统计学意义(P<0.05);与PⅡ H组比较,PⅡ H+H-89组GFAP阳性细胞数、IBA-1阳性细胞数增加,差异均有统计学意义(P<0.05)。见表3,图5、6。
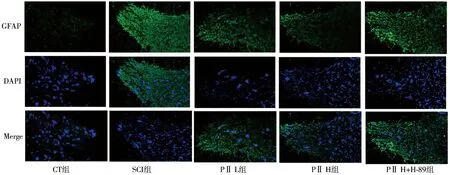
图5 5组大鼠脊髓组织星形胶质细胞免疫荧光染色(×200)

图6 5组大鼠脊髓组织小胶质细胞免疫荧光染色(×200)
表3 5组大鼠脊髓组织GFAP、IBA-1阳性细胞数比较 n=6,个,
2.5 5组大鼠脊髓组织MDA、SOD、cAMP含量比较 与CT组比较,SCI组MDA含量增加,SOD、cAMP含量降低(P<0.05);与SCI组比较,PⅡ L组、PⅡ H组MDA含量减少,SOD、cAMP含量增加,且呈剂量依赖性(P<0.05);与PⅡ H组比较,PⅡ H+H-89组MDA含量增加,SOD、cAMP含量降低(P<0.05)。见表4。
表4 5组大鼠脊髓组织MDA、SOD、cAMP含量比较 n=6,
2.6 5组大鼠脊髓组织p-PKA、PKA、p-CREB、CREB蛋白表达水平比较 与CT组比较,SCI组p-PKA/PKA、p-CREB/CREB蛋白表达水平降低(P<0.05);与SCI组比较,PⅡ L组、PⅡ H组p-PKA/PKA、p-CREB/ CREB蛋白表达水平呈剂量依赖性增加(P<0.05);与PⅡ H组比较,PⅡ H+H-89组p-PKA/PKA、p-CREB/
CREB蛋白表达水平降低(P<0.05)。见图7,表5。
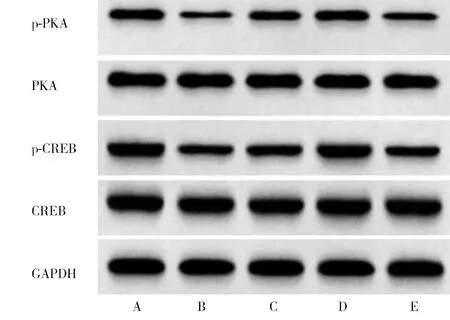
图7 5组大鼠脊髓组织蛋白表达水平;A CT组;B SCI组;C PⅡ L组;D PⅡ H组;E PⅡ H+H-89组
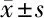
表5 5组大鼠脊髓组织蛋白表达水平比较 n=6,
3 讨论
SCI是一种危及生命的神经系统疾病,男性发病率更高,除了造成医疗相关经济负担外,尤其对截肢、瘫痪患者肠道、性功能、心理障碍的影响也是毁灭性的[8],因此,亟须开发治疗SCI的新策略。PⅡ基于其抗炎、抗氧化、抗凋亡特性,已经被用于预防和治疗器质性缺血/再灌注损伤、炎症、肝损伤、癌症转移及血管生成[9]。本研究主要探究PⅡ对SCI大鼠神经功能恢复的影响。
SCI分为原发性损伤和继发性损伤,原发性损伤由机械损伤、牵引力、挤压等引起脊髓通道血肿、缺血性梗死等;继发性损伤指在SCI数小时或数天后,由于缺血灌注受损导致的出血、脱髓鞘、水肿和空腔形成,并伴有轴突和神经元坏死及神经组织的一系列病理变化,进一步增加梗死[10]。本研究中,SCI模型大鼠BBB评分降低,受损脊髓组织缺损严重,空腔多,出现大量炎性细胞浸润且髓鞘减少,说明模型构建成功;PⅡ干预可以升高SCI模型大鼠BBB评分和髓鞘数量,组织损伤情况有所改善,空腔及炎性细胞浸润减少,说明PⅡ可以帮助SCI大鼠恢复运动功能,减少损伤、炎性反应及脱髓鞘。
SCI继发性损伤后,神经胶质细胞与外周免疫细胞一同对具有异质修复和病理特性的损伤产生强烈的炎性反应,并成为SCI治疗修饰的目标[11]。星形胶质细胞是中枢神经系统中数量最多的神经胶质细胞,对中枢神经系统生理学至关重要,并在维持稳态、突触可塑性发展和神经保护方面发挥重要作用,星形胶质细胞在SCI、慢性疼痛、退行性疾病、神经肿瘤及其他神经系统疾病中通过反应性增生发挥不利影响[12]。SCI引起的免疫反应由背角和腹角的小胶质细胞激活主导,揭示小胶质细胞激活/增生与运动功能神经元和感觉传入神经受损有关[13]。GFAP和IBA-1分别是星形胶质细胞和小胶质细胞的标志物,研究发现SCI大鼠受损周围脊髓组织GFAP和IBA-1表达升高,代表星形胶质细胞和小胶质细胞活化增生,从而加剧继发性损伤[5,14]。本研究与之一致,SCI大鼠受损脊髓组织GFAP和IBA-1表达增加,这种异常变化可以被PⅡ抑制,提示PⅡ可有效抑制星形胶质细胞和小胶质细胞的增生,为突触再生创造有益条件,减少神经炎性反应。
cAMP是维持细胞代谢和生理功能的重要物质,在G蛋白结合-耦联受体联合作用下激活腺苷酸环化酶(ACs),促进释放[15]。PKA是cAMP的主要靶点,cAMP可以结合PKA并诱导PKA磷酸化,继而促进CREB磷酸化并启动转录,形成cAMP/PKA/CREB信号通路控制细胞生长过程[16]。激活cAMP/PKA/CREB信号可以抑制神经元凋亡,改善神经细胞营养和能量不足,缓解SCI[17]。本研究提示,SCI大鼠脊髓组织cAMP、p-PKA/PKA、p-CREB/CREB表达减少,说明cAMP/PKA信号轴抑制;PⅡ干预可以增加SCI大鼠cAMP、p-PKA/PKA、p-CREB/CREB的表达,其对神经功能的恢复作用可能与上调cAMP/PKA信号轴有关。使用cAMP/PKA抑制剂H-89联合PⅡ干预SCI大鼠,其完全逆转PⅡ的治疗作用,验证了PⅡ对SCI大鼠神经功能的恢复作用与激活cAMP/PKA信号通路有关。此外,我们还检测了脊髓组织MDA、SOD的含量。MDA和SOD是氧化应激反应中的重要成员,MDA是自由基与脂质作用发生过氧化反应的产物,具有细胞毒性,促进细胞衰老;SOD能够抵消氧自由基对细胞的损伤,修复受损细胞[18-19]。研究发现,通过减少氧化应激反应可以减少细胞凋亡,改善SCI大鼠的运动功能[20]。本研究中,PⅡ逆转了SCI大鼠脊髓组织MDA含量增加、SOD含量降低,提高BBB评分,可能也是PⅡ在SCI中的另一个作用机制。
综上所述,PⅡ可能通过激活cAMP/PKA信号轴促进SCI大鼠神经功能恢复。
