EGFR基因突变对宫颈癌容积旋转调强放疗的效果及预后的影响
2024-05-23陈建
陈建
宫颈癌是一种多发于中年女性的妇科肿瘤,其发病机制较为复杂,主要是由多理化、多因素、多基因等因素联合导致,与早产多育、不良性行为、环境、病毒感染、吸烟等相关,而人头瘤病毒感染为主要致病原因,对患者生命安全威胁较大[1-3]。在宫颈癌治疗中放疗具有重要地位,调强放疗随着放疗技术的进步逐渐应用于宫颈癌的治疗中,容积旋转调强放疗可对不同靶区组织进行不同剂量的照射,进而克服了常规照射造成的直肠、膀胱、小肠较高剂量照射的损伤,提升肿瘤控制率的同时改善患者的生活质量[4]。表皮生长因子受体(EGFR)是一种可能参与血管生成、细胞增殖的原癌基因表达产物,在多种肿瘤中均呈较高r 表达,EGFR为癌症药物常用靶点,但关于EGFR基因突变后容积旋转调强放疗对宫颈癌治疗效果的研究报道较少[5]。基于此,本研究中分析EGFR基因突变对容积旋转调强放疗治疗宫颈癌的临床疗效及对预后的影响,报道如下。
1 资料与方法
1.1 一般资料 选取我院2019~2021年收治的EGFR基因突变宫颈癌(18号染色体上外显子点突变)患者50例为研究组,另选取同期EGFR基因未突变宫颈癌患者50例为对照组。2组一般资料比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准。见表1。

表1 2组一般资料比较 n=50
1.2 纳入与排除标准
1.2.1 纳入标准:患者符合《妇产科学》[6]中的诊断标准,均经病理学检查确诊。
1.2.2 排除标准:①既往有子宫手术史者;②有严重出血倾向者;③预计生存期<3个月;④存在放化疗禁忌者;⑤合并其他肿瘤;⑥合并严重脑、肺、心疾病者;⑦不能或不愿意配合定期随访者。
1.3 方法 2组患者均行顺铂化疗,顺铂(山东凤凰制药股份有限公司,规格 2 mL∶10 mg),静脉滴注,50 mg/周,共4~5次,在上述基础上给予容积旋转调强放疗,取患者仰卧位,双腿自然并拢,双手置于额眉,热塑体膜固定,后行CT扫描,扫描应在充盈膀胱后,自然呼吸状态下进行,第三腰椎上缘至坐骨结节下缘下5 cm为扫描范围,层间距为0.3~0.5 cm,扫描完成后将数据上传至工作站,放疗医师进行危及器官、靶区勾画,完成后行放疗,给予宫颈病灶、宫旁组织、宫体D95%55Gy,直肠、股骨头、膀胱V40Gy≤5%,双肾V20Gy≤32%,小肠V30Gy≤40%,脊髓V1ccGy≤50%,5次/周,共25次。处方剂量要求:(1)处方剂量应包绕靶区95%;(2)临床靶体积内无冷点,计划靶区无热点,直肠前、旁观后无高剂量区,对治疗机摆位进行核实,确认无误后进行治疗。
1.4 观察指标
1.4.1 临床疗效:2组患者临床疗效依照实体瘤疗效评价标准[7]进行评估。①完全缓解:肿瘤病灶消失时间≥4周;②稳定:肿瘤病灶两径乘积减少>50%时间≥4周;肿瘤病灶两径乘积减少或增大<25%;③病变进展:瘤病灶两径乘积增大≥25%。客观缓解率=(完全缓解+部分缓解)/总例数×100%;疾病控制率=(完全缓解+部分缓解+部分缓解)/总例数×100%。
1.4.2 免疫功能指标:2组患者治疗前1 d、治疗结束后1 d早晨采集4 mL空腹静脉血,置于促凝管中,低温离心(3 000 r/min)10 min,上清液吸取后置于-70℃冰箱中。流式细胞仪检测2组患儿CD3+、CD4+、CD8+水平,计算CD4+/CD8+。
1.4.3 肿瘤标志物:2组患者治疗前1 d、治疗结束后1 d早晨采集4 mL空腹静脉血,置于促凝管中,低温离心(3 000 r/min)10 min,上清液吸取后置于-70℃冰箱中。化学发光免疫分析检测2组患者糖类抗原125(CA125)、鳞状细胞癌抗原(SCC-Ag)、癌胚抗原(CEA)水平。
1.4.4 基质金属蛋白酶、生长因子:2组患者治疗前1 d、治疗结束后1 d早晨采集4 mL空腹静脉血,置于促凝管中,低温离心(3 000 r/min)10 min,上清液吸取后置于-70℃冰箱中。2组患者基质金属蛋白酶-2(MMP-2)、MMP-9、血管内皮生长因子(VEGF)、碱性纤维细胞生长因子(bFGF)水平通过酶联免疫吸附测定(ELISA)进行检测,孔中加入10 μL待测样品、40 μL待测样品稀释液,摇晃均匀,加入酶标试剂100 μL,封板并孵育60 min(37℃),将孔中液体弃去,Wash Sohltion重复清洗后加入50 μL显色剂,摇晃均匀,显色处理15 min(37℃),后面再加入终止液50 μL,OD值在450 nm波长下检测,然后检查MMP-2、MMP-9、VEGF、bFGF的水平情况。
1.4.5 预后情况:统计2组患者6个月生存率、1年生存率。
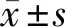
2 结果
2.1 2组患者临床疗效比较 与对照组比较,研究组患者客观缓解率、疾病控制率较高,差异有统计学意义(P<0.05)。见表2。

表2 2组患者临床疗效比较 n=50,例(%)
2.2 2组患者免疫功能比较 治疗前,2组患者CD3+、CD4+、CD8+、CD4+/CD8+水平差异均无统计学意义(P>0.05);治疗后,2组患者CD3+、CD4+、CD4+/CD8+水平降低,CD8+水平升高(P<0.05);与对照组比较,研究组CD3+、CD4+、CD4+/CD8+升高,CD8+水平降低(P<0.05)。见表3。
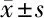
表3 2组患者免疫功能比较 n=50,
2.3 2组患者肿瘤标志物水平比较 治疗前,2组患者CA125、SCC-Ag、CEA水平差异均无统计学意义(P>0.05);治疗后,2组患者CA125、SCC-Ag、CEA水平降低,且研究组较低(P<0.05)。见表4。
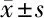
表4 2组患者肿瘤标志物水平比较 n=50,
2.4 2组患者基质金属蛋白酶水平比较 治疗前,2组患者MMP-2、MMP-9水平差异均无统计学意义(P>0.05);治疗后,2组患者MMP-2、MMP-9水平降低,且研究组较低(P<0.05)。见表5。
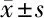
表5 2组患者基质金属蛋白酶水平比较 n=50,ng/mL,
2.5 2组患者生长因子水平比较 治疗前,2组患者VEGF、bFGF水平差异均无统计学意义(P>0.05);治疗后2组患者VEGF、bFGF水平降低,且研究组较低,差异均有统计学意义(P<0.05)。见表6。
表6 2组患者生长因子水平比较 n=50,
2.6 2组患者预后情况比较 与对照组比较,研究组患者6个月生存率、1年生存率较高,差异有统计学意义(P<0.05)。见表7。
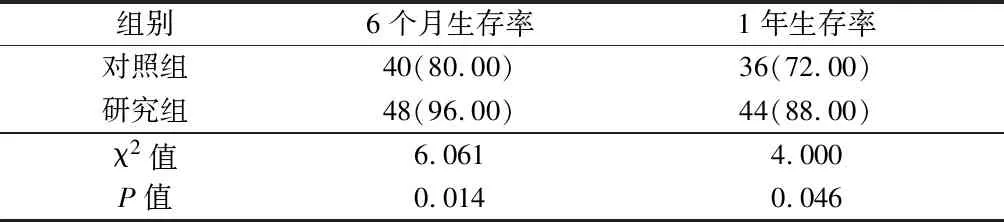
表7 2组患者预后情况比较 n=50,例(%)
3 讨论
宫颈癌的主要发病机制为高危HPV感染,多数患者早期症状并不明显,导致确诊时已为中晚期,失去了手术治疗的最佳时期[8-10]。但是近年来发现,越来越多的宫颈癌患者存在EGFR基因突变情况,EGFR基因突变多发于络氨酸激酶区域,主要包括18号外显子746-759、21号外显子L858R缺失,18号外显子G719DS、20号外显子T790M突变,上述EGFR基因突变均可对放疗效果造成影响,故分析EGFR基因突变对容积旋转调强放疗治疗宫颈癌的影响,对患者治疗方案制定及预后改善具有重要意义[11]。
宫颈上皮内瘤变为宫颈癌形成的基础,因此对患者进行精准治疗为生存率提升的关键,调强放疗为宫颈癌放疗中的常用方法,不仅可减少患者不良反应,且能提升治疗效果[12]。容积旋转调强放疗可利用三维治疗计划系统、CT影像学进行重建,进而对肿瘤靶区范围、危及器官进行准确定义,后通过逆向的放射治疗计划获得高度适形的靶区三维剂量分布,在确保足量照射肿瘤靶区的同时保护了正常组织,使得放射治疗增益比提升,肿瘤局部控制率提升,最终改善了患者预后[13]。本研究发现,EGFR基因突变可使容积旋转调强放疗治疗宫颈癌的疗效提升,且可改善患者预后。
T细胞亚群可通过影响机体免疫状态而参与肿瘤的发生发展,而放疗在杀灭肿瘤细胞时易对机体正常组织造成损伤,进而影响了机体免疫功能[14]。肿瘤标志物为癌细胞发生发展、转移、浸润期间分泌的活性物质,在非肿瘤患者体液中含量较低或不存在,而在肿瘤患者血液中则呈现不同程度的升高,故肿瘤标志物为肿瘤早期发现及治疗效果评估的重要方法[15-17]。本研究发现,EGFR基因突变宫颈癌患者容积旋转调强放疗治疗后CD3+、CD4+、CD4+/CD8+、CA125、SCC-Ag、CEA水平均较低,CD8+水平较高,提示EGFR基因突变可减轻容积旋转调强放疗治疗造成的免疫损伤,且有利于肿瘤标志物下降。CD3+、CD4+、CD8+均为T淋巴细胞组成细胞,其中CD3+、CD4+是可增强机体免疫的辅助性T细胞,而CD8+为具有细胞毒杀功能的细胞毒性细胞,当上述细胞表达失衡可造成机体免疫功能异常,进而对放疗效果造成了不利影响。郑顺杰等[18]发现,CA125、SCC-Ag、CEA均为典型肿瘤标志物,其水平变化与患者病理分期、预后均具有一定相关性。容积旋转调强放疗可精准照射肿瘤靶区,有利于肿瘤增殖、分裂的抑制,且对机体免疫功能影响较小。梅馨方等[19]研究发现,EGFR控制细胞分化、增殖、分裂的任一环节受破坏或干扰均可造成细胞失控,而EGFR基因突变与肿瘤标志物表达水平相关,EGFR基因突变可成为放化疗药物奏效的重要靶标。
研究表明,宫颈癌的发生发展与细胞外基质降解存在密切联系,基底膜完整性受损可促进癌细胞浸润、转移,且可加速新生血管形成,造成了宫颈癌患者不良预后[20]。本研究发现,EGFR基因突变宫颈癌患者容积旋转调强放疗治疗后MMP-2、MMP-9、VEGF、bFGF水平均较低,提示EGFR基因突变可提升容积旋转调强放疗治疗宫颈癌的临床疗效,进而降低MMP-2、MMP-9、VEGF、bFGF水平,抑制了新生血管形成,改善了预后。晏军等[21]研究表明,MMP-2、MMP-9均为明胶酶,可降解基底膜及结缔组织,其中MMP-2对血浆纤维连接蛋白、层黏蛋白等基底膜主要成分具有分解作用,而MMP-9可分解巢蛋白。卢书芳等[22]研究表明,VEGF是具有增强血管通透性、促进基质金属蛋白酶合成、改变血管内皮细胞基因表达方式等作用的二聚体糖蛋白;bFGF同样对肿瘤新生血管生成具有促进作用,VEGF、bFGF表达上升可造成血管增殖紊乱,进而促进了肿瘤生长,最终导致患者预后不良。容积旋转调强放疗可对机架旋转角度进行优化,且可调制靶区强度,从在保护危及器官的同时提升了肿瘤局部疗效,进而促进降低血清MMP-2、MMP-9、VEGF、bFGF水平[23]。
综上所述,EGFR基因突变可改善容积旋转调强放疗治疗宫颈癌的临床疗效,且可提升患者生存率,改善预后。
