白头翁皂苷 D 通过调控 circ_0001178/miR-885-5p 对甲状腺癌细胞的生物学行为的影响
2024-05-23潘巧虹周影颜卫文李莉孙雯陶桂兰肖欢
潘巧虹 周影 颜卫文 李莉 孙雯 陶桂兰 肖欢
甲状腺癌是临床常见的一种恶性肿瘤,银杏叶等天然植物的提取物具有清除氧自由基与抗甲状腺癌等作用,其作用途径主要涉及多个基因或信号通路[1-4]。白头翁皂苷 D 属于毛茛科植物白头翁的主要活性成分,其具有抗肿瘤作用,并可抑制乳腺癌细胞增殖[5]。但白头翁皂苷 D 与甲状腺癌的相关研究相对较少。环状 RNA(circular RNA,circRNA)是一类闭合的非编码RNA分子并可能参与多种疾病发生发展过程。研究显示,circ_0001178 在结直肠癌中表达上调,并可充当多个 miRNA 的海绵分子而促进结直肠癌细胞迁移及侵袭[6]。生物信息学预测显示circ_0001178 与 miR-885-5p 存在结合位点,研究表明 miR-885-5p 在甲状腺癌中表达水平降低,circ_0004458 可通过抑制 miR-885-5p 表达而促进甲状腺癌的发展[7]。但circ_0001178/miR-885-5p 是否参与甲状腺癌形成及发展过程,是否可作为白头翁皂苷 D 治疗甲状腺癌的潜在靶点尚未可知。因此,本研究主要探讨白头翁皂苷 D 是否可通过调控 circ_0001178/miR-885-5p 分子轴而影响甲状腺癌细胞的恶性生物学行为。
1 材料与方法
1.1 材料与试剂 白头翁皂苷 D(纯度≥98%)购自南京春秋生物工程有限公司;人甲状腺癌细胞 SW579 购自上海通蔚生物;DMEM 培养液与胎牛血清购自美国 Gibco;Trizol 试剂购自北京全式金生物;逆转录试剂与荧光定量 PCR 试剂购自北京天根生化;Lipofectamine2000、MTT、Transwell 小室、Matrigel 基质胶购自北京索莱宝;si-NC、si-circ_0001178、miR-NC、miR-885-5p mimics、anti-miR-885-5p 购自广州锐博生物;pcDNA3.1 与pcDNA-circ_0001178 购自美国Invitrogen;兔抗人 E-cadherin、N-cadherin 抗体与 HRP 标记的山羊抗兔 IgG 二抗购自美国 Santa Cruz。
1.2 方法
1.2.1 实验分组:白头翁皂苷 D 溶解于 DMSO(体积分数<0.1%)中,储存浓度为 100 nmol/mL,根据需求用培养基稀释成所需浓度(20、50、100 nmol/mL)[8],SW579 细胞按照每孔 1×104个细胞的密度接种于 24 孔板,分别加入含有不同浓度的白头翁皂苷 D 培养 24 h,分别记为白头翁皂苷 D-L 组、白头翁皂苷 D-M 组、白头翁皂苷 D-H 组。将未经处理的SW579 细胞正常培养记为对照组。用脂质体转染技术分别将 si-NC、si-circ_0001178、miR-NC、miR-885-5p mimics 转染至 SW579 细胞中,分别记为 si-NC 组、si-circ_0001178 组、miR-NC 组、miR-885-5p 组。用脂质体转染技术分别将 pcDNA-circ_0001178、anti-miR-885-5p 转染至 SW579 细胞后加入含有浓度为 100 nmol/mL 白头翁皂苷 D 的培养液培养 24 h,分别记为白头翁皂苷 D+pcDNA-circ_0001178 组、白头翁皂苷 D+anti-miR-885-5p 组。
1.2.2 qRT-PCR 检测 circ_0001178、miR-885-5p 的表达水平:用 Trizol 试剂提取 SW579 细胞总 RNA,RNA 定量后将 RNA 逆转录合成 cDNA,以 cDNA 为模板进行PCR 扩增,按照荧光定量 PCR 试剂盒说明书检测 circ_0001178、miR-885-5p 相对表达量。
1.2.3 MTT 检测细胞增殖:取各组 SW579 细胞按照每孔 3 000 个细胞的密度接种于 96 孔板,每孔分别加入 20 μL MTT 溶液,于培养箱内继续培养 4 h 后弃培养液,每孔加入 150 μL DMSO 溶液,室温孵育 10 min 后酶标仪检测 490 nm 波长处的吸光度值(OD 值)。
1.2.4 平板克隆形成实验:取各组 SW579 细胞按照每孔 1 000 个细胞的密度接种于 6 孔板,于培养箱内培养 14 d,直至出现细胞克隆,用 4%多聚甲醛固定 20 min,用 0.1%结晶紫染色液染色 15 min,统计细胞克隆形成数。
1.2.5 Transwell 实验检测细胞迁移与侵袭:用不含血清的培养液培养各组 SW579 细胞 12 h,迁移实验:在小室的上室与下室分别加入200 μL SW579 细胞悬液和 600 μL 含有 10%胎牛血清的培养液,24 h 后用多聚甲醛固定细胞后再用结晶紫染色液染色 15 min,于显微镜下观察并计数。侵袭实验:将 Matrigel 基质胶稀释液加入小室的上室(40 μL/孔),待其凝固,后续实验同迁移实验。
1.2.6 双荧光素酶报告基因检测circ_0001178 与 miR-885-5p 的靶向结合位点:将 circ_0001178 与 miR-885-5p 的结合序列及其突变序列克隆至 psi-CHECK 载体荧光素酶报告基因载体中,分别构建野生型载体 WT-circ_0001178 与突变型载体 MUT-circ_0001178,将 SW579 细胞按照每孔 1×105个细胞的密度接种于 6 孔板,常规培养 24 h 后,待细胞融合度达到70%时用脂质体转染技术分别将 WT-circ_0001178、MUT-circ_0001178 分别与 miR-NC、miR-885-5p mimics 共转染至 SW579 细胞中,转染 48 h 后收集细胞并按照荧光素酶检测试剂盒说明书检测其荧光素酶活性。
1.2.7 Western blot 检测 E-cadherin、N-cadherin 蛋白表达:用蛋白裂解液提取各组 SW579 细胞总蛋白,SDS-PAGE 电泳分离蛋白,反应结束后将蛋白样品转移至 PVDF 膜上,用封闭液封闭 PVDF 膜 1 h,加入 E-cadherin(1∶1 000)、N-cadherin(1∶1 000)、GAPDH(1∶3 000)一抗 4℃ 孵育 24 h,加入二抗(1∶5 000)室温孵育 2 h,曝光显影后ImageJ 软件分析蛋白条带灰度值。
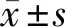
2 结果
2.1 白头翁皂苷 D 对 SW579 增殖的影响 与对照组比较,白头翁皂苷 D-L 组、白头翁皂苷 D-M 组、白头翁皂苷 D-H 组circ_0001178 的表达量降低(P<0.05),miR-885-5p 的表达量升高(P<0.05),细胞活力降低(P<0.05),克隆形成数减少(P<0.05),且不同剂量组间比较差异有统计学意义(P<0.05)。见表1。
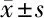
表1 白头翁皂苷D 抑制 SW579 增殖 n=3,
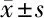
表2 白头翁皂苷D 抑制 SW57 迁移、侵袭 n=3,
2.2 白头翁皂苷 D 对 SW579 迁移、侵袭的影响 与对照组比较,白头翁皂苷 D-L 组、白头翁皂苷 D-M 组、白头翁皂苷 D-H 组迁移及侵袭细胞数减少,差异有统计学意义(P<0.05),白头翁皂苷 D 抑制N-cadherin表达而促进E-cadherin 表达(P<0.05),且呈剂量依赖性。见图1,表 2。

图1 白头翁皂苷 D 对 SW579 迁移、侵袭及 E-cadherin、N-cadherin 蛋白表达的影响;1 对照组;2 白头翁皂苷D-L组;3 白头翁皂苷D-M组;4 白头翁皂苷 D-H组
2.3 干扰 circ_0001178 对 SW579 增殖、迁移、侵袭的影响 与 si-NC 组比较,si-circ_0001178 组 miR-885-5p 的表达量升高(P<0.05),细胞活力降低(P<0.05),克隆形成数、迁移及侵袭细胞数减少(P<0.05),N-cadherin 蛋白水平降低(P<0.05),E-cadherin 蛋白水平升高(P<0.05)。见图2,表3。
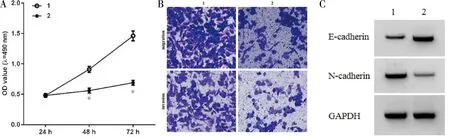
图2 干扰circ_0001178 对 SW579 细胞活性迁移侵袭及E-cadherin、N-cadherin 蛋白表达的影响;1 si-NC;2 si-circ_0001170
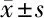
表3 干扰circ_0001178 抑制 SW579 增殖、迁移、侵袭 n=3,
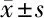
表4 miR-885-5p 抑制 SW579 增殖、迁移、侵袭 n=3,
2.4 miR-885-5p 对 SW579 增殖、迁移、侵袭的影响 与 miR-NC 组比较,miR-885-5p 组细胞活力降低(P<0.05),克隆形成数、迁移及侵袭细胞数减少(P<0.05),N-cadherin 蛋白水平降低(P<0.05),E-cadherin 蛋白水平升高,差异有统计学意义(P<0.05)。见图3,表 4。

图3 miR-885-5p 对 SW579 细胞活性迁移侵袭及E-cadherin、N-cadherin 蛋白表达的影响;1 miR-NC;2 miR-885-5p
2.5 circ_0001178 靶向 miR-885-5p circ_0001178 与 miR-885-5p 存在靶向结合位点。转染 miR-885-5p mimics 可明显降低野生型 WT-circ_0001178 的荧光素酶活性(P<0.05),而未能抑制 MUT-circ_0001178 的荧光素酶活性。见图4,表5。

图4 circ_0001178 和 miR-885-5p 的互补序
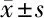
表5 双荧光素酶报告实验 n=3,
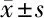
表6 过表达 circ_0001178 或抑制 miR-885-5p 可逆转白头翁皂苷 D 对 SW579 的抑制作用 n=3,
2.6 过表达 circ_0001178 或抑制 miR-885-5p 对白头翁皂苷 D 处理的 SW579 增殖、迁移、侵袭的影响 与白头翁皂苷 D 组比较,白头翁皂苷 D+pcDNA-circ_0001178 组、白头翁皂苷 D+anti-miR- 885-5p 组细胞活力升高(P<0.05),克隆形成数、迁移及侵袭细胞数增多(P<0.05),N-cadherin 蛋白水平升高(P<0.05),E-cadherin 蛋白水平降低(P<0.05)。见图5,表 6。
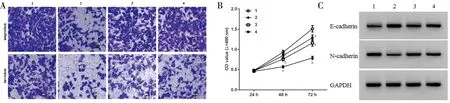
图5 过表达 circ_0001178 或抑制 miR-885-5p 对白头翁皂苷D 处理的 SW579 迁移侵袭及E-cadherin、N-cadherin 蛋白表达的影响;1 对照组;2 白头翁皂苷D组;3 白头翁皂苷 D+pcDNA-circ_0001178组;4 白头翁皂苷D+anti-miR-885- 5p组
3 讨论
甲状腺癌属于内分泌恶性肿瘤,目前甲状腺癌的发病机制尚未阐明,因而深入探究甲状腺癌的发病机制对研发新型的治疗药物成为重点研究,既往研究显示中医药可用于治疗甲状腺癌,其具有副作用小且效果好等优点,但其对甲状腺癌细胞生物学行为的影响及其可能作用机制尚需进一步探究[9]。circRNA 在甲状腺癌中表达异常,通过干扰或上调 circRNA 表达可能抑制甲状腺癌细胞增殖及转移等恶性生物学行为[10]。但 circRNA 是否可作为中医药治疗甲状腺癌的潜在靶点尚未阐明。
白头翁皂苷 D 可促进肺腺癌细胞凋亡而抑制肺腺癌发展[11]。白头翁皂苷 D 具有抗脑胶质瘤的作用,其可抑制脑胶质瘤细胞增殖及促进细胞凋亡[12]。白头翁皂苷 D 等白头翁皂苷的主要有效成分均可能通过调节circ_0001742 而抑制鼻咽癌发生发展[13]。本研究结果显示,白头翁皂苷 D 作用后甲状腺癌细胞活力降低,克隆形成数减少,且呈剂量依赖性,提示白头翁皂苷 D 可抑制甲状腺癌细胞增殖及克隆形成。E-cadherin、N-cadherin 属于上皮-间质转化(EMT)相关蛋白,其表达异常与 EMT 转化密切相关,而 EMT 转化可促进细胞转移[14]。本研究结果显示,不同剂量的白头翁皂苷 D 作用后甲状腺癌迁移及侵袭能力降低,并可抑制 N-cadherin 表达而促进 E-cadherin 表达,且呈剂量依赖性。提示白头翁皂苷 D 可抑制甲状腺癌细胞迁移及侵袭。但白头翁皂苷 D 调节甲状腺癌细胞生物学行为的分子机制尚需进一步验证。
本研究发现,随着白头翁皂苷 D 浓度的不断增加,甲状腺癌细胞中 circ_0001178 的表达量逐渐降低,而 miR-885-5p 的表达量逐渐升高,提示白头翁皂苷 D 可能通过抑制circ_0001178 的表达及促进 miR-885-5p 的表达而发挥抗甲状腺癌的作用。研究表明 circ_0001178 在肝细胞癌中表达上调,并可通过调节 miR-382 / VEGFA 轴而促进肝细胞癌的进展[15]。本研究结果显示,干扰 circ_0001178 表达后 miR-885-5p 的表达量升高,甲状腺癌细胞活力降低,克隆形成数、迁移及侵袭细胞数减少,提示干扰 circ_0001178 表达可能通过上调 miR-885-5p 的表达而抑制甲状腺癌细胞的生物学行为。本研究证实甲状腺癌细胞中 circ_0001178 可靶向结合 miR-885-5p,并可负向调控 miR-885-5p 的表达。研究表明 miR-885-5p 通过调节β-catenin抑制骨肉瘤细胞增殖、迁移和侵袭[16]。miR-885-5p 可通过抑制 Wnt/β-catenin 信号通路而抑制肝细胞癌转移。本研究结果显示,miR-885-5p 过表达后甲状腺癌细胞活力降低,克隆形成数、迁移及侵袭细胞数减少,而 circ_0001178 过表达或抑制 miR-885-5p 表达均可部分逆转白头翁皂苷 D 对甲状腺癌细胞增殖、克隆形成、迁移及侵袭的作用。
综上所述,白头翁皂苷 D 可抑制甲状腺癌细胞增殖、克隆形成、迁移及侵袭,抑制circ_0001178 的表达能够促进 miR-885-5p 的表达,而白头翁皂苷 D 抗甲状腺癌的分子机制与调控 circ_0001178/miR-885-5p 分子轴有关,即白头翁皂苷 D 可通过抑制 circ_0001178 的表达而促进 miR-885-5p 的表达进而发挥作用,可为进一步揭示甲状腺癌的发病机制提供理论基础,还可为研发甲状腺癌的治疗药物提供新方向。
