多模态全息影像技术辅助中央区脑膜瘤手术切除的应用价值
2024-05-23杨吉鹏王同聚卢圣奎宋燕飞刘洪亮孙晓枫霍浩然杨悦郭丽斯李琛
杨吉鹏 王同聚 卢圣奎 宋燕飞 刘洪亮 孙晓枫 霍浩然 杨悦 郭丽斯 李琛
脑膜瘤是颅内最常见的良性肿瘤之一,手术切除是其最主要治疗方式[1]。中央区脑膜瘤由于邻近重要功能区,手术难度及风险较高,如何减轻患者术后的肢体功能障碍是神经外科医生探索的重点之一[2]。随着影像学及电子数字技术的发展,利用各种软件基于多模影像数据的三维重建技术已逐步应用于临床,如3DSlicer软件,已被广泛用于神经外科的手术治疗中[3-5]。本研究利用3DSlicer、Matlab、Dsi Studio三种软件重建13例中央区脑膜瘤患者的全息影像并进行术前评估,辅助肿瘤的手术切除,报道如下。
1 资料与方法
1.1 一般资料 选取2021年6月至2022年10月河北医科大学第二医院收治的13例中央区脑膜瘤患者作为观察组,患者均为首次入院治疗,其中男4例,女9例;平均年龄(47.3±8.4)岁。根据术前核磁共振等影像学特征诊断,镰旁脑膜瘤2例,镰旁窦旁脑膜瘤6例,中央区凸面脑膜瘤5例,13例中3例患者存在不同程度的瘤周脑组织水肿;临床表现:轻度头痛4例,一侧下肢力弱1例,一侧下肢偶有麻木1例,无症状7例;查体:肌力正常12例,一侧下肢肌力Ⅳ级1例,跟膝胫试验一侧略差1例;既往病史:高血压1例,糖尿病1例。上述患者术前均行颅脑CT平扫、3D-T1WI加权成像(3D-T1WI)、弥散张量成像(DTI)等磁共振成像等影像学检查。选取2019年6月至2021年5月未应用全息影像技术辅助的中央区脑膜瘤患者15例作为对照组,其中男4例,女11例;平均年龄(48.6±6.5)岁;其中镰旁脑膜瘤2例,镰旁窦旁脑膜瘤8例,中央区凸面脑膜瘤5例;临床表现:不同程度头痛5例,一侧下肢力弱2例,无症状8例;查体:四肢肌力正常13例,一侧下肢肌力Ⅳ级2例,一侧跟膝胫试验略差2例。2组一般资料比较差异无统计学意义(P>0.05)。见表1。

表1 2组患者一般临床特征 例
1.2 影像学检查 患者术前常规应用3.0T磁共振仪(美国GE公司)进行3D-T1加权成像(3D-T1WI)、T1增强、三维相位对比静脉血管成像(three dimensional phase contrast magnetic resonance venography, 3D-PC-MRV)、弥散张量成像序列检查及颅脑三维CT平扫。
1.2.1 3D-T1WI序列:轴位扫描,TR为8.1 ms,TE为3.7 ms,层厚为1 mm,间距为0,FOV为231 mm×231 mm,矩阵为240 ×240。
1.2.2 DTI:轴位扫描,弥散梯度方向64个,TR为5 600 ms,TE为79.3 ms, FOV为240 mm × 240 mm,扩散加权系数b值为 1 000 mm2/s,矩阵为256×256,层厚 1.8 mm,层间距 0 mm,48通道线圈,激发次数2次。
1.2.3 CT扫描参数:层厚为1 mm,层间距0.8 mm,FOV为231 mm×231 mm,矩阵为240 ×240,管电压为140 kV ,管电流为350 mA。所有影像学数据均以DICOM格式收集。
1.3 影像数据后处理 将上述影像原始数据(DICOM格式)导入3DSlicer软件,利用General Registration(Elastix)模块以3D-T1WI作为基准序列,将其他磁共振序列及CT数据进行配准,利用Segment Editor模块建立颅骨、肿瘤、静脉窦的3D模型影像。将3D-T1WI数据转化为Nifti格式后利用Matlab软件中的Spm12插件中的Cat12工具包去除头皮和颅骨后得到只有脑组织的Nifti文件。将此文件导入3DSlicer软件并在Segment Editor模块重建大脑的三维影像。在3DSlicer软件上同时打开之前完成的全部模型影像,即可全息呈现患者颅骨、头皮、肿瘤、大脑皮层、上引流静脉、上矢状窦等解剖结构。将DTI数据以DICOM的格式转换成Nifti格式,利用Dsi Studio软件按照步骤重建双侧椎体束,利用Slice选项导入Nifti格式的3D-T1WI序列,配准后去除头皮颅骨并呈现大脑皮层与锥体束的三维影像。见图1。

1.4 手术方法
1.4.1 制定手术计划:术者根据包含肿瘤、大脑皮层、上引流静脉、上矢状窦和锥体束等解剖结构的三维全息影像制定个体化的手术方案,包括手术入路的选择、头皮切口的设计、肿瘤切除的策略、上引流静脉的保护措施、上矢状窦的处理等。
1.4.2 手术过程:根据三维全息影像协助肿瘤的头皮体表定位,选择适合的入路方式、头皮切口及手术体位,根据术前制定的手术方案显微镜下切除肿瘤,同时保护中央区的大脑皮层与上引流静脉。
1.5 术后检查及随访 术后6 h及术后第3天复查颅脑CT,明确颅内术区情况。观察并记录患者术后的肌力、共济等神经功能及术后并发症。对术后新出现肌力下降患者出院后进行随访。
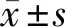
2 结果
2.1 全息模型影像的重建结果 13例均成功重建,肿瘤最长径22~51 mm,平均(33.6±11.4)mm,肿瘤主体位于中央沟前方6例,肿瘤主体位于中央沟后方3例,肿瘤位于中央沟正上方2例,肿瘤位于旁中央小叶下方2例;较粗大的上引流静脉在肿瘤前部2例,上引流静脉在肿瘤后部3例,肿瘤前后各有1根引流静脉3例,引流静脉走行于肿瘤下方或深部3例,肿瘤后上方存在引流静脉1例,引流静脉走行于肿瘤前上方1例;矢状窦受压局部变窄3例,无上矢状窦闭塞的病例。根据全息影像情况,决定拟采用弧形切口小骨瓣3例,马蹄形切口大骨瓣10例。证实13例患者术前重建结果均与术中实际情况相符。见图2。
2.2 手术结果 观察组患者按照术前计划实施手术,肿瘤定位准确,手术术野显露满意,均顺利完成肿瘤切除,其中SimpsonⅠ级切除8例,SimpsonⅡ级切除5例。对照组15例患者与观察组13例患者的临床特征无统计学差异。
2.3 2组患者术肢体肌力比较 观察组患者术后1周肢体肌力正常11例(84.6%),其中术前一侧下肢肌力Ⅳ级的患者术后1周肢体肌力已恢复正常,术后1周一侧上肢肌力Ⅲ级1例,一侧下肢肌力Ⅳ级1例,上述患者肌力下降均出现在术后第3天,出院后随访,此2例患者分别于术后第4周及第2~3周肌力恢复正常。对照组患者术后1周肢体肌力正常5例,对侧下肢肌力Ⅳ级6例,对侧上肢肌力Ⅲ级1例,对侧下肢肌力Ⅲ级3例,出院后随访1年10例患者肌力均恢复正常,2组患者术后1周肌力差异有统计学意义(P<0.05)。见表2。

表2 2组患者术后1周肌力比较 例(%)
2.4 2组患者术后脑水肿发生率比较 观察组术后6 h复查颅脑CT,无术区出血及脑水肿病例,术后第3天术区脑组织轻度水肿1例(7.69%)。对照组术后6 h复查颅脑CT,无术区出血及脑水肿病例,术后1周内复查CT发现7例(46.67%)患者出现不同程度脑水肿,差异有统计学意义(P<0.05)。见表3。

表3 2组患者术后脑水肿发生率比较 例(%)
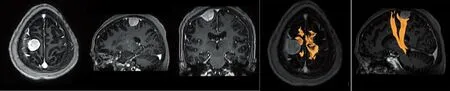
2.5 2组患者术后住院时间比较 2组患者术后平均住院时间差异有统计学意义(P<0.05)。见表4。
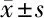
表4 2组患者术后住院时间比较 d,
2.6 2组患者术后共济失调发生情况比较 观察组术后1周存在不同程度的共济失调3例(23.08%),对照组有不同程度的共济失调6例(40.00%);2组共济失调发生情况比较,差异无统计学意义(P>0.05)。见表5。
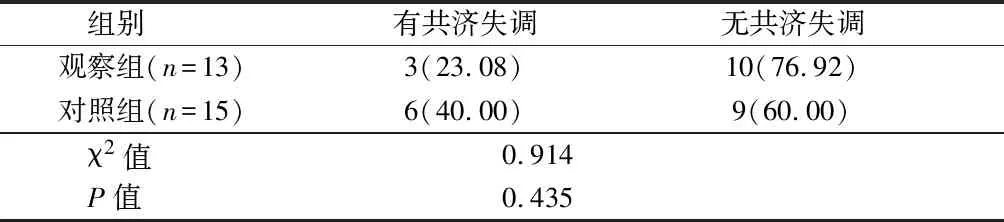
表5 2组患者术后共济失调比较 例(%)
2.7 2组患者术后皮下积液发生情况比较 2组术后1周发生皮下积液情况比较,差异无统计学意义(P>0.05)。见表6。

表6 2组患者术后皮下积液比较 例(%)
2.8 2组患者术后1周癫痫发生率比较 2组术后1周癫痫发生率比较,差异无统计学意义(P>0.05)。见表7。

表7 2组患者术后继发癫痫比较 例(%)
3 讨论
显微外科手术切除是中央区脑膜瘤最主要的治疗方式,术后肢体运动功能障碍目前仍是手术治疗最主要的风险[6-7]。研究表明,中央区脑膜瘤术后肢体功能障碍主要由术中运动中枢皮层的直接损伤及引流静脉损伤所致的脑水肿或出血所引起[8]。因此,术中妥善保护中央运动区皮层及中央区引流静脉(如中央沟静脉)是手术成功的关键。术前对肿瘤与大脑运动区及其周围引流静脉位置关系的评估对手术方案的制定至关重要[9]。但以往术者仅依靠二维的磁共振或CT影像胶片无法精准地预测肿瘤与周围结构的位置关系,尤其是肿瘤周围引流静脉和锥体束的走行。
随着影像学技术与计算机技术的发展,三维重建软件已逐步被神经外科医生应用于临床工作中。其中3DSlicer软件作为一个开源且功能强大的影像后处理软件已被广大神经外科医生学习并应用,现已被用于听神经瘤切除、脑出血穿刺外引流与微血管减压术等神经外科手术的术前评估[10-12]。但3DSlicer软件的功能也存在一些局限性,需与其他软件联合使用以重建出更高质量的全息影像[13]。本课题组决定通过3DSlicer、Matlab等多种软件克服了单一软件的功能缺陷,充分发挥各软件的优势成功建立大脑皮层、肿瘤、上矢状窦、上吻合静脉、颅骨、头皮等结构的全息影像,使术者在术前更直观、更精准地了解肿瘤与中央沟的位置关系、中央沟静脉等上引流静脉的走行、中央运动区移位后的位置等信息,为术者在选择手术入路、体表定位肿瘤、设计切口及骨窗、选取与规划硬脑膜剪开方式与范围、制定肿瘤切除策略、初步制定功能区皮质及重要引流静脉的保护方法等提供重要的参考依据。
全息影像技术具有的优势:(1)在手术设计方面,根据肿瘤的大小与位置,选择个体化的手术入路,设计适合的切口和骨瓣,有助于减少头皮、颅骨等组织的创伤[14]。本研究中对13例患者均采用了个体化的最佳手术入路,顺利显露并切除肿瘤,3例患者通过精准定位肿瘤实现弧形小切口完整切除肿瘤,手术创伤较以往明显减少,术后恢复快且无皮下积液等不良反应。(2)在术中指导开颅方面,特别是对于窦旁镰旁脑膜瘤,术者可参考全息影像明确上矢状窦相对矢状缝的位置及走行,指导术者确定中线处钻孔的位置与铣刀移动的路线,减少了骨瓣成形时上矢状窦的损伤及骨窗的无效显露。(3)在剪硬膜时,全息影像可帮助术者避免剪断汇入硬膜或上矢状窦的引流静脉,有利于减少重要引流静脉的损伤。本研究中8例镰旁及窦镰旁脑膜瘤患者均参考三维影像确定钻孔位置,骨瓣成型及硬膜剪开后均顺利实现理想的术野显露,开颅过程中无上矢状窦及引流静脉损伤的病例。(4)在功能区皮层与引流静脉保护方面,全息影像可呈现重要功能区皮层及引流静脉相对于肿瘤的位置,提示术者在重点保护区域轻柔且谨慎操作,保证引流静脉及功能区软脑膜的完整。当中央沟或中央前回受压严重时,术者无法准确地识别中央前回及确认重点保护的运动区皮层,术者可参考锥体束的走行来辅助运动中枢皮层的识别与保护[15]。本研究中13例患者肿瘤与中央沟的相对位置关系与术前呈现的完全相符。本研究观察组13例患者在术后1周虽然仍有一侧下肢肌力Ⅳ级及一侧上肢肌力Ⅲ级各1例,但肌力下降均出现在术后第3天,其中上肢肌力Ⅲ级的患者术后第3天复查CT提示术区出现轻度脑水肿,与对照组相比,观察组患者术后1周肌力表现及脑水肿情况均明显好于对照组。观察组2例患者术后4周肌力均恢复正常,考虑术中运动功能区皮层均已得到有效保护,可能由于术中功能区脑皮层被轻度骚扰或皮层血供术后发生变化导致在水肿高峰期出现术区脑水肿进而影响运动功能,且功能恢复期也明显短于对照组。此外,观察组患者术后住院时间短于对照组,虽然住院时间受多种原因影响,但缩短术后住院时间也提示全息影像技术在减少手术副损伤方面的优势与作用。通过比较2组术后共济失调及并发症的发生率,未发现2组存在统计学差异,考虑与本研究的样本量少有关。
经验总结:(1)重建上矢状窦与引流静脉时,建议通过MRV联合T1增强或对比增强磁共振静脉成像(CEMRV)一起重建,单纯MRV多采用相位对比法,对血流变慢的血液呈现较差,有时出现MRV提示上矢状窦血流中断而实际窦内仍存有部分血流的情况,而T1增强与CEMRV由于对比剂的流过因而假阴性率较低[16];(2)重建大脑皮层建议应用Matlab软件,3DSlicer软件中SwissSkullSripper模块在去除头皮和颅骨的同时也去掉不少皮层表面的核磁信号,导致脑沟与脑回的重建效果很不理想,无法清晰、完整的呈现中央沟与中央前后回等皮层结构,Freesurfer软件也常出现部分皮层信号缺失的情况且耗时较长。(3)紧贴于肿瘤表面走行的引流静脉有时不易重建,术中分离肿瘤时仍需精细轻柔操作及默契配合,尽可能避免损伤大脑皮层表面的任何血管,以减少患者术后迟发性功能障碍的发生。(4)本研究推荐Dsi Studio与Slicer软件联合重建锥体束,Dsi Studio可以快速自动重建锥体束,有效排除了胼胝体侧束等传导束的干扰,但对于肿瘤较大的患者有时出现锥体束重建失败,此时需Slicer软件进行重建。(5)当前的全息影像技术尚不能准确预测肿瘤与大脑皮层之间的粘连程度,可通过肿瘤周围的脑水肿情况初步评估肿瘤与周围皮层的粘连程度,瘤周水肿越明显往往越提示肿瘤与脑皮层间无蛛网膜界面且粘连紧密。(6)当肿瘤与功能区皮质间无蛛网界面或与引流静脉壁脉粘连紧密无法分离时,可酌情保留肿瘤包膜甚至少许肿瘤组织,不建议强行完全切除肿瘤,保证功能区皮层软脑膜的完整及引流静脉的回流顺畅[17]。
综上所述,基于多模影像数据的全息影像技术可在术前全方位地呈现中央区脑膜瘤手术相关的重要解剖结构,辅助术者制定个体化的最佳手术方案,有助于肿瘤的切除、上引流静脉及运动功能皮层的保护,减少手术副损伤。
