电针对2型糖尿病模型大鼠肠黏膜屏障的影响
2024-05-20严江天康文武郑灿磊苏振宏梁凤霞
严江天,曾 林,唐 倩,康文武,郑灿磊,2,苏振宏,梁凤霞,4△
1.湖北中医药大学,湖北 武汉 430065; 2.济宁医学院中西医结合学院,山东 济宁 272067;3.肾脏疾病发生与干预湖北省重点实验室,湖北 黄石 435003;4.针灸治未病湖北省协同创新中心,湖北 武汉 430065
糖尿病发病率逐年上升,预计将在2030年达到10.9%[1]。其中以2型糖尿病(Type 2 diabetes mellitus,T2DM)为主,我国的T2DM患者占总糖尿病人群的90%以上,随着经济发展和生活方式的改变,T2DM的发病率逐年上升并呈现年轻化的趋势[2]。同时,最新研究发现Covid-19患者在康复后患T2DM的可能性会大大增加[3-4]。
T2DM作为一种慢性持续性炎症疾病,炎症在其发生发展中起到了重要的作用[5-6]。高脂高糖等不良饮食习惯导致肠道菌群紊乱,使得肠道上皮组织紧密连接被破坏,肠道通透性增加,肠道屏障功能受损[7]。肠道屏障功能损伤又会进一步导致内毒素(Lipopolysaccharide,LPS)进入体循环,诱发机体全身肿瘤坏死因子(TNF-α)、白细胞介素-6(IL-6)等炎症因子的上调,炎症因子的上调进一步诱发β细胞功能紊乱,造成胰岛素抵抗,同时又会加剧肠黏膜屏障损伤,形成恶性循环。因此,修复肠道黏膜损伤、恢复肠屏障功能现已成为治疗T2DM的新靶点,本研究旨在观察电针对T2DM模型大鼠全身炎症及小肠黏膜屏障功能的改善作用,以期为针刺防治T2DM的临床应用和后续机制研究打下基础。
1 材料与方法
1.1 实验动物及分组
6周龄SPF级SD大鼠18只体质量160~200 g,购自湖北省医学科学研究院动物中心提供(动物合格证号:42010200006503)。动物房温度20~25 ℃,湿度(50±10)%,光照时间为12 h,自由进食与饮水,每笼5只,定期更换垫料并保证动物房清洁度达标。适应性喂养1周后,根据随机数字表法,将大鼠分为正常组、模型组与电针组,每组各6只。本实验过程对动物的处置严格按照科技部2006年颁布的《关于善待动物的指导性意见》。本课题经湖北中医药大学实验动物伦理委员会批准(审批号:HUCMS201904005)。
1.2 主要仪器和试剂
1.2.1 主要仪器 中研太和牌针灸针(天津亿朋医疗器械有限公司);HANS-LH202H型电针仪(南京济生医疗科技有限公司);血糖仪(江苏鱼跃医疗设备股份有限公司);DR-3518G酶标仪(无锡凯夫制药有限公司);AXTG16G高速离心机(盐城市安信实验仪器有限公司);DYY-6C电泳仪(北京市六一仪器厂);DYCZ-400D电泳仪槽(北京市六一仪器厂);Touch Imager成像系统(上海易孛特光电技术有限公司)。
1.2.2 试剂 链脲佐菌素(GC301002,武汉赛维尔生物科技有限公司);戊二醇固定液(BL-G014,南京森贝伽生物科技有限公司);LPS酶联免疫吸附测定试剂盒(ARD40472,广州奥瑞达生物科技有限公司);胰岛素酶联免疫吸附测定试剂盒(ARD40174,广州奥瑞达生物科技有限公司);大鼠IL-6/TNF-αELISA试剂盒(PI328、PT516,上海碧云天生物技术有限公司);大鼠D-乳酸(D-lacticacid,D-LA)/二胺氧化酶(diamine oxidase,DAO)ELISA试剂盒(RC-D907681、RC-D907054,天津睿创生物科技有限公司);大鼠单克隆ZO-1抗体(sc-33725,圣克鲁斯生物技术有限公司);小鼠单克隆Occludin抗体(sc-133256,圣克鲁斯生物技术有限公司);小鼠单克隆Claudin-1抗体(sc-166338,圣克鲁斯生物技术有限公司);小鼠单克隆GAPDH抗体(60004-1-Ig,武汉三鹰生物技术有限公司);山羊抗小鼠IgG(H+L)(SA00001-1,武汉三鹰生物技术有限公司);山羊抗大鼠IgG(H+L)(SA00001-15,武汉三鹰生物技术有限公司)。
1.3 模型建立及评价标准
大鼠适应性喂养1周后,随机选取6只大鼠作为正常组,给予普通饲料(3.8 kcal/g,含70%碳水化合物,20%蛋白质,10%脂肪)喂养。其余大鼠采用高脂饲料喂养结合小剂量单次注射STZ制备T2DM模型[8-9]。给予高脂饲料(5.4 kcal/g,含38.5%碳水化合物,15%蛋白质,46.5%脂肪)喂养8周,4周后大鼠禁食不禁水20 h,然后按大鼠体质量35 mg/kg腹腔注射STZ。注射完成后72 h开始测血糖,凡随机血糖水平在16.7 mmol/L以上,并维持2周以上者视为造模成功。
1.4 干预方法
参照《实验针灸学》[10]和中国针灸学会制定大鼠实验动物常用穴位名称与定位[11]选取大鼠双侧“足三里”“三阴交”“肾俞”“脾俞”进行针刺。针刺前使用自制鼠衣对大鼠进行固定,并剃除针刺部位毛发。针刺采用0.30 mm×13 mm一次性无菌针直刺3~5 mm。电针组大鼠同侧“足三里”“三阴交”接HANS-LH202H型电针仪,连续波,频率15 Hz,电流2 mA,电针20 min/d,每周3次,隔日1次,共治疗8周。以上采取的穴位选取、刺激频率、电针时间和疗程根据文献报道综合决定[12-14]。
1.5 观察指标及检测方法
1.5.1 大鼠空腹血糖检测 于干预前后测量并记录各组大鼠空腹血糖(Fasting blood glucose,FBG),检测前各组大鼠禁食不禁水12 h,取大鼠尾尖血用鱼跃血糖仪测量并记录FBG。
1.5.2 血清各项生化指标检测 干预结束后,大鼠禁食不禁水12 h,采用2%戊巴比妥钠(35 mg/kg)腹腔注射麻醉大鼠,用一次性采血针快速扎入心间处,见有回血后迅速将另外一头扎入促凝管中,3 000 r/min离心15 min后取上层血清,置于-80℃冰箱保存备用。采用ELISA法检测血清中空腹胰岛素(Fasting insulin,FINS)及TNF-α、IL-6、LPS、D-LA和DAO含量,并计算胰岛素抵抗指数(Homeostasis model assessment-insulin resistance,HOMA-IR);HOMA-IR=FBG×FINS/22.5。严格参照ELISA检测试剂盒说明书步骤检测各项指标。
1.5.3 小肠组织上皮超微结构观察 采用透射电镜观测大鼠小肠上皮超微结构。取位于胃下3~6 cm的小肠组织,用眼科剪去除小肠组织上的脂肪组织和结缔组织,经PBS冲洗后于冰上操作。用预冷的手术刀片将小肠组织切成0.5 mm×1 mm×3 mm大小,放入预冷的2.5%戊二醇中固定48 h,再用1%锇酸后固定2 h,梯度乙醇脱水,环氧树脂包埋,超薄切片(50 nm),3%醋酸铀与硝酸铅双染色,室温干燥过夜,透射电镜下观察并采集图像。
1.5.4 小肠组织ZO-1、Occludin蛋白检测 取各组大鼠小肠组织50 mg制备蛋白样本。蛋白样本采用BCA法测定浓度后,沸水浴加热10 min使蛋白变性并进行SDS-PAGE凝胶电泳,电泳后将蛋白湿转至PVDF膜。牛奶封闭2 h后,4 ℃摇床孵育一抗过夜(ZO-1 1∶500;Occludin 1∶1 000;Claudin-1∶1∶1 000;GAPDH 1∶10 000)。次日,根据一抗来源种属孵育相应二抗(1∶10 000),室温孵育1 h。配置ECL化学发光试剂,用Touch Imager成像系统对PVDF膜进行曝光显色。用Image Pro软件对蛋白条带进行定量分析。
1.6 统计学处理

2 结果
2.1 各组大鼠FBG、FINS和HOMA-IR比较
与正常组比较,模型组大鼠FBG、FINS和HOMA-IR显著升高(P<0.01)。与模型组比较,电针组大鼠FBG、FINS和HOMA-IR显著降低(P<0.01)。见表1。
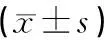
表1 各组大鼠FBG、FINS和HOMA-IR比较
2.2 各组大鼠血清TNF-α、IL-6含量比较
与正常组比较,模型组大鼠TNF-α、IL-6含量显著升高(P<0.01)。与模型组比较,电针组大鼠TNF-α、IL-6含量显著降低(P<0.01)。见表2。
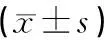
表2 各组大鼠血清TNF-α、IL-6含量比较
2.3 各组大鼠血清LPS、D-LA和DAO含量比较
与正常组比较,模型组大鼠LPS、D-LA和DAO含量显著升高(P<0.01)。与模型组比较,电针组大鼠LPS、D-LA和DAO含量显著降低(P<0.01)。见表3。
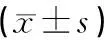
表3 各组大鼠血清LPS、D-LA和DAO含量比较
2.4 各组大鼠小肠组织超微结构比较
正常组大鼠小肠紧密连接完整,桥粒数量较多;模型组大鼠小肠紧密连接不完整,桥粒数量减少;电针组紧密连接完整、桥粒正常。见图1。
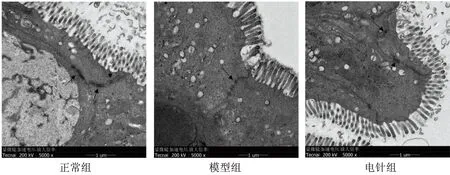
注:箭头指向为紧密连接。图1 各组大鼠小肠黏膜上皮超微结构观察(5 000×)
2.5 各组大鼠小肠组织ZO-1、Occludin与Claudin-1蛋白表达水平比较
与正常组比较,模型组大鼠小肠组织中ZO-1、Occludin与Claudin-1的表达水平显著降低(P<0.01);与模型组比较,电针组大鼠小肠组织中ZO-1、Occludin与Claudin-1的表达水平显著升高(P<0.01)。见图2、表4。
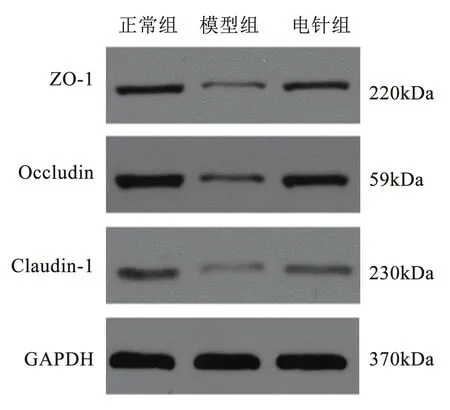
图2 各组大鼠小肠组织ZO-1、Occludin及Claudin-1蛋白表达

表4 各组大鼠小肠组织ZO-1、Occludin及Claudin-1蛋白表达水平比较
3 讨论
中医学中本无糖尿病这一病名,但根据其症状可将其归为“消渴”“脾瘅”等范畴。同时认为糖尿病的发生与饮食、情志和气候等因素有关,主要是由于肺、脾和肾三脏的功能失调,导致气血津液的异常代谢。《素问·奇病论篇第四十七》载:“帝曰:有病口甘者,病名为何?何以得之?岐伯曰:此五气之溢也,名曰脾瘅……肥者令人内热,甘者令人中满,故其气上溢,转为消渴。”认为本病的诱因在饮食不节,根源在于脾胃,逐步发展为“消渴”。糖尿病早期消渴,以阴虚燥热为主,煎灼津液,伤津耗气致脾肾两虚,日久脾虚及肾,肾阴虚火旺。故中医治疗糖尿病主要是以调节肺、脾和肾三脏为核心,健脾补肾、益气养阴,调和气血津液,消除痹阻,恢复正常代谢。故本研究选取肾俞、脾俞二穴相配伍,调理脾肾;选取足三里、三阴交,以扶正培元、益气养阴。
STZ是目前制备糖尿病模型运用最为广泛的药物,但单一使用STZ诱导对注射剂量把控要求较高,造模成功率不稳定且死亡率较高[15]。因此,本实验采用高脂饲料喂养结合单次小剂量注射STZ制备T2DM模型大鼠,一方面通过高脂饮食造成大鼠胰岛素抵抗,一方面通过小剂量注射STZ对大鼠胰岛β细胞造成轻度破坏,在提高造模成功率、降低死亡率的同时,也更加符合人类T2DM的发病机制[16]。
由LPS诱发的系统性炎症是包括T2DM在内的代谢性疾病发病机制的重要因素[17],体循环中LPS的增加能够引起多种组织炎症,并最终导致胰岛素抵抗[18-19]。肠黏膜屏障正是防止LPS进入体循环的关节结构。因此,改善肠道黏膜屏障功能,降低肠道通透性,减少肠道细菌代谢产物如LPS进入血液循环,目前被认为是改善T2DM等代谢性疾病的新治疗策略[20]。肠黏膜屏障主要由肠上皮细胞及其紧密连接等组成。紧密连接在维持肠道黏膜屏障的正常功能方面起着重要作用。闭锁蛋白(Occludin)、闭合蛋白(Claudins)和闭合小环蛋白(ZO-1、ZO-2及ZO-3)等是紧密连接的主要组成。这些蛋白协同作用,维持肠道上皮细胞稳定性,调节肠道屏障的通透性,减少肠道大分子和微生物通过肠壁进入内环境[21]。正常情况下,紧密连接并非是静止不动的,当肠上皮细胞受到细菌和毒素等的侵扰时,紧密连接可发生移位阻止这些有害物质进入,避免肠道细胞损伤。当肠道机械屏障遭到破坏时,细菌和毒素会侵入肠道细胞并引起多种细胞炎症因子的释放,从而导致肠道炎症的发生。本研究结果显示,电针能恢复T2DM大鼠小肠上皮紧密连接的完整性,并上调ZO-1、Occludin和Claudin-1的蛋白表达,从而修复T2DM大鼠的肠黏膜屏障。
除此之外,还能通过肠道通透性来评价肠黏膜屏障功能的完整性。在正常生理状态下,血液中的LPS、D-LA和DAO活性较低。然而,当肠上皮细胞或紧密连接结构受损时,肠道屏障的完整性会丧失,导致肠上皮细胞通透性增加,细菌易位,从而大量释放LPS、D-LA和DAO进入血液循环[22-23]。因此,血清中的D-LA、DAO和LPS浓度变化可以作为间接反映肠道屏障功能的重要指标。本研究结果显示,电针能下调T2DM大鼠血清中LPS、D-LA和DAO的含量,提示电针能够降低肠道通透性,恢复大鼠肠道屏障功能。
综上所述,电针“足三里”“三阴交”“脾俞”“肾俞”能够降低T2DM大鼠空腹血糖,减轻大鼠全身炎症及胰岛素抵抗状态,其机制可能与下调血清中LPS、D-LA和DAO的含量,降低肠道通透性,恢复小肠上皮细胞紧密连接,上调ZO-1、Occludin和Claudin-1的蛋白表达有关。
