恒温隔绝式PCR快速检测蜡样芽孢杆菌方法的建立及应用
2024-05-16寇肖迪孟含苏雅航汤承胡瑜唐俊妮
寇肖迪,孟含,苏雅航,汤承,胡瑜,唐俊妮,*
(1.西南民族大学食品科学与技术学院,四川成都 610225)(2.青藏高原动物遗传资源保护与利用教育部重点实验室,四川成都 610041)(3.康美包(苏州)有限公司,江苏苏州 215021)
蜡样芽孢杆菌(Bacillus cereus)是一种常见的食源性致病菌,广泛存在于土壤、空气、水、动物的肠道以及植物源和动物源食品中,尤其是蛋白质和碳水化合物含量丰富的食品,如粮食制品、乳制品、肉类制品和豆制品等[1-3]。近些年发现蜡样芽孢杆菌也能感染包括人在内的多种动物,是一种人畜共生细菌,感染者症状主要表现为恶心甚至呕吐、腹胀腹痛腹泻等[4]。据文献报道,我国发生的B.cereus食源性疾病主要是以呕吐型为主,占75.9%[5]。食用含有超过105CFU/g 的蜡样芽孢杆菌即可导致食物中毒[6]。因此,对食品是否污染蜡样芽孢杆菌的检测十分重要。目前,蜡样芽孢杆菌的检测方法主要有GB 4789.14-2014[7]、免疫学检测方法如ELISA、免疫组化及实时荧光PCR 等技术[8-11]、PCR 技术[12,13]。传统鉴定蜡样芽孢杆菌的方法操作繁琐、耗时长、检出率低;ELISA、免疫组化以及PCR 等方法对仪器设备和操作人员要求高[14,15]。因此,建立一种快速、准确、简捷检测蜡样芽孢杆菌的方法,具有十分重要的应用价值。
恒温热隔绝式PCR(Insulated Isothermal PCR,iiPCR)是一种以Rayleigh-Benard 对流系统为原理的能够通过反应管底部液体持续加热产生上下液体温差,控制对流时间与散热速率,使其在管内形成稳定温度梯度,从而提供PCR 所需快速、低耗的核酸扩增平台[16]。该技术最早在2002 年,由Krishnan 首次报道,结合POCKITTM系列手持式核酸检测仪,体积小、自带电源,加样后一键操作,反应仅需42 min 便可完成,结果以“+”、“-”、“?”直接显示于液晶屏幕上,方便快捷,可达到现场快速检测的目的[17]。如Tsen[18]等建立了iiPCR 方法检测鸡肉中沙门氏菌,样品培养到5 h 即可检测样品是否含有沙门氏菌;杨若璇等[19]使用iiPCR 检测食品中的沙门氏菌,其灵敏度较高,最低检出限可达75 CFU/mL,在6 h 内完成检测;李传友等[17]建立iiPCR 快速检测技术对食品中的金黄色葡萄球菌进行检测,检出限为102CFU/mL,检出时间为6 h 且具有较高稳定性。
蜡样芽孢杆菌的管家基因gyrB 基因具有高度保守性[20],能够编码蜡样芽孢杆菌旋转酶B 亚基,可用于蜡样芽孢杆菌PCR 快速检测[21-23]。本研究利用iiPCR 技术,建立一种快速检测蜡样芽孢杆菌gyrB基因的新方法,该方法能在更短的时间内完成高特异性和高灵敏性的扩增,仪器设备也简易便携,能够对现场检测提供有效稳定准确快速的技术支撑。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株来源
蜡样芽孢杆菌ATCC11778(Bacillus cereus)、金黄色葡萄球菌ATCC6538(Staphylococcus aureus)、大肠杆菌ATCC25922(Escherichia coli)、单增李斯特菌ATCC19115(Listeria monocytogenes)、肠炎沙门氏菌CICC 21482(Salmonellaenteritidis)等均由本实验室保存。
1.1.2 试剂与培养基
甘露醇卵黄多粘素培养基(Mannitol-Egg-Yolk-Polymyxin Agar Base,MYP)、多粘素B、胰蛋白胨大豆肉汤(Tryptic Soy Broth,TSB),购于青岛高科园海博生物技术有限公司;核酸染料GELVIEW、DL50 Marker、Premix Ex Taq(Probe qPCR)、TB Green Premix Ex Taq Ⅱ、Taq PCR Master Mix(2x,blue dye),购于宝生物工程(大连)有限公司;G-10电泳凝胶琼脂糖,购于Biowest 公司;各种食物样品购于学校食堂、超市以及摊位。
1.1.3 设备与仪器
POCKITTM小型智能型核酸分析仪、R-tube(48),厦门金瑞鸿捷生物科技有限公司;CFX96 荧光定量PCR 仪、VerSaDoc 2000 凝胶成像系统,美国 Bio-Rad 有限公司;PCR 仪,TSNENEN031445基因(美国)有限公司;Galanz WD800B 型微波炉,顺德市格兰仕微波炉电器有限责任公司;SC-15 数控超级恒温槽,宁波新芝生物科技股份有限公司;Eppendorf 5804R 型冷冻离心机,Eppendorf 公司;DYY-6C 电泳仪,北京六一仪器厂。
1.2 实验方法
1.2.1 引物及探针的设计与合成
选取蜡样芽孢杆菌的管家基因gyrB 基因作为靶基因,利用Primer Premier 5.0 软件设计一对引物及探针,并进行BLAST 比对,引物由生工生物工程(上海)股份有限公司合成,探针由北京擎科新业生物技术有限公司合成。引物和探针序列信息见表1。

表1 用于iiPCR方法的gyrB特异性引物、探针基本信息Table 1 Basic information for iiPCR of gyrB specific primers and probes
1.2.2 菌株复苏
从超低温冰箱中取出保存的蜡样芽孢杆菌、金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌、单增李斯特菌于室温解冻,分别吸取50 μL 菌液接种置5 mL TSB 液体培养基中,30 ℃(蜡样芽胞杆菌)或37 ℃(其他细菌)恒温震荡培养12~18 h。
1.2.3 DNA模板提取
取1.2.2 中蜡样芽胞杆菌、金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌、单增李斯特菌等菌株过夜培养菌液1 mL 于1.5 mL 的无菌EP 离心管中,4 ℃,12 000 r/min 离心2 min,PBS 洗涤菌体2~3次,弃上清液收集菌体。参考周晏阳等[24]微波提取DNA 方法,向离心管中加入500 μL TE 缓冲液,涡旋震荡30 s,取100 μL 于PCR 管中,Galanz WD 800B 型微波炉预热1 min 后将PCR 管用微波炉加热40~120 s;12 000 r/min 离心1 min 收集上清液即为模板DNA。
1.2.4 引物及探针验证
采用实时荧光定量PCR 仪(CFX96)对蜡样芽孢杆菌、金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌、单增李斯特菌及阴性对照进行扩增检测,以验证引物和探针的可行性。
反应体系及条件参考崔溢和张贵海[25],10 μL 2×Premix Ex Taq,2 μL 探针(10 μmol/L),上、下游引物各1.0 μL(10 μmol/L),5 μL DNA 模板,无菌水补足至20 μL,利用无菌去离子水代替DNA 模板做无模板阴性对照。反应条件:95 ℃预变性10 min;95 ℃ 10 min;60 ℃ 1 min;40 个循环,在56 ℃结束开始收集荧光信号。
1.2.5 iiPCR反应体系摸索
参考杨若璇等[19]方法,采用25 μL 体系分别对Taq 酶(预混酶)5 U/μL(11~13.5 μL)上下游引物10 μmol/μL(0.5~2 μL)、探针10 μmol/μL(0.25~1 μL)、模板DNA(原始浓度94.75 ng/μL)(1~4 μL)、无菌水的用量进行条件探索,确定各自用量的最佳值。
1.2.6 特异性实验
采用本实验建立的iiPCR 方法对大肠杆菌、金黄色葡萄球菌、单增李斯特菌、肠炎沙门氏菌标准菌株基因组DNA 进行扩增,同时设置1.2.3 中的蜡样芽孢杆菌DNA 为阳性对照,无菌ddH2O 为阴性对照。
1.2.7 灵敏度试验
对浓度为1.5×108CFU/mL 的菌悬液进行10 倍的梯度稀释,并对10 个梯度浓度的菌液进行DNA提取,测定DNA 浓度,采用已建立的iiPCR 方法进行检测。同步进行常规PCR 灵敏性对比试验,常规PCR 反应体系为20 μL:2×TSINGKE Master mix 10 μL;10 μmol/L 上下游引物各0.4 μL;DNA 模板2 μL;无菌去离子水7.2 μL,阴性对照试验利用无菌去离子水代替DNA 模板。扩增条件:95 ℃预变性5 min;95 ℃变性40 s,56 ℃退火50 s,72 ℃延伸40 s;循环35 次;所得产物进行4%(m/V)琼脂糖凝胶电泳,在凝胶成像系统下观察结果,并对比常规PCR 扩增结果。
1.2.8 稳定性试验
采用建立的iiPCR 方法对菌液的三个稀释度(10-5、10-6、10-7)进行三组重复实验,以评价该方法的稳定性。
1.2.9 与其它蜡样芽孢杆菌检测方法比较
分别采用传统PCR 方法和荧光定量PCR 对蜡样芽胞杆菌DNA 和菌液不同稀释梯度进行检测。
常规PCR 方法参考高瑞等[26]的方法稍作修改,即常规PCR 反应体系共20 μL:2×TSINGKE Master mix 10 μL;10 μmol/L 上下游引物各0.4 μL;DNA模板1 μL;无菌去离子水8.2 μL,阴性对照利用无菌去离子水代替DNA 模板。扩增条件:95 ℃预变性5 min;95 ℃变性40 s,56 ℃退火50 s,72 ℃延伸40 s;循环35 次;所得产物进行4%(m/V)琼脂糖凝胶电泳,在凝胶成像系统下观察结果。
实时荧光定量PCR(SYBER Green Ⅰ荧光染料法)根据董歆[27]的方法稍作修改,反应体系共15 μL:TB Green Premix Ex Taq Ⅱ 7.5 μL;上下游引物各0.5 μL;模板DNA 1 μL;ddH2O 15 μL,阴性对照试验利用无菌去离子水代替DNA 模板。反应条件:95 ℃预变性5 min;95 ℃变性10 s,56 ℃退火20 s,72 ℃延伸30 s,40 个循环,在延伸时采集荧光信号。
实时荧光定量PCR(TaqMan 探针法)根据柯振华[28]的方法稍作修改,反应总体系为25 μL:Premix Ex Taq(Probe qPCR)12.5 μL;上下游引物各1 μL;探针0.5 μL;模板DNA 2 μL;ddH2O 8 μL,阴性对照试验利用无菌去离子水代替DNA 模板。反应条件:95 ℃预变性5 min;95 ℃变性10 s,56 ℃退火20 s,72 ℃延伸30 s,40 个循环,在延伸时采集荧光信号。
将上述实验结果与1.2.6 结果做对比。
1.2.10 实际样品检测
从成都各大农贸市场、路边小摊、食堂、餐馆等地购买粮食制品、肉制品、豆制品、乳制品以及熟食样品共计42 份(详见表3),并将食品样品切成1 cm 长小段搅拌混匀,准确称取各处理后的食品样品25 g 至胰蛋白胨大豆肉汤中,振荡培养2、4、6、8 h 取样(通过预实验iiPCR 需培养6 h,常规PCR 至少培养8 h),按1.2.3 方法提取基因组DNA,采用1.2.4 已建立iiPCR 方法和常规PCR 方法进行检测,并分析蜡样芽孢杆菌在食品中的流行情况。
1.2.11 数据处理
数据处理采用Excel 2020 进行整理计算。
2 结果与分析
2.1 引物及探针验证结果
采用实时荧光定量PCR 分别对不同标准菌株提取DNA 进行扩增,结果如图1 所示,只有1 号蜡样芽孢杆菌出现阳性,能够得到特异性扩增,2~5号其他菌株为阴性,证明本研究根据选取的gyrB基因所设计的引物与探针具有良好特异性。

图1 蜡样芽胞杆菌引物、探针验证结果Fig.1 The primer and probe verification for Bacillus cereus
2.2 优化后的反应体系
通过对Taq 酶、探针、引物、模板用量进行区间优化(如图2),最终确定的反应体系如表2 所示。Taq 预混酶的用量确定为各2.5×106U/L,上、下游引物用量确定为各0.2 mol/L,探针用量确定为0.2 mol/L,DNA 模板用量确定为7.58 ng/μL。

图2 iiPCR 反应体系优化结果Fig.2 The optimization results of iiPCR
2.2 特异性评价
对纯培养的蜡样芽孢杆菌、大肠杆菌、金黄色葡萄球菌、单增李斯特菌和沙门氏菌提取DNA 作为模板,按上述建立的方法进行iiPCR 扩增,结果如图3a、b 所示,POCKITTM手持式核酸分析仪界面上显示只有蜡样芽孢杆菌检出为阳性(+),阴性对照和大肠杆菌、金黄色葡萄球菌、单增李斯特菌、沙门氏菌检出均为阴性(-)。表示针对蜡样芽孢杆菌所建立的iiPCR 检测方法特异性良好。

图3 特异性试验Fig.3 Specific test
2.3 灵敏度试验结果
将制备好的菌悬液梯度10 倍稀释,分别选择100 μL 不同梯度的稀释菌液,均匀涂于营养琼脂平板上,在(30±1)℃下倒置过夜培养,当培养基上生长出清晰的单个菌落,并统计典型菌落数,取平均值后得到第10-5稀释梯度的菌落平均数为1 500 CFU/mL,经计算得出所制得菌悬液的原始浓度为1.5×108CFU/mL。
对所稀释的10 个梯度浓度的蜡样芽孢杆菌的菌悬液采用微波法提取DNA,采用上述扩增体系进行检测,结果如图4 所示,POCKITTM手持式核酸分析仪界面上浓度为1.5×103CFU/mL 和1.5×102CFU/mL均显示为阳性(+),浓度为15 CFU/mL 和阴性对照显示为阴性(-),说明建立的iiPCR 检测方法对蜡样芽孢杆菌纯培养菌液的最低检出限为150 CFU/mL。

图4 蜡样芽胞杆菌不同浓度菌液检出结果Fig.4 Detection results of Bacillus cereus in different concentrations of bacterial solution
注:1~4 泳道分别为1.5×103、1.5×102、1.5×10 CFU/mL、阴性对照。
2.4 稳定性评价
分别对纯培养蜡样芽孢杆菌菌悬液的10-5、10-6、10-7,3 个稀释梯度即1.5×103、1.5×102、1.5×10 CFU/mL,分别提取DNA 作为模板,通过上述建立的iiPCR方法对其扩增,进行三次重复性平行试验,结果如图5a、b、c 所示,POCKITTM手持式核酸分析仪界面上阴性对照和1.5×10 CFU/mL 显示为阴性(-),1.5×103、1.5×102CFU/mL 显示为阳性(+),三次重复检测结果一致,表示本研究所建立的iiPCR 方法具有良好的稳定性。

图5 稳定性试验结果Fig.5 Stability evaluation test results
2.5 与其他检测方法比较结果
将纯培养的浓度为1.5×108CFU/mL 蜡样芽孢杆菌菌悬液经10 倍梯度稀释,采用传统PCR 方法、实时荧光定量PCR(荧光染料SYBR Green Ⅰ和TaqMan 探针法)技术扩增对其灵敏性进行检测。检测结果如图6 所示。

图6 传统PCR、实时荧光定量菌液浓度灵敏度试验结果Fig.6 Traditional PCR,real-time fluorescence quantitative PCR Concentration sensitivity test results
结果表明,传统PCR 方法对蜡样芽孢杆菌的最低检出限为1.5×103CFU/mL;实时荧光定量PCR方法对蜡样芽孢杆菌的最低检出限为1.5×102CFU/mL;与2.3 中结果比较分析可知,本研究建立的iiPCR方法对蜡样芽孢杆菌的最低检出限与实时荧光检测技术相同,均比常规PCR 技术检测结果高出一个数量级。
iiPCR 方法无需凝胶电泳检测,总检测流程仅需7~8 h 即可得到结果,扩增时间40 min 即可显示检测结果。
2.6 实际样品检测结果分析
为验证已建立方法对食品中蜡样芽胞杆菌的检测效果,采集实际食品样品42 份进行方法的检验。采用上述研究建立的iiPCR 方法对采集的42 份实际食品样品中蜡样芽孢杆菌进行检测,结果如图7 所示,从图中可以看出,当培养到6 h 时,42 份食品样品中共检测出蜡样芽孢杆菌阳性有19 份,总检出率为45.23%(19/42),其中米面制品的检出率为23.81%(10/42),乳制品的检出率为4.76%(2/42),熟食类(肉制品及凉拌菜)检出率分别为4.76%(2/42)和2.38%(1/42),豆制品检出率为9.52%(4/42)。如果按米面制品细分,其检出率为62.50%(10/16)。

图7 食品样品iiPCR 检出结果Fig.7 Food samples iiPCR detection results
2.7 实际样品iiPCR与普通PCR方法检出结果比较
采用常规PCR 方法对上述采集的食品样品检测加以验证iiPCR 方法的准确性,当样品增菌培养到8 h 时提取DNA(前增菌6 h 常规PCR 未能检测出),通过常规PCR 进行扩增,结果如图8 所示,由图可以看出此时常规PCR 方法可对19 份样品均检出阳性结果,将两种方法的检出结果进行比较,比较结果如表3 所示,常规PCR 方法与iiPCR 方法的检测结果一致。可见,本研究所建立对蜡样芽孢杆菌检测的iiPCR 方法比传统PCR 方法具有耗时更短、操作更简便的优势,在实际食品样品的现场检测应用方法中,建立的iiPCR 方法更加快捷、实用。
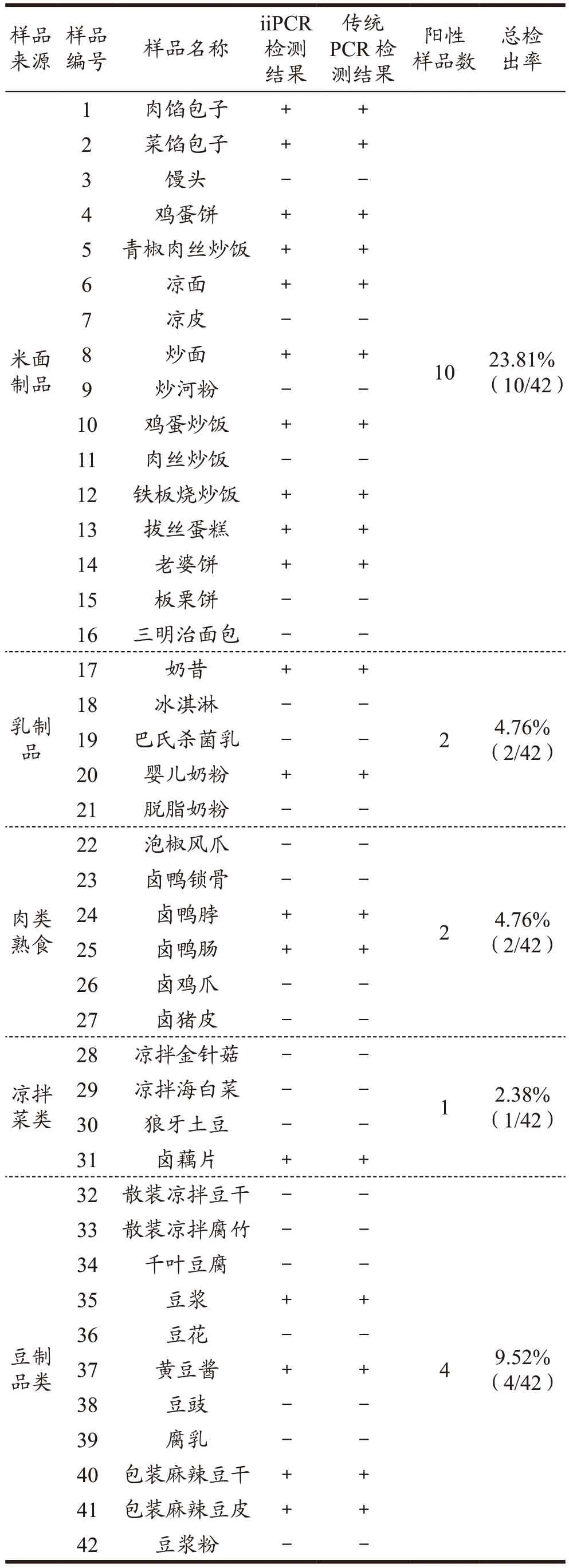
表3 iiPCR与常规PCR检测结果的比较Table 3 Comparison of iiPCR and traditional PCR results
本研究所采集的食品样品蜡样芽孢杆菌的总检出率为45.23%(19/42),与田万帆等[29](24.00%)、李芳等[30](26.56%)、权玉玲等[31](13.03%)、毕宇涵等[32](30.51%)的研究检测结果偏高,可能的原因是本研究所采集的食品样品集中在7~9 月,夏季气温高导致大部分食源性致病菌生长繁殖快。粮食制品是蜡样芽孢杆菌最易感染的食品来源,本研究中米面等粮食制品的小类检出率最高,为62.50%(10/16),连国平等[33]在分析四类不同食品中蜡样芽孢杆菌的分布规律时,也得出熟制米面制品最易感染蜡样芽孢杆菌的结论,且检出率最高,与本研究结论相同。
食品中蜡样芽孢杆菌含量超过105CFU/g 即可作为食物中毒的判断依据[34],但由于本次所采样品未进行蜡样芽孢杆菌含量及是否含有能够产生呕吐及腹泻毒素的毒力基因检测,虽所检出样品含有蜡样芽孢杆菌,但无法断定其含量是否会导致食物中毒症状发生,以后我们会进一步针对食品中细菌的含量及毒素进行定量检测。
3 结论
本研究建立了快速检测蜡样芽孢杆菌的iiPCR方法,选择gyrB 基因作为检测靶基因,通过iiPCR方法与传统检测方法以及荧光PCR 等方法对不同致病菌的对比得出iiPCR 方法蜡样芽孢杆菌最低检出限仅为1.5×102CFU/mL,且耗时仅为7~8 h,此结果远远低于传统PCR 方法与荧光PCR 方法的检测结果,说明该方法灵敏度高、耗时短、操作便捷;通过重复试验及对实验室其他保藏菌进行试验对比,说明已建立方法稳定性好、特异性强;采用已建立方法与常规PCR 方法做实际样品检测验证,结果表明两种方法检测结果一致,iiPCR 方法可以用于食品的检测。
综上,本研究建立的基于恒温热隔绝式PCR 技术检测食品中的蜡样芽孢杆菌,可应用于现场快速检测,不仅节省时间还提高了检测效率,降低了微生物检测工作的部分难度。
