肠襻法结合药动学探讨复合红花籽油的吸收特性
2024-05-16商雪珂杨晓君杨冬梅敬磊赵得秀
商雪珂,杨晓君,杨冬梅,敬磊,赵得秀
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
复合红花籽油(Complex Safflower Seed Oil,CSSO)由红花籽油和亚麻籽油提取物按照3:2 的比例复配而得。其中亚麻籽油富含亚麻酸(Linolenic Acid)、亚油酸(Linoleic Acid,LA)和油酸(Olenic Acid,OA)等不饱和脂肪酸,尤其富含α-亚麻酸(α-Linolenic Acid,ALA),其含量达50% 以上,是ω-3 多不饱和脂肪酸(ω-3 Polyunsaturated Fatty Acids,ω-3 PUFA)的主要植物来源[1]。红花籽油也富含不饱和脂肪酸,在已知作物中,其亚油酸含量可达73%~85%,被誉为“亚油酸之王”[2]。α-亚麻酸和亚油酸均为人体必需脂肪酸,具有调节血脂血糖、抗血栓、抗炎、抗癌及改善眼睛疾病等功能[3-8]。
吸收是影响口服药物生物利用度的主要环节,小肠是药物吸收的主要场所[9],且肠道是脂肪酸吸收的主要场所[10],课题组前期通过体外模型(外翻肠囊法)对CSSO 的肠吸收部位进行了研究,结果表明LA 和ALA 在十二指肠肠段吸收较好[11],与文献报道一致[12],故本实验将以十二指肠为主要吸收肠段来考察CSSO 的吸收情况。肠襻法是将含有一定药物浓度的人工肠液注入肠襻中,经过一定时间后取出肠襻,收集肠襻液,测定药物剩余量计算吸收参数,进而了解药物的吸收情况。采用肠襻法研究药物吸收,未切断血管和神经,不冲洗肠道,破坏肠道菌群,使整个生理状态更接近自然给药,可以更真实、全面的反映药物在肠道的吸收代谢情况。药代动力学是口服给药后,于不同时间点采集血液,分离血清(血浆)后,测定其中主要组分的含量,以此来评价药物的吸收情况。
口服药物的吸收特性无法使用单一方法或模型来判断[13],因此,本实验以CSSO 为受试物,以LA 和ALA 为目标成分,建立大鼠肠襻吸收模型结合药代动力学,考察药物浓度、pH 值条件、吸收促进剂对药物吸收的影响,以阐明其吸收特性以及CSSO 在动物体内的吸收速度与程度,为后续药物研究及制剂开发提供理论基础。
1 材料与方法
1.1 实验动物
SD 大鼠(200±20 g),均购自新疆医科大学实验动物中心(生产许可证号:SCXK(新)2018-0002),于新疆维吾尔自治区药物研究所饲养,温度20~25 ℃,湿度50%~60%,自由摄食及饮水。实验动物伦理审查批准号为XJIMM-2019004。
1.2 实验仪器
AL204 电子天平,梅特勒-托利多仪器有限公司;TGL-16M 冷冻离心机,湖南湘鑫仪器仪表有限公司;SF-TDL-40D 离心机,上海菲恰尔分析仪器股份有限公司;PHS-3G 型pH 计,上海仪电科学仪器股份有限公司。
1.3 实验试剂
复合红花籽油,实验室自制;正己烷(色谱纯),天津市光复科技发展有限公司;乙腈(色谱纯),天津市鑫铂特化工有限公司;盐酸维拉帕米,北京索莱宝科技有限公司;壳聚糖,北京索莱宝科技有限公司;脱氧胆酸钠,北京索莱宝科技有限公司;羧甲基纤维素钠,上海山浦化工有限公司;Krebs-Ringer's缓冲液,武汉普诺赛生命科技有限公司。
1.4 药液的配制
1.4.1 在体肠吸收溶液配制
在体肠吸收药物浓度参考文献[14,15],并根据《中国居民膳食指南》(2022)中建议成年人每天摄入烹调油25~30 g[16],故CSSO 用0.5% CMC-Na 溶液和Krebs-Ringer,s 缓冲溶液配置为低(13.02 mg/mL)、中(26.04 mg/mL)、高(52.08 mg/mL)梯度质量浓度。
1.4.2 药代动力学溶液配制
根据《药物非临床药代动力学研究技术指导原则》(2014 年5 月)[17]及《中国居民膳食指南》(2022)中建议成年人每天摄入烹调油25~30 g[16],按照人与大鼠剂量换算,故大鼠给药剂量为低(1.302 g/kg)、中(2.604 g/kg)和高(5.208 g/kg),给药质量浓度为0.13、0.26、0.52 g/mL(用0.5%CMC-Na 溶液配置)。
1.5 肠襻吸收实验
参考文献[18],取实验前禁食18 h(自由饮水)的SD 雌性大鼠,随机分组,分为空白对照组、复合红花籽油组,每组6 只,麻醉后固定,沿腹中线打开腹腔,暴露肠段,结扎十二指肠肠段(距幽门1~10 cm 处)。用注射器将含有一定浓度的药液注入肠襻中,将肠襻放回腹腔,覆盖37 ℃生理盐水浸湿的纱布,保持体温37 ℃,2 h 后剪下肠襻,将肠内容物完全转移至10 mL 棕色容量瓶,用Krebs-Ringer's 溶液少量多次冲洗肠襻内部肠腔,洗涤液转移至容量瓶中,并用Krebs-Ringer's 溶液定容至10 mL,样品前处理后,进行HPLC 检测。
1.6 药代动力学实验设计
按照体质量,随机分为高、中、低三个给药剂量组,每组3 只大鼠,均为雄性。采用单次灌胃给药,给药前禁食不禁水16 h。给药前每只大鼠分别取空白血0.5 mL 后,以给药体积为10 mL/kg,灌胃以不同剂量CSSO(1.302、2.604 和5.208 g/kg)。分别在给药后1、2、3、4、6、8、10、12、24 h 于眼眶静脉丛取血500 μL 于1.5 mL EP 管中,3 000 r/min离心15 min,取上层血清,于-80 ℃保存备用。按“2.2.2”及“2.2.3”项下方法前处理并测定ALA 和LA 浓度。
1.7 样品前处理及检测方法
1.7.1 肠收集液样品前处理
参考文献[11],将收集液转移至20 mL 离心管中,-4 ℃,3 000 r/min,冷冻离心15 min 后,吸取上清液置另一离心管中,加1/2 上清液的正己烷,以每分钟75次的频率室温振荡10 min后,冷冻离心,取正己烷层用0.25 μm 有机滤膜过滤后,测定其中ALA 和LA 的含量。
1.7.2 血清样品前处理
参考文献并优化[19],取血清200 μL 于5 mL 离心管中,加入1.5 mL 乙腈,振摇5 min 后,离心10 min(3 000 r/min)后取上清,氮气吹干,加1 mL 甲醇复溶后上机检测。
1.7.3 检测方法
Agilent 1260 液相色谱仪,紫外检测器,波长203 nm,色谱柱Thermo Tris C18(250 mm×4.6 mm,5 μm),柱温30 ℃,流动相:乙腈 : 水=80:20(V/V)。
1.8 CSSO 中ALA 和LA 的标准曲线
配制0.5、1、2、5、10、25、50、100 mg/mL 梯度质量浓度的ALA 和LA 标准溶液后,按2.4 项下“样本的预处理及检测条件”进行HPLC 检测,以质量浓度为横坐标,峰面积为纵坐标绘制标准曲线,如图1 和图2 所示,ALA 的线性方程为y=57.111x+21.975(R2=0.999 8),LA 的线性方程为y=30.062x+13.071(R2=0.999 9),R2均>0.999,表明ALA 和LA 的线性符合要求。

图1 CSSO中ALA的标准曲线Fig.1 Standard curve of ALA in compound safflower seed oil

图2 CSSO中LA的标准曲线Fig.2 Standard curve of LA in compound safflower seed oil
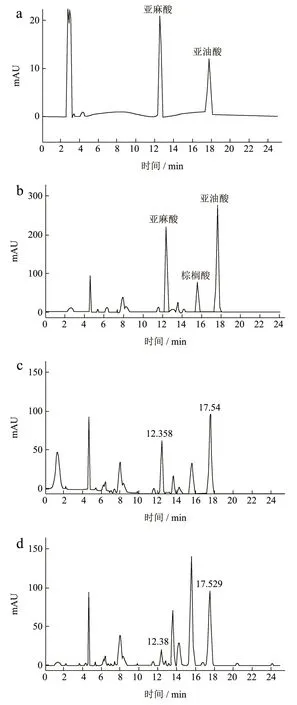
图3 CSSO中ALA和LA的部分HPLC检测图谱Fig.3 Partial HPLC detection map of ALA and LA in compound safflower seed oil
1.9 数据分析
1.9.1 在体肠吸收参数计算及数据处理
肠收集液中ALA 和LA 吸收参数用Excel 进行计算,并用IBM SPSS Statistics 26 进行统计分析,文中数据均以“x±s”表示。在体肠吸收计算公式如下[20,21]:
式中:
M——吸收药量,mg;
B——累计吸收率,%;
Ka——吸收速率常数,h-1;
t1/2——吸收半衰期,h;
C0——加入肠襻内药物溶液初始质量浓度,mg/mL;
V0——加入肠襻内药物溶液体积,mL;
Ct——试验结束后肠收集液中药物溶液质量浓度,mg/mL;
Vt——试验结束后肠收集液总体积,mL;
t——时间,h。
1.9.2 药代动力学数据处理
不同时间CSSO 中ALA 和LA 浓度用IBM SPSS Statistics 26 进行统计学分析,药动学参数采用DAS 2.0 进行分析,利用Graph pad 8.0.2 作血药浓度-时间曲线图,文中数据均以“x±s”表示。
2 结果与讨论
2.1 在体肠吸收部分
2.1.1 CSSO 质量浓度依赖性考察
按“2.2”项下建立大鼠肠襻吸收模型,用0.5% CMC-Na 溶液配制为高(52.08 mg/mL)、中(26.04 mg/mL)、低(13.02 mg/mL)三种药物质量浓度进行试验,120 min 时取下肠襻,取出肠收集液后,按“2.4”项下进行样品前处理及HPLC 检测。吸收参数结果见表1。

表1 不同质量浓度CSSO中ALA和LA的吸收参数Table 1 Absorption parameters of ALA and LA in different concentrations of CSSO (n=6,x±s )
由表1 可见,随着CSSO 质量浓度的升高,ALA和LA 的M随之增加,高质量浓度时吸收量最大(ALA:23.77 mg;LA:42.27 mg),组间均有显著性差异(P<0.05),说明药物质量浓度对CSSO 的吸收有一定影响;同时,随着CSSO 质量浓度的升高,ALA 和LA 的B均随着质量浓度的升高呈现先降低后升高的趋势,其中高质量浓度吸收率最高(ALA:94.92%;LA:91.89%),低质量浓度次之(ALA:91.33%;LA:90.20%),中质量浓度最低(ALA:93.21%;LA:87.23%),组间无显著性差异(P>0.05),其中高质量浓度的吸收率最高,无高质量浓度饱和现象,提示CSSO 的吸收具有质量浓度依赖性[22]。综上所述,在试验120 min 内高质量浓度的CSSO的吸收最好,故后续试验选择高质量浓度CSSO(52.08 mg/mL)为受试药物质量浓度。
Ka和t1/2均随着质量浓度的升高呈现下降趋势,但各组间均无显著性差异(P>0.05),提示CSSO 在大鼠十二指肠肠段的吸收无自身质量浓度抑制,转运机制可能为被动扩散[23]。有研究表明,当肠腔浓度高于肠上皮细胞浓度时主要通过扩散的方式进行吸收跨膜,当肠腔浓度较低时,其吸收主要通过转运酶类介导[24]。因此,在此实验药物质量浓度范围内(13.02~52.08 mg/mL)M未出现饱和现象可能是由于肠腔浓度高于肠上皮细胞,转运机制为被动扩散[25,26]。
2.1.2 CSSO 的pH 值条件依赖性考察
采用高质量浓度CSSO(52.08 mg/mL)进行pH 值条件依赖性实验。按“2.2”项下建立大鼠肠襻吸收模型,将药物溶液pH 值调至4.0、6.0、8.0进行试验,120 min 时取下肠襻,取出肠收集液后,按“2.4”项下进行样品前处理及HPLC 检测。吸收参数结果见表2。

表2 不同pH值条件下CSSO中ALA和LA的吸收参数Table 2 Absorption parameters of ALA and LA in CSSO at different pH values (n=6,x±s )
由表2 可见,随着CSSO 溶液pH 值的变化,ALA 和LA 的B和M均呈现逐渐升高的趋势,其中,pH 值为8.0 时吸收量(ALA:24.19 mg;LA:43.38 mg)和吸收率(ALA:96.59%;LA:94.29%)最高,组间均无显著性差异(P>0.05),说明pH 值为8.0 时CSSO 的吸收情况较好,提示在酸性条件下CSSO 的吸收较差,弱碱性环境时CSSO 主要以分子形式存在,易于药物的吸收[27],故后续试验将药物溶液酸碱条件调至pH 值为8.0。
随着药液pH 值的增加,CSSO 中ALA 的Ka呈先升高后缓慢降低的趋势,其中,pH 值 6.0(1.98 h-1)≈pH 值 8.0(1.93 h-1)>pH 值 4.0(1.68 h-1),组间均无显著性差异(P>0.05);CSSO 中LA 的Ka随着pH 值的升高逐渐增加,pH 值为8.0 时最大(1.73 h-1),说明药物溶液的pH 值条件会影响CSSO 的吸收。其次,CSSO 中ALA 和LA 的t1/2均呈现下降趋势,其中LA 的t1/2呈线性变化,但其组间均无显著性差异(P>0.05),说明pH 值条件为8.0时CSSO 吸收较快。
2.1.3 吸收促进剂对CSSO 吸收的影响
采用高质量浓度CSSO(52.08 mg/mL,pH 值为8.0)进行吸收促进剂对吸收影响的考察。按“2.2”项下建立大鼠肠襻吸收模型,含药溶液中加入盐酸维拉帕米(50 μg/mL)、壳聚糖(5 mg/mL)、胆酸钠(1 mg/mL)进行试验,120 min 时取下肠襻,取出肠收集液后,按“2.4”项下进行样品前处理及HPLC 检测。吸收参数结果见表3。
表3 添加吸收促进剂的CSSO中ALA和LA的吸收参数Table 3 Absorption parameters of ALA and LA in CSSO with absorption enhancers (n=6, )

表3 添加吸收促进剂的CSSO中ALA和LA的吸收参数Table 3 Absorption parameters of ALA and LA in CSSO with absorption enhancers (n=6, )
由表3 可见,CSSO 添加吸收促进剂后,各组ALA 和LA 的P与M均低于空白组(ALA:94.49%,23.66 mg;LA:88.56%,40.74 mg),且无显著性差异(P>0.05),各吸收促进剂组Ka均低于空白组(ALA:1.61 h-1;LA:1.22 h-1),但无显著性差异(P>0.05),CSSO 中ALA 和LA 均为脂溶性较好的成分,壳聚糖和胆酸盐均能提高药物脂溶性,从而使药物吸收量增加[28],推测CSSO 不受吸收促进剂的影响且不是P-gp 的底物,后续将通过细胞实验进一步考察CSSO 的吸收是否受P-gp介导。
2.2 药代动力学部分
由图4 和表4 可见,各剂量组ALA 的Tmax均为2.33 h,说明在此实验给药剂量(1.302 g/kg、2.604 g/kg 和5.208 g/kg)对ALA 吸收的速度影响不大,其中高剂量ALA 出现“双峰”现象,在2 h 时,ALA 质量浓度为2.72 mg/mL,4 h 时,ALA 质量浓度为2.67 mg/mL;ALA 的AUC(0-t)随着药物剂量的升高而增加,高剂量最高[18 565.72 mg/(L·h)],中剂量次之[14 209.78 mg/(L·h)],低剂量最小[4 321.11 mg/(L·h)],提示高剂量CSSO 中ALA 生物利用度较高;由ALA 的Cmax可见,从高到低顺序为:中剂量>高剂量>低剂量,提示中剂量CSSO中ALA 的吸收程度较好;由ALA 的t1/2z可见,高剂量半衰期最短(1.76 h),低剂量次之(3.44 h),中剂量半衰期最长(4.84 h),提示高剂量CSSO 中ALA 在动物机体内消除速度最快。
表4 CSSO中ALA在大鼠体内的药动学统计矩参数Table 4 Pharmacokinetic statistical moment parameters of ALA in CSSO in rats ()

表4 CSSO中ALA在大鼠体内的药动学统计矩参数Table 4 Pharmacokinetic statistical moment parameters of ALA in CSSO in rats ()

图4 不同给药剂量CSSO中ALA药-时曲线Fig.4 ALA drug-time curves in CSSO at different doses
由图5 和表5 可见,低剂量组Tmax为1.33 h,中、高剂量组Tmax均为2.33 h,说明低剂量吸收较其余组快,其中高剂量LA 质量浓度出现“双峰”现象,在2 h 时,LA 质量浓度为10.94 mg/mL,4 h 时,LA 质量浓度为10.18 mg/mL;各剂量组AUC(0-t)的高低顺序为:中剂量>高剂量>低剂量,故中剂量CSSO 中LA 的生物利用度较高;由ALA 的Cmax可见,中剂量最高(16.59 mg/mL),高剂量次之(10.94 mg/mL),低剂量最低(6.98 mg/mL),提示中剂量CSSO 中LA 的吸收程度较好;由t1/2z可见,中剂量的消除速度最慢(12.65 h),低剂量消除速度较快(9.58 h),高剂量次之(8.64 h),提示低剂量CSSO 中LA 在动物机体内消除速度较快。
表5 CSSO中LA在大鼠体内的药动学统计矩参数Table 5 Pharmacokinetic statistical moment parameters of LA in rats in CSSO ()
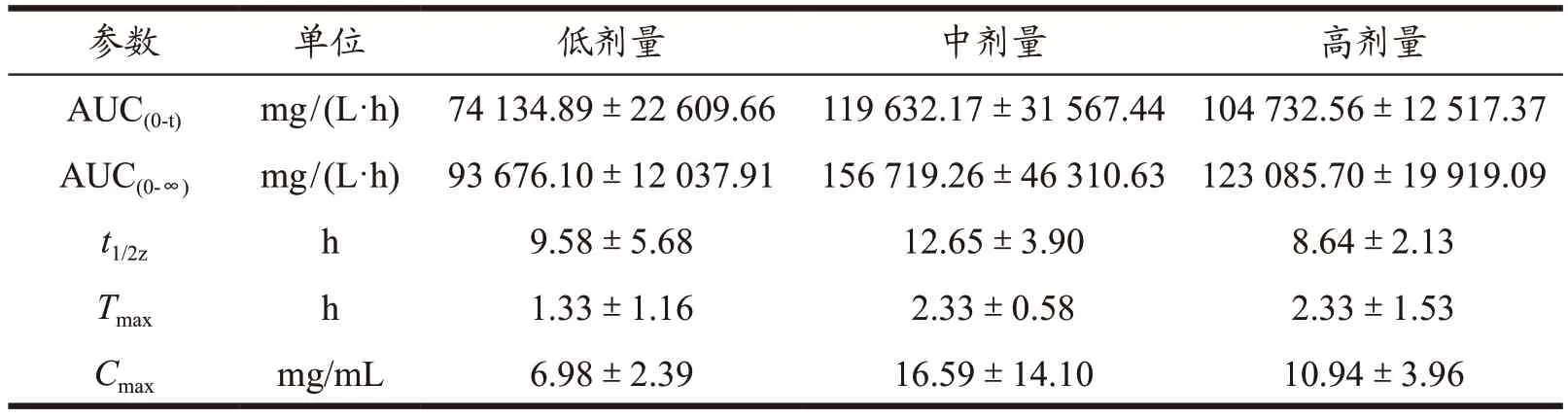
表5 CSSO中LA在大鼠体内的药动学统计矩参数Table 5 Pharmacokinetic statistical moment parameters of LA in rats in CSSO ()

图5 不同给药剂量CSSO中LA药-时曲线Fig.5 LA drug-time curves in CSSO at different doses
综上所述,中剂量CSSO 中ALA 和LA 的Cmax均最高,高剂量CSSO 中ALA 和LA 的血药质量浓度均出现“双峰”现象,与文献报道一致[29],提示高剂量药物溶液在小肠停留时间长,在胃肠道内吸收有快有慢,或存在肝肠循环[30]。LA 和ALA 均属于内源性成分,药物含量过高时可能在分布到各组织后,经肝肠循环出现二次释放入血,导致血药质量浓度二次升高至Cmax附近,且CSSO 吸收较快,在1.33~2.33 h 可达到最大血药浓度。CSSO 中ALA 的生物利用度与剂量呈正相关,其中高剂量组中ALA 生物利用度较高,中剂量组中LA 生物利用度较高,高剂量中ALA 吸收速度较快,低剂量中LA 的吸收速度较快[31]。有文献报道,LA 的达峰时间为3.83 h,ALA 的达峰时间为4.53 h[32,33],均高于本实验CSSO 的达峰时间,表明CSSO 的复配能够使ALA 和LA 在动物机体内更快的发挥作用。由ALA 和LA 药动学参数可知,LA 的Cmax、AUC、t1/2z均大于ALA 药动学参数,且差异较大,可能是由于在大鼠血清中LA 的质量浓度本就较高所致[32]。
3 结论
由在体肠吸收实验可以得出:高质量浓度且pH值8.0 时CSSO 吸收较好,吸收促进剂对CSSO 吸收无影响,因此,推测CSSO 在大鼠十二指肠肠段可能的吸收机制以被动扩散为主,具有质量浓度依赖性,CSSO 在偏碱性条件下较易吸收,可能不是P-gp 的底物。由药动学实验可以得出:CSSO吸收速度较快,在1~2 h 即可达到峰质量浓度,在2.604~5.208 g/kg 内生物利用度较高,中剂量CSSO吸收程度较好。口服药物的转运特性与机制不能仅用一或两种方法确定,应采用多种方法或模型进行综合性的考察时结论更可靠,本实验为后续的研究工作提供数据支持,更全面的解释CSSO 的吸收转运机制,为临床应用提供科学依据。
