甘油增塑剂浓度对羟丙基淀粉-琼脂复配软胶囊囊皮性能的影响
2024-05-16蔡幸哲余龙胡凯甄陈家奕刘宏生缪承杜
蔡幸哲,余龙,胡凯甄,陈家奕,刘宏生,缪承杜
(1.华南理工大学食品科学与工程学院,广东广州 510640)(2.广州辐锐高能技术有限公司,广东省工业钴-60伽玛射线应用工程技术研究中心,广东广州 511458)
软胶囊是指将油性液体、混悬液或乳浊液等半固体物质封闭于软质囊皮内的一种制剂[1],由于其具备良好的密封性和储存性、生物利用率高及方便携带等优点,被广泛应用于医药、保健品和化妆护肤品行业[2]。目前,软胶囊囊皮所用原料以动物明胶(Gelatin,Gel)为主,明胶具有良好的成膜性,形成的囊皮具有较好的机械性能,但其存在熔融温度较低、高温下容易粘连,动物源成分存在传播疯牛病风险、容易受到特殊文化者排斥等缺陷[3]。因此,寻找明胶替代材料以制备植物软胶囊囊皮已成为研究热点。
近年来,淀粉基软胶囊囊皮研究引起了广泛关注。淀粉由于其成膜性好、来源广泛、价格便宜,被认为是最具潜力的明胶替代物。但天然淀粉具有易回生、耐热性差等缺点,需经过改性以用于软胶囊囊皮制备[1]。羟丙基淀粉(Hydroxypropyl Starch,HPS)具有出色可加工性、良好的成膜性和粘度稳定性[4],同时羟丙基的引入可有效抑制淀粉的老化回生。然而,HPS 凝胶冻力低,无法满足传统工艺制备软胶囊的要求[5],因而通常需与其他食用凝胶复配,以改善其凝胶性能,从而制备出性能良好的淀粉基软胶囊囊皮。琼脂(Agar,AG)具有极强的凝胶能力,且形成的凝胶具有热可逆性,广泛应用于食品和医药领域[6],目前关于羟丙基淀粉和琼脂复配的研究鲜见报道。同时,软胶囊制备过程中通常需要添加增塑剂来改善囊皮性能以满足加工要求[7],其中增塑剂用量与软胶囊成品质量密切相关。
因此,本实验以羟丙基淀粉和琼脂作为原料制备淀粉基复配软胶囊囊皮,选用甘油(Glycerol,G)作为增塑剂。通过预实验确定HPS 质量分数为25%(m/m),AG 质量分数为5%(m/m),采用流延法制备不同甘油含量的复配囊皮。利用拉伸仪对其机械强度进行测定,同时表征复配囊皮的表面化学特性、结晶度、热稳定性、透光率、微观结构和表面疏水性,探究甘油浓度对复配囊皮性能的影响及其作用机理,为淀粉基软胶囊囊皮的工业化生产提供理论基础和技术依据。
1 材料与方法
1.1 材料与试剂
羟丙基淀粉(食品级),购自杭州普罗星淀粉有限公司;琼脂(食品级),购自美国Sanland Chemical 公司;250 冻力明胶(食品级),购自河南富源明胶有限公司;甘油(分析纯),购自国药集团化学试剂有限公司。
1.2 主要仪器设备
BS210S 型电子分析天平,德国Sartorius 公司;ASTM D638 型力学定能测定仪,美国Instron 公司;Tensor 37 型傅里叶变换红外光谱仪、D8 ADVANCE A25 型X-射线衍射仪,德国Bruker 公司;DSC 8000 型热重分析仪,美国PerkinElmer 公司;WFZ UV-3802 型紫外分光光度计,上海洪富仪器仪表有限公司;FTA 200 型接触角测定仪,美国First Ten Angstroms 公司;Phenom Pro 型电子扫描电镜,荷兰Phenom 公司。
1.3 试验方法
1.3.1 HPS-AG 复配囊皮的制备
采用流延法制备复配囊皮,胶液的制备配方如表1 所示,制备方法如下:
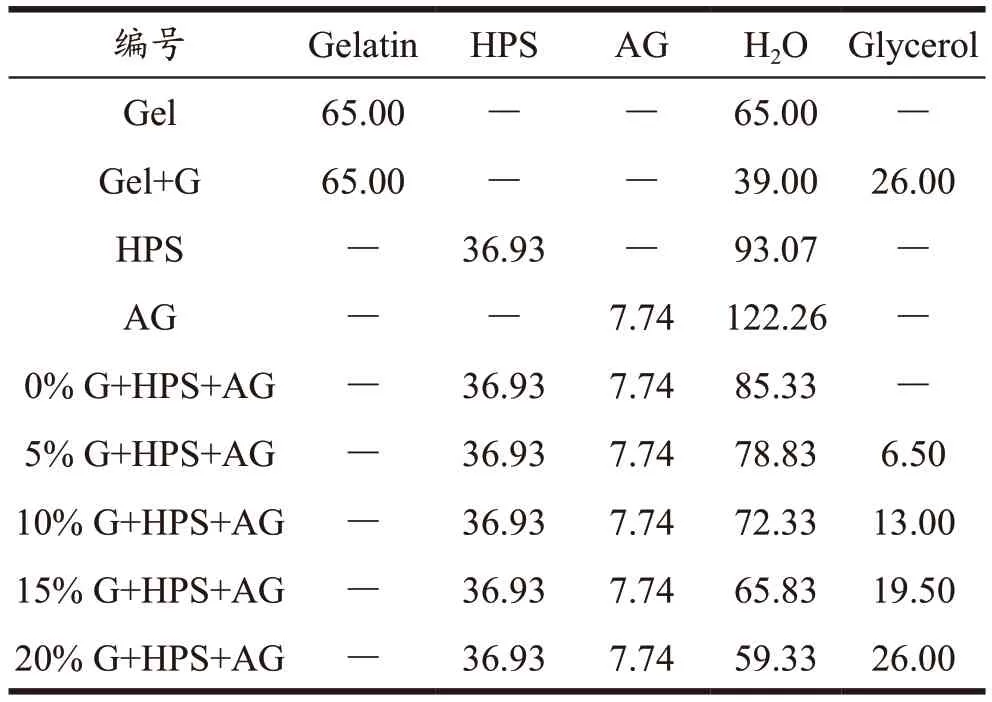
表1 样品编号及制备样品所需原料(g)Table 1 Sample’s ID and contents of material
(1)HPS 胶液制备:称取一定量的HPS 淀粉、甘油与去离子水混合,在95 ℃下缓慢搅拌,糊化30 min,至样品充分溶解;制备好的胶液在95 ℃下保温2 h 除尽气泡。
(2)Gel、Gel+G 胶液制备:称取一定量的250冻力明胶,将一定量的去离子水与甘油共混后添加至明胶颗粒中,在25 ℃下溶胀2 h,将溶胀后的明胶于60 ℃下缓慢搅拌30 min 至完全融化;将上述制备好的胶液在60 ℃下保温2 h 除尽气泡。
(3)HPS-AG 胶液制备:称取一定量的HPS 淀粉、甘油与去离子水混合,在95 ℃下缓慢搅拌,糊化30 min,再加入一定量AG,在95 ℃下缓慢搅拌30 min,至样品充分溶解;制备好的胶液在95 ℃下保温2 h 除尽气泡。
将上述制备好的胶液倒入玻璃平板中,于45 ℃下烘干12 h。测试前所有囊皮均在低于20%的湿度下平衡10 d 以上。
1.3.2 表面化学特性测试
采用傅里叶红外变化光谱仪(Fourier Transform Infrared Spectroscopy,FT-IR)对囊皮表面化学特性进行测试分析,利用衰减全反射技术可以反映出样品表层(<5 μm)的结构信息。将平衡湿度后的囊皮压制成适宜大小用于分析,在室温下以4 cm-1的分辨率进行扫描,扫描范围为4 000~400 cm-1,共扫描64 次。
1.3.3 结晶结构测试
将平衡水分后的囊皮压制成适宜大小,利用X-射线衍射仪(X-ray Diffractometry,XRD)分析样品的结晶特性。分析条件为:Cu Kα为特征射线,扫描速度为10°/min,步宽为0.02°,电流和管压分别为40 mA 和40 kV,扫描区域2θ:起始角5°,终止角50°。
1.3.4 热重测试
采用热重分析仪(Thermal Gravimetric Analyzer,TGA)对囊皮的热稳定性进行测试分析,将囊皮裁剪成合适大小(约4 mg)平铺于测试坩埚中,在20 mL/min 流速的氮气氛围中进行测试,测试温度范围为30~580 ℃,升温速率为10 ℃/min。
1.3.5 透光性能测试
将平衡水分后的囊皮裁剪成1 cm×2 cm 的长条,贴于石英比色皿内壁。利用紫外-可见光分光光度计测定其透光率(Transmittance,T),波长检测范围为200~1 000 nm,扫描间隔为1 nm。取600 nm处的透光率计算吸光度(Absorbance,A),透光率与吸光度转换由下式(1)计算,由于囊皮厚度不同,最终吸光度以下式(2)进行统一修正。
式中:
T——透光率,%;
A0——初始吸光度,L/(g·cm);
A——最终吸光度,L/(g·cm);
d——囊皮厚度,mm。
1.3.6 微观形貌表征
将平衡水分后的囊皮压制成合适大小固定于样品台,在20 mA 下喷金处理60 s,15 kV 电压下,采用扫描电镜(Scanning Electron Microscope,SEM)观察囊皮表面微观结构,放大倍率为1 000倍。同时将囊皮于液氮中进行冷冻淬断,相同条件下进行喷金后,观察囊皮断面微观结构。
1.3.7 水接触角测试
利用接触角测定仪测定囊皮在空气中的静态水接触角(Water Contact Angle,WCA),表征囊皮表面亲水性。在室温下进行接触角测定,将5 μL 水快速滴加于样品表面,在囊皮的不同位置测量5 次,计算平均值。
1.3.8 力学性能测试
利用美国Instron 公司的ASTM D638 拉伸仪对囊皮进行力学性能测试,测试样品均压制成哑铃型,中间的矩形尺寸为2 mm×12 mm,杨氏模量(Young’s Modulus,YM)、拉伸强度(Tensile Strength,TS)和断裂伸长率(Elongation at Break,EAB)在100 mm/min 的拉伸速度下测定。每个样品重复5 次,计算平均值。
1.3.9 数据分析
所有试验结果都经过至少三次测定以获得数据,数据以平均值±标准差表示,利用Origin 2021 软件进行作图分析。
2 结果与讨论
2.1 复配囊皮的表面化学特性分析
图1 显示了不同复配囊皮的红外光谱图。Gel+G 囊皮中1 635 cm-1和1 546 cm-1处的吸收峰分别归属于酰胺Ⅰ带(C=O 伸缩振动)和酰胺Ⅱ带(N-H 弯曲振动),是肽键的主要吸收峰,表明了蛋白质的存在。2 932 cm-1和2 886 cm-1处吸收峰分别归属于-CH2-基团与-CH3基团中C-H的伸缩振动。1 600~1 700 cm-1的弱吸收峰归因于无定形区域中水的O-H 伸缩振动[8]。HPS(film)在3 282 cm-1的吸收峰与分子间氢键和羟基(O-H)伸缩振动有关,HPS-AG 复配囊皮该峰出现于3 302 cm-1处,发生了明显的红移现象,O-H 基团的吸收峰波数变化证实HPS 与AG 之间存在明显的氢键相互作用[9]。HPS 在1 000 cm-1的吸收峰和AG 在1 039 cm-1的吸收峰为多糖特征吸收峰,是由C-O、C-C 伸缩振动和C-O-H 弯曲振动引起的[9]。AG(powder)和AG(film)在930 cm-1和886 cm-1处的吸收峰归因于琼脂中的半乳糖结构,是琼脂最具代表性的特征吸收峰[10];在1 366 cm-1的吸收峰是由硫酸盐基团引起的[11]。添加HPS 后,AG 在886 cm-1和1 366 cm-1的吸收峰消失,1 039 cm-1的多糖特征吸收峰发生偏移,以上结果表明,HPS 与AG 之间存在明显的相互作用[9]。实验结果表明,甘油的添加量对红外谱图的影响较小,说明甘油对主要官能团不存在破坏作用,但添加甘油可显著增强O-H 吸收峰,说明添加甘油可以显著影响复配囊皮中氢键的数量。

图1 不同甘油质量分数下HPS-AG复配囊皮的红外光谱Fig.1 FT-IR spectra of HPS-AG compound capsule shell at different glycerol concentrations
2.2 复配囊皮的结晶结构
图2 为不同复配囊皮的XRD 图谱,可以观察到HPS(powder)在2θ为15°、17°、18°、23° 附近存在明显结晶峰,为典型的A 型晶型结构。HPS(film)仅在2θ为19°附近存在一个无定形宽峰,说明在制备囊皮的糊化过程中HPS 的A 型结晶双螺旋结构被完全破坏,HPS(film)在实验的储存条件下未发生重结晶。AG(powder)仅在2θ为19°附近显示无定形宽峰,14°处显示轻微肩部,说明AG(powder)不具备明显的结晶结构,而AG(film)在 2θ为13.5°处存在较为明显的结晶峰,该结果与Wu 等[12]的研究结果一致。这可能是由于在溶液成膜和干燥过程中,琼脂高分子链由于氢键相互作用形成紧密的双螺旋构成强大的三维网络,由此形成微晶结构[13]。通过对比AG(film)与0% G+HPS+AG复配囊皮的XRD 图谱可知,添加HPS 后AG 的结晶峰消失,说明HPS 的存在会阻碍AG 高分子链的聚集,阻碍其形成氢键,从而抑制AG 结晶。
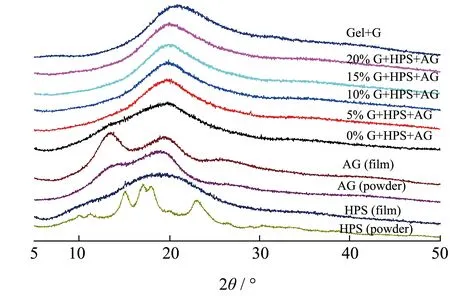
图2 不同甘油质量分数下HPS-AG复配囊皮的XRD曲线图Fig.2 XRD of HPS-AG compound capsule shell at different glycerol concentrations
对比0% G+HPS+AG 和5% G+HPS+AG 复配囊皮的XRD 图谱可知,添加甘油后复配囊皮的主宽峰宽度减小,强度增大,这表明甘油与HPS 和AG之间相互作用,使得囊皮结构有序程度提升。该结果与Bergo 等[14]的实验结果一致,通过往淀粉膜中添加甘油,XRD 图谱显示在2θ≈20°处观察到一些结晶峰的趋势。这可能是由于甘油的添加增大了高分子的迁移率,使其结构有序性增强,允许部分微晶形成[14]。实验结果表明随着甘油添加量的增大,HPS-AG 复配囊皮峰值变化较小,并未形成明显结晶峰。该现象与Gel+G 囊皮一致,可知在实验条件下Gel+G 囊皮与HPS-AG 复配囊皮均未发生明显重结晶,体现二者良好的贮存稳定性。
2.3 复配囊皮热重分析
图3 和4 为不同复配囊皮的TG 和DTG 曲线图。样品的第一个降解阶段在200 ℃以前,该阶段质量的损失通常与样品中自由水与结合水的损失有关[15]。由于甘油的热分解,可以在243 ℃附近观察到一个热降解峰[16]。Gel+G 囊皮在320 ℃的降解峰是由于明胶的分解;HPS(film)在299 ℃的降解峰归因于HPS 的热降解;AG(film)在268 ℃的降解峰归因于AG 的热降解。

图3 不同甘油质量分数下HPS-AG复配囊皮的热重曲线Fig.3 TG curves of HPS-AG compound capsule shell at different glycerol concentrations
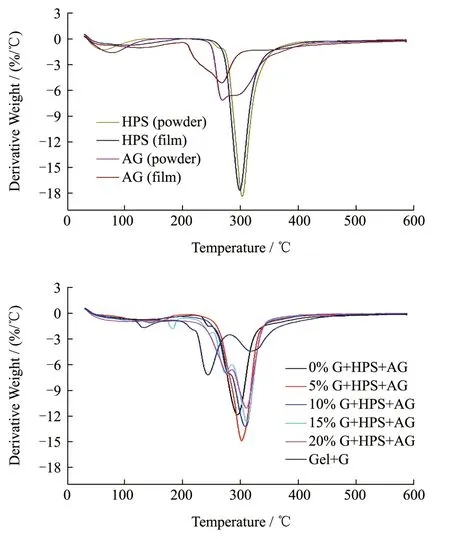
图4 不同甘油质量分数下HPS-AG复配囊皮的失重速率曲线Fig.4 DTG curves of HPS-AG compound capsule shell at different glycerol concentrations
在甘油的热降解峰以后,0% G+HPS+AG 和5% G+HPS+AG 复配囊皮仅在295 ℃和301 ℃处出现单个热降解峰,说明HPS 与AG 之间具有一定的相容性,HPS 的添加提升了AG 的热降解温度[17]。随着甘油浓度的进一步增大,10% G+HPS+AG、15% G+HPS+AG 和20% G+HPS+AG 复配囊皮分别出现了两个热降解峰,分别位于275 ℃和310 ℃附近,分别对应AG 和HPS 的特征降解峰,说明AG 与HPS 之间相容性降低,发生一定程度的分离[18]。同时随着甘油添加量的增大,不论是0% G+HPS+AG 和5% G+HPS+AG 复配囊皮的单峰还是10% G+HPS+AG、15% G+HPS+AG 和20% G+HPS+AG 复配囊皮中的特征双峰,其峰值温度均有所提升,说明在实验的浓度范围内,随着甘油的添加量的增大,复配囊皮的热稳定性有所提升。Huo等[19]的研究结果表明,甘油的存在会与AG 或淀粉之间形成新的氢键,从而提升囊皮的热稳定性。同时甘油会与AG 竞争与HPS 的氢键结合位点,因此随着甘油添加量的增大,HPS 与AG 之间的相容性反而有所降低。与Gel+G 囊皮相比,HPS-AG 复配囊皮的热降解峰温度均低于Gel 的热降解峰温度,因此Gel+G 囊皮具备更高的热降解温度。
2.4 复配囊皮透光性分析
利用紫外分光光度计对不同囊皮的透光性能进行了测试,其紫外光谱图如图5 所示。除了纯AG囊皮,其余囊皮在200~1 000 nm 波段扫描范围内,透光率呈现类似的变化趋势。当波长达到600 nm时,囊皮的透光率曲线趋于平稳,600 nm 处的波长常用于薄膜透光率的测定[20]。因此选取波长600 nm 处的透光率转化为吸光度。由于囊皮的厚度不同,需要将该吸光度值对应囊皮厚度进行统一校准,由此绘制图6。

图5 不同甘油质量分数下HPS-AG复配囊皮的全波段紫外光谱图Fig.5 Full band ultraviolet spectrograms of HPS-AG compound capsule shell at different glycerin concentrations
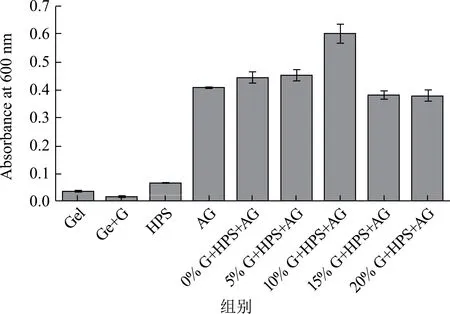
图6 不同甘油质量分数下HPS-AG复配囊皮在600 nm处的吸光度Fig.6 The absorbance of HPS-AG compound capsule shell at 600 nm at different glycerol concentrations
由图6 可知,HPS-AG 复配囊皮的吸光度值均显著高于Gel+G 囊皮,说明其具备较好的阻光性,更适用于包裹光敏性内容物。实验结果表明HPSAG 复配囊皮的吸光度值均高于纯HPS 和纯AG 囊皮,随着甘油量添加量的增大,复配囊皮的吸光度值先增大后减小,在甘油添加量为10%(m/m)时,囊皮吸光度最高为0.60。目前关于甘油对膜材光学性能影响的研究较多:Liang 等[21]发现,随着甘油添加量的增大,薄膜的吸光度升高;而Fu 等[22]发现,甘油含量更高的薄膜透光性更好,吸光度更低。甘油主要通过影响薄膜成分的相容性、表面宏观平整度和内部微观结构的有序性来影响薄膜的吸光度值[18,22,23]。结合2.3 TGA 的分析结果可知,随着甘油添加量的增大,HPS 与AG 的相容性降低,两相界面的光散射会导致囊皮透光率的降低,因此10%G+HPS+AG 复配囊皮吸光度的升高是由于HPS 与AG 相容性降低引起的[18]。但随着甘油浓度的进一步增大,当甘油添加量为15%(m/m)和20%(m/m)时,复配囊皮的吸光度反而下降。这可能是由于甘油的添加可以增大高分子的迁移率,使得复配囊皮内部结构有序性增强,从而促进可见光通过复配囊皮,降低复配囊皮吸光度值[23]。这与2.2 XRD 的结果一致,对比0% G+HPS+AG 和5% G+HPS+AG 复配囊皮的XRD 谱图可知添加甘油后HPS-AG 复配囊皮结构的有序程度增大。
2.5 复配囊皮微观形貌表征
图7 显示了不同复配囊皮的表面和截面扫描电镜图。实验结果表明Gel、Gel+G、HPS 和AG 囊皮表面和截面均较为光滑,说明体系均一性较好。Gel 和Gel+G 囊皮截面边缘的裂纹可能是囊皮在干燥过程中失水引起的干裂[24]。由图可知,与Gel+G囊皮相比,HPS-AG 复配囊皮表面粗糙度较高。0%G+HPS+AG 复配囊皮的表面较为平整,但也存在少量不均匀的突起。添加甘油后复配囊皮表面形成明显的细团块,截面也出现少量团块结构,说明HPS与AG 之间的相容性下降。该结果与2.3 的TGA 分析结果保持一致,证实添加的甘油会与AG 竞争和HPS 的氢键结合位点(与HPS 竞争与AG 的氢键结合位点),从而导致HPS 与AG 相容性下降,复配囊皮表面和截面变得更为粗糙。目前已有研究表明,淀粉与AG 之间相容性降低会导致复配薄膜表面粗糙度增大[12]。

图7 不同甘油质量分数下HPS-AG复配囊皮的表面、截面扫描电镜图Fig.7 SEM diagrams of surface and cross-section of HPS-AG compound capsule shell at different glycerin concentrations
2.6 复配囊皮水接触角分析
表2 和图8 为不同囊皮的水接触角。通过WCA 可以评估囊皮表面的疏水性和润湿性。对比t=0 s 和t=30 s 的WCA 可知,当水滴在囊皮表面时由于水分的吸收和蒸发,WCA 通常随着时间的推移而减小[25]。实验结果表明Gel+G 囊皮表面的疏水性最好,在t=0 s 和t=30 s 时WCA 均最大,分别为99.49°和90.10°。与Gel+G 囊皮相比,HPS-AG 复配囊皮的WCA 均较小,说明HPS-AG复配囊皮表面亲水性高于Gel+G 囊皮,其较适合包裹油溶性内容物。为了提升复配囊皮的表面疏水性,可在囊皮表面涂覆适当的疏水性材料,以用于亲水性内容物的包裹[26]。由2.5 SEM 分析结果可知,HPS-AG 复配囊皮表面较高的粗糙度有利于疏水性材料的涂覆与保留。随着甘油添加量的增大,HPS-AG 复配囊皮的WCA(t=0 s)呈先增大后减小的趋势,在15% G+HPS+AG 处WCA 最大,为86.17°。结合2.5 SEM 结果分析,15% G+HPS+AG 复配囊皮WCA 较高可能是由于囊皮表面粗糙度较高。已有研究表明,材料表面微米或纳米级别的粗糙结构可以赋予材料更高的疏水性[27]。而20% G+HPS+AG 复配囊皮WCA 减小可能是因为高浓度的甘油使得复配囊皮含水量升高,囊皮表面亲水性提升,因此WCA 减小[25]。
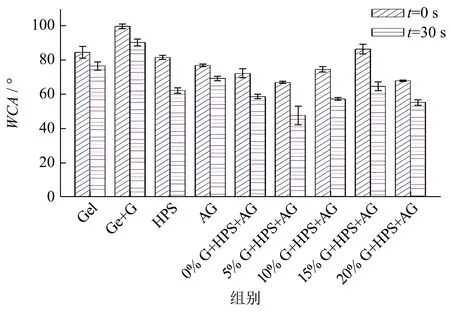
图8 不同甘油质量分数下HPS-AG复配囊皮的接触角Fig.8 WCA of HPS-AG compound capsule shell at different glycerin concentrations
2.7 复配囊皮力学性能分析
由图9 可知,随着甘油质量分数的增大,HPSAG 复配囊皮的YM 和TS 逐渐减小,EAB 逐渐增大,这与Sandhu 等[28]的研究结果是一致的。这是由于甘油作为保湿剂在相同条件下能使囊皮保留更多水分,甘油和水均可作为囊皮的增塑剂,减小高分子之间的相互作用力,使高分子链更具流动性和柔性,拉伸过程中高分子链更容易发生位移,囊皮更容易发生形变[29]。其中当甘油质量分数为15%(m/m)时,囊皮表现出较好的EAB,为94.17%。同时其YM 和TS 分别为17.47 MPa 和3.17 MPa,满足稳定生产条件,表现出了制备软胶囊囊皮的良好潜力。Ock 等以木薯淀粉(25.4%,m/m)、IC(8.8%,m/m)、甘油(18.6%,m/m)和D-山梨糖醇(5.4%,m/m)为原料,使用薄膜涂布机制备的淀粉基软胶囊囊皮(50% RH 下平衡)TS 和EAB 分别为21.54 MPa 和120.23%,本实验制备的HPS-AG 复配囊皮在更低的湿度条件下表现出良好的柔软性和韧性[30]。但与Gel+G 囊皮相比,其EAB 较低,后续可通过三元复配或添加一定量的离子进一步增强其性质。

图9 不同甘油质量分数下HPS-AG复配囊皮力学性能Fig.9 Mechanical properties of HPS-AG compound capsule shell at different glycerol concentrations
3 结论
对不同甘油含量的HPS-AG 复配囊皮的性能进行了研究。红外结果表明,复配囊皮中HPS 与AG之间存在氢键相互作用;热重结果表明,甘油的添加使得HPS 与AG 相容性降低,随着甘油质量分数升高,复配囊皮热稳定性提高;复配囊皮吸光度和WCA 先增大后减小,10% G+HPS+AG 复配囊皮遮光性最好,15% G+HPS+AG 复配囊皮疏水性最强;拉伸测试结果表明,15% G+HPS+AG 复配囊皮具备较好的机械强度,满足稳定生产条件;与传统明胶囊皮(Gel+G)相比,15% G+HPS+AG 复配囊皮在干燥贮存条件下更加柔软,具备良好的储存稳定性,且原料均为非动物源,安全性更好。结合不同甘油浓度复配囊皮的结晶结构、热稳定性和微观结构等性能分析,可阐明甘油对HPS-AG 复配囊皮性能的影响机理:(1)低质量分数下甘油的存在可能促进HPS 与AG 之间的结合;(2)高质量分数下甘油会与AG 竞争与HPS 之间的氢键结合位点(与HPS 竞争与AG 之间的氢键结合位点),导致HPS与AG 之间的相容性降低;(3)甘油的存在可能使得高分子迁移率提升,囊皮内结构的有序程度增大。以上结果表明,HPS-AG 复配体系表现出了制备淀粉基软胶囊囊皮的良好潜力,可为今后淀粉基软胶囊囊皮的工业化生产提供理论和实践基础。
