气相色谱-质谱法测定饲料中的二氢吡啶
2024-05-13刘文秋董宁孙莹莹
刘文秋 董宁 孙莹莹
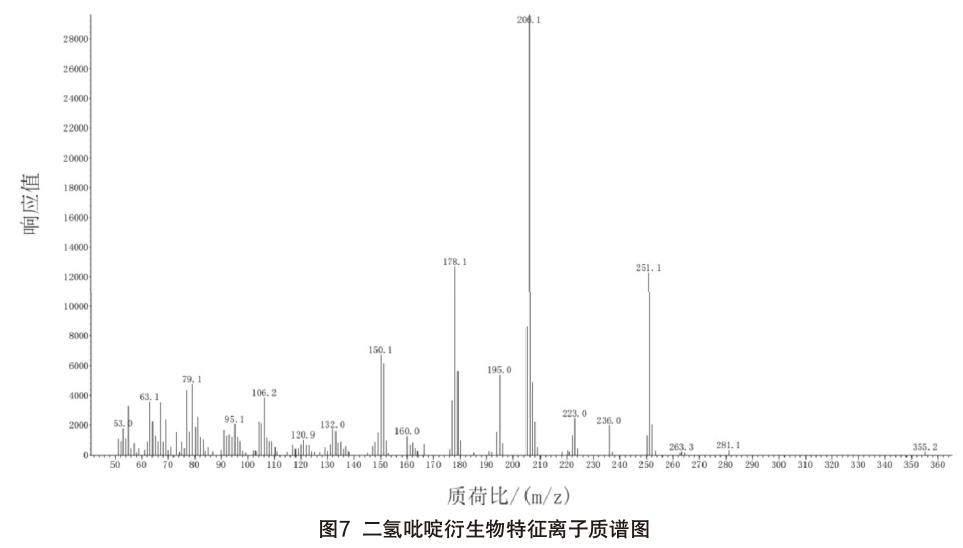
摘 要:本文建立一种气相色谱-质谱法(GC-MS)测定饲料产品中二氢砒啶含量的方法。采用避光的环境,在饲料样品中添加保护剂降低二氢砒啶的光化学反应,采用乙腈提取待测物,经浓缩和固相微萃取净化,采用BSTFA进行衍生,衍生物通过GCMS气化分离以及选择离子监测(SIM)模式进行检测。对二氢吡啶衍生物的电子轰击(EI)质谱碎片进行解析,特征碎片离子(m/z)206、178、251、151、150、195為定性离子,206为定量离子。该分析方法中二氢吡啶在3~150 mg/kg范围内呈良好线性关系,样品分析精密度RSD<3%,样品中二氢吡啶的检出限0.3 mg/kg。结果表明,这项方法灵敏、稳定、可靠,有效避免了饲料中二氢吡啶在处理过程中的降解,并有效排除了主要杂质的干扰,适用于饲料产品中二氢吡啶的定量分析与确证。
关键词:二氢吡啶,气相色谱质谱,避光,衍生,饲料
DOI编码:10.3969/j.issn.1002-5944.2024.04.035
0 前 言
二氢吡啶(diludine),化学名称2,6-二甲基-3,5-二乙酯基-1,4-二氢吡啶,添加于饲料中作为抗氧化剂及畜禽促生长剂,能显著促进家畜、家禽、鱼、虾、牛羊等动物的生长,改善产肉、产蛋与繁殖性能[1]。《兽药质量标准》(2003)规定每1000 kg牛饲料中可添加100~150 g二氢吡啶,每1000 kg种肉鸡饲料中可添加150 g二氢吡啶[2]。畜禽类饲料主要以玉米、大豆饼、肉骨粉等为主,辅氨基酸等营养成分以及促生长剂、维生素等添加剂,配方设计多样、组成成分复杂,给二氢吡啶的检测带来了非常严重的杂质干扰。在现有研究中,二氢吡啶含量测定多采用紫外分光光度法、气相色谱电子俘获检测器法、高效液相色谱法等检测技术[3-4],不能区分目标物与杂质,已不能满足对二氢吡啶检测的需求。
另外,二氢吡啶中-N H-的给电子共轭效应与-COOR的吸电子共轭效应,导致其结构不稳定,光稳定性较差。有研究表明,在自然光、漫射光、钨灯光等光源下,二氢吡啶均会发生不同程度的光化学反应[5],《中华人民共和国药典》和《兽药质量标准》(2003)都提出了“避光、密闭保存”“现混现喂”的规定。这一点,笔者也通过试验证实了二氢吡啶含量持续下降的现象。如何在分离纯化过程中保持二氢吡啶的稳定性并有效降低基质的干扰,是饲料产品中二氢吡啶含量测定的巨大难题和挑战。
本文对饲料中二氢吡啶检测方法进行研究,探讨了基于气相色谱质谱联用的方法,通过避光操作和添加紫外线吸收剂、BSTFA衍生化等措施,着重提高方法的稳定性;通过固相萃取净化、质谱分析等方式,解决饲料产品复杂的基质干扰、准确定性定量;方法的检出限、准确性能满足饲料产品中二氢吡啶的含量测定,为饲料产品更科学准确地管控质量安全提供依据。
1 材料与方法
1.1 材料
1.1.1 试剂
二氢吡啶(98.00%),TRC公司;N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA,99%),Supelco公司;乙腈,色谱纯。
C 1 8 、P S A 吸附剂(c l e a n e r t ? P S A ,cleanert?C18):博纳艾杰尔科技公司。
紫外线吸收剂:4-甲基苄亚基樟脑、丁基甲氧基二苯甲酰基甲烷、苯基苯并咪唑磺酸、对氨基苯甲酸、甲氧基肉桂酸乙基己酯、对甲氧基肉桂酸异戊酯等,均为分析纯。
1.1.2 仪器和设备
气相色谱质谱联用仪(Agilent 5975C,配EI源):美国安捷伦公司。
旋转蒸发仪(EYELA N-1100):上海爱朗仪器公司。
离心机(冷冻离心机L535R):湖南湘仪实验室仪器开发公司。
1.2 方法
1.2.1 前处理方法
称取2 g(精确至0.001 g )饲料,加入2~3种紫外线吸收剂混合物0.2 g,混匀。加入40 mL乙腈,振荡摇匀,超声萃取5 min,加入1 g氯化钠并剧烈振荡,5000 r/min离心5 min,移取上清液。40 ℃减压旋蒸至约1 mL,乙腈定容至2 mL。添加1 gPSA、无水硫酸镁与C18的混合吸附剂粉末对定容液进行净化处理,高速振荡1~3 min,涡旋后5000 r/min离心3 min。上清液过0.45 μm滤膜,取滤液50 uL,加入100 uL BSTFA,80 ℃加热20 min,冷却后供上机分析。
前处理全程均采用棕色器皿并避光操作。采用遮光窗帘阻挡室外阳光,操作时关闭实验台近处灯光,尽可能减少实验环境的光照强度和光照时长。
1.2.2 色谱与质谱条件
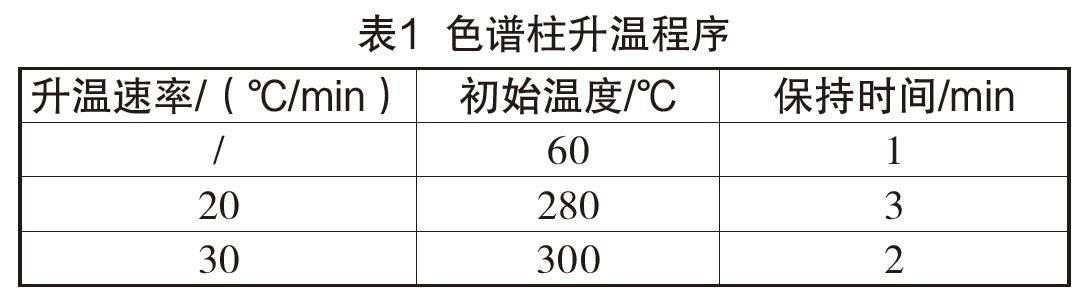
色谱柱:DB-5 ms,30 m×0.25 um×0.25 mm;进样口温度:260 ℃;载气流速:1 mL/min;分流比:50∶1;色谱柱升温程序见表1;离子源温度:150℃;SCAN模式、SIM模式、定性离子、定量离子等参数见表2;二氢吡啶衍生化物结构图见图1。
2 结果与讨论
2.1 光线对稳定性的影响
比较了10 ug/mL未衍生标准溶液在正常光线条件下,每1 h测定一次的响应值(见图2),结果表明响应值随着时间的推移整体呈下降趋势,5 h内连续下降了近30%。
2.2 添加紫外线吸收剂与衍生化对稳定性的影响
在2 g样品中添加200 μg二氢砒啶,加入4-甲基苄亚基樟脑、甲氧基肉桂酸乙基己酯各0.1 g,混匀后进行前处理并采用BSTFA衍生化,待测溶液每1 h测定一次(图3)。结果表明在本试验的光照和GCMS加热条件下,待测物响应值基本一致,波动较小,稳定性良好。
2.3 衍生化条件的优化
2.3.1 待测溶液是否氮吹至干的比较
在衍生温度、时间、BSTFA用量一致的情况下,比较了待测溶液经氮吹至干后加BSTFA(A)与待测溶液不经氮吹直接加BSTFA(B)两种方式下,50 μg/mL二氢吡啶标准溶液的响应值变化(图4)。结果表明,两种情况下响应值没有明显变化,氮吹对衍生化效率影响较小,为了减少目标物损失的机会以及提高操作效率,因此采用待测溶液不经氮吹的方式。
2.3.2 衍生化时间的优化
在衍生化温度、BSTFA用量一致的情况下,比较了50 μg/mL待测溶液分别加热10 min、20 min、30 min、60min后的响应值变化(见图5)。结果表明衍生化产物随着时间的增加而上升,20 min的响应值最高,时间增加响应值下降,因此选择衍生化时间为20 min。
2.4 方法标准溶液校正曲线、检出限
本文方法中二氢吡啶的检出限为0.3 mg/kg(SN>3),线性范围为3~150 mg/kg,定量限为3 mg/kg(SN>10),详见表3。方法中目标物的峰形及分离度均良好,有效排除了样品中复杂基质的干扰,满足实际样品的检测需求。二氢吡啶衍生物的色谱图见图6,特征离子质谱图见图7。
2.5 方法准确度
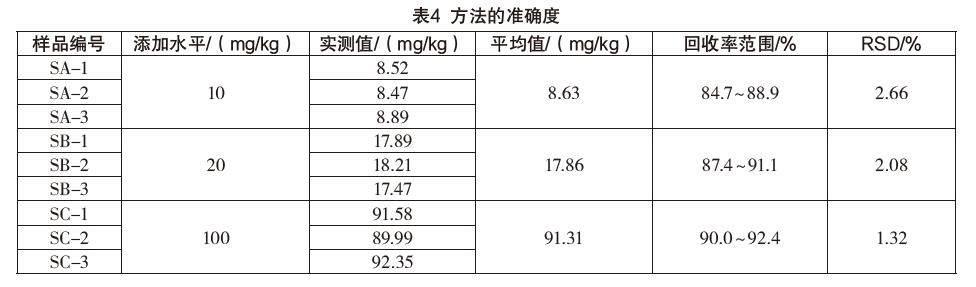
以配合饲料、预混合饲料、浓缩饲料为例,称取2 g样品,分别添加100 mg/L的二氢吡啶标液溶液0.2 mL、0.4 mL、2 mL,制备3个不同浓度水平的加标样品,每个水平制备3个平行样,按前处理方法处理后上机测定,测定结果见表4。結果表明,二氢吡啶的回收率在84.7%~92.4%之间,相对标准偏差为1.32%~2.66%,满足配合饲料、预混合饲料、浓缩饲料产品中二氢吡啶含量的分析测定要求。
3 结 论
本研究开发了饲料中二氢砒啶的GCMS外标定量检测方法,结果显示在避光环境下,饲料样品中加入紫外线吸收剂,用乙腈溶液提取,在40℃进行旋转蒸发浓缩定容,经C18、PSA固相微萃取吸附剂净化后,净化液与BSTFA于80 ℃衍生20 min,即可得到80%以上的回收率,排除了饲料产品中主要杂质的干扰。方法的检出限、稳定性、准确性均能满足饲料产品中二氢吡啶含量的分析测试要求,同时有效解决了二氢吡啶在处理过程中的降解问题。
参考文献
[1]王彦波.多功能饲料添加剂二氢吡啶的研究进展[J].饲料博览,2005,12(6):35-37.
[2]兽药质量标准(2003年版).中华人民共和国农业部第307号公告附件[Z].2003.
[3]金瓯,郑之詹,郭慧. HPLC法测定二氢吡啶的含量[J].饲料研究,2007,12(12):24-25.
[4]ODYNETS A G, PARINOVV V Y , KIMENIS A A , e tal. Metabolism of diludine in experimental animals[J].Pharmaceutical Chemistry Journal, 1986, 20(4): 243-246.
[5]梅其炳,商澎,赵德化.五种二氢吡啶光稳定性比较[J].中国药学杂志,1998,33(5):291-294.
作者简介
刘文秋,本科,工程师,标准中心主任,研究方向为检验检测分析方法及标准化。
董宁,博士研究生,高级工程师,研发经理,研究方向为检验检测分析方法及专利。
孙莹莹,博士研究生,高级工程师,技术研发中心主任,研究方向为检验检测分析技术及自动化设备应用。
(责任编辑:张佩玉)
