酪蛋白磷酸肽-钙螯合物的分级、表征及持钙特性
2024-05-12刘卫震王冠华袁延佩伍昌军贾永秀隋文杰
刘卫震,王冠华,袁延佩,伍昌军,贾永秀,隋文杰,*
(1.天津科技大学食品营养与安全国家重点实验室,天津科技大学食品科学与工程学院,天津 300457;2.天津科技大学轻工科学与工程学院,天津 300457;3.内蒙古蒙特威生物科技有限公司,内蒙古包头 014000)
作为人体必需矿物质成分之一,钙参与到人体代谢、骨骼生长和酶调节等多种生理过程[1-2]。通过饮食摄入是增加身体中钙储存最有效的方法[3-5]。然而,传统钙制剂容易在小肠中形成不溶性沉淀物,从而减少人体对钙离子的吸收效果[6-7]。酪蛋白磷酸肽(Casein Phosphopeptides,CPPs)是以牛乳酪蛋白为原料,经酶水解、分离、纯化而制得的含有磷酸丝氨酰基的天然活性肽。其在pH 呈中性到弱碱性的动物肠道内,能阻止磷酸钙沉淀的产生,从而促进钙的吸收[8-11]。
钙-乙醇沉淀法是目前分离酪蛋白磷酸肽最普遍的方法之一[12-15],即向酪蛋白水解液中加入一定浓度的Ca2+,使CPPs 分子之间形成钙桥,再向溶液中加入一定量的乙醇,改变溶液的介电常数,使CPPs 沉淀下来。但是,由于传统钙乙醇沉淀法加入的Ca2+相对于酶解液中CPPs 来说是过量的,导致溶液中与其螯合的CPPs 达到饱和,进而全部沉淀下来,所以获得的产品在钙螯合能力和纯度等方面有限,降低了产品的应用价值。
本研究利用酪蛋白磷酸肽螯合钙离子的特性,以钙离子浓度为尺度,分级制取不同钙螯合能力的CPPs,同时提高其纯度。通过改变钙离子浓度,连续沉淀出不同钙螯合活性的酪蛋白磷酸肽,以钙螯合量为指标对CPPs 进行分级。测定不同级分的氨基酸组成、N/P 摩尔比对其进行分析。并通过紫外吸收光谱、FT-IR 红外吸收光谱及Zeta 电位对钙螯合量最高的酪蛋白磷酸肽和肽钙螯合物结构进行表征。最后,进行了分级酪蛋白磷酸肽的体外持钙能力测定和酪蛋白磷酸肽钙螯合物的体外消化模拟实验,并分析了酪蛋白磷酸肽钙螯合物在模拟胃肠消化中的生物利用度,特别是在肠道pH 环境下的钙保持能力,旨在为提高酪蛋白磷酸肽及钙螯合物的生物利用度提供理论依据。
1 材料与方法
1.1 材料与仪器
干酪素 蛋白含量90%,湖北百特威生物科技有限公司;酪蛋白磷酸肽 纯度80%,阿拉丁试剂股份有限公司;胰蛋白酶(25000 U/g)、胃蛋白酶(15000 U/g)上海源叶生物科技有限公司;EDTA、碳酸氢钠、磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸 均为分析纯,国药集团化学试剂有限公司;无水乙醇 津东天正精细化学试剂厂。
H1850 型高速离心机 湖南湘仪有限公司;Scientz-10N/A 型冷冻干燥机 宁波新芝生物科技股份有限公司;Kjeltec 8400 型凯氏定氮仪 福特(中国)有限公司;IS50 型傅里叶红外光谱仪 美国尼高利仪器公司;BeNano 90 Zeta 型Zeta 电位仪 英国马尔文帕纳科公司。
1.2 实验方法
1.2.1 酪蛋白酶解液的制备 称取适量酪蛋白酸钠溶于去离子水(50 mg/mL)中,利用1 mol/L NaOH溶液调至pH8。加入胰蛋白酶(酶与底物质量比1:50,w/w),于45 °C 水浴锅中酶解4 h,酶解结束后置于90 °C 水浴锅中灭酶10 min,冷却至室温。将酶解液用1 mol/L HCl 调节pH 至4.6,静置,10000 r/min 离心 10 min,取上清液备用。此制备条件下酪蛋白酸钠酶解较充分,水解度为19.22%±0.68%。
1.2.2 钙-乙醇分级酪蛋白磷酸肽 将酪蛋白酶解液用1 mol/L HCl 溶液调至pH 为5.5,加入CaCl2,使CaCl2浓度为0.24%。将CaCl2总量分为三个等级(终浓度分别为0.05%、0.08%、0.11%),加入无水乙醇,使其终浓度达到55%(v/v),对酶解液进行钙-乙醇分级。静置6 h,10000 r/min 离心 10 min,取沉淀进行冷冻干燥。收集不同组分,分别命名为CPP1-Ca、CPP2-Ca、CPP3-Ca。将直接加入CaCl2浓度为0.24%的酶解液进行钙乙醇沉淀,得到的组分被命名为CPP-Ca。
1.2.3 PBS 脱钙 取1 g 不同级分肽钙螯合物,加入200 mL 0.2 mol/L 的pH 为8 的PBS 缓冲液,搅拌4 h 后离心10 min[16]。取上清液进行透析,去除磷酸根,然后将不同级分进行冷干,得到脱钙后的各级分,分别命名为CPP,CPP1,CPP2,CPP3。该方法可脱除酪蛋白磷酸肽钙螯合物中99%以上的钙,且酪蛋白磷酸肽无损失。
1.2.4 分级酪蛋白磷酸肽钙螯合物纯度和得率测定参考国标钡乙醇法GB 31617-2014《食品安全国家标准 食品营养强化剂酪蛋白磷酸肽》测定不同级分酪蛋白磷酸肽的纯度。不同级分酪蛋白磷酸肽钙螯合物得率计算公式如下:
式中:W1表示酪蛋白磷酸肽钙螯合物绝对得率,%;A1为不同级分酪蛋白磷酸肽质量,g;A2为酪蛋白质量,g;W2表示酪蛋白磷酸肽钙螯合物相对得率,%;B1为不同级分肽钙螯合物质量,g;B2为总肽钙螯合物质量,g。
1.2.5 分级酪蛋白磷酸肽钙螯合物理化性质测定钙螯合量测定参照GB 5009.92-2016《食品安全国家标准 食品中钙的测定》中火焰原子吸收光谱法;氨基酸组成的测定参照GB 5009.124-2016《食品安全国家标准 食品中氨基酸的测定》;氮含量测定参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法;磷含量测定采用半微量定磷法[17-18],根据下式计算得出N/P(摩尔比)。
式中:W1为氮的质量百分含量;W2为磷的质量百分含量。
1.2.6 分级酪蛋白磷酸肽及肽钙螯合物结构表征Zeta 电位采用电位分析仪进行测定[19]:样品溶于去离子水中,充分混匀后使其浓度为1 mg/mL。随后利用纳米粒度电位仪对不同级分样品的ξ电势进行测定。测定紫外吸收光谱[19-22]:将CPP3-Ca 和CPP3 样品分散在浓度为1 mg/mL 的蒸馏水中,滤膜(0.22 μm)过滤后用紫外吸收分光光度计在190~400 nm 波长范围内扫描,记录样品的紫外可见光谱。参考齐立伟等[21]的方法测定傅里叶红外光谱:少量样品(CPP3 和CPP3-Ca)与溴化钾混合,挤压成透明片,装入FT-IR 样品板。每个样本在4000~400 cm-1的波数范围内进行扫描。
高文军[4]等认为超声引导下穿刺活检方便、简单、安全、准确,在严格掌握适应证的情况下,可以用于卵巢癌的诊断及鉴别诊断。本研究在超声引导下穿刺活检中有6例穿刺病例病理提示:无法诊断(组织量少或坏死物),并将这6例归为阴性。其中有2例术后证实为畸胎瘤,4例术后证实为恶性卵巢肿瘤。回归分析:这6例盆腔肿块内部回声均以囊性成分为主,肿块较大,穿刺物为:坏死物或纤维组织,存在假阴性。
1.2.7 分级酪蛋白磷酸肽持钙能力测定和体外生物利用度 酪蛋白磷酸肽持钙能力测定:采用pH-stat法测定不同级分酪蛋白磷酸肽的持钙能力[23-24]。反应条件为37 °C,pH 为8.0,与人体小肠末端环境一致。加入不同级分CPP 的终浓度为0.1 g/L,以不加CPP 样品的为空白对照。体外消化模拟[25-27]:将不同级分肽钙螯合物、氯化钙分别溶解于去离子水(1 mg/mL)中,调节pH 至2.0,37 °C 孵育5 min 后,按1:35(w/w)的酶底物比加入胃蛋白酶消化2 h。胃消化完成后,用饱和NaHCO3调pH 至6.8 后,按照1:25(w/w)的酶底物比加入胰蛋白酶,继续用1 mol/L NaOH 调节至pH7.5 后消化2 h。分别在体外消化0、30、60、90 和120 min 时取一定量样品,沸水浴灭酶 10 min 后进行样品可溶性钙含量测定。用EDTA 滴定法[27-28]测定消化过程中样品可溶性钙含量的变化,以不同时间间隔计算样品的钙含量。钙的溶解度计算公式如下:
式中:M1为溶解钙含量,mg/L;M0为总钙含量,mg/L。
1.3 数据处理
所有试验均重复3 次,试验数据采用 SPSS 22.0软件的 ANOVA(变异系数分析)进行显著性分析(P<0.05),利用Origin Pro 9.0 进行制图。
2 结果与分析
2.1 酪蛋白磷酸肽及肽钙螯合物的制备
图1 为钙乙醇分级酪蛋白磷酸肽的制备工艺流程。酪蛋白经胰蛋白酶酶解后,利用钙乙醇沉淀酶解液中酪蛋白磷酸肽的原理,改变钙离子浓度,连续沉淀出不同钙螯合量的酪蛋白磷酸肽钙螯合物(CPP1-Ca、CPP2-Ca 和CPP3-Ca),并且以传统钙乙醇沉淀的方法得到的酪蛋白磷酸肽钙螯合物(CPP-Ca)作对照。另外,相对应的酪蛋白磷酸肽(CPP1、CPP2 和CPP3)可以通过以磷酸肽钙螯合物为原料,经PBS脱钙法得到[16]。
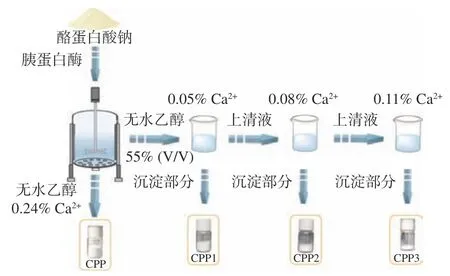
图1 分级酪蛋白磷酸肽制备流程图Fig.1 Flow chart of the preparation of different grades of casein phosphopeptides
得率和纯度是评价分离酪蛋白磷酸肽的重要指标。由图2 可知,未分级得到的酪蛋白磷酸肽钙螯合物得率为22.16%。钙乙醇分级得到的CPP1-Ca、CPP2-Ca、CPP3-Ca 得率分别为10.36%、8.02%和4.31%,相较于未分级的酪蛋白磷酸肽钙螯合物得率较低。其中,三种不同级分的酪蛋白磷酸肽钙螯合物中CPP1-Ca 的相对得率最高,为46.18%,CPP3-Ca的相对得率最低,仅有18.15%。郭长慧等[29]在酪蛋白磷酸肽制备工艺参数的优化研究中得到最优条件下CPPs 的得率最大为16.11%(质量分数)。由图3可知,实验所制备的CPP1-Ca、CPP2-Ca、CPP3-Ca和CPP-Ca 纯度均在70%以上。利用钙乙醇分级得到的不同级分酪蛋白磷酸肽钙螯合物中,CPP3-Ca 的纯度最高,为89.42%,相较于未分级的酪蛋白磷酸肽钙螯合物(CPP-Ca)的83.77%的纯度提高了6.74%。陈雪香等[13]的研究中用乙醇-钡法测定8 种商品CPPs 的纯度,其中样品CPP 纯度最大的为38.01%,最小的为19.43%。CPP1-Ca 到CPP3-Ca的钙螯合量逐渐增高,其中CPP3-Ca 的钙螯合量最高,为69.59 mg/g,均显著(P<0.05)高于CPP1-Ca 和CPP2-Ca 两个级分的42.53 和58.54 mg/g 以及未分级的CPP-Ca(55.05 mg/g)。
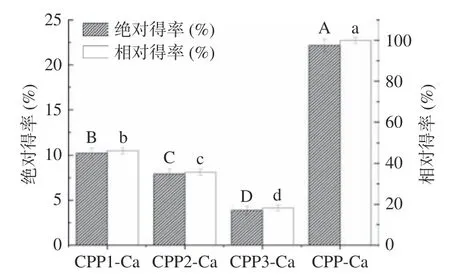
图2 分级酪蛋白磷酸肽钙螯合物得率Fig.2 Yield of calcium chelates of casein phosphopeptide of different grades
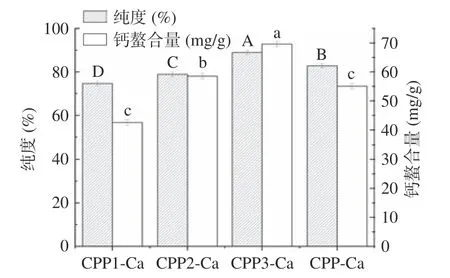
图3 分级酪蛋白磷酸肽钙螯合物纯度和钙螯合量Fig.3 Purity and calcium chelation of graded casein phosphopeptide
2.2 分级酪蛋白磷酸肽钙螯合物的理化性质分析
2.2.1 氨基酸组成分析 有研究表明,肽结合金属离子的能力主要取决于其氨基酸组成,其中,酪蛋白磷酸肽的钙结合量与其中的磷酸丝氨酸基团含量呈正相关[30]。为了研究不同级分酪蛋白磷酸肽中氨基酸组成对酪蛋白磷酸肽与钙离子反应的影响,测定了酪蛋白磷酸肽钙螯合物的氨基酸组成。从总氨基酸含量结果(表1)来看,各级分酪蛋白磷酸肽钙螯合物中谷氨酸含量较高,其次还含有亮氨酸和异亮氨酸,这与文献[31-32]所报道的结果相似。由表2 可知,四种酪蛋白磷酸肽钙螯合物的氨基酸组成中,丝氨酸(Ser)和谷氨酸(Glu)含量最高,可见四种酪蛋白磷酸肽钙螯合物的核心结构-SerP-SerP-SerP-Glu-Glu-占整个肽链的比例较大,酪蛋白磷酸肽的纯度较高,这一结果与前文酪蛋白磷酸肽纯度的测定结果一致(图3)。磷酸化残基在矿物结合中起重要作用,研究表明去磷酸化的肽并没有显示与任何矿物结合的活性[33]。由表2 可知,CPP1-Ca、CPP2-Ca、CPP3-Ca、CPP-Ca 分别具有较高含量的磷酸丝氨酰残基,其中CPP-Ca 的丝氨酸(Ser)和谷氨酸(Glu)含量最低,仅占29.87%,而 CPP3-Ca 的丝氨酸(Ser)和谷氨酸(Glu)含量最高,占33.25%。该结果与冯颖杰等[33]利用米曲霉蛋白酶制备CPP 的氨基酸组成分析中结果一致。所以由此可证明CPP3-Ca 具有更高的钙螯合能力。这也进一步表明磷酸化的残基在矿物结合和运输中起重要作用。
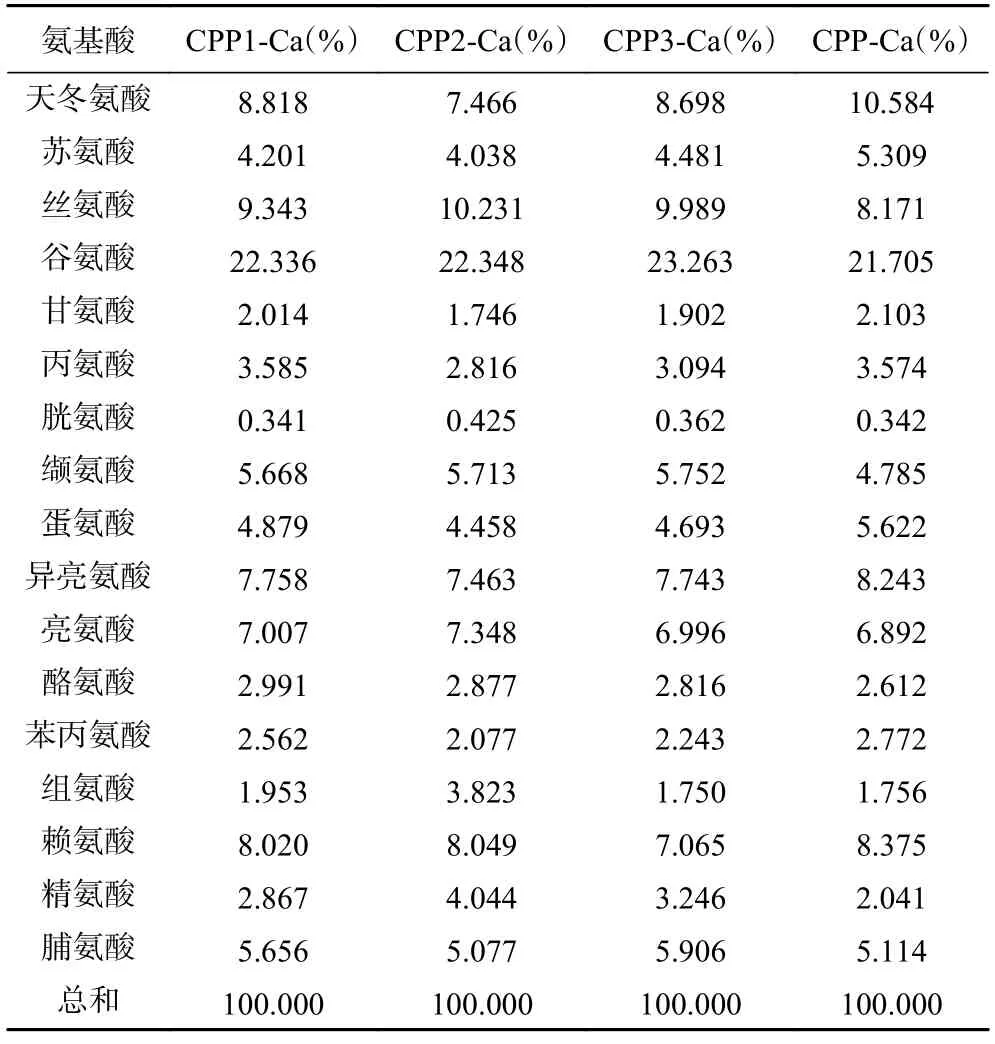
表1 不同酪蛋白磷酸肽钙螯合物中氨基酸组成及含量Table 1 Amino acid compositions and contents in different calcium casein phosphopeptide chelates

表2 不同酪蛋白磷酸肽钙螯合物中Ser 和Glu 含量Table 2 Ser and Glu contents in different casein phosphopeptide calcium chelates
2.2.2 N/P(摩尔比)分析 N/P(摩尔比)是评价CPP 质量的一个重要指标,本研究规定N/P 在24 以上 的CPP 为 高N/P 的CPP,N/P 在15~24 的CPP为中N/P 的CPP,摩尔比在15 以下的CPP 为低N/P的CPP[17,34]。N/P 反映了产品中磷酸丝氨酸残基的密度,N/P 越低,磷酸丝氨酸残基密度越高。由图4可以看出,四种酪蛋白磷酸肽高螯合物的N/P 均在15 以下,属低N/P 的CPP,而市售CPPs 的N/P 为15.55,属于中N/P 的CPP。其中CPP3 的N/P 最低,达到8.27。在Alcalase 水解酪蛋白制备磷酸肽和非磷肽的研究中,赵一明[35]发现酪蛋白水解液经选择沉淀法得到的酪蛋白磷酸肽N/P(摩尔比)是9.61。由此可以说明CPP3 含有较高密度的磷酸丝氨酸残基,这一结果与前文中氨基酸组成的测定结果一致(表2)。

图4 分级酪蛋白磷酸肽钙螯合物N/P 摩尔比Fig.4 Graded casein phosphopeptide calcium chelates N/P molar ratio
2.3 分级酪蛋白磷酸肽及肽钙螯合物结构表征
2.3.1 紫外吸收光谱分析 从紫外线吸收光谱的强度和位移的变化中可以推导出酪蛋白磷酸肽和钙之间可能的相互作用机制。CPP 和CPP-Ca 的UV 光谱显示在图5 中。CPP3 在200 nm 附近显示出高强度的吸收峰,这是对应肽链中酰胺键C=O 的n→π*跃迁产生的特征峰,与钙离子螯合后,CPP3-Ca 可以观察到吸收峰强度明显增加,这可能是由于酪蛋白磷酸肽螯合钙后,导致酰胺键的电子云和配体的吸收特性发生变化而引起的[36]。在275 nm 处观察到CPP 有较弱的吸收峰。这是由于多肽中芳香族氨基酸的构象变化造成的[27]。钙螯合后,吸收峰强度明显降低,这表明在反应过程中存在分子或原子相互作用,并发生了电子跃迁[36-37]。该结果与宋丽等[37]的研究卵黄高磷蛋白肽-钙螯合物的紫外吸收光谱结果趋于一致。上述结果表明,CPP3 与Ca2+相互作用形成了不同于CPP3 的肽钙螯合物。

图5 CPP3 及CPP3-Ca 紫外吸收光谱图Fig.5 UV absorption spectra of CPP3 and CPP3-Ca
2.3.2 FT-IR 红外吸收光谱分析 FT-IR 是探究肽结构和肽钙反应机制的方法之一[37]。吸收峰的变化可以反映金属离子和有机基团之间的协调反应。与CPP3 的红外光谱相比,CPP3-Ca 螯合物的红外光谱具有明显的不同,这可能是钙离子在与酪蛋白磷酸肽进行螯合时,使肽的某些官能团结构发生变化,引起吸收峰发生变化[38-39]。从图6 可以看出,CPP3 经过钙螯合反应后,在某些波数上的红外吸收量上有所变化。CPP 的光谱中位于3444 cm-1的特征吸收带对应于-NH 的拉伸振动。当与钙螯合时,该带移到较低的波数3395 cm-1,表明酰胺中-NH 可能与钙离子发生反应,N-Ca 键取代氢键导致N-H 键延伸。代表-COOH 弯曲振动的1378 cm-1的波段,随着强度的减弱而转移到1386 cm-1,这表明羧基氧的非键合自由电子转移到钙离子上,羧基氧参与了钙结合反应。该结果与刘玉玉等[40]利用FT-IR 研究白鲢鱼皮胶原蛋白肽的羧基和氨基与钙离子螯合后生成肽-钙螯合物结果趋于一致。此外,与CPP3 相比,CPP3-Ca 在1120 cm-1处的吸收峰几乎消失,PO43-上的吸收峰几乎消失,PO43-上的P-O 伸缩振动的红外特征吸收峰在1150~1060 cm-1范围内[38],1120cm-1正好在其吸收特征峰内,所以可推测CPP3 的磷酸基团参与到与金属离子钙的螯合。基于以上结果分析,CPP3 与Ca2+结合位点主要是氨基氮原子、羧基氧原子和磷酸基团。
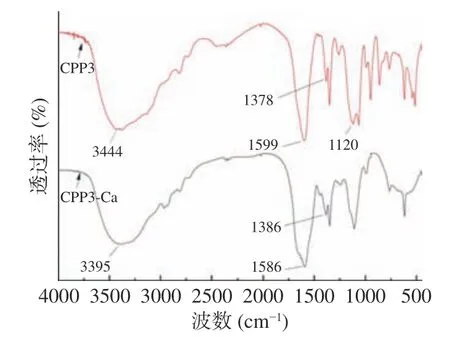
图6 CPP3 及CPP3-Ca FT-IR 红外光谱图Fig.6 FT-IR spectra of CPP3 and CPP3-Ca
2.3.3 Zeta 电位分析 Zeta 电位值可表征多肽溶液的稳定性。不同级分酪蛋白磷酸肽的表面电荷性质通过ξ电势进行确定[19]。如图7 所示,酪蛋白磷酸肽与钙离子结合后,电位绝对值有显著下降,其中,CPP3 的电位变化最大。这是可能是由于CPP 与钙离子相互作用,多肽中带负电荷的磷酸基团和羧基基团与带正电荷的钙离子相结合,导致多肽表面所带负电荷被中和,整体电位发生明显变化。这与宋丽等[37]探究卵黄高磷蛋白肽与钙离子结合机制中Zeta 电位分析结果一致。在钙乙醇分级得到的三个级分中,CPP3 的电势最低,为-36.3 mV,CPP1 的电势最高,为-24.27 mV。这可能是因为CPP3 带有更多的磷酸丝氨酸残基,本身带有负电荷。且在N/P 摩尔比和氨基酸组成分析中可以得出,CPP3 的磷酸丝氨酸残基的密度最大。由此也可以证明钙乙醇分级能富集含更多的磷酸丝氨酸残基的酪蛋白磷酸肽。
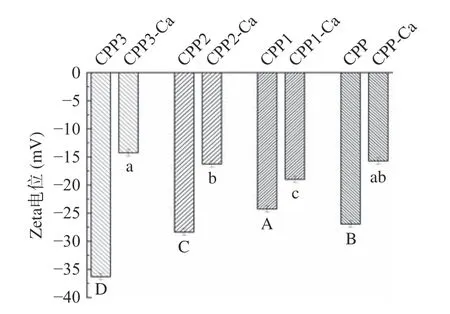
图7 分级酪蛋白磷酸肽及肽钙螯合物Zeta 电位Fig.7 Zeta potentials of casein phosphopeptides and peptide calcium chelates of different grades
2.4 分级酪蛋白磷酸肽持钙能力和体外生物利用度
2.4.1 分级酪蛋白磷酸肽持钙能力 由图8 可以看出,未添加CPP 时,在5 min 内迅速形成磷酸钙沉淀。而添加CPP 后,磷酸钙沉淀形成速度明显减慢。这在一定程度上说明了CPP 的确能够延迟和阻止磷酸钙沉淀的形成,具有较好的持钙能力。其中,CPP1、CPP2 分别在第30、35 min 时出现沉淀,可使磷酸钙沉淀的形成推迟10~15 min。CPP 样品在40 min 时出现沉淀,使磷酸钙沉淀的形成推迟20~25 min。而CPP3 样品在第50 min 时出现磷酸钙沉淀,可使沉淀的形成时间推迟40 min 以上,持钙能力明显优于其他级分。结合之前对不同级分酪蛋白磷酸肽的几项指标测试结果来看,与其他级分相比较,CPP3 磷酸丝氨酸残基的密度最大,同时N/P摩尔比最低,与钙离子结合机会增加,从而可有效阻止磷酸钙的形成。

图8 不同等级CPP 的持钙能力比较Fig.8 Comparison of calcium holding capacity of different grades of CPP
2.4.2 分级酪蛋白磷酸肽-钙螯合物体外生物利用度 钙被吸收的一个先决条件是它在肠道中的溶解度(即生物利用度)。在胃液消化过程中钙离子的溶解度变化趋势如图9,当各级分酪蛋白磷酸肽钙螯合物刚进入模拟胃液进行消化时,五种钙源的溶解度均能达到80%以上,这是由于各样品的初始pH 为2,酸性条件下,样品的钙离子被释放出来呈游离状态。各级分酪蛋白磷酸肽钙螯合物释放率相较于CaCl2来说变化较慢,说明酪蛋白磷酸肽钙螯合物具有一定的抗消化性,能降低对胃部的刺激。
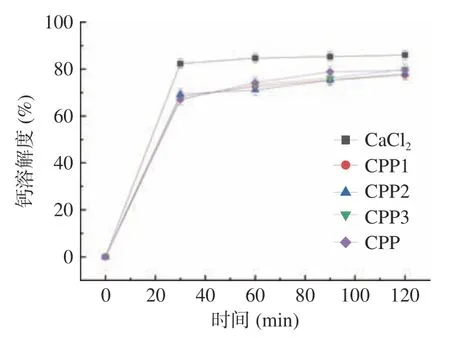
图9 分级酪蛋白磷酸肽钙螯合物在胃中的钙溶解度Fig.9 Calcium solubility of graded casein phosphopeptide calcium chelate in the stomach
如图10 所示,在肠液消化过程中,由于肠道环境呈弱碱性,钙离子易形成氢氧化钙沉淀,使钙的生物利用度降低。经体外模拟胃肠道消化后,五种钙源的钙溶解率均逐渐降低。在消化结束时,CPP3-Ca的钙溶解度最高,达到62.82%,CaCl2的溶解度最低,仅有21.05%。这说明CPP3-Ca 能使更多的Ca2+在弱碱性环境的肠道中溶解,被人体消化吸收。因此,钙乙醇分级得到的CPP3-Ca 能有效提高钙的生物利用度。
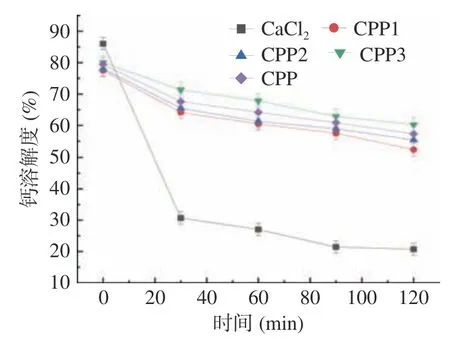
图10 分级酪蛋白磷酸肽钙螯合物在肠消化中的钙溶解度Fig.10 Calcium solubility of graded casein phosphopeptide calcium chelate in intestinal digestion
3 结论
以传统的钙乙醇沉淀法分离酪蛋白磷酸肽为基础,通过逐级增加酶解液中钙离子浓度,再用终浓度为55%(v/v)的乙醇沉淀出不同钙鳌合量的酪蛋白磷酸肽钙鳌合物。第三级分(CPP3-Ca)的钙鳌合量最高,达到69.59 mg/g,其纯度和体外持钙能力均比未分级的高。基于氨基酸组成和N/P 摩尔比测定分析,证明了CPP3-Ca 有更高密度的磷酸基团。通过紫外吸收光谱、红外吸收光谱以及Zeta 电位可以证明酪蛋白磷酸肽中参与钙鳌合的主要是羧基、氨基和磷酸基团,从而证明了CPP3 具有更高的钙鳌合能力以及酪蛋白磷酸肽钙鳌合物的形成。研究不同级分酪蛋白磷酸肽阻止磷酸钙沉淀形成的能力,分析结果显示CPP 能够延迟和阻止磷酸钙沉淀的形成,具有较好的持钙能力,其中,CPP3 具有更高的持钙能力。在模拟胃消化过程中,不同级分酪蛋白磷酸肽钙螯合物的释放率相对较慢,说明酪蛋白磷酸肽钙螯合物具有一定的抗消化性,能降低对胃部的刺激。在模拟肠道消化过程中,分级出的CPP3-Ca 有更高的钙溶解度,表明分级出的酪蛋白磷酸肽钙鳌合物的体外生物利用度更高。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
