黍稷麸皮多糖分离纯化、结构表征及抑菌活性分析
2024-05-12陈燕云杜远芳张丽珍
陈燕云,平 华,高 媛,杜远芳,刘 静,张丽珍,*
(1.山西大学生命科学学院,山西太原 030006;2.北京市农林科学院质量标准与检测技术研究所,北京 100097)
黍稷(Panicum miliaceumL.)又称糜子、黍子,禾本科黍属一年生草本植物,广泛种植于山西、陕西等中国北方地区,含有丰富的淀粉、蛋白质、脂肪及钾、镁、钙、磷等大量元素和铁、铜、锌、硒等微量元素,具有消炎、抗氧化和预防心脑血管疾病等功效[1]。黍稷磨米去除皮壳后称黄米,麸皮作为加工副产物,除用作动物饲料外,大部分被丢弃,开发利用程度低[2]。所以黍稷麸皮中活性物质的提取与生物活性研究极其重要。
多糖是由十个以上的单糖聚合在一起形成的碳水化合物。现已从小麦、藜麦等禾本科植物中提取纯化出多糖,并对其进行结构表征,发现每种植物多糖具有不同的分子量与单糖组成[3-4]。研究表明多糖具有多种生物活性,如抗氧化[4]、降血糖[5]、降血脂[6]、免疫调节[7]等作用,广泛应用于食品、医药等领域。如今具有抑菌活性的天然多糖也被发现,研究表明多糖类物质对革兰氏阳性菌、革兰氏阴性菌均具有不同程度的抑制效果[8],其对革兰氏阳性菌的抑制能力高于革兰氏阴性菌[9]。多糖生物活性高、安全性高、毒副作用小,且从麸皮中提取多糖价格低廉,具有极高的应用价值。
目前关于黍稷麸皮多糖的抑菌活性研究未见报道,金黄色葡萄球菌Staphylococcus aureus、大肠杆菌Escherichia coli作为常见食源性致病菌对人类生活产生影响,而枯草芽孢杆菌Bacillus subtilis在植物生长等方面发挥作用[10],本研究选择这三种菌具有对比参考价值。多糖生物活性与其结构紧密相关[11],包括单糖组成比例、官能团类型和糖苷键连接方式等。因此,对黍稷麸皮多糖进行分离,并研究其抑菌活性与结构间的构效关系具有重要意义。本实验旨在通过采用碱提法提取黍稷麸皮多糖,并对其分离纯化,分析多糖分子量、单糖组成及结构特征,进而研究其体外抗菌活性,为黍稷加工副产物中营养物质进一步利用提供参考。
1 材料与方法
1.1 材料与仪器
黍稷麸皮 购自山西河曲;无水乙醇、苯酚、硫酸、正丁醇、氯仿、氢氧化钠、氯化钠 分析纯,国药集团化学试剂有限公司;AB-8 大孔树脂、DEAE 纤维素DE-52、葡聚糖凝胶G-100 北京索莱宝科技有限公司;金黄色葡萄球菌Staphylococcus aureus、枯草芽孢杆菌Bacillus subtilis、大肠杆菌Escherichia coli本实验室-80 ℃密封保藏。
JHBE-50V 实验型闪式提取器 河南盛孚生物科技有限公司;Ifinite 200 Pro 多功能微孔板检测仪帝肯贸易有限公司;HH-4 数显恒温水浴锅 江苏省金坛市环宇科学仪器厂;HC-2062 高速离心机安徽中科中佳科学仪器有限公司;RV8 旋转蒸发仪 艾卡仪器设备有限公司;Alpha2-4 LD plus 真空冷冻干燥机 北京博劢行仪器有限公司;MS7-Pro 数控方盘磁力搅拌器 上海世泽生物技术有限公司;依利特液相色谱仪 大连依利特分析仪器公司;高效液相色谱1260 美国安捷伦科技有限公司;Regulus8230 扫描电镜 日立公司;Dimension Icon 原子力显微镜 德国Bruker 公司;STA449F3 TGDSC 同步热分析 德国Netzsch 公司;MiniFlex 600X-射线衍射仪 日本东京理学公司。
1.2 实验方法
1.2.1 黍稷麸皮多糖的提取 参考陈树俊等[12]的方法,稍作修改,黍稷麸皮经提取皂苷多酚等小分子物质后,采用碱提醇沉法对滤渣进行多糖提取,称取30.00 g 黍稷麸皮滤渣,料液比为1:20(m/V)加入0.16 mol/L 的NaOH 溶液,65 ℃下磁力搅拌浸提2 h,离心过滤得上清液,合并上清液,浓缩至150 mL,加入4 倍体积95%乙醇沉淀过夜,离心收集沉淀,冷冻干燥得粗多糖。
1.2.2 黍稷麸皮多糖的分离纯化 将粗多糖溶液用Sevag 试剂(氯仿:正丁醇=4:1)进行脱蛋白处理,用AB-8 大孔树脂脱色,透析48 h(Mw=3500 Da)。将多糖溶液进行DEAE-52 纤维素柱层析,用蒸馏水、0.1~0.3 mol/L NaCl 溶液依次洗脱,流速为1 mL/min,每5 min 收集一管,采用苯酚-硫酸法测定洗脱液中的总糖含量[12],收集洗脱组分,冻干后得到含量较高的多糖组分,经Sephadex G-100 凝胶柱层析,洗脱液经测定收集冻干后得到纯化多糖,并通过紫外光谱法测定其纯度,测量的波长范围为200~400 nm[12]。
1.2.3 黍稷麸皮多糖的结构表征
1.2.3.1 分子量分布的测定 参考倪茂君等[13]的方法:采用高效凝胶渗透色谱法,称取10 mg 的多糖样品溶于2 mL 水中,配制己知分子量的葡聚糖系列标准品溶液,以保留时间为横坐标,分子量的对数为纵坐标绘制标准曲线。色谱条件:示差折光检测器(shodex RI201-H);色谱柱(TSKgel GMPWxl),柱温35 ℃;流动相为超纯水;流速为1 mL/min;进样量20.0 μL。
1.2.3.2 单糖组成测定 参考Liang 等[14]的方法:多糖水解及衍生化:称取10 mg 的多糖样品,加入2 mol/L 三氟乙酸(TFA)6 mL 在110 ℃下水解3 h,减压蒸干后加1 mL 甲醇,再蒸干,重复3 次后得到水解产物,加入0.3 mol/L NaOH 200 μL,0.5 mol/L PMP-甲醇200 μL,在70 ℃下水浴进行衍生化1 h,冷却后加入0.3 mol/L 的HCl 溶液200 μL,用1 mL氯仿萃取,重复萃取3 次后取上清液经0.45 μm 滤膜过滤进行单糖组成测定。
色谱条件:采用UltimateXB-C18色谱柱;流动相:A 为0.05 mol/L 的KH2PO4(pH6.7);B 为乙腈;A:B=82:18;流速:1.0 mL/min;柱温:35 ℃;进样量:10 μL;波长:250 nm。
1.2.3.3 傅里叶红外光谱分析 参考刘露等[15]的方法:称取5 mg 黍稷麸皮多糖样品和KBr 混合研匀压片后,在4000~650 cm-1波长范围内通过红外光谱仪扫描,扫描16 次。
1.2.3.4 X-射线衍射分析 参考李占君等[16]的方法:通过XRD 衍射图谱分析多糖的晶体结构,操作条件:Cukα辐射,管内电压40 kV,管内电流40 mA,角度4°~60°,角度梯度0.02°,扫描运行速度5 ℃/min。
1.2.3.5 扫描电镜分析 参考杨许花等[17]的方法:将样品粘在导电胶上,置于真空离子溅射仪内镀导电层,时长90 s,厚度7±2 nm,将样品台放入冷场扫描电镜进行抽真空,开启加速电压,选二次电子模式,电子枪加速电压5 kV,选择不同放大倍数进行拍照测试。
1.2.3.6 原子力显微镜(AFM)分析 参考梁涛等[18]的方法:取部分多糖样品分散到乙醇溶液中进行超声,然后取几滴分散好的液体逐滴滴加在云母片上,晾干后,进行原子力显微镜观测。
1.2.3.7 TG-DSC 测定 参考马永强等[19]的方法:通过同步热分析TG-DSC 观察多糖的量热变化,测试条件:以氮气为载气,流速为20 mL/min 温度升高速率为10 ℃/min 温度变化范围为30~800 ℃。
1.2.4 黍稷麸皮多糖体外抑菌活性测定
1.2.4.1 体外抑菌效果测定 采用牛津杯法测定多糖抑菌效果:将菌悬液用生理盐水依次稀释10-1,10-2,10-3,10-4倍,用移液枪分别移取50 μL 上述稀释的菌悬液至凝固的培养皿上,用无菌的涂布棒均匀涂布,置于培养箱中培养24 h,发现当上述菌悬液稀释10-3倍时培养基中细菌分布的密集度最符合实验要求。按方法重新制备菌悬液后,稀释10-3倍,移取50 μL,均匀涂布到无菌的固体培养基上。静置10 min 后,每个培养皿等距离放置3 个灭菌的牛津杯,将配制好的样品溶液经0.22 μm 滤膜过滤除菌后各取200 μL 加入牛津杯中,用青霉素作为阳性对照,用无菌生理盐水作为阴性对照。细菌置于37 ℃恒温培养箱中培养24 h,观察抑菌圈情况,量取各个培养皿中抑菌圈直径,各组取平均值后进行比较[20]。
1.2.4.2 最小抑菌浓度(MIC)的测定 将多糖样品用无菌水溶解,浓度为15 mg/mL,然后用无菌LB 肉汤稀释,达到15 mg/mL 至0.9375 mg/mL 的连续梯度浓度。将稀释后的细菌悬液(100 μL)加入到96 孔微孔板中,然后加入不同的样品(100 μL)。每个孔中的最终细菌浓度为1×105集落形成单位(CFU/mL)。以无多糖试剂肉汤作为空白对照。以青霉素为阳性对照,96 孔板在37 ℃下孵育24 h。观察孔中浊度MIC 为抑制细菌生长的多糖的最低浓度[21]。
1.3 数据处理
本研究均进行3 次重复实验,数据以平均值±标准差表示,采用Origin8.0 和Excel 软件作图分析。
2 结果与分析
2.1 黍稷麸皮多糖的提取、分离和纯化
以葡萄糖质量浓度和其吸光度值绘制葡萄糖标准曲线,回归方程为y=7.314x+0.0012,R2=0.999。根据标准曲线,采用苯酚硫酸法测得黍稷麸皮多糖含量为45.7%±0.32%,如图1 所示,经DEAE-50 纤维素柱分级得到MBP-A(后续称MBP),由于MBP-B和MBP-C 峰较小即含量较少,则不做后续研究。由图2 可知,经Sephadex G-100 洗脱后呈现单一对称峰,经测定纯度达到98.40%±0.09%。从图3 可知,在260 和280 nm 处没有出现核酸和蛋白质的特征吸收峰,说明MBP 不含核酸和蛋白质,纯度较高。
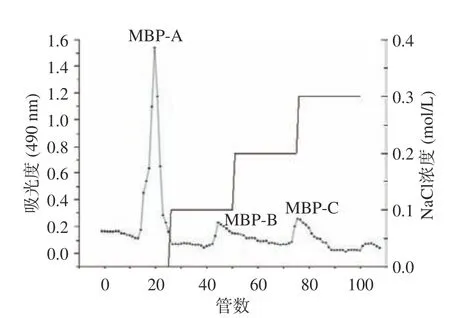
图1 黍稷麸皮多糖的DEAE-50 洗脱曲线Fig.1 DEAE-50 elution curves of proso millet bran polysaccharide
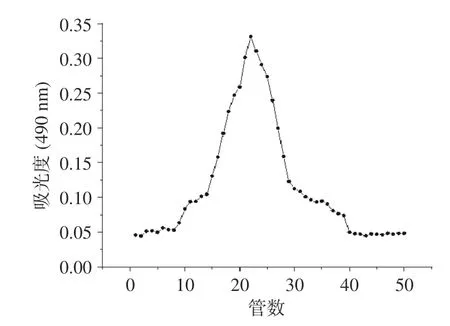
图2 黍稷麸皮多糖的Sephadex G-100 洗脱曲线Fig.2 Sephadex G-100 elution curve of proso millet bran polysaccharide
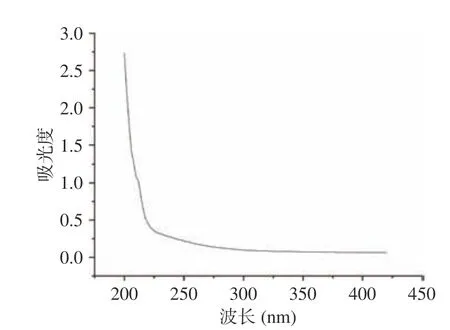
图3 黍稷麸皮多糖的紫外光谱图Fig.3 UV-VIS spectroscopy of proso millet bran polysaccharide
2.2 黍稷麸皮多糖结构表征
2.2.1 分子量分析 采用高效凝胶渗透色谱测定多糖分子量,图4 可以看出,MBP 在色谱图中呈现单一峰,保留时间8.76 min,根据标准曲线y=-1.1004x+14.181(R2=0.9984)计算,黍稷麸皮多糖MBP 分子量为3.479×104Da。
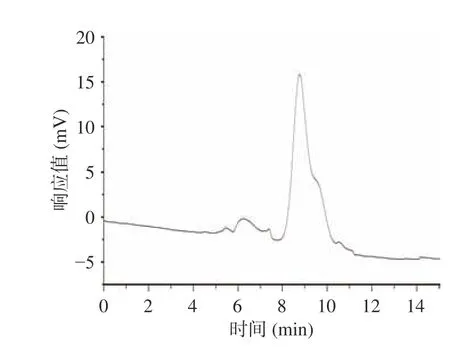
图4 黍稷麸皮多糖凝胶渗透色谱图Fig.4 Gel permeation chromatogram of proso millet bran polysaccharide
2.2.2 单糖组成分析 混合的单糖标准品色谱图见图5。采用PMP 衍生化HPLC 法检测黍稷麸皮多糖的单糖组成,通过与图5 对比,得出黍稷麸皮多糖由6 种多糖组成(见图6),摩尔比为甘露糖:鼠李糖:葡萄糖:半乳糖:阿拉伯糖:木糖=0.11:0.13:5.86:0.62:1.00:0.52。MBP 是一种中性杂多糖,主要单糖为葡萄糖和阿拉伯糖。与其他一些麦麸等多糖相比,虽然大多数单糖组成相似,但含量最高的单糖却有所不同,如在Shang 等[22]的研究中麦麸多糖主要由木糖与阿拉伯糖组成。
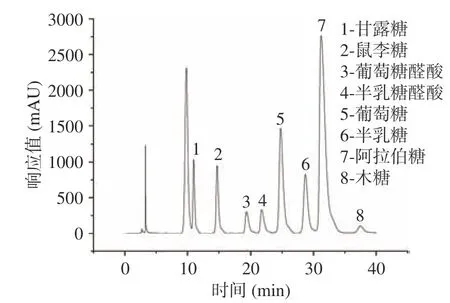
图5 混合单糖标准品高效液相图谱Fig.5 HPLC chromatograms of mixed monosaccharide standard
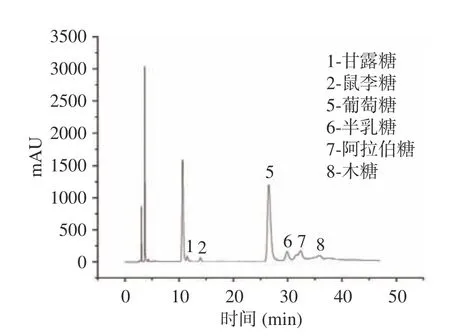
图6 黍稷麸皮多糖的单糖色谱图Fig.6 Composition of proso millet bran polysaccharide
2.2.3 红外光谱结果分析 采取傅里叶红外光谱对黍稷麸皮多糖官能团进行分析,由图7 可知,黍稷麸皮多糖红外光谱中分子内或分子间氢键的OH 伸缩振动在3336.3 cm-1处有一个强吸收峰[23],在2927.2 cm-1左右的弱吸收带归因于不对称的CH 伸缩振动,在1622.7 cm-1左右的吸收峰是糖环上的C-O 不对称拉伸峰,这可以说明样品在4000~650 cm-1波长区域范围内是具有多糖类物质的一般性共性特征。1022.7 cm-1是吡喃环的特征吸收峰;854.5 cm-1是β型糖苷键吸收峰[24];在1741.18 cm-1处未观察到吸收峰,表明没有大量糖醛酸[25]。由上可知,此多糖是一种含β型糖苷键结构的吡喃糖。
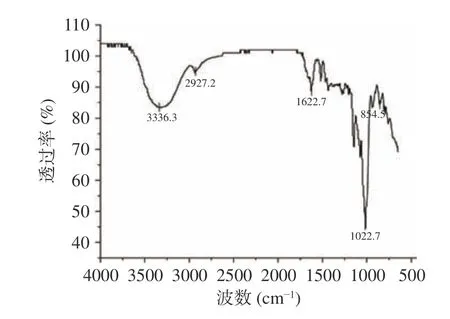
图7 黍稷麸皮多糖傅里叶红外光谱图Fig.7 FT-IR spectroscopy of proso millet bran polysaccharide
2.2.4 X-射线衍射结果分析 采用X-射线衍射法分析黍稷麸皮多糖MBP 的晶体结构,一般来说,晶体材料呈尖锐的窄衍射峰,而非晶组分呈宽峰。如图8 所示,MBP 在20°处有一个宽的衍射峰,在32°有少量峰值较小的峰出现,并无较明显性吸收峰产生,呈现出一种无定形状态。Ren 等[26]采用XRD 分析藜麦多糖(QP)及其分离纯化得到的多糖组分的构象,发现QP 未经进一步分离纯化不能形成单晶,以无定形形式存在,而MBP 经分离纯化后仍呈现无定形状态,这可能与提取方式以及分子量大小单糖组成等不同有关,水解程度增加、分子量和聚合度的降低等均会破坏多糖的内部晶体结构。
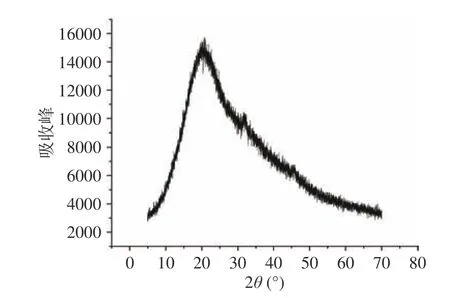
图8 黍稷麸皮多糖X 射线衍射结果Fig.8 X-ray diffraction (XRD) patterns of proso millet bran polysaccharide
2.2.5 表观形貌分析 采用扫描电镜观察黍稷麸皮多糖MBP 的表观形貌,如图9 所示,SEM 图中多糖呈现不规则片状,结构疏松,分子间存在空隙,图中观察到一些光滑的球形颗粒和棒状结构,为多糖聚合物之间的相互连接提供机会。Shang 等[22]从小麦麸皮中提取的多糖呈光滑片状形态,表面边缘有褶皱。多糖的形态结构受到原料来源或提取工艺的影响,如超声波产生的强剪切力会使多糖形态粗糙多孔。

图9 黍稷麸皮多糖SEM 图Fig.9 SEM images of proso millet bran polysaccharide
2.2.6 分子形貌分析 采用原子力显微镜观察黍稷麸皮多糖MBP 的分子形貌,如图10 所示,AFM 图上出现了相对均匀的颗粒状结构,多糖分子高度最高为12.46 nm。有研究表明,多糖中的单链高度一般在0.1~1.0 nm 范围内,所以推断图中的线性链结构是由多条链通过范德华力或氢键连接缔合形成的凝聚结构[27]。
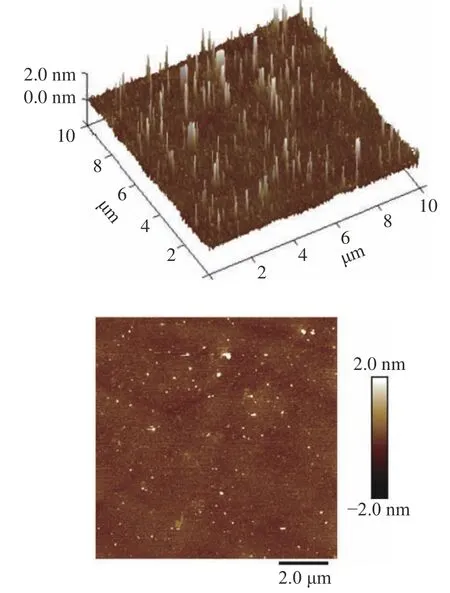
图10 黍稷麸皮多糖AFM 图Fig.10 AFM images of proso millet bran polysaccharide
2.2.7 热性能分析 采用TG-DSC 分析黍稷麸皮多糖MBP 的热力学性质,如图11 所示,黍稷麸皮多糖热重变化主要分为3 个阶段:第1 阶段,室温至193.94 ℃,质量损失率为9.17%,质量损失主要是失去了多糖分子中的自由水和结合水;第2 阶段,193.94 ℃至389.47 ℃,质量损失率为62.89%,此阶段多糖质量损失率加快,热降解速率和重量损失达到最大值,主要可能是高温使多糖分子碳链和氢键被破坏,多糖分子被分解;第3 阶段,389.47 ℃至800 ℃,样品损失率较慢,质量损失率为7.38%。这可能是由炭的热分解引起的[28]。王鑫等[29]的研究表明小麦麸皮多糖在30~132 ℃温度范围内具有较好的稳定性,与之相比,黍稷麸皮多糖在室温至193.94 ℃范围内保持稳定,说明黍稷麸皮多糖的热稳定性更好。差示扫描量热分析(图12)显示黍稷麸皮多糖分别在63.25、257.66、291.29、354.17 ℃有吸热反应。这可能是由于脱水或外围多糖链和脱羟基化反应,在保护性气体(氮气)的保护下并无放热峰的产生,说明黍稷麸皮多糖MBP 是一种无定形性多糖,这与X 射线条件下的试验结果一致。结果表明,多糖MBP 的热稳定性良好,可作为添加物用于需高温处理食品中[30]。
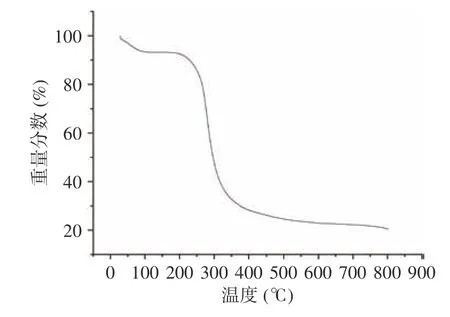
图11 黍稷麸皮多糖的热重分析结果Fig.11 Rmogravimetry analysis curves of proso millet bran polysaccharide
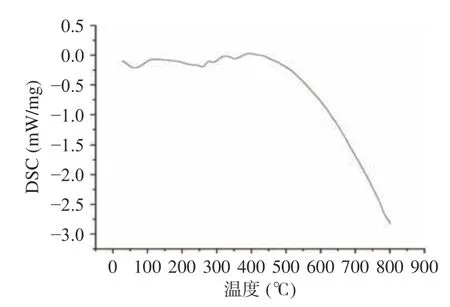
图12 黍稷麸皮多糖的差示扫描量热分析Fig.12 Scanning calorimetry curve of proso millet bran polysaccharide
2.3 黍稷麸皮多糖抑菌活性分析
由表1 可知,黍稷麸皮多糖提取物对3 种指示菌中的金黄色葡萄球菌表现出较强的抑制作用,MIC 值为2 mg/mL,对大肠杆菌和枯草芽孢杆菌抑制作用不明显。黍稷麸皮多糖提取物对金黄色葡萄球菌、大肠杆菌和枯草芽孢杆菌抑菌圈直径分别为16.10±0.32,9.30±0.00,10.70±0.32 mm,其中大肠杆菌抑菌圈直径高于对照青霉素组。多糖对革兰氏阳性菌的抑菌能力高于革兰氏阴性菌,可能是因为阳性菌的细胞膜比阴性菌敏感,这与前人关于茯苓多糖抑菌实验结果一致[31]。周欣[20]研究结果表明香菇多糖对大肠杆菌抑菌作用最强,MIC 为1.25 mg/mL,这可能是由于香菇多糖和黍稷麸皮多糖在结构方面存在差异;香菇多糖对金黄色葡萄球菌、枯草芽孢杆菌MIC 均为2.5 mg/mL,黍稷麸皮多糖对金黄色葡萄球菌的抑制作用略高于香菇多糖。魏磊等[32]研究得出赤松茸多糖对金黄色葡萄球菌的MIC 为25 mg/mL。与之相比,本研究的黍稷麸皮多糖抑菌活性明显高于赤松茸多糖,且成本更低。因此,利用黍稷麸皮生产饲用多糖作为一种新型、天然的抑菌剂具有良好的开发前景。
3 结论
黍稷麸皮多糖提取物经分离纯化后,MBP纯度达到98.40%±0.09%,分子量为3.479×104Da,主要由甘露糖、鼠李糖、葡萄糖、半乳糖、阿拉伯糖和木糖等6 种单糖组成。进一步进行结构鉴定,红外光谱结果表明MBP 为β型吡喃多糖,扫描电镜及原子力显微镜观察多糖MBP 的形态学特征多为片层状结构且连接紧密,X-射线衍射结果表明多糖MBP 在晶体结构方面呈现出无定形状态,TGDSC 结果表明多糖MBP 具有良好的热稳定性。通过抑菌实验,结果表明多糖MBP 对金黄色葡萄球菌具有较强的抑菌活性。本研究为黍稷麸皮的开发提供了参考,为其功能性食品或医药工业中的应用提供了理论依据。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
