亚临界水萃取薄荷黄酮工艺优化及神经保护活性研究
2024-05-12张晴晴张梦娇马翊铭蔡学一
张晴晴,张梦娇,马翊铭,蔡学一
(1.亳州学院中药学院,安徽亳州 236800;2.江南大学化学与材料工程学院,江苏无锡 214000;3.安徽雷允上药业有限公司,安徽亳州 236800)
神经退行性疾病,包括阿尔茨海默病(Alzheimer disease,AD)、帕金森氏病(Parkinson′s disease,D)等,是一种中枢神经系统细胞组织发生的非正常蜕变现象[1-3]。随着社会老龄化,AD 和PD 发病率和病死率逐年上升,严重地影响着老年人的生活质量,故预防和治疗具有十分重要的意义[4-6]。近年来,研究报道黄酮类成分能够保护神经元,能够对抗神经细胞凋亡保护脑损伤,在一定程度上在退行性疾病中具有神经保护作用[7-9]。甘草黄酮中甘草素能够保护大鼠肾上腺嗜铬细胞(PC12 细胞)的凋亡,具有神经保护作用[10]。葛根素对β淀粉样蛋白(Aβ)[11]、MPP+[12]、H2O2[13]诱导PC12 细胞的损伤均有抗凋亡的保护作用,说明能够缓解对PC12 细胞的损伤。同时,黄酮类物质因具有多种促进人类健康的生物活性、且无毒副作用,因此被认为是功能性食品和药品的重要原料,受到广泛关注[14]。
薄荷(Mentha haplocalyxBriq.)是一种常用的药食同源类植物,是唇形科植物薄荷的干燥地上部分[15]。现代研究表明,薄荷具有抗病毒、抗癌、抗菌、抗氧化和抗辐射等药理作用,另外,薄荷还可以改善新型冠状病毒肺炎患者的症状[16-17]。薄荷中具有多种化学成分,起主要作用的有黄酮类、醌类、挥发油、有机酸等,其中黄酮类物质为薄荷中重要的活性成分[18-19]。从薄荷中已分离出40 多种黄酮类化合物,例如橙皮苷、蒙花苷、芦丁、二氢黄酮苷、香蜂草苷等[20-21]。目前,薄荷黄酮生物活性研究主要集中于抗氧化活性[16]、抗炎活性[17]、抗菌活性[18]等,而对其体外神经保护活性的研究鲜有报道[22-23]。
薄荷黄酮类物质常用的提取方法主要有机溶剂浸提法、超声波提取法和超临界CO2萃取法[24-26],且提取溶剂(或夹带剂)均为有机溶剂,以上方法存在溶剂易残留、提取时间长、工艺复杂、产率低、对环境不够友好等问题,因此不能满足现代化医药的生产需求。近年来,亚临界水提取技术(subcritical water extraction,SWE)因绿色环保、时间短、产率高等优势成为研究的热点,被广泛用于天然产物活性成分的提取[27-29]。亚临界水是指在一定压力下,将水加热到100~374 ℃下仍保持液态,通过控制温度和压力改变水的极性、黏度和表面张力,因此具有与有机溶剂类似的性质,有利于中、弱极性物质的提取[30-32]。Lachos-Perez 等[33]采用亚临界水萃取法(SWE)从脱脂橙子中萃取黄烷酮,研究了通过改变介电常数来提取非极性黄酮类化合物的绿色工艺,并与三种常规提取方法进行了比较,结果表明,与常规提取相比,SWE 是一种高效的方法,用于回收具有高抗氧化活性的生物活性化合物。Zhang 等[34]首次采用亚临界水作为萃取葛根异黄酮的有效溶剂。通过单因素实验确定了4 种主要异黄酮的最佳提取工艺条件,并进一步通过响应面法确定了总异黄酮提取的最佳工艺条件。与常规溶剂相比,亚临界水使用更少的溶剂并且需要更短的萃取时间。因此,SWE 因高效清洁、绿色环保等优点被广泛应用于挥发油类、黄酮类等成分的提取。但有关亚临界水萃取薄荷黄酮的研究尚未见报道。
本文采用亚临界水提取薄荷中的黄酮类物质,利用响应面法优化提取工艺,体外建立H2O2诱导PC12 细胞自由基损伤模型,通过噻唑蓝(methyl thiazolye tetrazolium,MTT)法考察薄荷黄酮对PC12细胞存活力的影响,旨在实现薄荷黄酮绿色高效萃取的同时,为薄荷资源的深度开发利用及工业化生产提供数据支持。
1 材料与方法
1.1 材料与仪器
薄荷全草 购于安徽省亳州市康美中药材市场;PC-12(高分化)细胞株(大鼠肾上腺嗜铬细胞瘤) 购于中国科学院上海生化细胞所;二甲基亚砜(DMSO)购于上海泰坦科技股份有限公司;噻唑蓝试剂(methyl thiazolye tetrazolium,MTT)、PBS 缓冲液、1640 基础培养基(无血清)、胰酶细胞消化液、PC12(高分化)细胞专属培养基(RPMI 1640 培养基+10% FBS+1% P/S)均购于合肥博美生物科技有限责任公司;芦丁对照品 购于中国药品生物制品检定所;其他试剂 均为分析纯,购于国药集团化学试剂有限公司。
KCFD05-03 型亚临界反应釜 烟台科立自控设备研究所;UV4150 紫外可见分光光谱仪 日本岛津;IKA/RV10 数显型旋转蒸发仪 艾卡仪器设备有限公司(德国);Axiovert 5 倒置生物显微镜 蔡司公司(德国);Thermo Multiskan FC 全自动酶标仪、Thermo Scientific Forma CO2恒温恒湿培养箱 赛默飞世尔科技公司(美国)。
1.2 实验方法
1.2.1 亚临界水萃取薄荷黄酮 将干燥的薄荷全草粉碎成粉末,过60 目筛,石油醚脱脂,准确称取5.0000 g 粉末,置于亚临界反应釜,控制温度、压力、时间、液料比等进行提取,冷却后离心,收集上清液,减压浓缩至无水,加乙醇定容至100 mL,测定薄荷黄酮质量,计算薄荷黄酮得率[34]。
将上述提取液离心后将上清液置于分液漏斗内,取适量石油醚倒入分液漏斗并摇匀,静置,取上清液,将上清液与二氯甲烷以及70%乙醇溶液于分液漏斗中摇匀,静置,取下清液。将得到的下清液进行减压蒸馏,直至无醇味,即可得到薄荷黄酮浓缩液。将薄荷黄酮浓缩液置于AB-8 型大孔吸附树脂,加入解析液(30%乙醇溶液),吸附流速1.5 BV·h-1,洗脱30 h,以致洗脱平衡,得到薄荷黄酮纯化液,减压蒸馏,60 ℃下于真空干燥箱中进行干燥,得到薄荷黄酮干燥样品,用于配制药物溶液。
1.2.2 薄荷黄酮含量的测定 参考高丹丹等[25]的芦丁标准曲线的绘制方法,经改良后用于测定本实验的薄荷黄酮。量取2 mL 1.2.1 制备的薄荷黄酮提取液,加入1.0 mL 的5% NaNO2溶液,充分振荡,摇匀静置,再加入1.0 mL 的10% Al(NO3)3溶液,振荡摇匀,然后加入6 mL 的4% NaOH 溶液,充分振荡后,放置15 min 后于510 nm 处测定吸光度,以芦丁为标准对照品,绘制芦丁标准曲线,带入回归方程:Y=12.329X+0.002(R2=0.9997)。按公式(1)计算薄荷黄酮的得率。
式中:W 表示薄荷黄酮得率,%;C 表示黄酮提取液浓度,mg·mL-1;V 表示黄酮提取液体积,mL;m 表示薄荷原料质量,g。
1.2.3 亚临界水提取薄荷黄酮的工艺优化
1.2.3.1 单因素实验 称取5.0000 g 粉末,在液料比20:1 mL/g、提取时间40 min、提取压力2.5 MPa条件下,考察不同提取温度(110、120、130、140、150、160 ℃)对薄荷黄酮得率的影响。
称取5.0000 g 粉末,在液料比20:1、提取温度140 ℃、提取压力2.5 MPa 条件下,考察不同提取时间(10、20、30、40、50、60 min)对薄荷黄酮得率的影响。
称取5.0000 g 粉末,在提取温度140 ℃、提取时间40 min、提取压力2.5 MPa 条件下,考察不同液料比(10:1、15:1、20:1、25:1、30:1、35:1)对薄荷黄酮得率的影响。
称取5.0000 g 粉末,在提取温度140 ℃、提取时间40 min、液料比20:1 mL/g 条件下,考察不同压力(1、1.5、2.0、2.5、3.0、3.5 MPa)对薄荷黄酮得率的影响。
1.2.3.2 Box-Behnken 响应面优化试验 根据单因素实验,选取3 个对薄荷黄酮得率影响较大的因素:提取温度(A)、提取时间(B)和液料比(C),各取三个水平,利用Box-Behnken 进行响应面优化试验设计,详见表1。
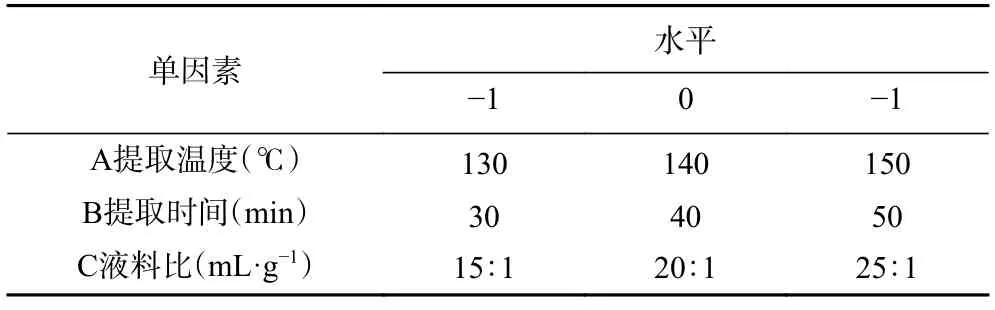
表1 响应面分析因素与水平Table 1 Factors and levels of response surface analysis
1.2.4 不同提取方法提取薄荷黄酮
1.2.4.1 回流提取薄荷黄酮 精密称取薄荷粉5.0000 g,加入75 mL 60%乙醇,于80 ℃下提取2 h,离心,上清液加乙醇定容至100 mL,参照1.2.2 测定薄荷黄酮质量,计算薄荷黄酮得率[24]。
1.2.4.2 超声波辅助提取薄荷黄酮 精密称取5.0000 g 薄荷粉置于试剂瓶中,分别加入100 mL 的50%乙醇溶液,60 ℃恒温水浴1 h,超声处理30 min,离心,上清液加乙醇定容至100 mL,参照1.2.2 测定薄荷黄酮质量,计算薄荷黄酮得率[25]。
1.2.4.3 超临界CO2萃取薄荷黄酮 精密称取5.0000 g 薄荷粉装入萃取釜中,启动冷循环,设定萃取温度55 ℃,达到设定温度后,打开钢瓶阀门,开启CO2泵,CO2经过滤后由压缩机压缩入萃取罐,达到萃取压力25 MPa,加入50 mL 70%乙醇为夹带剂进行超临界萃取,90 min 后收集萃取物,离心,用乙醇溶解定容100 mL,参照1.2.2 测定薄荷黄酮质量,计算薄荷黄酮得率[26]。
1.2.5 薄荷黄酮对PC12 细胞氧化损伤的保护作用
1.2.5.1 PC12 细胞的培养与传代 将复苏后的PC12细胞放入加有专属培养基的培养瓶中,放于37 ℃、5% CO2培养箱中培养48 h 后取出,PBS 缓冲液润洗细胞,胰酶细胞消解液消化90 s,于显微镜下观察细胞形态趋于圆形,取少量PC12 专属培养基于培养瓶中终止消化,离心,置于显微镜下观察,当细胞悬液至1×105细胞/mL 即可,将细胞悬液接种至96 孔板,置于CO2细胞恒温培养箱孵育48 h,即可用于实验。
1.2.5.2 药物溶液的配制 精密称取1.2.1 制备的薄荷黄酮干燥样品(标记为MF),加入一定体积的DMSO 使之溶解,配成0.1 g·L-1的药物储备液,随后进行等比例稀释即可。
1.2.5.3 MTT 法测定细胞活力 在正常对照组、空白对照组以及给药组每孔分别加入浓度为10 μL 10 mg·mL-1的MTT 溶液,放入CO2培养箱中培养4~6 h 产生结晶,吸走上清液,每孔加入150 μL 的DMSO 溶液,振荡10 min,使结晶充分溶解,酶标仪测OD 值(490 nm 处),根据公式(2)计算细胞存活率[35]。
1.2.5.4 薄荷黄酮对PC12 细胞增殖的影响 待PC12 细胞长至96 孔板室底面积的80%后,弃原培养液,PBS 缓冲液洗两次,正常对照组加入无血清的1640 培养基,空白对照组加入20 μL 的PBS 缓冲液,给药组加入不同浓度的药液20 μL,于CO2培养箱中培养24 h,采用上述MTT 法测定各组细胞活力[36]。
1.2.5.5 过氧化氢(H2O2)诱导PC12 细胞自由基损伤模型的建立及细胞活力的测定 待PC12 细胞长至96 孔板室底面积的80%后,弃原培养液,PBS 缓冲液洗两次,加入浓度为0.2 mmol/L 含过氧化氢的1640 基础培养基100 μL/孔,作用1 h,造成细胞自由基损伤[13]。弃原培养液,用PBS 缓冲液清洗,弃PBS 缓冲液,于给药组、空白对照组、造模组以及正常对照组中每孔各加入1640 基础培养基200 μL,置于CO2培养箱中培养24 h 后取出,采用上述MTT法测定各组细胞存活率。每组8 孔,实验重复2 次。
1.3 数据处理
2 结果与分析
2.1 单因素实验结果
单因素实验结果详见图1。由图1A 可知,随着提取温度的升高,薄荷黄酮的得率逐渐增加,当温度超过140 ℃后,得率快速下降。温度升高,溶剂水的黏度和极性减小,此时水的性质接近于有机溶剂,使得室温下不易溶于水的薄荷黄酮溶解度增大,同时温度升高增加了黄酮分子扩散的运动速度。但温度超过140 ℃后,高温使黄酮类物质发生分解,一些非目标产物(蛋白质、多糖等)溶解度增加,此时水的承载能力和密度也会减小,使得率下降,这与Wan 等[36]相关的研究结果一致。因此,在后续的响应面试验中提取温度选择140 ℃为宜。
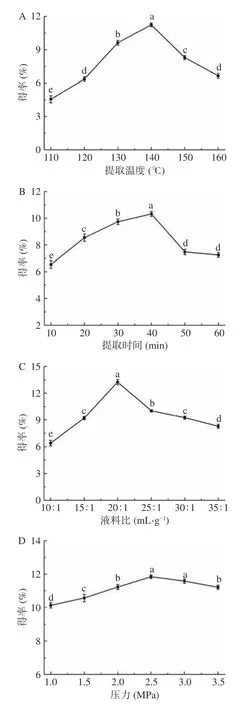
图1 不同因素对薄荷黄酮得率的影响Fig.1 Effects of different factors on the yield of mint flavonoids
提取时间对薄荷黄酮得率的影响如图1B 所示,反应40 min 时,得率最大,达到10.32%±0.1850%。合理的提取时间使固液相充分接触,此时溶剂水在高温高压下具有较强的溶解能力,能够充分渗入到细胞中,有利于传质过程。反应达到平衡后,过分延长提取时间,不会明显增加溶质黄酮的量,反而可能导致非目标产物溶出量的增加。这与Nkurunzizaad 等[37]相关的研究结果一致。因此,在后续的响应面试验中提取时间选择40 min 为宜。
液料比对薄荷黄酮得率的影响如图1C 所示,随着液料比的增加,薄荷黄酮得率呈现先升高后降低的趋势。当液料比为20:1 mL/g 时,得率最大,达到13.25%±0.2914%。液料比的增大有利于降低亚临界水的黏度,同时有利于增大浓度梯度,但液料比过大会降低提取液中薄荷黄酮含量。这与冀恬等[38]的研究结果一致。因此,在后续的响应面试验中液料比选择20:1 mL/g 为宜。
压力对薄荷黄酮得率的影响如图1D 所示,随着压力的增加,薄荷黄酮得率的变化幅度不大,由此可知压力对薄荷黄酮得率的影响较小。这可能是由于在提取过程中,压力仅起到使水保持液态的作用,而对水的极性以及黏度等影响较小[32]。而压力过高将导致物料颗粒堆积,不利于与溶剂的充分接触,从而使薄荷黄酮得率略有下降,这与董兴叶等[39]相关的研究结果一致。
2.2 Box-Behnken 响应面优化试验结果
2.2.1 响应面回归模型分析 利用Box-Behnken 进行的试验设计与结果详见表2。以得率为响应值,运用Design expert 10.0.7 数据分析软件进行多元回归拟合,得到二次多项回归方程:Y得率=14.28+0.43A-0.32B+0.42C-0.47AB-0.03AC+0.08BC-1.28A2-1.04B2-1.14C2。

表2 Box-Behnken 试验设计与结果Table 2 Design and results of Box-Behnken experiment
回归模型的方差分析以及回归系数显著性试验分析结果见表3。由表3 可知,该回归模型F=36.62,P<0.0001,说明该模型极具显著性,具有统计学意义。其失拟项P=0.4974(P>0.05)(不显著),表示该模型不具有显著的误差,对实验工艺能进行较好的模拟,实验误差小较可靠。同时模型回归系数R2=0.9792,调节后的R2=0.9525,说明95.25%的响应值变化来源于模型自变量。可利用该回归方程确定最佳提取工艺。一次项A 提取温度、B 提取时间对得率具有极显著影响(P<0.01),C 液料比对得率具有显著影响(P<0.05),各因素的主效应关系为:A(F=20.76)>C(F=19.93)>B(F=11.7),即提取温度>液料比>提取时间。其二次项交互作用AB 对得率具有极显著的影响(P<0.01)。
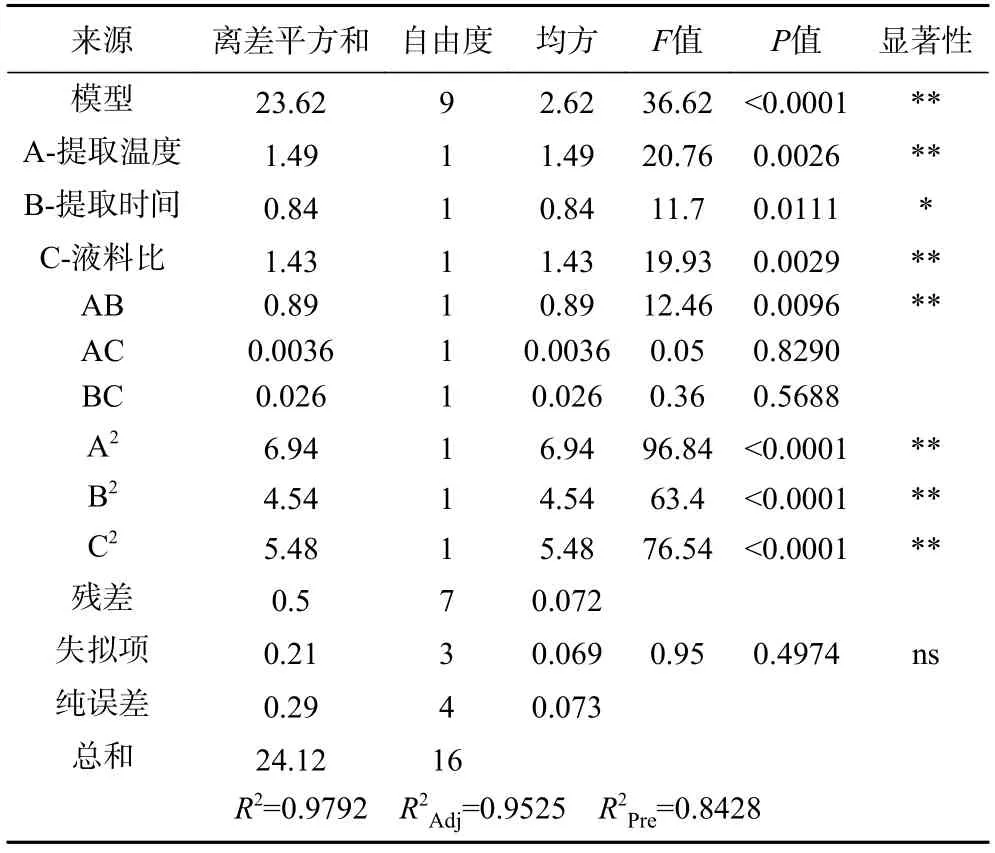
表3 Box-Behnken 试验回归模型方差分析Table 3 AVOVA of Box-Behnken experiment
2.2.2 响应面交互作用分析 A 提取温度、B 提取时间和C 液料之间的相互作用详见图2。图2(a)为A 提取温度和B 提取时间的交互作用对得率的影响图,观察提取温度和提取时间的响应曲面可知,响应面坡度陡峭,等高线密集且趋于椭圆。随着提取时间的增加,得率呈先增加后降低的趋势,当提取时间较少时,随着提取温度的增加,得率的坡度呈先增加后缓慢降低的趋势,降低的幅度较小。当提取时间较高时,得率的变化坡度随提取温度的增加呈先增加后降低的趋势,降低的幅度较大。由此说明,提取温度和提取时间之间存在显著的交互效应。仅考虑二者交互作用的条件下,当提取温度为135~145 ℃水平左右、提取时间在35~45 min 水平范围内时,得率达到最大值,且得率随提取温度的变化坡度大于提取时间,说明提取温度对得率的影响大于提取时间,曲面图与表3 中的结果也是相一致的。
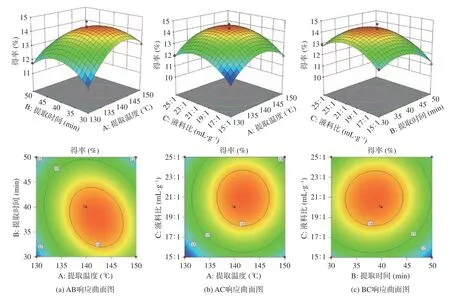
图2 各因素间交互作用对响应值的影响Fig.2 Effects of interaction between various factors on response values
A 提取温度和C 液料比的交互作用对得率的影响如图2(b)所示,观察提取温度和液料比的响应曲面可知,响应面坡度相对平缓,等高线稀疏且趋于圆形,说明提取温度与液料比之间的交互作用对响应值的影响不显著。此外,得率的变化坡度随提取温度、液料比的增加呈先增加后降低的趋势。仅考虑二者交互作用的条件下,当提取温度为135~145 ℃、液料比为17~23 mL/g 水平范围内,得率达到最大值,且得率随液料比的变化坡度大于提取温度,说明液料比对得率的影响大于提取温度,曲面图与表3 中的结果是一致的。
B 提取时间和C 液料比的交互作用对得率的影响如图2(c)所示,观察提取时间和液料比的响应曲面可知,响应面坡度相对平缓,等高线稀疏且趋于圆形,说明提取时间与液料比之间的交互作用对响应值的影响不显著。此外,得率的变化坡度随液料比、提取时间的增加呈先增加后缓慢降低的趋势。仅考虑二者交互作用的条件下,在提取时间为35~45 min、液料比为17~23 mL/g 水平范围内,其得率取得最大值,且得率随液料比的变化坡度大于提取时间,说明液料比对得率的影响大于提取时间。曲面图与表3 中的结果也是一致的。
2.2.3 验证试验结果 根据回归方程模型,得到最佳提取工艺条件:提取温度142.019 ℃、提取时间38.047 min、液料比20.877:1 mL/g,此模型实验条件下预测薄荷黄酮的得率为14.39%。为验证此模型的结果,考虑到实验的实际条件,将最佳工艺条件修正为提取温度142 ℃、提取时间38 min、液料比21:1 mL/g,在此条件下经3 次平行试验,得到薄荷黄酮得率为14.07%±0.23%,与模型的相对误差在5%范围内,说明实验值与模型值之间具有良好的相关性,此模型可靠。
2.3 不同提取方法对比试验结果
由于薄荷产地不同、采收期不同、提取部位不同等会对薄荷黄酮类化合物的含量产生影响,因此文献中已报道的薄荷黄酮提取率差异较大,不利于提取方法的比较[40]。本文参照已报道的提取方法进行实验验证[24-26],以水和不同浓度的乙醇为溶剂进行提取,平行实验3 次,验证结果如表4 所示。由表4 可知,亚临界水萃取法的薄荷黄酮得率比回流提取法提高了334%,比超声波辅助提取法提高了75%,比超临界CO2萃取法提高了173%,显著高于以上的3 种提取方法的得率(P<0.001),说明该法具有高选择、高得率的特点。亚临界水萃取法所需提取时间仅有38 min,其他方法提取时间均在90 min 以上,提取时间的缩短可以减少能耗。同时,乙醇回流法和超声辅助提取法均以乙醇为溶剂,超临界CO2萃取法虽然以CO2为萃取剂,但在萃取过程中仍需添加乙醇作为夹带剂进行萃取,因此以上三种提取方法均存在有机溶剂残留、对人体以及环境不够友好的问题。而亚临界水萃取法是以纯水为溶剂,在萃取过程中无需添加任何有机溶剂,因此不存在有机溶剂残留,且绿色环保。水不仅资源丰富且价格低廉,大大降低了提取过程的成本。这些特点为薄荷黄酮实现工业化生产提供了极大地可行性。
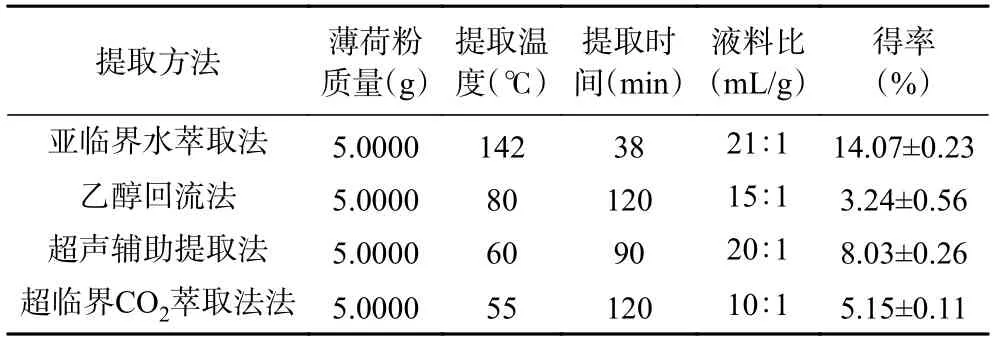
表4 不同提取方法的比较Table 4 Comparison of different extraction methods
2.4 薄荷黄酮的体外神经保护活性
2.4.1 薄荷黄酮对PC12 细胞增殖的影响 如图3所示,不同浓度的薄荷黄酮作用PC12 细胞24 h 后,与正常对照组比较,给药组在1~100 μg/mL 范围内的细胞存活率均在90%以上,说明薄荷黄酮在此浓度范围内对细胞存活率没有显著影响[41]。
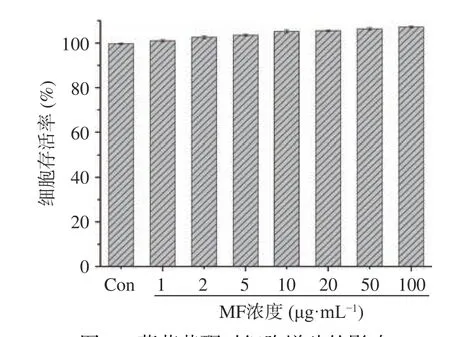
图3 薄荷黄酮对细胞增殖的影响Fig.3 Effects of flavonoids from Mentha haplocalyx Briq.on cell proliferation
2.4.2 薄荷黄酮对H2O2诱导细胞自由基损伤的影响 由图4 可知,与正常组相比,H2O2组的细胞存活率降至50.09%±1.03%,当PC12 细胞经薄荷黄酮(MF)溶液处理后,在1~5 μg/mL 浓度范围内,细胞存活率有一定的提高,从53.61%±0.64%提高到58.57%±0.86%,说明薄荷黄酮溶液对PC12 细胞具有一定的保护作用,并且随着薄荷黄酮溶液浓度的增大,细胞存活率逐渐提高,细胞氧化损伤程度明显降低,当溶液浓度为100 μg/mL 时,细胞存活率提高至78.49%±0.84%。说明在1~100 μg/mL 浓度范围内,薄荷黄酮能明显缓解细胞氧化损伤,对PC12 细胞具有极显著的保护作用(P<0.01)。
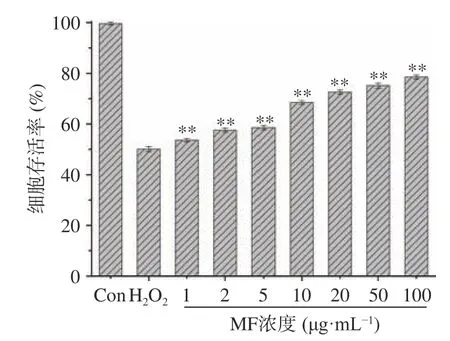
图4 薄荷黄酮(MF)对H2O2 损伤PC12 细胞活力的影响Fig.4 Effects on the viability of MF for PC12 cells injured by H2O2
3 结论
本文建立了一套绿色、高效、可靠的提取薄荷黄酮的提取工艺,以薄荷黄酮得率为考察指标,通过单因素实验、响应面试验对提取工艺进行优化,建立亚临界水萃取薄荷黄酮最佳提取工艺,具体工艺参数为:提取温度142 ℃、提取时间38 min、液料比21:1 mL/g,在此条件下得到薄荷黄酮得率为14.07%±0.23%。与已报道的提取方法比较,亚临界水萃取薄荷黄酮得率比回流提取法提高了334%,比超声波辅助提取法提高了75%,比超临界CO2萃取法提高了173%,显著高于以上3 种提取方法的得率(P<0.001)。亚临界水萃取法具有得率高、选择性好、时间短、无污染、成本低廉等优势。这些优势为薄荷黄酮实现工业化生产提供了极大地可行性。体外建立H2O2诱导PC12 细胞损伤模型,在1~100 μg/mL 浓度范围内,薄荷黄酮能明显缓解细胞氧化损伤,对PC12 细胞具有极显著的保护作用(P<0.01)。该结果暗示薄荷黄酮可能是预防与治疗神经退行性疾病的一个有前景的候选天然产物。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).
