芍药雌配子发育和2n雌配子诱导1)
2024-05-11孙榕泽朱绍才崔雅琦赵家庚王宇暄于晓南
孙榕泽 朱绍才 崔雅琦 赵家庚 王宇暄 于晓南
(北京林业大学,北京,100083)
多倍体植物通常具有茎秆健壮、花色丰富、花瓣多、叶片厚、抗性强的特点[1]。有性多倍化育种一直是芍药属(Paeonia)植物创制新品种的重点关注领域,即通过诱导配子减数分裂时期紊乱,从而形成2n配子参与受精培育多倍体的一种手段。已有研究证明,2n配子在植物系统进化中起重要作用,在传递杂合性和上位性中具有特殊价值[2]。同时,通过2n配子途径培育的多倍体具有高杂合性和遗传多样性的特征[3]。目前,已有部分植物通过有性多倍化培育出多倍体品种[4-6]。
虽然已陆续有研究在多个物种中报道了天然2n配子的存在[7-8],但其发生概率低,难以被人为利用。人工诱导2n配子产生已成为一种多倍体育种的有效方法,包括2n花粉和2n雌配子的诱导。其中,有关2n花粉诱导的报道详尽且深入[9-10],2n雌配子的探索则较为浅显。但2n花粉的花粉竞争力差,难以竞争过单倍性花粉,导致多倍体得率较低[10]。而2n雌配子诱导在避免竞争问题的同时,还具有母系遗传的优势[11]。大多数被子植物的细胞质几乎全部遗传自母本[12],因此,诱导具有优良性状的母本2n雌配子,可能使其细胞质遗传物质增加,进而遗传给后代,使后代表现出更近似于母本的优良性状。
诱导2n配子产生,把握最佳处理时期是关键。大孢子母细胞经历2次减数分裂,产生功能大孢子,进入胚囊发育期,经历3次有丝分裂,最终形成雌配子。其他物种的研究表明,对减数分裂时期(大孢子发生期)[13-14]和胚囊发育期进行诱导都可能产生2n雌配子[15]。但目前,有关芍药属雌配子发育的细胞学研究较少,仅在黄牡丹(Paeoniadelavayivar.lutea(Delavay ex Franch.) Finet &Gagnep.)和‘凤丹’牡丹(Paeoniaostia‘Fengdan’)中有相关报道。其中,王雁等[16]完整观察了黄牡丹雌配子的发育过程,并建立雌配子体发育与外部形态的相关性。‘凤丹’牡丹却难以观察整个雌配子发育进程的典型结构,但花蕾形态也与大孢子母细胞的发育阶段呈现一定的对应关系[13]。因此,芍药属雌配子发育的细胞学观察存在一定的困难,但与花蕾的外部形态可以建立相关性,以即时辨别芍药雌配子发育阶段。
此外,芍药属已通过高温诱导的物理方法成功诱导2n雌配子,并获得了三倍体植株[13]。化学药剂诱导法是目前使用最广泛,也是诱导率最高的方法[17]。其中,秋水仙素是应用最广泛的化学诱变剂,对旺盛分裂的细胞作用效果优秀。因此,秋水仙素诱导2n雌配子的方法非常适合于芍药。
本研究以二倍体芍药品种‘朱砂判’(Paeonialactiflora‘Zhushapan’)为材料,在掌握其雌配子发育过程的基础上,利用秋水仙素诱导2n雌配子的产生,探究处理时期、秋水仙素质量浓度、注射次数对2n雌配子诱导率的影响,为芍药人工诱导2n雌配子,培育多倍体种质途径提供理论参考。
1 材料与方法
试验材料:本研究选用的试验材料为育性良好、性状优良的二倍体芍药品种‘朱砂判’(Paeonialactiflora‘Zhushapan’,2n=2x=10),选择生长势良好、无病虫害的植株,种植于国家花卉工程技术研究中心北京市昌平区小汤山基地,常规田间管理。
芍药花蕾形态特征观察:2022年、2023年4月末至5月中旬,于田间拍照并记录花蕾形态特征,包括花蕾直径、花瓣颜色、萼片颜色和雌蕊长度。其中,花蕾直径和雌蕊长度使用标准游标卡尺测量,单位为mm。花蕾直径划分组别见表1。

表1 芍药花蕾形态特征记录
芍药雌配子发育过程观察:根据花蕾直径分组,每一组分别用标准(FAA)固定液(V(体积分数50%的乙醇)∶V(冰醋酸)∶V(甲醛)=18∶1∶1)固定10个不同植株花蕾的全部心皮。固定后的心皮置于冰箱4 ℃保存,通过常规石蜡切片法对心皮进行细胞学观察,切片厚度8~10 μm,番红-固绿染色,切片置于徕卡光学显微镜下拍摄,同步统计发育时期及所占比例,建立雌配子发育过程与花蕾形态的关系。
秋水仙素诱导处理:采取注射法(即采用一次性注射器对花蕾缓慢注射试剂,至试剂从鳞片渗出为止),研究花蕾直径、秋水仙素质量浓度和注射次数3个因子对四倍体得率的影响。花蕾直径(d)范围为11 mm≤d<12 mm、14 mm≤d<15 mm、15 mm≤d<17 mm、23 mm≤d<26 mm、26 mm≤d<29 mm、29 mm≤d<32 mm。对照组为蒸馏水处理。对各直径范围的花蕾注射不同质量浓度的秋水仙素(0、1、2、3 g/L),每个质量浓度分为3组,分别注射1、2、3次,每组处理30朵花蕾。同步记录花蕾存活数。
四倍体父本杂交:待试验组和对照组雌蕊柱头分泌粘液,去除母本花瓣,进行杂交工作。选择花粉生活力良好及亲和性良好的四倍体父本芍药品种‘Cream Delight’授粉杂交[18],连续授粉3 d后,套硫酸纸袋以防止外来花粉污染,10 d后更换为杂交网袋,后续常规田间管理。
种子采收及常规管理:待杂种种子成熟后,根据试验组合分别进行采收,通过赤霉素浸泡及沙藏处理促进萌发。种子生根后转移至种植钵中继续生长。在此过程中,记录结实数量、种子总数、有胚种子数。
体细胞染色计数观察:取杂种种子新生根尖,采用常规染色体压片法,于徕卡光学显微镜下进行体细胞计数、观察,统计四倍体后代数。倍性鉴定材料选取和处理参照朱炜等[18]的方法。
数据处理:采用Office软件、SPSS 24整合和分析数据。其中,花蕾存活率=(花蕾存活数/处理数)×100%,结实率=(结实数/花蕾存活数)×100%,有胚率=(有胚种子数/种子总数)×100%,四倍体得率=(四倍体种子数/有胚种子数)×100%。采用Adobe Photoshop CC 2019和Image-Pro Plus 6.0处理图片。
2 结果与分析
2.1 芍药雌配子发育过程
大孢子发生进程:芍药胚囊发育类型为蓼型,倒生胚珠,具有双珠被结构(图1)。

图1 芍药胚珠结构纵切面
芍药大孢子母细胞由珠心的一个细胞分化而来,细胞体积大,细胞质浓厚,细胞器丰富。芍药同一胚珠内可能存在一至多个大孢子母细胞(图2A、B),这些大孢子母细胞不同步进入减数分裂时期或退化。大孢子母细胞继续发育,陆续进入第一次减数分裂(图2C~F),第一次减数分裂结束,大孢子母细胞形成二分体,进入第二次减数分裂前期(图2G),最终二分体分裂成纵向排列的四分体大孢子(图2K)。多数胚珠中,仅合点端的大孢子具有功能性,发育成功能大孢子(图2L),其余大孢子退化。极少数情况下,珠孔端大孢子继续发育。大孢子母细胞完成减数分裂,进入胚囊发生阶段。
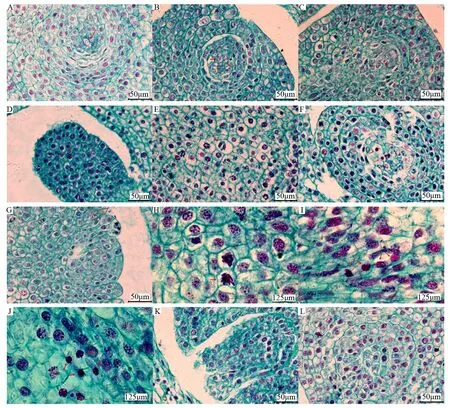
A为间期(单个大孢子母细胞);B为间期(多个大孢子母细胞);C为减数分裂I前期;D为减数分裂I中期;E为减数分裂I后期;F为减数分裂I末期;G为减数分裂II前期;H为减数分裂II中期;I为减数分裂II后期;J为减数分裂II末期;K为四分体;L为功能大孢子。图中红色箭头表示处于该发育时期的细胞。图2 芍药大孢子发生过程
胚囊发生进程:进入胚囊发生阶段后,功能大孢子体积增大,逐渐变得细长,产生液泡,形成单核胚囊(图3A)。随后发生3次有丝分裂,逐步形成二核胚囊(图3B)、四核胚囊(图3C)和八核胚囊(图3D)。伴随胚囊的成熟,珠孔端和合点端模糊,中央部分细长。此外,同一胚珠中可能同时存在不同发育阶段的胚囊,多个胚囊结构的堆叠使得胚囊结构难以辨认(图3E)。

A为单核胚囊;B为二核胚囊;C为四核胚囊;D为八核胚囊;E为多个非典型胚囊结构。图中红色箭头表示处于该发育时期的细胞。图3 芍药胚囊发生过程
雌配子发育过程与花蕾形态的关系:芍药雌配子发育过程与花蕾形态呈现一定的对应关系,一个花蕾直径范围对应一个主要的雌配子发育阶段,即处于该发育阶段的雌配子数量占全部雌配子数量的比例最大。同时,跟踪观察了不同花蕾直径范围对应的其他花蕾形态特征,包括萼片颜色、花瓣颜色、花瓣软硬程度和雌蕊长度。具体可见表1、2和图4。因此,花蕾形态可以作为判断芍药雌配子发育过程的判断指标。
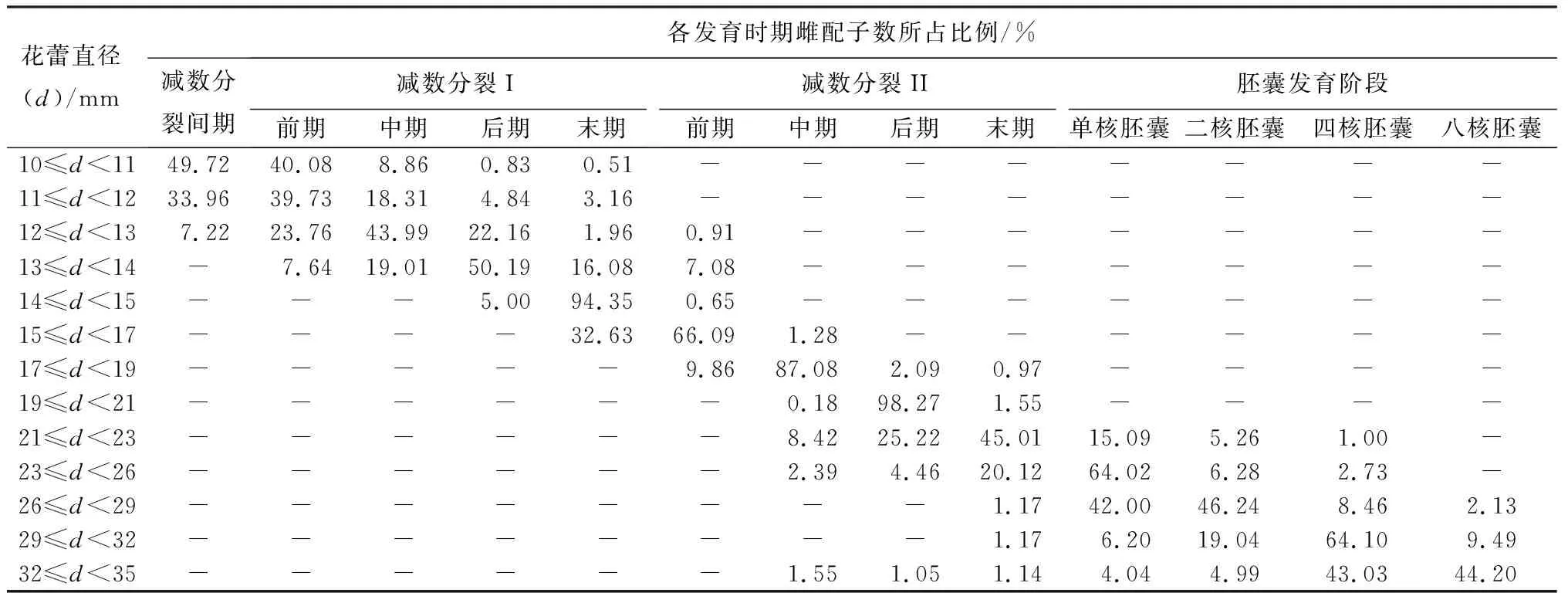
表2 不同直径花蕾中各发育时期雌配子数所占比例

A为10 mm≤d<11 mm;B为11 mm≤d<12 mm;C为12 mm≤d<13 mm;D为13 mm≤d<14 mm;E为14 mm≤d<15 mm;F为15 mm≤d<17 mm;G为17 mm≤d<19 mm;H为19 mm≤d<21 mm;I为21 mm≤d<23 mm;J为23 mm≤d<26 mm;K为26 mm≤d<29 mm;L为29 mm≤d<32 mm;M为32 mm≤d<35 mm。d为花蕾直径。图4 芍药花蕾形态发育进程
2.2 秋水仙素诱导芍药大孢子染色体加倍
部分被子植物大孢子减数分裂进程的细胞学观察研究[17,19]表明,第一次减数分裂前期和第二次减数分裂前期诱导效率最佳。而牡丹的研究表明,第一次减数分裂末期也能作为大孢子染色体加倍的适宜时期[13]。故本研究诱导的花蕾直径范围为11 mm≤d<12 mm(减I前期主导期)、14 mm≤d<15 mm(减I末期主导期)、15 mm≤d<17 mm(减II前期主导期)。共处理1 080朵花蕾,收获有胚种子2 322个。经根尖染色体压片鉴定(图5),筛选出7个四倍体种子,均来自试验组,对照组均未获得四倍体种子(表3)。

表3 秋水仙素诱导芍药大孢子染色体加倍选育四倍体得率

图5 芍药大孢子染色体加倍获得四倍体后代的体细胞染色体
由表3可知,3个减数分裂时期均成功获得四倍体种子。进一步对2n雌配子诱导率减数分裂进程进行相关性分析,结果表明,2n雌配子诱导率和减数分裂I前期(r=0.496,p=0.284)、减数分裂I末期(r=0.547,p=0.168)、减数分裂II前期(r=0.044,p=0.925)的主导期雌配子数量占比(即主导期雌配子数量占全部雌配子数量的比)呈正相关。据此判断,在减数分裂I前期、减数分裂I末期和减数分裂II前期均可以诱导雌配子加倍。其中,在减数分裂II前期,质量浓度为1 g/L的秋水仙素注射3次的诱导效果最好,2n雌配子诱导率为2.74%。
2.3 秋水仙素诱导芍药胚囊染色体加倍
芍药功能大孢子经过3次有丝分裂形成成熟胚囊。故3次有丝分裂给胚囊染色体加倍提供了可能性。因芍药八核胚囊结构的不典型性,本研究仅探讨前两次有丝分裂的诱导效果,即单核胚囊期(23 mm≤d<26 mm)、二核胚囊期(26 mm≤d<29 mm)和四核胚囊期(29 mm≤d<32 mm)。共处理1 080朵花蕾,获得有胚种子数2 408个,经根尖染色体压片法鉴定(图6),获得9个四倍体种子(表4),均来自试验组。对照组未获得四倍体种子。
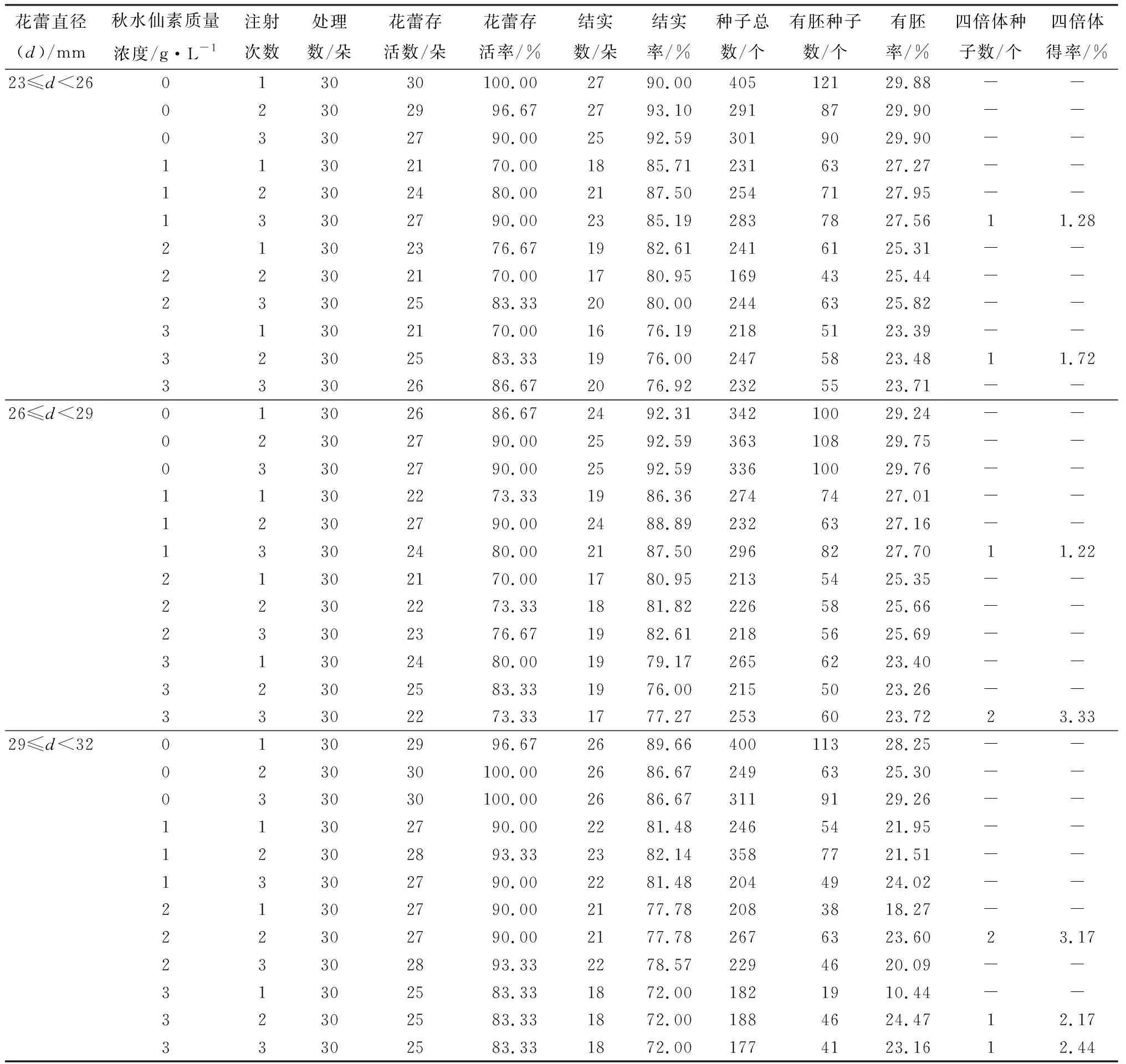
表4 秋水仙素诱导芍药胚囊染色体加倍选育四倍体得率

图6 芍药胚囊染色体加倍获得四倍体后代的体细胞染色体
单核胚囊期、二核胚囊期和四核胚囊期均能获得一定比率的四倍体种子。进一步对胚囊发育时期中主导期雌配子数量占比和四倍体得率进行相关性分析,结果表明,四倍体得率与单核胚囊主导期雌配子数量占比(r=-6.980,p=0.258)呈负相关,与二核胚囊(r=0.448,p=0.403)和四核胚囊(r=0.641,p=0.389)主导期雌配子数量占比呈正相关。综上,在胚囊发育的前两次有丝分裂过程施加处理均可获得四倍体种子。其中,质量浓度为3 g/L的秋水仙素对二核胚囊期的材料注射3次诱导效果最佳,诱导率为3.33%。该结果较之减数分裂时期处理组合的最佳诱导率略高,可视为芍药2n雌配子人工诱导的最佳组合。
3 结论与讨论
目前,芍药属植物配子发育规律的研究,主要集中在对雄配子的研究上[20-22]。本研究发现,芍药雌配子发育过程为蓼型。胚珠内具有一至多个具有发育潜力,且发育不同步的大孢子母细胞。即胚珠内可同时观察到不同发育时期的大孢子、胚囊和退化细胞。当大孢子进入胚囊发育期,伴随3次有丝分裂,胚囊拉伸为细长的结构。加州芍药(Paeoniacalifornica)的研究结果称这种细长结构为“珠孔端扩大、合点端模糊,中央部分极细长”[23]。但在本研究中,难以通过石蜡切片法观察到形态清晰的典型成熟胚囊结构。同时,在多胚囊胚珠中,胚囊结构的堆叠使得胚囊结构的观察更加困难。这种多胚囊发育的特性与黄牡丹雌配子发育观察结果不一致。黄牡丹的多个大孢子母细胞在经减数分裂后,形成多个功能大孢子,但在同一胚珠内只观察到了一个胚囊结构[16]。此外,在本研究中,虽观察到芍药的多胚囊结构,但目前仍未有报道显示,芍药属种子具多胚结构。故推测在雌配子发育和胚胎发育的过程中可能存在“淘汰”机制:①成熟胚囊形成前,不同胚囊之间相互存在竞争和选择,只有那些在竞争中取得优势的胚囊才能进一步发育成熟,获得受精的资格;②多个胚囊均能发育成熟并受精,除某一获得竞争优势的胚胎外,其余胚胎的淘汰必然发生在胚胎发育的某一时期。
本研究建立花蕾形态与芍药雌配子发育过程的关联性,能够做到对雌配子发育阶段的即时性判断,最大程度提高2n雌配子的诱导率。其中,不同花蕾直径范围对应一个雌配子发育主导时期,主导时期雌配子数量占比对2n雌配子诱导率存在一定影响。如,在对芍药大孢子染色体加倍的研究中,最佳诱导时期在减数分裂II前期,表明而非减数分裂I前期。花蕾直径在11 mm≤d<12 mm范围内,大孢子发生主导时期(减数分裂I前期)雌配子数量占比仅有39.73%,有33.96%的大孢子母细胞处于间期阶段。而花蕾直径在15 mm≤d<17 mm范围内,大孢子发生主导时期(减数分裂II前期)所占比例高达66.09%。
后续工作中,需进一步探索更适宜芍药雌配子发育过程的石蜡切片技术,可辅以其他技术手段,如胼胝质沉积定位等[24],以追求更准确、具体的发育过程细胞学观察,建立更高效的芍药2n雌配子诱导体系。同时,对芍药雌配子发育和胚胎发育过程中可能存在的“淘汰”机制进行深入研究。
