西宁市杨树腐烂病病原菌分离及杨树腐烂病菌的寄主范围和药剂敏感性测定1)
2024-05-11刘媛媛马强张磊李正男孙平平
刘媛媛 马强 张磊 李正男 孙平平
(内蒙古农业大学,呼和浩特,010018)
杨树(Populus)为高大落叶乔木,因生长速度快、经济效益高,成为三北地区防护林、用材林和绿化的优选树种[1]。其中,新疆杨(Populusalbavar.pyramidalis)是林木生物学研究的重要模式树种[2],因其抗逆性强、生长速度快、经济效益高等特点成为我国北部地区重要的经济林、用材林和防风林树种之一[3-4]。随着杨树的大面积种植,杨树腐烂病作为杨树的主要病害之一,在杨树上的发生率达到20%~40%,严重区域达到90%[5],感病杨树表现为树干干腐或者枯梢,甚至整株死亡,对杨树的生长、林业生态和经济的可持续发展造成了严重威胁[6-7]。
杨树腐烂病主要由金黄壳囊孢菌Cytosporachrysosperma(有性型为Valsasordida)引起,病原菌以无性型危害为主[8-9]。此外,Valsanivea、C.davidiana、C.atrocirrhata、C.kantschavelii和C.tritici等也可引起该病害[10-13]。青海和内蒙古是我国“三北”防护林工程建设的主要省和自治区,杨树成为当地重要的防风和造林树种,但是由于寒冷、干旱等条件造成当地的腐烂病发生尤其严重。目前,从青海地区的新疆杨、小叶杨(P.simonii)、河北杨(Populus×hopeiensis)、毛白杨(P.tomentosa)等分离到C.chrysosperma、C.gigaspora、Cryptosphaeriapullmanensis、C.ailanthicola等病原菌[8,14]。从内蒙古地区的新疆杨、山杨(P.davidiana)和大青杨(P.ussuriensis)上分离发现了C.chrysosperma、C.davidiana、C.fugax、C.translucens和Cryptosphaeriapullmanensis等病原菌[8,14-15]。明确当地杨树腐烂病的病原种类将为病害的有效防控提供基础。
青海和内蒙古地区因昼夜温差大,光照条件好等气候特点,成为李子(Prunussalicina)、杏(P.sarmeniaca)、金红苹果(Maluspumilacv. Jinhong)、海棠(M.spectabilis)和枸杞(Lyciumchinense)等果树的高品质产区[16-17]。其中,杨树作为果园防护林的主要树种,能有效降低风力、风速,减少风害对果园的影响,提高果树的抗逆能力,达到增产、增收的目的,成为当地主要的防风林树种。杨树腐烂病为典型的寄主主导型病害,除了危害杨属(Populus)植物,还可危害柳属(Salix)、榆树属(Ulmus)、胡桃属(Juglans)等多个树种[14,18-19]。明确该病害是否能够侵染李子、杏、金红苹果、海棠和枸杞等果树,将为果园病害的防控提供技术指导。
化学药剂的施用是杨树腐烂病防控的有效措施,刘淑香等[20]发现苯醚甲环唑微乳剂对杨树腐烂病菌C.chrysosperma有良好的抑制效果。徐明等[21]测定了不同杀菌剂对杨树腐烂病菌的毒力,发现吡唑醚菌酯对杨树腐烂病菌的孢子萌发和菌丝生长抑制性最强。此外,多菌灵、戊唑醇和腈菌唑对杨树腐烂病病菌菌丝生长也有显著的抑制作用[22],但是由于不同地区杨树腐烂病病原种类不同,以及同一种病原的不同株系之间的毒力也存在差异,因此针对当地病原菌进行高效药剂的筛选将为病害的有效防控和“减药”措施提供重要的基础。
作者前期从内蒙古呼和浩特市的‘新疆杨’上分离得到Cryptosphaeriapullmanensis和C.chrysosperma病原菌[23]。2021年,在青海省西宁市发现多棵新疆杨表现出典型的腐烂病症状,为了明确引起青海省西宁市‘新疆杨’杨树腐烂病病原种类,以及杨树腐烂病菌对当地不同果树树种的侵染能力,并筛选有效防控药剂,本研究对采自青海省西宁市的杨树腐烂病菌进行分离和鉴定,以分离自青海省西宁市和内蒙古呼和浩特市的杨树腐烂病病原菌为供试菌株,测定其对5种当地主栽果树的侵染能力,以及对不同化学药剂的敏感性,拟为两地杨树腐烂病的防控提供参考。
1 材料和方法
1.1 供试材料
供试病原菌菌株:CryptosphaeriapullmanensisYSFL1、CytosporachrysospermaYSFL3、C.chrysospermaYSFL4-2分离自内蒙古呼和浩特市的‘新疆杨’,由内蒙古农业大学园艺作物病害病原生物学及病害综合防控研究室保存[23]。
枝条样品采集:2021年在青海省西宁市青海大学校园内的‘新疆杨’上发现多棵树表现腐烂病的症状,发病的杨树表现为干腐型,发病部位树皮龟裂,容易脱落,病斑有明显的黑褐色边缘,树皮表面布满黑色分生孢子器,病部皮层变暗褐色糟烂,易与木质部剥离,甚至腐烂达木质部。随机选取有症状的5棵杨树进行取样,取样时,沿病斑周围切至木质部取出整个病斑,将所采集的标本装入塑料袋且贴好标签,带回内蒙古农业大学园艺作物病害病原生物学及病害综合防控研究室冰箱4 ℃保存。室内接种用的杨树枝条、大紫李(P.salicina)、串枝红杏(P.armeniacacv. Chuanzhihong)、海棠、金红苹果和中华枸杞(L.chinense)1~2年生枝条均采集自内蒙古农业大学校园。
供试药剂:杨树腐烂病菌敏感性测定药剂购买于当地市场,药剂名称、药剂有效成分、药剂类型以及生产公司信息见表1。

表1 6种供试药剂的成分、剂型及其来源
1.2 青海新疆杨树腐烂病病原菌分离纯化和致病性测定
无菌操作箱内,选取样品病健交界处切成5 mm×5 mm小块,体积分数为1%的NaClO消毒3 min,体积分数为75%的酒精消毒2 min,无菌水清洗3次,置于孟加拉红培养基中,25 ℃培养3 d,挑取菌落边缘菌丝转接于新的马铃薯葡萄糖琼脂(PDA)培养基中,28 ℃培养并多次纯化,直至得到单一菌株,纯化后菌株用于下一步研究。
利用枝条接种法检验致病性,将采集到的杨树枝条截成约10 cm长,依次用体积分数为1%的NaClO浸泡5 min,体积分数为75%的酒精浸泡3 min,无菌水冲洗3次,风干后用石蜡封住枝条两端。用直径4 mm的实心打孔器烫伤树皮,在烫伤点接种已在PDA培养基上培养5 d、直径6 mm的分离菌,用浸湿的无菌脱脂棉裹住接种位点后,用保鲜膜包扎,每个处理重复6个枝条。以只接种PDA培养基的枝条作为阴性对照。处理枝条置于铺有双层纱布的塑料盘中,保鲜膜封口保湿。一周后去掉保鲜膜,保持水分,观察枝条发病情况。
1.3 青海新疆杨树腐烂病致病菌的鉴定
形态学观察:将分离到的致病菌接种于马铃薯葡萄糖琼脂平板培养基上,28 ℃黑暗培养,定期观察并记录菌落形态特征,并在显微镜下观察孢子及分生孢子器的形态、大小等。
分子鉴定:收集致病菌菌丝,用真菌DNA提取试剂盒(生工生物工程(上海)股份有限公司,B518229)提取DNA。以提取的真菌DNA为模板,利用通用引物ITS1(5’TCCGTAGGTGAACCTGCGG3’)/ITS4(5’TCCTCCGCTTATTGATATGC3’)、Bt2a(5’GGTAACCAAATCGGTGCTGCTTTC3’)/Bt2b(5’ACCCTCAGTGTAGTGACCCTTGGC3’)分别扩增致病菌的内转录间隔区(ITS)和β微管蛋白序列(TUB2)。PCR反应体系均为:2×M5Hipper超光速Mix 10 μL、ddH2O 7 μL、DNA模板1 μL,上下游引物各1 μL;ITS的PCR程序:95 ℃ 3 min,94 ℃ 25 s,55 ℃ 30 s,72 ℃ 40 s,35个循环;72 ℃ 10 min。TUB2序列在PCR反应的退火温度为61 ℃,其余同ITS序列。PCR扩增产物经体积分数为1.2%的琼脂糖电泳检测,用普通琼脂糖凝胶DNA回收试剂盒(天根生化科技(北京)有限公司)纯化、回收后,送至上海生工生物工程股份有限公司进行测序。测序结果在美国国家生物技术信息中心(NCBI)上进行BLAST同源序列比对,采用MEGA11.0软件的Clustal W对表2中的菌株序列进行比对分析,按照ITS-TUB2的顺序进行首尾相连,用邻接法(NJ)构建系统发育进化树(校正值设定为1 000)。
表2 用于核酸一致性分析和系统进化树构建所用参考序列
1.4 6株杨树腐烂病病原菌对5种果树的致病性测定
上述分离鉴定出的致病菌C.chrysospermaQHYSFL6、C.chrysospermaQHYSFL7、C.chrysospermaQHYSFL8和分离自内蒙古呼和浩特的CryptosphaeriapullmanensisYSFL1、C.chrysospermaYSFL3、C.chrysospermaYSFL4-2,共6株病原真菌转入PDA平板中28 ℃培养5 d,参照1.2方法分别接种大紫李、串枝红杏、海棠、金红苹果和中华枸杞枝条,观察并记录发病情况。
1.5 6株腐烂病菌的药剂敏感性测定
利用室内菌丝生长速率法评价腐烂病菌C.chrysospermaQHYSFL6、C.chrysospermaQHYSFL7、C.chrysospermaQHYSFL8、CryptosphaeriapullmanensisYSFL1、C.chrysospermaYSFL3、C.chrysospermaYSFL4-2对市场上常用6种药剂的敏感性。利用无菌水将供试药剂稀释至一定质量浓度,按照不同比例加入到冷却至50 ℃左右的马铃薯葡萄糖琼脂培养基中,混合均匀后倒入直径9 cm的培养皿中,获得一系列有效质量浓度的培养平板,每个质量浓度重复3次。在含药培养基中央接种供试病原菌菌饼(6 mm),以不加药剂的马铃薯葡萄糖琼脂平板为空白对照,25 ℃黑暗培养。待对照菌落菌丝基本长满整皿后,利用十字交叉法垂直方向量取菌落直径,采用下列公式计算菌丝生长的抑制率。
菌丝生长抑制率=[(对照菌落直径-处理菌落直径)/(对照菌落直径-0.6)]×100%。
利用Excel 2020统计软件整理药剂敏感性数据,横坐标是处理质量浓度的对数值,纵坐标是抑制率值,以求出毒力回归方程(y=ax+b),计算相关系数(R),然后利用回归方程计算6种供试药剂对杨树腐烂病菌丝生长的抑制中浓度(EC50),比较不同杀菌剂对病菌的抑制作用。
2 结果与分析
2.1 青海省杨树腐烂病病原菌分离及致病性测定结果
对从青海省新疆杨采集到的样品进行分离、纯化,共得到9株形态差异的菌株,命名为QHYSFL1~QHYSFL9。对分离、纯化得到的9个菌株进行致病性检测。其中,接种菌株QHYSFL6、QHYSFL7、QHYSFL8的杨树枝条在接种14 d后,从接种点开始发软,接着横向褐色病斑扩展绕枝条一周,树皮皱缩,且出现大量黑色分生孢子器,为典型的杨树腐烂病症状(图1)。
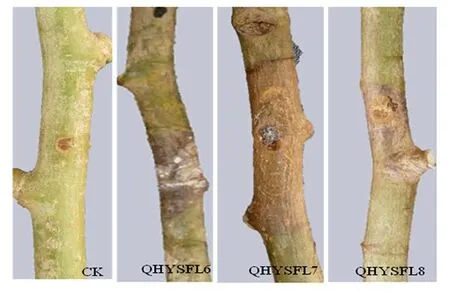
图1 致病菌在杨树枝条上的危害症状
2.2 青海省杨树腐烂病病原菌鉴定
形态学观察:菌株QHYSFL6、QHYSFL7、QHYSFL8在马铃薯葡萄糖琼脂(PDA)培养基上培养3~5 d后,菌落颜色呈白色,放射状分布,边缘整齐。培养8 d,菌丝长满培养基,黄灰色、黄白色至深褐色,培养基背面呈黄灰色及黄白色。培养20 d后,菌落均随机长出黑色且呈现球状孢子体的分生孢子器,可观察到黄色孢子角产生。显微镜观察QHYSFL6、QHYSFL7、QHYSFL8的分生孢子,为无色,单孢,香蕉型,孢子长为3.0~5.5 μm,菌丝直径为1.1~5.0 μm(图2)。从菌落特点和产孢子的形态特征,初步认定QHYSFL6、QHYSFL7、QHYSFL8为壳囊孢属[17,24]。
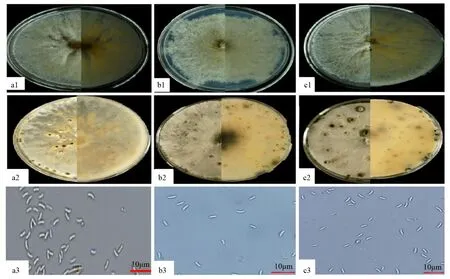
a、b、c分别为QHYSFL6、QHYSFL7、QHYSFL8;1、2、3依次为菌株皿内培养8、12 d形态以及孢子形态。图2 QHYSFL6、QHYSFL7、QHYSFL8的皿内形态和分生孢子
分子鉴定结果:采用通用引物ITS(ITS1/ITS4)和TUB2(Bt2a/Bt2b)从菌株QHYSFL6、QHYSFL7、QHYSFL8分别获得了长度为579、579、591 bp的ITS基因片段和496、497、508 bp的TUB2基因片段。将上述基因序列在NCBI的BLASTn程序进行同源序列比对,选取序列利用MEGA11.0对ITS-TUB2拼接序列构建系统发育进化树(图3),结果表明,QHYSFL6、QHYSFL7、QHYSFL8与C.chrysosperma聚在一支上,形态学结合分子序列可知QHYSFL6、QHYSFL7、QHYSFL8为C.chrysosperma。

图3 基于ITS-β微管蛋白多基因序列的系统发育进化树
2.3 6株杨树腐烂病菌对5种果树枝条的侵染能力
寄主范围测定结果显示,供试的6株杨树腐烂病病原菌均能侵染大紫李、串枝红杏,但是不能侵染金红苹果、海棠和中华枸杞枝条(图4)。CryptosphaeriapullmanensisYSFL1和C.chrysosperma(QHYSFL6、QHYSFL7、QHYSFL8、YSFL3、YSFL4-2)均可引起大紫李和串枝红杏枝条上典型的腐烂病症状,接种21 d后,从接种部位开始凹陷,剥开后韧皮部和木质部变为棕色,有酒糟味;而接种的金红苹果、海棠和中华枸杞枝条在接种60 d均未发病。此外,虽然6株供试病原菌均能侵染大紫李和串枝红杏,但是其致病能力均有差异(表3)。接种培养21 d,CryptosphaeriapullmanensisYSFL1发病率在20%~40%,病斑直径为4 mm以下,其余5株菌的发病率为60%~100%,病斑平均直径为6.00~11.50 mm。

a~e依次为大紫李、串枝红杏、金红苹果、海棠、中华枸杞枝条;1~7依次为CK、QHYSFL6、QHYSFL7、QHYSFL8、YSFL1、YSFL3、YSFL4-2。图4 6种杨树腐烂病菌对5种果树枝条的致病性测定结果
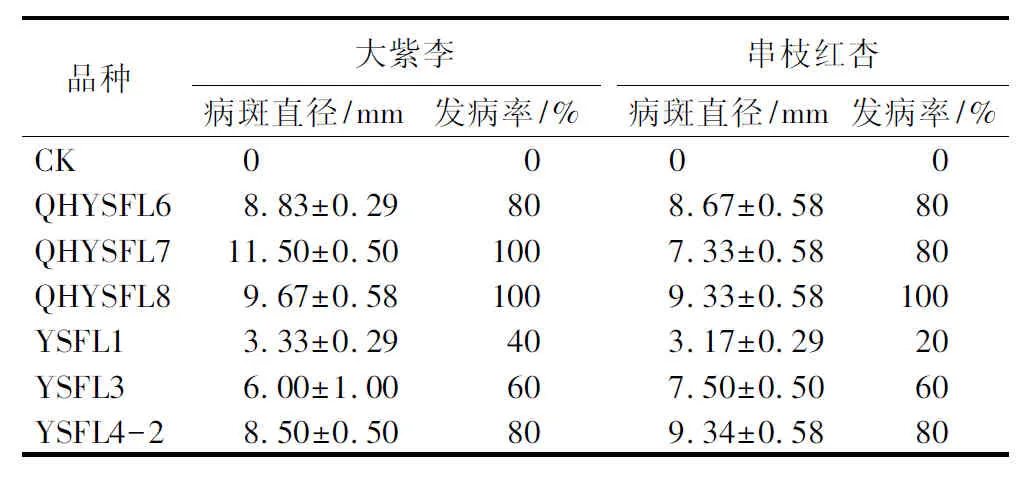
表3 6株杨树腐烂病菌接种大紫李和串枝红杏枝条21 d的致病结果
2.4 6株杨树腐烂病菌对6种药剂的敏感性比较
利用菌丝生长速率法构建6株杨树腐烂病病菌对不同药剂的敏感性回归方程,并计算其相关系数及EC50(表4)。杨树腐烂病病菌回归方程相关系数在0.667 5~1.000 0之间,6株杨树腐烂病菌对6种药剂敏感性的EC50在1.126 5×10-5~1.310 0×10-1mg/L之间,其中C.chrysosperma5个菌株的EC50在1.126 5×10-5~1.310 0×10-1mg/L之间,Cryptosphaeriapullmanensis的EC50在1.230 0×10-5~2.570 0×10-3mg/L之间。苯醚甲环唑处理6株菌的EC50在1.134 8×10-5~6.440 0×10-4mg/L之间,对病原菌抑制效果最好。不同菌株对不同药剂的敏感性不同,腈菌唑处理的EC50在1.126 5×10-5~1.310 0×10-1mg/L之间,C.chrysospermaYSFL3菌株敏感性最强,C.chrysospermaQHYSFL8菌株敏感性最弱;吡唑醚菌酯处理的EC50在9.000 0×10-4~6.140 0×10-2mg/L之间,C.chrysospermaQHYSFL7菌株敏感性最强,C.chrysospermaQHYSFL6菌株敏感性最弱;戊唑醇处理的EC50在5.160 0×10-4~2.300 0×10-2mg/L之间,C.chrysospermaQHYSFL6菌株敏感性最强,C.chrysospermaQHYSFL8菌株敏感性最弱;咪鲜胺处理的EC50值在5.946 2×10-5~6.390 0×10-3mg/L之间,CryptosphaeriapullmanensisYSFL1菌株对咪鲜胺的敏感性最强,C.chrysospermaQHYSFL6的敏感性最弱。

表4 6株杨树腐烂病菌对6种药剂敏感性测定结果
3 讨论
本研究利用形态学结合分子序列鉴定,确定青海西宁市新疆杨树腐烂病病原菌菌株QHYSFL6、QHYSFL7、QHYSFL8均为C.chrysosperma。利用ITS和TUB2多基因序列构建进化树,QHYSFL6、QHYSFL7、QHYSFL8与C.chrysosperma聚到一支。QHYSFL6、QHYSFL7、QHYSFL8都能形成分生孢子器,且分生孢子长为3.0~5.5 μm,形态学结合分子序列结果鉴定为C.chrysosperma。
前期研究表明,C.chrysosperma、C.translucens、C.fugax、C.kantschavelii、Cryptosphaeriapullmanensis、C.multicontinentalis、C.salicacearum、C.paratranslucens、C.davidiana等腐烂病病原菌在国内杨树上均可造成侵染,金黄壳囊孢属(C.chrysosperma)是侵染新疆杨的主要病原菌[8]。除此之外,Cryptosphaeriapullmanensis、C.salicacearum、C.paratranslucens、C.tritici、V.nivea在新疆杨上也有报道[14,18]。美洲及伊朗白杨(P.tomentosa)和黑杨(P.nigra)、内蒙古呼和浩特新疆杨、新疆箭杆杨(P.nigravar.thevestina)和胡杨(P.euphratica)上均发现杨树腐烂病病原菌Cryptosphaeriapullmanensis[14,18,25-26]。陕西、甘肃、新疆、内蒙古呼和浩特、加格达奇和乌兰浩特等地区的新疆杨上都发现了C.chrysosperma(有性型V.sordida)[9,14,27-28]。青海湟中县青杨(P.cathayana)、小叶杨(P.simonii),箭杆杨(P.nigravar.thevestina)和北京杨(P.×beijingensis)的杨树病原菌均为C.chrysosperma[29]。本研究是首次从青海省的新疆杨树上发现了病原菌C.chrysosperma,该结果对青海地区的杨树腐烂病病原种类提供更多信息,为之后开展本土杨树腐烂病防治研究奠定基础。
已报道的C.chrysosperma寄主分为8个属,分别为山楂属(Crataegus)、栗属(Castanea)、杨树属、槐属(Styphnolobium)、桑树属(Morus)、柳属、榆树属、胡桃属[14,30-31]。Cryptosphaeriapullmanensis寄主有松属(Pinus)、柳属、葡萄(Vitisvinifera)、杨树属、沙枣(Elaeagnusangustifolia)[25-26,32]。本研究发现,C.chrysosperma与Cryptosphaeriapullmanensis也可侵染大紫李和串枝红杏,而不能侵染金红苹果、海棠和中华枸杞。杨树作为果树园的防护林被广泛种植,本研究结合前期研究结果显示,杨树不易与仁果类的金红苹果、海棠以及枸杞发生腐烂病的交叉侵染,因此可以作为苹果、海棠和枸杞园的防风树种;而已报道的山楂、沙枣、胡桃和本研究发现的大紫李、串枝红杏等核果类果树均易与杨树发生交叉感染,促进杨树腐烂病菌侵染,因此,杨树不易作为核果类果园的防风林树种。
C.chrysosperma和Cryptosphaeriapullmanensis皆为杨树腐烂病的病原菌,本研究中利用CryptosphaeriapullmanensisYSFL1与5种C.chrysosperma接种不同果树枝条,结果显示,Cryptosphaeriapullmanensis的发病率和病斑直径均小于供试病原菌C.chrysosperma,Cryptosphaeriapullmanensis相对C.chrysosperma侵染力更弱,进一步解释了杨树腐烂病的主要病原菌是金黄壳囊孢属(C.chrysosperma)[8]。QHYSFL6、QHYSFL7、QHYSFL8、YSFL3、YSFL4-2是C.chrysosperma同种菌的不同株系,均可侵染大紫李和串枝红杏,但是致病能力均有差异。因此,生产实践中要结合杨树腐烂病的不同菌和同种菌不同株系进行研究,为病害的精确防治提供思路。
本文利用C.chrysosperma的不同株系和两种菌(C.chrysosperma、Cryptosphaeriapullmanensis)进行药剂试验,结果显示,不同药剂对供试菌株的毒性存在差异,同时,同种菌不同株系对药剂的敏感性不同。因此,在杨树腐烂病防控中要针对当地的病原种类筛选高效药剂。供试的6种药剂对杨树腐烂病菌均具有一定的抑制作用,其中,苯醚甲环唑对6种供试病原菌的抑制效果最好,EC50值为1.134 8×10-5~6.440 0×10-4mg/L,可用苯醚甲环唑作为两地杨树腐烂病防控的首选药剂。
4 结论
本研究鉴定出青海省西宁市新疆杨腐烂病致病菌为C.chrysosperma;通过寄主范围检测发现大紫李和串枝红杏是Cryptosphaeriapullmanensis与C.chrysosperma的寄主,用杨树作为核果类果树防风林时容易发生杨树腐烂病的交叉感染;苯醚甲环唑、吡唑醚菌酯、多菌灵、腈菌唑、咪鲜胺和戊唑醇均对杨树腐烂病菌有着较好的抑制作用,但是同种菌不同株系和不同菌对药剂敏感性不同,因此在防控中应根据当地病原种类选取高效药剂或复配药剂。该研究结果为杨树腐烂病的防控提供基础。
