基于多链结构的CD30 CAR-T细胞的抗肿瘤作用研究
2024-05-10宋羽佳王恩秀
宋羽佳,汪 晨,王恩秀,汪 波
霍奇金淋巴瘤主要来源于B细胞谱系,包括两种亚型,经典型霍奇金淋巴瘤和结节性淋巴细胞为主的霍奇金淋巴瘤。霍奇金淋巴瘤是一种罕见的淋巴瘤,经典型霍奇金淋巴瘤占所有霍奇金淋巴瘤病例的近95%[1]。霍奇金淋巴瘤具有双峰年龄分布,峰值分别在20~30岁和50~70岁,偶尔会发生在≥75岁的患者中[2]。靶向CD30的抗体偶联药物本妥昔单抗治疗霍奇金淋巴瘤的客观缓解率能达到75%,完全缓解率为34%[3]。然而,抗体疗法受限于体内分布,临床获益是短暂的,因此必须探索其他方法。过继性细胞疗法是治疗癌症的一种策略,近年来展示出极大的应用前景[4-5]。对于霍奇金淋巴瘤,CD30是作为CAR-T细胞治疗靶点的极好候选者,因为其在霍奇金淋巴瘤肿瘤细胞上的丰富和特异性表达,但在正常组织上的表达有限[6-8]。因此,该研究基于DAP12的多链嵌合抗原受体开发靶向CD30 CAR-T,研究CD30 CAR-T对霍奇金淋巴瘤肿瘤细胞的体外和体内临床前药效。
1 材料与方法
1.1 实验材料
1.1.1细胞及质粒 HEK-293T细胞购自美国细胞培养物收藏中心,由南京卡提医学科技有限公司保存。L428人霍奇金淋巴瘤细胞保存于南京卡提医学科技有限公司。T细胞来源于健康志愿者外周血。慢病毒表达载体包装质粒 pMDLg/PRRE、pRSV-Rev、pMD2.G购自湖南丰晖生物科技有限公司。JM109感受态细胞购自上海唯地生物技术有限公司。
1.1.2主要试剂 T4 DNA连接酶和限制性内切酶购自NEB(北京)有限公司,中提质粒抽提试剂盒购自南京诺维赞生物科技有限公司,PEI转染试剂购自上海碧云天生物技术有限公司,Ficoll分离液购自 GE公司;T细胞分选试剂盒(EasySepTMHuman T Cell Isolation Kit)购自STEMCELL Technologies;T细胞激活试剂(CD3/CD28 Dynabeads)、Optmizer培养基、DMEM培养基、RPMI 1640培养基、胎牛血清(fetal bovine serum,FBS)购自Gibco公司,X-VIVO 15培养基购自LONZA公司;人白介素-2(interleukin-2,IL-2)和干扰素-γ(interferon-γ,IFN-γ)细胞因子检测试剂盒购自R&DSystems公司,无血清细胞冻存液CS10购自BioLife公司。抗人CD3抗体(FITC)、抗人CD3抗体(APC-Cy7)、链霉亲和素(PE)、链霉亲和素(APC)和抗人CD30 antibody(APC)均购自BD公司;Biotinylated Human CD30蛋白购自 Acro Biosystems公司。
1.2 实验方法
1.2.1肿瘤细胞培养 L428细胞为人经典型霍奇金淋巴瘤细胞,用含有灭活的10%FBS、100 U/ml青霉素和100 μg/ml链霉素的RPMI-1640培养基在37 ℃、5% CO2的培养箱中培养,每隔2~3 d待细胞长满后分瓶传代,将处于对数生长期的肿瘤细胞用于体内肿瘤的接种。
1.2.2CAR慢病毒表达载体构建及包装 CD30 scFv委托上海生工生物工程有限公司合成含有CD30 scFv的DNA片段。CD30 scFv基因序列通过双酶切将CD30 scFv片段插入CAR慢病毒骨架载体(KIRS2/DAP12-BB和BBζ)中构建CD30-KIRS2/Dap12-BB 和CD30-41BBζ慢病毒表达载体,选取筛选得到的阳性克隆细菌进行摇菌并且抽提质粒小提。质粒送上海生工进行测序。选择测序结果正确的克隆进行摇菌,用去内毒素的质粒大提试剂盒提取质粒。采用第三代慢病毒包装系统进行病毒包装:将293T细胞培养于T150 培养瓶中,5%CO2、37 ℃培养,每48 h进行换液传代及规模放大,最终放大至8个T150方瓶。待汇合度达到 80%~90%时进行转染;将CAR质粒和3个包装质粒,通过PEI转染,每个T150瓶需要添加10.9 μg pMDLg/PRRE、5.5 μg pRSV-Rev、5.5 μg pMD2.G、21.8 μg CAR质粒。PEI转染6 h换液,24 h第一次收集慢病毒悬液保存至4 ℃冰箱,48 h第2次收集慢病毒悬液,与第1次收集到的慢病毒悬液合并,用0.45 μm 的滤膜过滤去除细胞碎片,4 ℃、12 000~24 000 r/min离心过夜,离心后,倾倒全部上清液,每管加入 200 μl X-vivo15培养基重悬,进行病毒分装,迅速存放于-80 ℃冰箱备用。
1.2.3CAR-T细胞的制备和鉴定 通过淋巴细胞分离液提取外周血单个核细胞,磁珠分选CD3+T细胞。加入完全培养基(optmizer培养基+10%人AB血清+100 IU/ml IL-2+2 mmol/L Glutamax+Supplement)重悬,按数量比3 ∶1加入CD3/CD28刺激磁珠。24 h后,取所需量的T细胞,以感染复数MOI=3将T细胞与慢病毒混合铺入合适的培养容器中,未转导(not transduced,NTD)组不加入慢病毒,置于37 ℃、5% CO2培养箱进行培养。每隔1~2 d传代补液一次,培养至细胞处于静息状态,去除CD3/CD28磁珠后,将细胞冻存于液氮中,用于后续细胞功能分析。制备的 CAR-T 细胞分别命名CD30-KIRS2/Dap12-BB组和CD30-41BBζ组,未做病毒侵染的T细胞命名为NTD组。
1.2.4CAR-T 细胞体外杀伤能力的检测 用含10%FBS的DMEM培养基常规培养L428,收集细胞,1×104细胞/孔接种于96孔板中,按照效靶比(E ∶T)为0 ∶1、1 ∶1、5 ∶1、10 ∶1将CAR-T细胞加入到靶细胞中,以NTD作为阴性对照,置于37 ℃、5%CO2培养箱中培养18 h,根据乳酸脱氢酶(lactate dehydrogenase,LDH)检测CAR-T细胞对靶细胞杀伤作用。
1.2.5CAR-T细胞因子分泌试验 靶细胞培养:L428用含10%FBS的RPMI 1640培养基进行培养,37 ℃、5% CO2进行培养。细胞因子释放试验在96孔板上通过共培养靶细胞与CAR-T共培养进行,E ∶T为2 ∶1,靶细胞接种1×104细胞/孔,共培养培养基为200 μl 含10%FBS的RPMI 1640培养基。共培养24 h后,参考IFN-γ的ELISA试剂盒说明书,检测上清液中IFN-γ含量。
1.2.6实验动物及伦理 实验所用动物的种属为 Mus Musculus,品系为 NCG,6~8周龄,性别为雌性。动物级别为 SPF级,体质量18~22 g,由江苏集萃药康生物科技有限公司提供。动物试验设计和实施符合赫尔辛基宣言、医学伦理道德标准及我国的法律法规,并得到中山大学附属第七医院实验动物伦理委员会的批准。许可证号:SCXK(苏)2023-0009。
1.2.7肿瘤细胞的接种、分组及给药方案 将PBS重悬的L428肿瘤细胞接种于小鼠右侧胁肋部皮下,5×105细胞/只,在肿瘤细胞注射接种20 d后,根据荷瘤小鼠肿瘤体积将其随机分为3组(NTD组、CD30-KIRS2/Dap12-BB组和CD30-41BBζ组)进行治疗(当天记为分组后0 d, D0),给药途径采用尾静脉给药,每组5只。
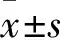
2 结果
2.1 CAR表达质粒构建及验证通过上海生工生物工程有限公司全基因合成CD30 scFv,在实验室现有载体pWC032和pKT004的基础上,通过酶切连接的方法,分别构建CD30-KIRS2/Dap12-BB CAR质粒和CD30-BBζ CAR质粒,对CAR质粒进行双酶切鉴定,CD30-KIRS2/Dap12-BB CAR质粒条带约为756 bp和8 583 bp,CD30-41BBζ CAR质粒条带约为756 bp和8 449 bp。载体示意图及酶切鉴定结果如图1所示,两个CAR质粒条带大小均正确。

图1 CAR质粒酶切电泳图
2.2 CAR慢病毒及CAR-T 细胞制备将CAR表达质粒与包装质粒用PEI转染 293T 细胞进行慢病毒包装,经超速离心浓缩后,CD30-KIRS2/Dap12-BB CAR慢病毒和CD30-41BBζ CAR慢病毒滴度分别为 2.7×107TU/ml 和 4.6×107TU/ml。T 细胞激活 24 h后,以 MOI=3加入慢病毒进行感染,在细胞收获冻存时检测CAR阳性率,两种CD30 CAR结构示意图见图2A,结果表明两种CD30 CAR-T细胞均能较好表达CAR分子,CAR表达都在50%以上(图2B)。

图2 CAR结构设计及表达
2.3 基于多链结构的CD30 CAR-T细胞体外功能测试为了检测CD30 CAR-T细胞的杀伤活性,本研究采用L428作为抗原阳性的靶细胞,流式细胞术检测结果表明L428高表达CD30抗原(图3A)。

图3 肿瘤细胞抗原表达及靶向CD30 CAR-T体外功能分析
细胞杀伤实验结果表明两种CD30 CAR-T细胞对靶细胞均有显著的杀伤作用,其中CD30-KIRS2/Dap12-BB组杀伤作用优于CD30-41BBζ组(图3B)。NTD组没有展现出特异性杀伤作用,表明两种CD30 CAR-T是依赖CD30抗原的特异性杀伤作用,CD30-KIRS2/Dap12-BB组抗肿瘤效果更好。
CAR-T与靶细胞共培养的细胞因子分泌实验结果表明,CD30-KIRS2/Dap12-BB组分泌IFN-γ能力最强,CD30-41BBζ组分泌IFN-γ能力稍弱于CD30-KIRS2/Dap12-BB组,两种CD30 CAR-T与抗原阳性肿瘤细胞共培养均能产生显著的响应作用(图3C)。
2.4 基于多链结构的CD30 CAR-T细胞体内抗肿瘤作用为了研究CD30-KIRS2/Dap12-BB CAR-T的体内抗肿瘤活性,本研究用L428细胞建立了NCG小鼠皮下移植瘤模型。20 d后,待肿瘤体积大小达到50 mm3时,将荷瘤小鼠随机分为3组,并且尾静脉注射细胞进行治疗。结果表明,CD30-KIRS2/Dap12-BB组和CD30-41BBζ组可以迅速实现肿瘤消退,而NTD组没有产生肿瘤抑制作用。结果表明CD30-KIRS2/Dap12-BB抗肿瘤效果更持久,具备强大的靶向CD30的抗肿瘤活性(图4)。

图4 小鼠肿瘤体积变化情况(n=5)
3 讨论
霍奇金淋巴瘤是一种影响跨越儿童和成人人群的恶性淋巴瘤。虽然大多数霍奇金淋巴瘤患者通过一线治疗治愈,但约15%的患者要么是原发难治性疾病,要么是在最初治疗有反应后复发[9]。CAR-T细胞是治疗复发或难治性血液系统恶性肿瘤(包括淋巴瘤)的一种具有前景的新疗法[10-12]。CD30是一个高特异性的靶点,因为它在几乎所有的经典霍奇金淋巴瘤、间变性大细胞淋巴瘤以及其他部分淋巴瘤类型(包括皮肤T细胞淋巴瘤和弥漫性大B细胞淋巴瘤)中普遍表达[13]。传统的CAR结构体系普遍采用的是单链嵌合分子结构的设计,主要结构包括抗原结合区、铰链区、跨膜区和细胞内信号区[14],然而在生理状态下细胞的免疫受体通常是以多链复合物的结构存在,例如包括配体结合链和免疫酪氨酸活化序列[15]。
本项目组根据免疫受体的这一生理特性设计了独特的多链CAR结构体系,以杀伤细胞免疫球蛋白样受体(KIR)和DAP12为基础的多链体系。该CAR结构优点在于允许所有相关信号结构域位于细胞膜附近[16]。从研究结果可以看出,CD30-KIRS2/Dap12-BB CAR-T细胞与CD30-41BBζ组对L428细胞体外杀瘤效应相当。ELISA法检测IFN-γ分泌水平结果显示,在L428肿瘤细胞刺激下CD30-KIRS2/Dap12-BB组较CD30-41BBζ组IFN-γ分泌水平显著提高。分别将两种CD30 CAR-T治疗NCG小鼠皮下移植瘤模型,结果显示CD30-KIRS2/Dap12-BB组能够实现肿瘤完全消退且100 d内肿瘤没有复发。结果表明CD30-KIRS2/Dap12-BB组抗肿瘤效果更持久,具备强大的靶向CD30的抗肿瘤活性。
本研究从体外杀伤、细胞因子分泌以及体内药效等多个方面证明了多链CAR-T在抗肿瘤药效活性方面优于传统二代CAR-T。尽管如此,CAR-T的临床治疗在开发高效抗肿瘤候选药物的同时需要考虑到临床的安全性,高抗肿瘤活性可能带来更大的临床毒副作用(如细胞因子释放综合征等),多链CAR-T虽然在临床前药效评估中具有一定的优势,但细胞因子分泌水平更高可能会给临床的副作用处理带来更大的挑战。
