雷帕霉素上调人脐静脉内皮细胞自噬活性抑制细胞增殖
2024-05-10王雅雯程亚楠苏碧昊
王雅雯,程亚楠,杨 宾,苏碧昊,徐 普
骨重建中新生血管生成主要涉及以内皮细胞为主的血管再生,血管内皮细胞作为血管再生的主要参与者,细胞的增殖、迁移和分化是骨再生的重要促进因素[1-2]。有研究[3-5]表明,在新生骨形成的微环境中,新生血管与骨组织之间相辅相成,内皮细胞分泌的血管内皮生长因子有利于骨重建的发生。自噬通过吞噬并溶解多余或受损的细胞器为细胞供能,是维持细胞正常生长发育的有利因素。雷帕霉素(rapamycin,Rapa)通过抑制哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)达到激活细胞自噬的目的,是研究自噬较为成熟的自噬激活剂[6-7]。
课题组前期研究[8-9]结果表明,氧浓度的改变会影响成骨细胞的自噬活性,进而改变细胞的增殖和分化能力。但内皮细胞的自噬活性改变对局部成骨造成影响目前少见报道。该研究通过Rapa作用于人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)建立细胞自噬模型,探讨Rapa上调HUVECs自噬对细胞增殖的影响,为后续血管再生与骨重建相关性研究提供一定理论依据。
1 材料与方法
1.1 实验材料HUVECs购自中国典型培养物保藏中心。Rapa购自美国MCE公司,人脐静脉血管内皮细胞完全培养基购自中国典型培养物保藏中心(F-12K+0.1 mg/ml heparin+ECGS+10%FBS),PBS磷酸钾缓冲液、青链霉素购自美国Gibco公司,微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3, LC3)、unc-51样激酶1(unc-51-like kinase 1, ULK1)和mTOR一抗购自美国CST公司,Beclin1 一抗、GAPDH一抗、Goat Anti-Rabbit IgG二抗购自英国 Abcam公司,CCK-8试剂盒购自日本同仁公司,自噬染色检测试剂盒(MDC法)、EdU-488细胞增殖检测试剂盒购自中国碧云天生物技术有限公司。
1.2 方法
1.2.1细胞培养和实验分组 HUVECs常规培养,每2 d换液1次。待细胞生长达合适密度时进行相关实验。以正常培养(10%FBS培养)为对照组,以10%FBS培养液中加入终浓度100 nmol/L的Rapa为实验组,作用于HUVECs,3、6、12、24 h收集细胞进行实验检测。
1.2.2Western blot检测自噬相关蛋白表达 细胞常规培养,以50%的密度接种于10 cm2培养皿中,待细胞生长融合至85%时加入终浓度为100 nmol/L的Rapa分别处理3、6、12、24 h。加入RIPA细胞裂解液1 ml,4 ℃、12 140 r/min离心5 min,BCA蛋白定量后加上样缓冲液,95 ℃蛋白变性5 min,-20 ℃冰箱保存备用。将10 μg蛋白样品加入4%~20%梯度胶上样孔中,依次120 V恒压50 min蛋白电泳,冰上300 mA恒流30 min转膜,封闭后分别加入一抗LC3(1 ∶1 000)、Beclin 1(1 ∶3 000)、ULK1(1 ∶1 000)和GAPDH(1 ∶2 000),4 ℃孵育过夜;室温下孵育二抗(1 ∶2 000和1 ∶10 000)1 h,化学发光1 min后拍照。Image J软件进行灰度值测量,相对蛋白表达强度以目标条带与内参蛋白的灰度比值表示。
1.2.3透射电镜(transmission electron microscope,TEM)检测自噬小体 细胞处理24 h后取1 ml电镜固定液加入皿中,室温固定5 min,随后细胞刮轻轻刮下细胞置于1.5 ml EP管,1 200 r/min离心3 min,加入新固定液1 ml,室温固定30 min,4 ℃备测。
1.2.4MDC法检测自噬荧光表达 细胞常规培养后,以1×104/孔接种于24孔板中,24 h后吸净培养液。每孔加入250 μl MDC染色液,培养箱避光孵育1 h;吸净MDC染色液,使用Assay Buffer洗涤3次,更换新Assay Buffer,荧光显微镜下拍摄绿色荧光,荧光强度用Image J进行统计。
1.2.5CCK-8法检测细胞增殖情况 细胞常规培养后,以1×104/孔接种于96孔板中,设置4个复孔,按实验分组分别于3、6、12、24、48 h加入10 μl CCK-8液,37 ℃继续孵育1 h,酶标仪450 nm测光密度(optical density, OD)值,计算抑制率,抑制率(%)=(1-实验组OD值/对照组OD值)×100%。
1.2.6EdU检测细胞增殖 细胞以2×104/孔接种于24孔板中,处理24 h;去除50%原培养基,加入等体积EdU工作液进行细胞标记;37 ℃继续孵育细胞2 h;4%多聚甲醛室温固定15 min,洗涤液洗3次;加入通透液室温孵育15 min,洗涤液洗2次;每孔加入100 μl的Click反应液,室温避光孵育30 min,洗涤液洗3次;每孔加入100 μl Hoechst 33342溶液,室温孵育10 min进行细胞核染色,荧光倒置显微镜进行荧光检测。Hoechst 33342为蓝色荧光,EdU染色为绿色荧光。
1.2.7血管形成实验检测细胞管腔形成能力 Matrigel提前4 ℃过夜,所需枪头、EP管及24孔板4 ℃过夜预冷。培养基和Matrigel配比2∶1配置实验用胶,96孔板内加入50 μl/孔实验用胶铺胶,培养箱中固化。细胞消化离心后依据分组选用相对应的培养基进行重悬,2×104/孔加入细胞悬液,37 ℃培养箱静置2 h后,观察血管形成情况,并于最佳时间点进行拍照。
1.3 统计学处理应用SPSS 19.0软件进行统计学分析,结果以均数±标准差表示,组间比较用单因素方差分析,两组间比较用独立样本t检验,各组实验均重复3次,P<0.05为差异有统计学意义。
2 结果
2.1 Rapa上调HUVECs自噬活性
2.1.1自噬蛋白表达上调 经过Rapa处理后,自噬蛋白相对蛋白表达高于对照组,自噬活性增强。LC3-II/LC3-I相对比值的蛋白表达在起始3 h时出现明显升高(P<0.001),随后蛋白表达强度减弱,但在作用的24 h时又明显增强(P<0.001)。Beclin1的相对蛋白表达均高于对照组,最高值出现在作用后的6 h(P<0.001),而ULK1的相对蛋白量同样呈现不断升高的趋势,最高值出现在作用后的24 h(P<0.001)。见图1。

图1 Western blot法检测 Rapa 分别处理HUVECs 3、6、12、24 h后自噬蛋白表达水平
2.1.2自噬小体形成 TEM检测观察自噬小体形成情况,结果显示,对照组和实验组均可见自噬小体及自噬溶酶体,自噬体融合变成单层膜结构的自噬溶酶体,其内可见已溶解的细胞器,见图2。
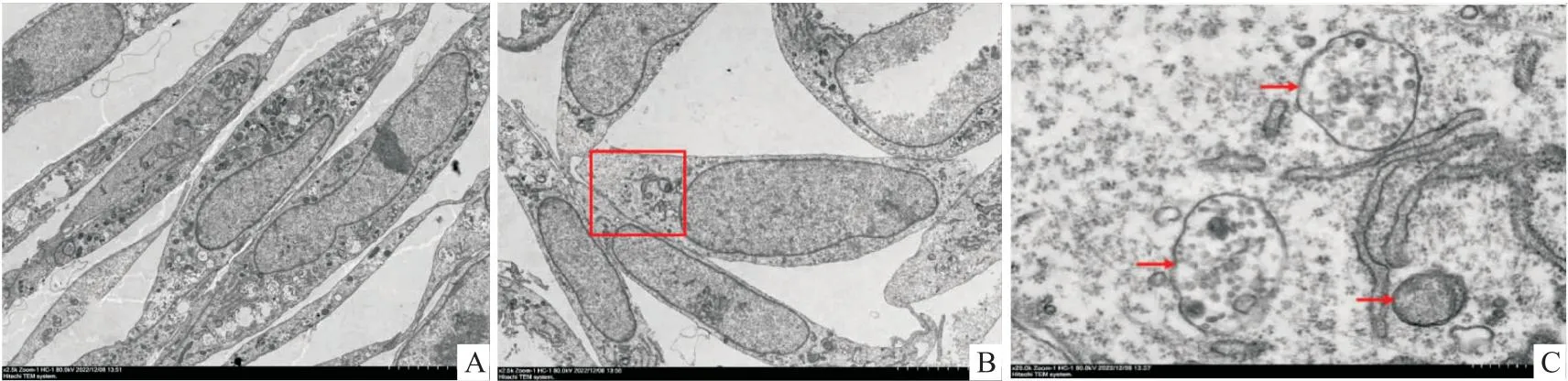
图2 TEM观察Rapa作用后自噬体形成
2.1.3自噬荧光表达增强 MDC法检测结果显示,经过Rapa处理的实验组,HUVECs的自噬荧光表达较强,荧光强度为 15.706±2.776,高于对照组的8.782±2.310(F=0.162,P=0.029),见图3。

图3 MDC法检测Rapa作用后自噬荧光表达 ×200
2.2 Rapa上调HUVECs自噬活性抑制细胞增殖
2.2.1HUVECs的增殖能力减弱 CCK-8法检测结果显示,随着细胞培养时间延长,OD值不断增加,在6 h前,实验组与对照组OD值的差值虽随着时长增大,但差异无统计学意义(P>0.05),见表1。与对照组相比,在处理24 h时细胞抑制率值最高,为(55.56±1.30)%(F=109.069,P=0.001)。见图4。
表1 Rapa处理HUVECs后OD450值

图4 CCK-8法检测Rapa作用后细胞增殖抑制率
2.2.2增殖细胞减少 EdU法检测结果显示,实验组可观察到EdU绿色荧光细胞数减少,平均每视野(9±1)个,明显低于对照组(21±3)个(F=1.160,P=0.001),见图5。
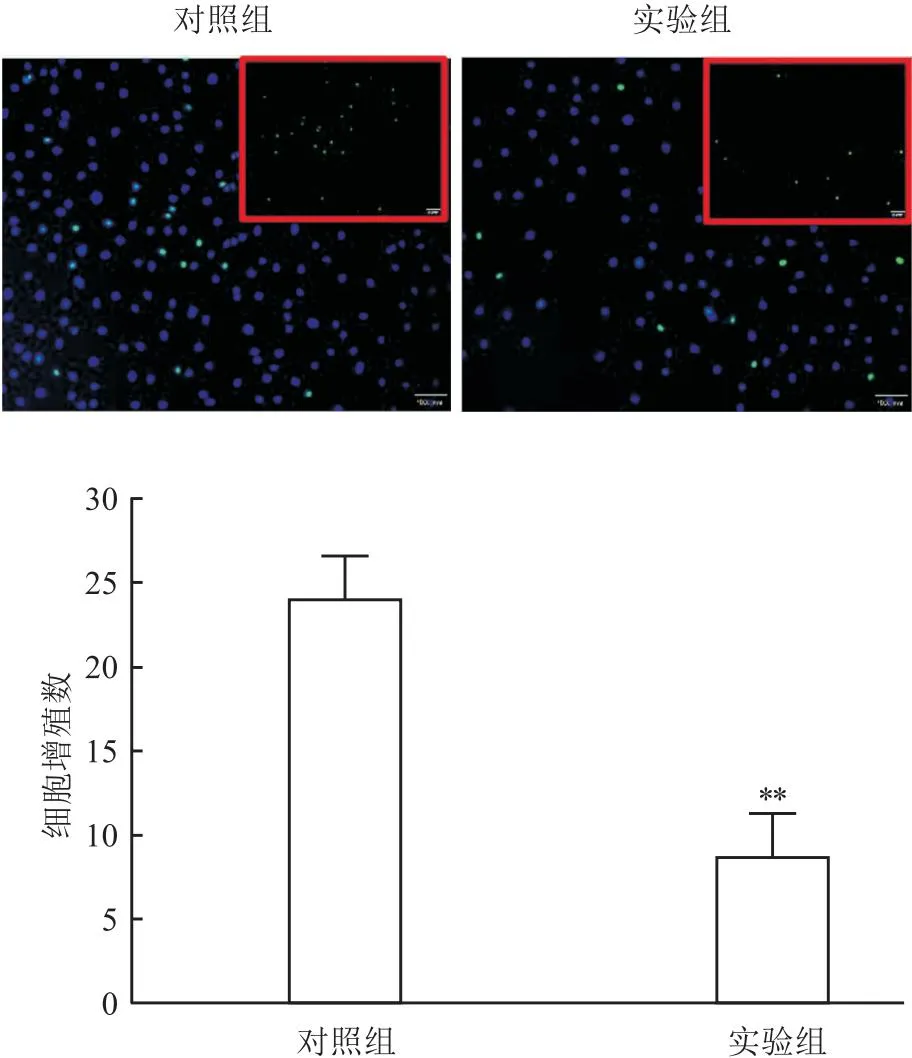
图5 EdU法检测自噬上调后细胞增殖水平 ×200
2.3 HUVECs管腔形成能力减弱与对照组相比,实验组未能很好地形成完整的管腔样结构,管腔壁连续性破坏,出现残缺、断裂等表现,细胞血管形成能力减弱,见图6。
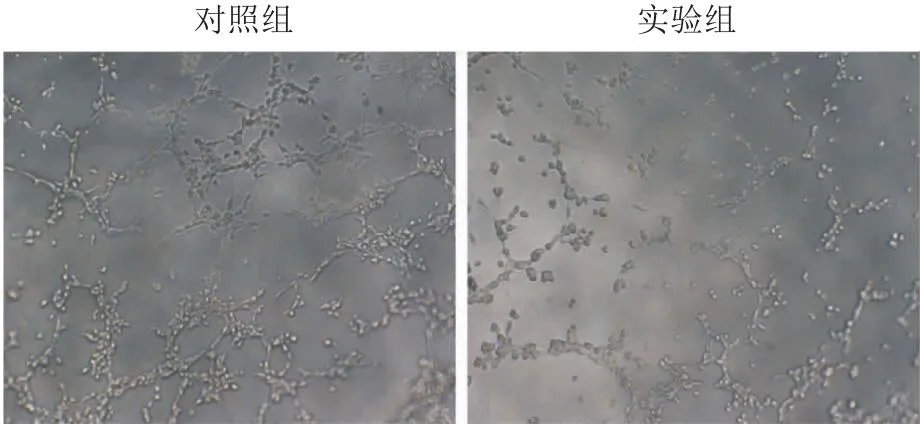
图6 血管形成实验检测自噬活性上调对HUVECs管腔形成的影响 ×100
3 讨论
局部新生微血管作为影响种植区域良好骨结合的重要因素,是促进种植成功的关键基础[10]。自噬是细胞生活的基础,自噬活性的改变引发一系列的细胞功能变化,而过度的自噬则会抑制细胞生长[11]。细胞自噬的过程受自噬相关基因所调控,目前发现的自噬相关基因约31个,Beclin1是首个被学者所熟悉的关键自噬启动基因,ULK1能促进Beclin1的磷酸化诱导自噬,而LC3是自噬体膜形成的关键蛋白[12]。因此,本研究通过Rapa诱导HUVECs构建自噬模型,探讨HUVECs自噬活性改变对细胞增殖的影响,为骨修复材料促血管化提供一定的理论依据。
mTOR是一种调节细胞生长的丝氨酸苏氨酸激酶,是细胞自噬活化的核心,mTOR信号通路是氧感受重要自噬信号通路,对细胞的生长、分化和增殖起着重要调控作用,Rapa通过降低mTOR的稳定性和转录活性,上调细胞自噬活性[13-15]。既往研究[13,16-22]表明,Rapa作为mTOR蛋白的抑制剂能有效降低mTOR的表达,mTOR作为许多疾病,如卵巢癌、乳腺癌、肝损伤、视网膜病变、阿尔茨海默病及心血管疾病潜在治疗靶点,在血管形成中起着重要的作用。ULK1是自噬启动的关键因子,通过磷酸化Beclin1参与自噬体膜的延伸,同时也是mTOR的负调控蛋白[23]。本研究中,经Rapa处理HUVECs后ULK1表达上调,细胞自噬启动,提示ULK1可能参与Rapa对HUVECs的自噬调控,但mTOR作为治疗的靶点及ULK1在其中的调控作用可能需要更多的研究证据。
细胞受到外界刺激后由Beclin1启动自噬反应,LC3由非脂质型的LC3-Ⅰ转变为脂质型LC3-Ⅱ参与构成自噬小体双层膜结构,进而包裹并溶解受损细胞器或衰老蛋白,释放能量维持细胞稳定[6,23]。本研究结果显示,与对照组相比,Beclin1和LC3-Ⅱ 的蛋白表达升高,提示自噬已被激活,即Rapa能上调HUVECs的自噬活性。同时,透射电镜和MDC自噬荧光检测的结果也显示,细胞胞质内可见自噬小体形成,自噬荧光表达增强,进一步证实Rapa能增强HUVECs自噬活性。这与其他学者关于Rapa能上调HUVECs的自噬活性的研究结果一致[20,24]。
自噬作为维持细胞内环境稳定的重要因素,其活性的改变对细胞功能产生的影响已成为研究的焦点。众多学者研究结果显示,自噬活性改变对细胞功能的调控受疾病种类、治疗方式以及种属差异所影响。本课题研究的结果初步显示,在一定的时间内,激活HUVECs 的自噬活性,细胞的增殖能力减弱,增殖受到抑制,同时细胞管腔形成能力降低。有研究提示,内皮细胞自噬活性对细胞增殖的调控具有双面性,处理的方式、作用时间都是可能的影响因素。上调HUVECs 自噬活性能增强过氧化氢处理后细胞的增殖能力,而敲低GRB2关联结合蛋白1(Grb2-associated binder1,GAB1)表达同样如此[25-26],但缺血环境下,自噬活性的改变则对细胞增殖起反作用[27]。而在本研究中,Rapa作用48 h后,细胞的抑制率下调,其中的原因仍需要深入研究。
自噬是细胞选择性降解过程,能消除异常积累的蛋白质和受损细胞器,增加细胞在低氧环境存活概率[28]。骨重建中新生血管生成是促进新骨形成的重要因素,自噬在种植骨结合过程中对新生血管及新生骨形成的调控,以及两者之间的关系目前仍不清楚。本研究结果提示,上调HUVECs自噬活性能抑制细胞增殖,在此基础上,仍需继续探讨在骨组织工程中自噬活性介导血管内皮细胞增殖可能的分子机制,为骨生物材料血管化研究提供新的理论依据。
