T细胞条件性敲除Spi1基因小鼠的繁育及鉴定
2024-05-10王卉卉朱向玲吴旭铭张慧茹周园园王安琪涂佳杰
王卉卉,朱向玲,吴旭铭,张慧茹,周园园,王安琪,刘 崇,涂佳杰
PU.1作为E26 transformation-specific(ETS)转录因子家族的成员之一,由Spi1基因编码,重要的功能区域包括羧基端高度保守的DNA结合区,也就是ETS结构域,可以识别拥有GGA(A/T)序列的DNA结合位点[1]。PU.1主要在造血细胞中表达,能够调控多种免疫细胞的分化和功能,从而影响一些自身免疫性疾病的病程,比如类风湿关节炎(rheumatoid arthritis,RA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)和实验性自身免疫性脑脊髓炎(experimental autoimmune encephakmyelitis, EAE)等[2]。课题组前期研究[3]已证实,PU.1可以通过直接靶向巨噬细胞和成纤维样滑膜细胞中的FMS样酪氨酸激酶3(FMS-like tyrosine kinase, FLT3)来促进类风湿关节炎的发展。同时,许多研究也表明PU.1在T细胞的发育及相关疾病中也发挥了重要作用,PU.1对于T细胞的调控有望在未来成为RA新的药物靶点[4]。因此该研究利用Cre/LoxP系统和CRISPR/Cas9 技术,构建出T细胞条件性敲除Spi1基因的小鼠,并对其进行繁育及基因型鉴定,为进一步探索PU.1在T细胞相关疾病中的具体作用和潜在机制提供可靠的模型。
1 材料与方法
1.1 实验动物所有小鼠的遗传背景均为C57BL/6,由赛业(苏州)生物科技有限公司提供,生产许可证号:SCXK(苏)2018-0003。实验动物均饲养于SPF级动物房,并且所有实验均通过了安徽医科大学临床药理研究所动物实验伦理委员会批准,批准号为PZ-2022-024。
1.2 主要试剂核酸染料、100bp Ladder DNA Marker和2×HotStrat Taq PCR Master Mix(北京博迈德基因技术有限公司);Agarose(德国BioFroxx公司);淋巴细胞分离液(北京达科为生物科技有限公司);CD4 MicroBeads mouse(德国Miltenyi Biotec公司);山羊抗鼠IgG(美国Proteintech公司);TRIzol、固定/破膜液(美国Thermo Fisher Scientific公司);BCA试剂盒、qPCR试剂(南京诺唯赞生物科技有限公司);PU.1抗体(美国GeneTex公司,货号:GTX17997);PE抗PU.1流式抗体(美国BioLegend公司,货号:681307)。
1.3 主要仪器荧光定量PCR仪(上海伯乐生命医学产品有限公司);通用型电泳仪DYY-7C型(北京六一生物科技有限公司);Tanon-1600全自动数码凝胶图像分析系统、Tanon-5200成像系统(上海天能科技有限公司);QuantStudio 3实时荧光定量PCR仪(美国Thermo Fisher Scientific公司);Cytoflex十色流式细胞仪(美国Bectman Coulter公司)。
1.4 方法
1.4.1T细胞Spi1条件性敲除小鼠的建立与繁育 利用CRISPR/Cas9系统中的Cas9酶识别gRNA切割Spi1基因第2外显子的两侧,随后将两个LoxP分别置于切割位点,在淋巴细胞蛋白酪氨酸激酶(lymphocyte-specific protein-tyrosine kinase,Lck)启动子的控制下表达Cre,使用Cre重组酶特异性地切除T细胞中被LoxP位点标记的序列,构建策略示意图见图1。将Lck-Cre小鼠与Spi1flox/flox小鼠杂交获得Lck-Cre×Spi1flox/+基因型的F1代杂合子小鼠,再将F1代小鼠进行交配,筛选后得到Lck-Cre×Spi1flox/flox基因型的小鼠。
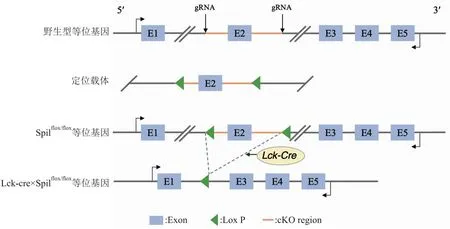
图1 Lck-Cre×Spi1flox/flox小鼠的构建策略示意图
1.4.2小鼠的基因型鉴定
1.4.2.1 小鼠尾部DNA的提取 小鼠3周龄时,剪取3 mm左右的鼠尾,向EP管中加入50 μl A液(50 μl 5 mol/L氢氧化钠与4 μl 0.5 mol/L pH 8.0 EDTA溶于10 ml ddH2O所得),使鼠尾沉至管底,置于95 ℃电热恒温水箱中进行裂解,30 min后取出加入50 μl B液(400 μl 1 mol/L pH 8.0 Tris-HCl溶于10 ml ddH2O所得),于涡旋震荡器上震荡并充分
混匀,以3 000 r/min的速度离心5 min,取上清液作为DNA模板。
1.4.2.2 PCR扩增反应及琼脂糖凝胶电泳 首先分别进行两次PCR扩增反应。小鼠Spi1flox/flox基因型的PCR引物为flox×F和flox×R,Lck-Cre基因型的引物为 Primer-1和Primer-2,具体引物序列见表1。PCR反应体系为:总体积25 μl;ddH2O 9 μl,2×HotStrat Taq PCR Master Mix 12.5 μl,正反向引物均为1 μl,DNA 1.5 μl。PCR扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火35 s,72 ℃延伸35 s,35个循环;72 ℃ 5 min终止反应。其次取10 μl PCR扩增产物进行琼脂糖凝胶电泳,120 V电泳30 min,用全自动数码凝胶图像系统分析成像并保存。
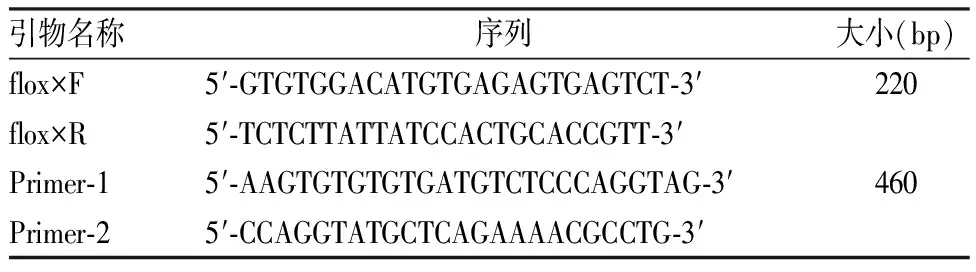
表1 PCR扩增反应引物序列
1.4.3磁珠分选小鼠脾脏CD4+T细胞 将小鼠颈椎脱臼处死后,分离脾脏,用PBS清洗2次后包裹于200目细胞筛网中,加入4 ml淋巴细胞分离液,将脾脏充分碾碎,收集组织悬液,在液面上添加1ml RPMI 1640 培养基,2 200 r/min离心30 min,收集中间薄膜层于新的15 ml离心管中,用PBS洗涤1次。加入80 μl PBS和20 μl CD4+T细胞磁珠,4 ℃孵育15 min。添加PBS洗涤1次后,用1 ml PBS重悬,加到已安装在磁分选器上的分选柱中,待液体自然流尽后,再用PBS洗脱1次,最后取下分选柱,冲出CD4+T细胞。
1.4.4Western blot检测小鼠PU.1表达水平 提取脾脏CD4+T细胞总蛋白,应用BCA法进行定量后,按一定比例加入上样缓冲液,100 ℃恒温煮沸10 min使其变性。采用10% SDS-PAGE电泳后,转移至PVDF膜,快速封闭液室温封闭15 min,加入PU.1一抗(1 ∶1 000),37 ℃孵育1 h,TBST洗3次,6 min/次,加入山羊抗鼠IgG(1 ∶10 000),室温孵育2 h,TPBS洗3次,6 min/次,PBS洗3 min,化学发光成像分析仪进行曝光拍照并保存。Image J软件分析目的条带灰度值。
1.4.5qPCR检测小鼠Spi1表达水平 应用TRIzol法抽提脾脏CD4+T细胞的RNA,将其定量后进行逆转录,得到的cDNA再进行实时荧光定量PCR。逆转录扩增程序为:50 ℃ 15 min;85℃ 5 s;4℃ ∞。设计Spi1基因的qPCR引物为Left Primer: ACTTCACAGAGCTGCAGAGT;Right Primer:TCACCCTCCTCCTCATCTGA;内参GAPDH基因的引物为Left Primer:CAAGGTCATCCATGACAACTTTG;Right Pri-mer:GTCCACCACCCTGTTGCTGTAG。qPCR反应体系为:2×AceQ qPCR SYBP Green Master Mix 10 μl,50×ROX Reference Dye 2 0.4 μl,正反向引物均为0.4 μl,cDNA 2 μl,ddH2O补至20 μl。qPCR反应条件为:95 ℃预变性5 min;95 ℃ 10 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
1.4.6流式细胞术检测小鼠PU.1表达水平 对脾脏CD4+T细胞进行细胞计数和固定破膜后,分成Blank组、Spi1flox/flox及Lck-Cre×Spi1flox/flox组,Blank组适量PBS重悬后直接用十色流式细胞仪进行分析,其余两组用100 μl PBS重悬,加入PU.1抗体(0.125 μg/106个细胞),4 ℃孵育30 min。离心弃上清液,适量PBS重悬后,上机分析最终样品细胞。
2 结果
2.1 T细胞Spi1条件性敲除小鼠的鉴定T细胞Spi1条件性敲除小鼠的基因型鉴定结果见图2A、2B,可见编号1、2、3号在flox扩增产物220 bp处有阳性条带,Cre扩增产物460 bp处没有条带,为Spi1flox/flox基因型小鼠;编号4、5、6号在flox扩增产物220 bp处有阳性条带,Cre扩增产物460 bp处有阳性条带,为Lck-Cre×Spi1flox/flox基因型小鼠。以上结果说明初步构建出了T细胞条件性敲除Spi1基因的小鼠。

图2 Lck-Cre×Spi1flox/flox小鼠的构建及基因鉴定结果
2.2 T细胞Spi1条件性敲除小鼠的表型验证Western blot、qPCR及流式细胞术检测发现Lck-Cre×Spi1flox/flox小鼠脾脏CD4+T细胞的Spi1表达水平与Spi1flox/flox小鼠相比显著降低,分析结果见图3A-3C。此结果验证了条件性敲除小鼠T细胞中的Spi1已被成功敲除。

图3 Lck-Cre×Spi1flox/flox小鼠的表型验证结果
3 讨论
CRISPR是原核生物基因组内的一段重复序列,CRISPR相关蛋白Cas9是一种内切酶,CRISPR/Cas9技术就是通过利用单链向导RNA(small guide RNA,sgRNA)介导Cas9与DNA靶序列形成碱基对,对靶位点进行切割,进而造成DNA位点特异性的双链断裂,以此达到对一个或者多个等位基因进行可遗传性修饰的目的。目前,这项技术在一系列基因治疗和生物技术等多个应用领域上都展现出了极大的应用前景[5]。随着基因敲除技术的广泛应用,基于Cre/LoxP系统的条件性敲除小鼠模型得到了越来越多的关注。Cre/LoxP系统的构建策略是由带有LoxP序列的基因突变小鼠和带有Cre重组酶基因的转基因小鼠杂交并筛选,得到特异性地删除目的片段的小鼠[6]。LoxP位点是由1个非回文核和2个反向重复序列组成,Cre是一种可以使2个LoxP位点之间发生特异性DNA重组的酶,Cre-LoxP 系统具有很高的组织及空间特异性,能够准确地控制目的基因在何时何地表达[7-8]。CRISPR/Cas9技术与Cre-LoxP系统的结合具有容易操作、精确靶向等多种优点[9],是基因研究领域的重要实验工具。
根据NCBI数据库提供的参考序列,Spi1基因位于小鼠的2号染色体上,其中共有5个外显子,本模型选择外显子2作为条件性基因敲除(conditional knockout,CKO)区域,CKO的有效区域大小为597 bp,且这段区域并没有任何其他已知基因。为了进一步研究PU.1对T细胞的调控在类风湿关节炎疾病中所起到的作用,以及避免PU.1全身性敲除可能导致胚胎致死的问题[10],采用CRISPR/Cas9介导的基因组工程技术以及Cre/LoxP重组系统,将Cas9 mRNA、CKO片段的gRNA和含有loxP位点的靶向载体共同注射到受精卵中,Cas9通过识别gRNA先导链切割CKO片段的两侧,随后将两个loxP分别放置于切割位点,经过数代杂交并筛选后得到基因型为Spi1flox/flox的小鼠。在与Lck-Cre小鼠交配后,Cre重组酶会切割loxP位点,即实现特异性地删除CKO区域,从而建立起T细胞Spi1基因条件性敲除的小鼠模型,同时依据PCR扩增反应和琼脂糖凝胶电泳法确保小鼠的基因型背景符合预期,利用qPCR和Western blot及流式细胞术检测小鼠的Spi1表达水平及敲除效果,证实了PU.1特异性缺陷的小鼠模型建立成功。
既往研究[4]表明,PU.1对T细胞的前期增殖和后期分化有着重要作用。在自身免疫性疾病中,PU.1对于T细胞的调控也扮演着重要角色。例如,在SLE中,PU.1与T细胞的过度激活有关;在EAE中,PU.1能够作用于T细胞来促进疾病的进展[2]。然而,RA中PU.1对于T细胞的调控机制有待进一步研究。因此,借助CRISPR/Cas9技术结合Cre/LoxP系统,成功构建出T细胞中Spi1基因特异性敲除小鼠,有利于在整体动物水平上研究PU.1在T细胞相关癌症及自身免疫性疾病中调控T细胞的具体作用机制,并为相关药物靶点的研发提供理论基础和实验基础。
