促结缔组织增生性小圆细胞肿瘤18F-FDG PET/CT 显像1 例
2024-05-07王琳玮姚伟根汪建华
王琳玮 姚伟根 汪建华
促结缔组织增生性小圆细胞肿瘤(desmoplastic small round cell tumor,DSRCT)是一种极少见的侵袭性软组织恶性肿瘤,1989 年Gerald 和Rosai 首次报道本病[1]。有研究在细胞遗传学研究中发现t(11;22)(p13;q12)染色体易位会产生融合性基因EWSR1-WT1[2-3],它是DSRCT 发生的驱动因素,可导致细胞增殖、结缔组织发育、新血管生成[4]。腹膜是该病典型的原发部位,但该病发病率低,国内外文献报道多为个案分析。本文报道盆腔DSRCT 伴肝脏及淋巴结转移患者1 例,结合相关文献分析该患者18氟-氟代脱氧葡萄糖(18F-flurodeoxyglucose,18F-FDG)正电子发射体层成像(positron emission tomography,PET)/CT 影像,为临床诊治该病提供参考。
患者男,20 岁。因“无明显诱因下腹部持续性隐痛胀痛1 d”于2023 年7 月5 日收治于宁波大学附属第一医院胃肠外科。入院查体:腹部膨隆,下腹轻压不适,可触及饱满感,未触及明显肿块,无反跳痛;肝脾肋下未触及;移动性浊音阴性;肝浊音界正常;肝脾肾区无叩痛,肠鸣音正常。实验室检查:血常规、肝功能正常,肿瘤标志物糖类抗原-125(cancer antigen 125,CA125)26.1 ng/mL(参考值0~24 ng/mL)。腹部增强CT、肠系膜上动脉计算机断层扫描血管造影(computer tomography angiography,CTA)检查结果提示盆腔混杂密度肿块影,增强呈中度不均匀强化(图1),病灶周围较丰富迂曲血管影。盆腔增强MRI 检查结果提示病灶主体位于直肠膀胱间隙,呈T1WI等、低信号,T2WI 高信号,弥散加权成像(diffusion weighted image,DWI)(b 值为1 000 s/mm2)高信号,较大层面范围约66 mm×60 mm×57 mm,增强示病灶与直肠分界欠清(图2)。18F-FDG PET/CT 检查结果提示直肠膀胱间隙巨大类圆形混杂低密度肿块呈环状FDG 浓聚,最大标准化摄取值(maximum standard uptake value, SUVmax)为9.36。肝脏边缘(肝Ⅵ、Ⅶ段水平)及左上腹腹膜多发大小不等结节状FDG 浓聚,SUVmax较高处为11.15。腹膜后、左侧骼总及髂内动脉、右侧骼内及骼外动脉周围多枚肿大淋巴结,表现为局灶性高代谢,SUVmax较高处为6.17(图3,插页)。考虑直肠系膜来源恶性肿瘤可能。本病例报告经宁波大学附属第一医院医学伦理委员会审查通过(批准文号:2023 研第135RS 号)。
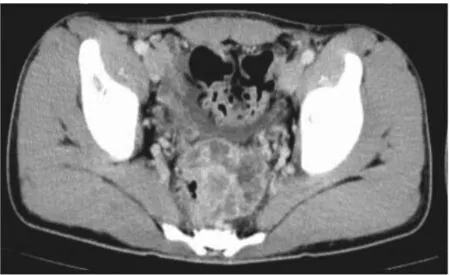
图1 直肠膀胱间隙占位增强CT图像(病灶呈不均匀中度强化,内部可见坏死区)
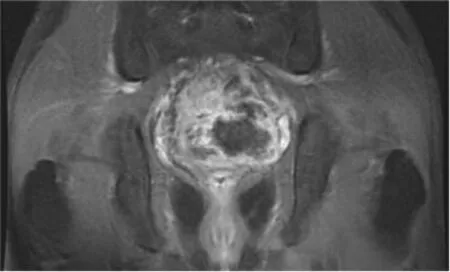
图2 增强MRI 冠状位图像(病灶与直肠分界不清)
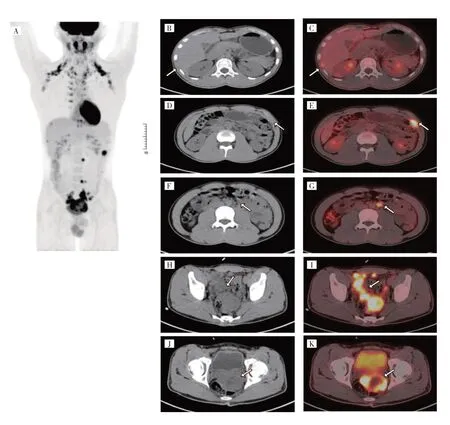
图3 患者18F-FDG PET/CT 显像图[A:MIP 图见全身多处FDG 浓聚影;B-G:肝边缘、左上腹腹膜及腹膜后多枚结节状FDG 高摄取(箭头所示);H-K:示直肠膀胱间隙混杂低密度肿块呈环形FDG 高摄取(箭头所示)]
2023 年7 月7 日,患者经超声内镜行穿刺活检,病理检查提示:HE 染色光镜下见瘤组织呈巢状弥漫浸润生长,有大量增生的纤维结缔组织分隔,肿瘤细胞体积较小,形态较一致,胞质稀少,核呈圆形或卵圆形,深染,核分裂象易见,见图4(插页)。免疫组化:CK(pan)(+);Desmin(+);EMA(局灶+);CD34(血管+);Vimentin(+);Wilms Tumor(弱+);SMA(肌+);Ki-67(30%阳性)。荧光原位杂交技术(fluorescence in situ hybridization,FISH)提示EWSR1-WT1(阳性)。结合病理、免疫组化、基因学检查、临床及影像学检查,考虑为DSRCT。

图4 DSRCT 肿瘤组织病理图(A、B:成堆肿瘤细胞伴坏死,分化较差;C:疏松纤维结缔组织分隔小圆细胞巢)
2023 年7 月20 日患者行姑息一线化疗,具体方案为:长春新碱2 mg、d1(1.5 mg/m2),表柔比星60 mg/m2、d1~2,环磷酰胺1.0 g/m2、d1~2(1.5 g/m2),每3周为1 个周期;截至2024 年1 月10 日,患者已行7 个周期化疗。患者主体病灶较前缩小约50 mm,但肝边缘、左上腹腹膜病变及肿大淋巴结仍存在,因此患者仍需维持化疗,等待手术时机。
讨论DSRCT 属于罕见疾病,平均发病年龄为22 岁,确诊患者中男性较多,但在年龄<20 岁的患者中,女性比例较高[5]。DSRCT 影像学检查缺乏典型特征,本例患者CT、MRI 及PET/CT 检查均未提供较为可靠的诊断依据,最终确诊需要临床、影像学及病理检查结果相结合。本病易被误诊,无论是发生在腹膜还是睾丸、筛窦、下颌下腺等少见部位[5-9],其临床表现均无特异性。DSRCT 患者的CA125 水平可升高,但该指标仅具有提示作用缺乏特异性,不能作为确诊的依据。DSRCT 主要起源于间皮细胞,镜下表现为纤维组织分隔将小圆形肿瘤细胞分隔成大小不一的巢状结构,不同区域肿瘤和间质的比例不同。发现EWSR1-WT1 融合基因是目前确诊DSRCT 的重要依据。DSRCT 患者需要接受综合治疗,包括手术切除、放化疗及靶向治疗等[10-11]。DSRCT 进展迅速,早期即可发生肝脏及淋巴结转移,该病的生存分析尚未在以人群为基础的研究中展开调查,根据多篇文献报道,患者的5 年生存率较低,约为20%~25%[12-16]。
18F-FDG PET/CT 在本病的应用研究已经开展。从影像学角度看,在目前的研究中,确诊为DSRCT 的患者SUVmax范围为3.70~24.66[17-18],范围跨度较大,其中代谢较活跃1 例患者为Du 等[18]报道的胫骨原发性DSRCT,病灶局限,未出现转移,镜下小圆肿瘤细胞呈弥漫性分布,纤维结缔组织成分较少,这种比例可能是病灶代谢活跃的原因。从临床角度看,18F-FDG PET/CT 既能较为全面的显示DSRCT 病变范围,又能显示肿瘤的生存能力和代谢活动,因此可被用来识别原发肿瘤及转移[19],有无转移对治疗方式的选择较为重要。虽然临床上没有广受认可的DSRCT 分期系统及治疗规范,但有报道已证明对于没有发生转移的患者,尽可能的完全切除病灶对延长患者的生存期有益[20],但完全切除存在技术挑战及术后并发症的风险。本例患者18F-FDG PET/CT 显示肝脏及淋巴结均有转移,这也导致患者首诊时不能进行手术治疗。此外18F-FDG PET/CT 监测术后肿瘤复发及化疗药物治疗反应更有优势。有研究指出,相较病变范围,SUVmax的变化更能反映患者的治疗效果[21]。
根据病变的部位及类型,DSRCT 需与以下疾病进行鉴别。(1)转移瘤:本例最初考虑直肠来源,虽然直肠癌腹膜转移者相对少见,但有文献报道高达25%的患者可发生腹膜转移[22]。18F-FDG PET/CT 虽然不作为直肠癌的常规检查,但其不仅可以明确原发灶,在显示转移灶方面有更高的灵敏度。(2)淋巴瘤:表现为无痛性淋巴结肿大,全身各组织器官均可受累。首先,18F-FDG PET/CT 显示淋巴瘤代谢高摄取处多位于腹膜后及肠系膜根部等处,大网膜及肠系膜远端少见,而DSRCT 主要分布于网膜、系膜及实质脏器包膜面;其次,淋巴瘤典型者表现为“血管漂浮征”,病灶常包绕大血管而血管管腔无明显受侵;此外,淋巴瘤间质很少出现坏死及纤维化,在18F-FDG PET/CT 高摄取处出现代谢减低区相对少见。(3)骨外尤文氏肉瘤:表现为腹膜后、颈背区等较深部位的软组织肿块,临床表现不典型,进展迅速,易发生转移。病灶多为单发,边界较清,易发生肺转移,这有助于两者鉴别。此外,CD99 表达及EWS/FLI1 融合基因有助于诊断。然而应用18F-FDG PET/CT 对两者进行鉴别仍有困难[23]。(4)结核性腹膜炎:结核性腹膜炎以混合型较为多见,表现为腹膜均匀增厚或小结节病灶为主,病灶边缘较为光滑。既往研究显示腹膜结核与腹膜恶性肿瘤SUVmax无明显差异,因此还应综合参考病史及其他临床检查来鉴别本病[24]。
综上所述,DSRCT 是一种罕见、病变范围较广、高侵袭性、预后差的恶性肿瘤,好发于青年男性,多见于腹膜,临床症状、实验室检查及影像学表现均缺乏特异性,难与其他软组织肿瘤鉴别,应加强对该病的认识。PET/CT 作为一站式全身性检查,既可与其他检查方式互补检查隐匿病灶,又可帮助选择最佳部位穿刺活检,还可以帮助临床医师确定治疗方案,不仅可以提高诊断本病的准确性,还对患者长期随访有益。但由于DSRCT 缺乏大样本量的随机对照研究,目前PET/CT 对疾病诊断的价值未被完全发掘,仍需进一步探索其应用价值。
