脾硬度及血小板计数联合脾脏大小在肝硬化食管胃底静脉曲张诊断中的应用
2024-05-07王硕王建红张迪吴晓冬杨子祯蔡金贞
王硕 王建红 张迪 吴晓冬 杨子祯 蔡金贞

[收稿日期]2022-12-05; [修訂日期]2023-12-01
[基金项目]青岛大学附属医院青年科研基金(QYFY-2021-36)
[第一作者]王硕(1987-),女,硕士研究生,主治医师。E-mail:mywangshuo001@163.com。
[通信作者]王建红(1978-),女,博士,主任医师,硕士生导师。E-mail:ningtai@sina.com。
[摘要] 目的
探讨脾硬度(SSM)、血小板计数(PLT)联合脾脏大小对肝硬化食管胃底静脉曲张(GOV)的诊断价值。
方法 选取109例在我院就诊的乙型肝炎肝硬化病人,超声测量其脾脏厚径(ST)和脾脏长径(SD),应用瞬时弹性扫描仪测量其SSM,并进行血清学检测及胃镜检查。以胃镜检查结果为标准,采用Logistic回归分析乙型肝炎肝硬化中-重度GOV与SSM、PLT/SD、PLT/ST的关系,建立回归模型。
结果 有、无GOV组SSM、PLT/ST、PLT/SD比较差异有统计学意义(Z=3.03~5.53,P<0.05)。建立判断中-重度GOV的回归模型Logit(P)=-6.373+0.298×SSM-0.443×PLT/ST。SSM、PLT/ST、PLT/SD及回归模型诊断中-重度GOV的受试者工作特征曲线下面积分别为0.94、0.79、0.77、0.95。
结论 SSM、PLT/ST、PLT/SD对肝硬化是否存在GOV有一定的诊断价值,且SSM诊断中度以上GOV的价值比PLT/ST和PLT/SD更高;SSM及PLT联合脾脏大小建立的无创诊断模型也可用于诊断中-重度GOV。
[关键词] 肝硬化;食管和胃静脉曲张;脾;超声检查;弹性成像技术;血小板计数;诊断
[中图分类号] R575.2;R571.3
[文献标志码] A
[文章编号] 2096-5532(2024)01-0124-05
doi:10.11712/jms.2096-5532.2024.60.013
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://link.cnki.net/urlid/37.1517.R.20240306.1552.001;2024-03-09 16:07:01
Application of spleen stiffness and platelet count plus spleen size in the diagnosis of gastroesophageal varices in liver cirrhosis
\ WANG Shuo, WANG Jianhong, ZHANG Di, WU Xiaodong, YANG Zizhen, CAI Jinzhen
\ (Center of Organ Transplantation of The Affiliated Hospital of Qingdao University, Qingdao 26603, China)
\; [Abstract]\ Objective\ To investigate the value of spleen stiffness measurement (SSM) and platelet count (PLT) combined with spleen size for the diagnosis of gastroesophageal varices (GOV) in patients with liver cirrhosis.
\ Methods\ We included 109 patients with hepatitis B cirrhosis admitted to our hospital. They underwent ultrasonography for spleen thickness (ST) and spleen diameter (SD) and transient elastography for SSM as well as serological examination and gastroscopy. A Logistic regression analysis was performed to analyze the relationship between moderate-to-severe GOV and SSM, PLT/SD, and PLT/ST in patients with hepatitis B cirrhosis.
\ Results\ There were significant differences in SSM, PLT/ST, and PLT/SD between the patients with GOV and those without GOV (Z=3.03-5.53,P<0.05). The regression model for determining moderate-to-severe GOV was as following: Logit (P)=-6.373+0.298×SSM-0.443×PLT/ST. The areas under the receiver operating characteristic curves of SSM, PLT/ST, PLT/SD, and the regression model for diagnosing moderate-to-severe GOV were 0.94, 0.79, 0.77, and 0.95, respectively.
\ Conclusion\ SSM, PLT/ST, and PLT/SD have certain value for determining the presence or absence of GOV in liver cirrhosis, and SSM is superior to PLT/ST and PLT/SD in predicting moderate-to-severe GOV. The model combining SSM, PLT, spleen size can be an invasive alternative for the diagnosis of moderate-to-severe GOV.
[Key words]\ liver cirrhosis; esophageal and gastric varices; spleen; ultrasonography; elasticity imaging techniques; platelet count; diagnosis
基于肝脏瞬时弹性成像技术(TE)的FibroScan作为一种无创检查,目前已广泛用于肝脏脂肪变、纤维化及早期肝硬化诊断[1]。已有相关研究证实,肝脏硬度值(LSM)可应用于评估肝硬化导致的门静脉高压(PH)及食管胃底静脉曲张(GOV),但不同研究由于研究对象、研究方式、应用器械的不同,结果有一定的区别[2-7]。同时,LSM容易受到病人自身因素的影响,如肥胖、饮食、肝脏炎症、腹腔积液等,造成硬度值偏高,出现假阳性。脾脏位置相对表浅,且脾静脉与门静脉相延续,脾脏的解剖特点和微循环特征也决定了其大小及硬度与PH、GOV有一定的相关性。既往有研究表明,血小板计数(PLT)
与脾脏大小诊断GOV有一定的临床价值[8-10]。但上述研究中脾脏大小往往只选取脾脏厚径(ST)或脾脏长径(SD)之一来进行讨论,未能阐明二者在预估GOV中有无区别。本研究选择乙型肝炎肝硬化病人作为研究对象,通过胃镜检查证实有无GOV,评估比较脾硬度(SSM)、PLT/ST、PLT/SD在不同GOV程度下是否存在差异,并应用上述无创参数构建诊断模型,探讨SSM、PLT/ST、PLT/SD和诊断模型预测中度以上GOV的临床价值。现将结果报告如下。
1 资料与方法
1.1 研究对象
选取2020年6月—2022年5月于我院就诊的乙型肝炎肝硬化病人109例,其中男性病人71例,女性病人38例,年龄为55(50,64)岁。纳入标准:①符合《慢性乙型肝炎防治指南(2015更新版)》[11]的诊断标准;②年龄大于18岁;③FibroScan测量LSM>17 kPa。排除标准[1]:①乙型肝炎以外的其他病毒性肝炎、酒精性及非酒精性脂肪肝、自身免疫性肝病和遗传代谢性肝病病人;②脾脏内存在较大占位性病变;③病人近1周内使用过影响机体凝血机制与血小板水平的药物,近1周内进行过血液透析、腹膜透析或输血等;④用TE多次测量SSM不成功或脾脏切除术后。
1.2 生化指标检测
所有研究對象均采集全血进行血常规、生化检测。血常规使用帝迈8600全自动血细胞分析仪进行检测。血清学检查时间与超声测量脾脏大小、硬度及胃镜检查时间不超过1周。
1.3 常规超声检查和FibroScan测量
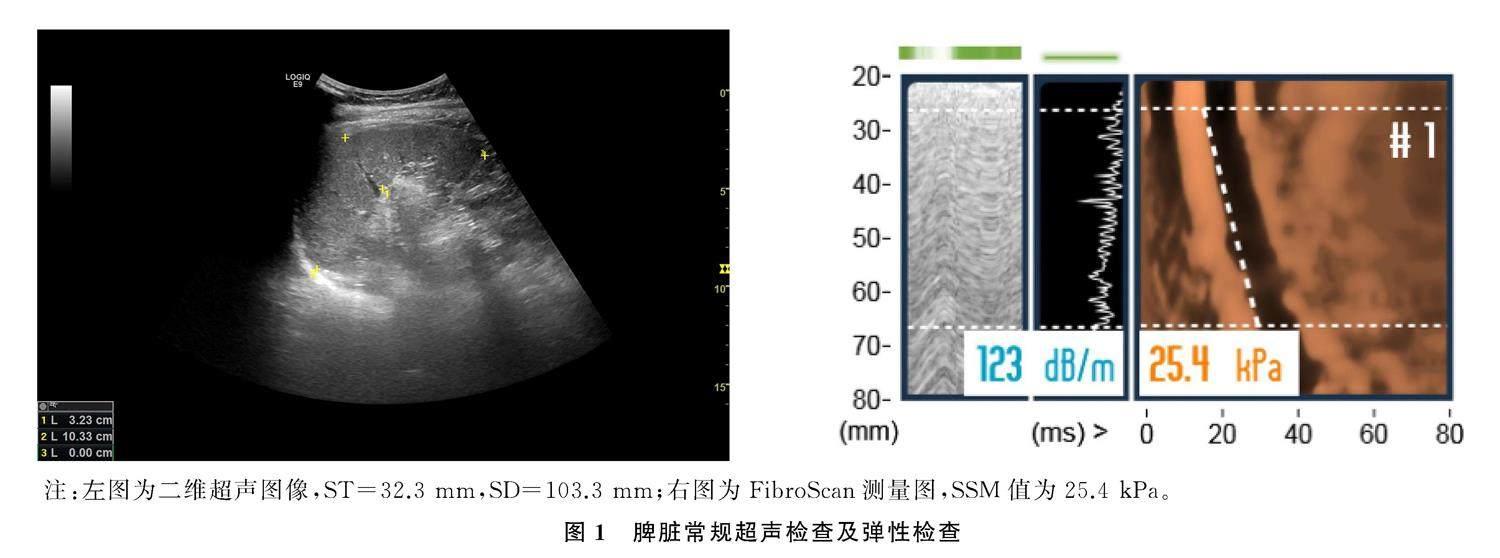
应用LOGIQ E9超声诊断仪、腹部凸阵探头C1-6进行脾脏常规超声检查。研究对象处于空腹状态,右侧卧位,左臂置于头部;将凸阵探头置于左肋间斜切面,嘱病人吸气,二维图像能清晰显示脾脏时,嘱病人屏住呼吸,冻结图像,测量ST和SD。ST为脾门到脾对侧缘弧线的垂直距离(mm),SD为脾脏上极最高点至脾脏下极最低点的距离(mm)。应用装备M探头和XL探头的FibroScan 502 touch进行FibroScan测量。研究对象取右侧卧位,将左臂置于头部并充分暴露肋间隙;选取腋中线至腋后线第9~11肋间,同部位行10次检测,取检测成功的10次检测值的中位数作为最终检测结果,用弹性值(kPa)表示。偏差值大于中位数值的30%及成功率小于60%视为检测无效。脾脏常规超声检查及弹性检查均由接受过专业培训的同一位主治医师完成。见图1。
1.4 胃镜检查
应用Olympus CV-260SL胃镜,由经验丰富的、接受过培训的两名专科主治医师完成检查。按照《肝硬化门静脉高压食管胃静脉曲张出血的防治共识》对研究对象进行分级。以胃镜检查无静脉曲张为G0级,胃镜检查轻度、中度、重度静脉曲张分别为G1、G2和G3级。
1.5 统计学处理
采用SPSS 25.0统计学软件进行数据处理。符合正态分布的计量资料数据以±s表示,组间比较采用t检验;不符合正态分布的计量资料数据以M(P25,P75)表示,组间比较采用秩和检验。将单因素Logistic回归分析差异有显著性的变量纳入二元Logistic回归(向后有条件)分析构建诊断模型。以胃镜诊断中度以上GOV为标准,绘制各参数的受试者工作特征(ROC)曲线,并选取最佳截断值,计算最佳截断值下的诊断灵敏度和特异度,应用De-long检验比较几种无创性检查指标曲线下面积(AUC)的差异。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组一般资料指标比较
本文109例乙型肝炎肝硬化病人,胃镜诊断为G0级19例,G1级31例,G2级32例和G3级27例。将病人分为无GOV组(G0级)和有GOV组(G1~G3级),两组的清蛋白、凝血酶原时间、PLT、ST、SD、脾静脉内径、SSM、PLT/ST、PLT/SD比较,差异有统计学意义(Z=2.25~5.53,t=3.97、2.90,P<0.05)。见表1。
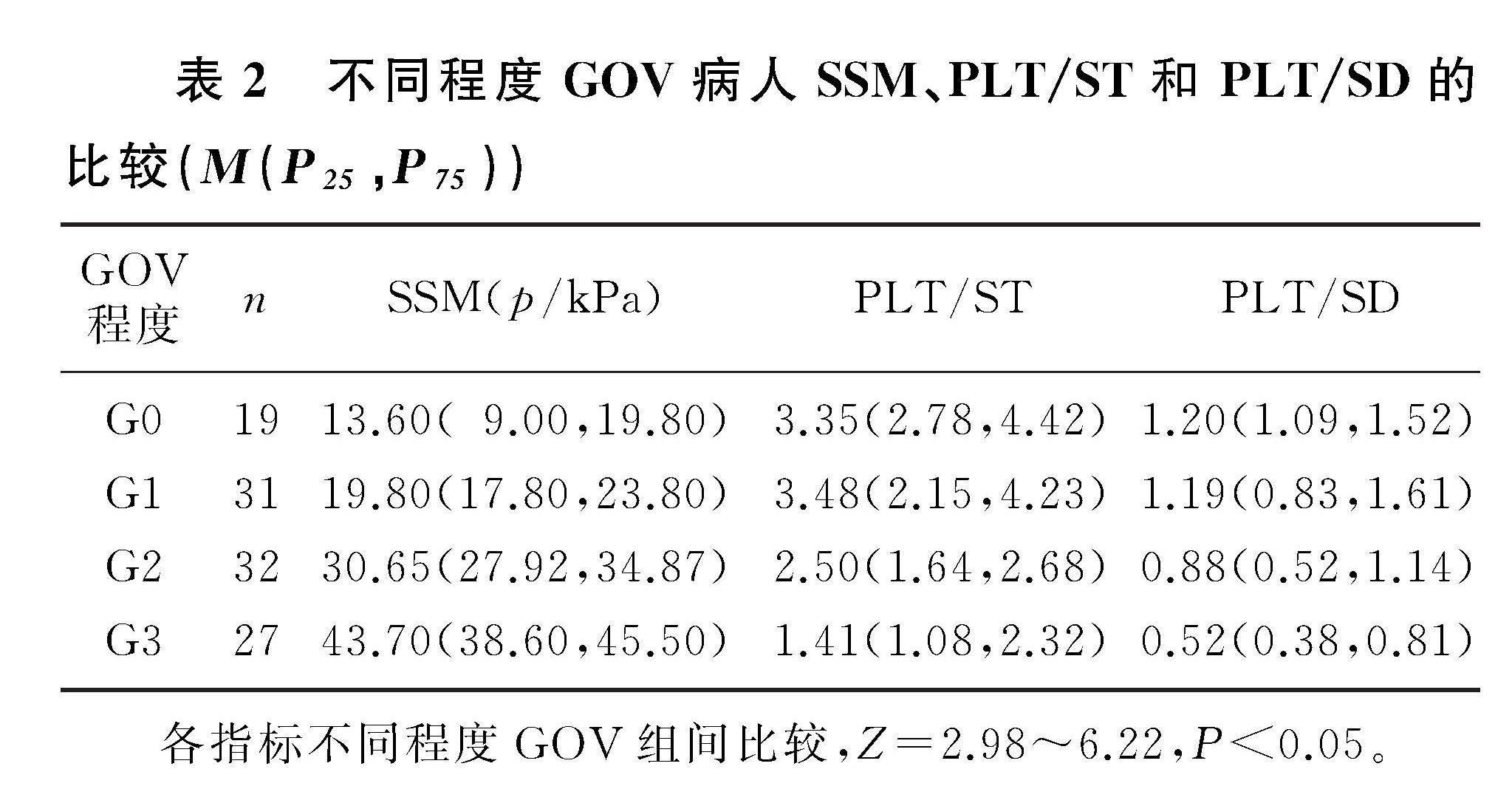
2.2 不同程度GOV组SSM、PLT/ST和PLT/SD的比较
SSM、PLT/ST和PLT/SD在不同程度GOV组中差异均有统计学意义(Z=2.98~6.22,P<0.05),其中SSM与GOV程度呈正相关性(r=0.838,P<0.05),即随着GOV程度的提高SSM不断增加。见表2。
2.3 中-重度GOV无创诊断模型的构建
将病人按照胃镜诊断结果分为无-轻度GOV组(G0+G1)50例和中-重度GOV组(G2+G3)59例。将单因素Logistic回归分析差异具有统计学意义的3个变量(SSM、PLT/ST、PLT/SD)采用二元Logistic回归分析,结果显示PLT/SD差异无统计学意义(P>0.05),即PLT/SD不是中-重度GOV的獨立影响因素,最终纳入SSM和PLT/ST构建模型:Logit(P)=-6.373+0.298×SSM-0.443×PLT/ST。
2.4 各指标对中-重度GOV的诊断价值
ROC曲线分析显示,SSM、PLT/ST、PLT/SD以及回归模型预测中-重度GOV的AUC分别为0.94、0.79、0.77和0.95,其中SSM和回归模型预测中-重度GOV的最佳界值为23.85 kPa、0.57。Delong检验结果显示,回归模型诊断中-重度GOV的AUC高于PLT/ST和PLT/SD,差异均具有统计学意义(Z=4.08、4.40,P<0.05);而回归模型诊断中-重度GOV的AUC与SSM相比较,PLT/ST与PLT/SD相比较,差异均无统计学意义(Z=0.74、0.14,P>0.05)。见表3、图2。
3 讨 论
胃镜检查作为一种常见的侵入性检查,可以直接观察胃黏膜的病变和出血情况,尤其是对于早期GOV与胃底黏膜下其他病变的鉴别诊断有重要意义[12-13]。GOV程度与曲张静脉直径呈线性正相关,轻度静脉曲张是指曲张静脉直径<5 mm,临床多暂时不予治疗[14-15]。随着静脉直径的增加,GOV程度不断增加,出血风险也不断增加。
近年来,针对GOV的无创诊断研究已取得一定进展。血小板减少为肝硬化常见的临床表现之一,其原因可能与脾功能亢进、血小板在脾脏内的潴留和破坏增加、血小板相关免疫球蛋白增加及血小板生成素减少有关[16]。因此,PLT也常作为GOV的无创评估指标之一,但其结果容易受到脾脏或治疗的影响[8]。已有研究表明,将PLT与脾脏大小相结合可以有效地评估GOV[9-10]。本研究结果表明,PLT/ST、PLT/SD在肝硬化有无GOV组间差异有统计学意义,PLT/ST和PLT/SD分别小于2.89、1.01可以提示有中度以上GOV的存在,但其预测价值较SSM要低,且PLT/ST和PLT/SD的AUC差异无显著性。
与LSM相比,SSM用于预测GOV具有很多优势[17-19]。刘芳等[20]研究显示,肝脏病变程度与LSM和SSM呈正相关,而LSM和SSM与内镜下GOV、B超下门静脉宽度以及PLT有相关性,且SSM预测GOV要优于LSM(AUC分别为0.804、0.737),其最佳界值分别为18.0和44.5 kPa。STEFANESCU等[21]研究结果显示,SSM≥53 kPa有较高风险会出现GOV。COLECCHIA等[22]的研究结果显示,SSM为55 kPa对于预测GOV具有非常高的特异度。本研究结果显示,基于FibroScan测量的SSM在不同程度GOV中差异有统计学意义,随着GOV程度的增加,SSM值不断增加。当取值大于23.85 kPa时,SSM预测中-重度GOV的AUC达0.94,诊断灵敏度和特异度均达80%以上,对中-重度GOV有较好的预测效果,且其预测效果较PLT/ST和PLT/SD要高。
现有很多研究将多个无创参数联合应用,以提高诊断的灵敏度、特异度,进一步提高其临床应用价值。有研究表明,LSM联合PLT/脾脏直径构建的LSPS模型能有效预测肝硬化是否并发GOV,当LSPS>6.5时病人出现GOV的风险很高,LSPS<3.5时可以暂时不予胃镜检查[23-24]。Baveno Ⅵ指南将LSM与PLT组合纳入专注于高风险静脉曲张(HRV)研究发现,当LSM取值大于20 kPa或PLT取值小于150×109/L时可认为肝硬化病人存在静脉曲张的风险很高,且HRV的漏诊率低于5%[25]。但此模型研究多是基于未进行抗病毒病因治疗的病毒性肝硬化病人。BOTA等[26]采用多元回归分析构建GOV评分(-0.572+0.041×LSM+0.122×SSM+0.325×腹腔积液),取最佳界值0.395时,其AUC为0.721,准确率为69.6%。本研究采用Logistic回归分析构建模型Logit(P)=-6.373+0.298×SSM-0.443×PLT/ST,其预测中度以上GOV的AUC为0.95,最佳界值取0.57时,也有很高的预测价值,且灵敏度和特异度均在85%以上。联合后的回归模型的预测价值较单独应用PLT/ST、PLT/SD均有所提高,但与SSM相比较差异无统计学意义。
总的来说,回归模型仍不失为一种预测中度以上GOV的良好的无创诊断方法。本研究存在的不足:①纳入病人均为乙型肝炎病人,未纳入其他病因导致的肝炎病人;②仅纳入脾脏测量成功者,脾脏切除术后或测量不成功者未纳入,高风险GOV只纳入一部分,导致结果稍有偏倚。因此,未来需要进一步进行大量临床样本的分析研究,以提高对中度以上GOV诊断的准确性。
[参考文献]
[1]中国肝炎防治基金会,中华医学会感染病学分会,中华医学会肝病学分会和中国研究型医院学会肝病专业委员会,等. 瞬时弹性成像技术诊断肝纤维化专家共识(2018年更新版)[J]. 中华肝脏病杂志, 2019(3):182-191.
[2]FOUCHER J, CHANTELOUP E, VERGNIOL J, et al. Diagnosis of cirrhosis by transient elastography (FibroScan): a prospective study[J]. Gut, 2006,55(3):403-408.
[3]CASTRA L, BAIL B L, ROUDOT-THORAVAL F, et al. Early detection in routine clinical practice of cirrhosis and oesophageal varices in chronic hepatitis C: comparison of transient elastography (FibroScan) with standard laboratory tests and non-invasive scores[J]. Journal of Hepatology, 2009,50(1):59-68.
[4]SAAD Y, SAID M, IDRIS M O, et al. Liver stiffness mea-
surement by fibroscan predicts the presence and size of esophageal varices in Egyptian patients with HCV related liver cirrhosis[J]. Journal of Clinical and Diagnostic Research, 2013,7(10):2253-2257.
[5]ZHANG W, WANG L Q, WANG L, et al. Liver stiffness measurement, better than APRI, fibroindex, fib-4, and NBI gastroscopy, predicts portal hypertension in patients with cirrhosis[J]. Cell Biochemistry and Biophysics, 2015,71(2):865-873.
[6]PR G, TROSITS A, PAKODI F, et al. Liver stiffness measurement selects patients with chronic liver diseases at risk of bearing large oesophageal varices[J]. Zeitschrift Für Gas-
troenterologie, 2013,51(5). doi:10.1055/s-0033-1347502.
[7]KIM T Y, JEONG W K, SOHN J H, et al. Evaluation of portal hypertension by real-time shear wave elastography in cirrhotic patients[J]. Liver International: Official Journal of the International Association for the Study of the Liver, 2015,35(11):2416-2424.
[8]MADHOTRA R, MULCAHY H E, WILLNER I, et al. Prediction of esophageal varices in patients with cirrhosis[J]. Journal of Clinical Gastroenterology, 2002,34(1):81-85.
[9]GIANNINI E, BOTTA F, BORRO P, et al. Platelet count/spleen diameter ratio: proposal and validation of a non-invasive parameter to predict the presence of oesophageal varices in patients with liver cirrhosis[J]. Gut, 2003,52(8):1200-1205.
[10]韓莹,刘燕敏,廖慧钰,等. 无创伤诊断指标对乙型肝炎肝硬化患者伴食管胃底静脉曲张风险的评估[J]. 中华肝脏病杂志, 2012,20(2):141-143.
[11]王贵强,王福生,成军,等. 慢性乙型肝炎防治指南(2015年版)[J]. 实用肝脏病杂志, 2016,19(3):389-400.
[12]HWANG J H, SHERGILL A K, ACOSTA R D, et al. The role of endoscopy in the management of variceal hemorrhage[J]. Gastrointestinal Endoscopy, 2014,80(2):221-227.
[13]GARCIA-TSAO G, ABRALDES J G, BERZIGOTTI A, et al. Portal hypertensive bleeding in cirrhosis: risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases[J]. Hepatology, 2017,65(1):310-335.
[14]DE FRANCHIS R, BAVENO Ⅵ FACULTY. Expanding consensus in portal hypertension: report of the Baveno Ⅵ Consensus Workshop: Stratifying risk and individualizing care for portal hypertension[J]. Journal of Hepatology, 2015,63(3):743-752.
[15]BONNET N, PAUL J, HELLEPUTTE T, et al. Novel insights into the assessment of risk of upper gastrointestinal bleeding in decompensated cirrhotic children[J]. Pediatric Transplantation, 2019,23(4):e13390.
[16]李琴,孙桂珍,王宝恩,等. 肝硬化患者血小板计数与血小板生成素及脾脏指数间的关系[J]. 中华肝脏病杂志, 2004(4):210-212.
[17]TAKUMA Y, NOUSO K, MORIMOTO Y, et al. Measurement of spleen stiffness by acoustic radiation force impulse imaging identifies cirrhotic patients with esophageal varices[J]. Gastroenterology, 2013,144(1):92-101.e2.
[18]HIROOKA M, OCHI H, KOIZUMI Y, et al. Splenic elasti-
city measured with real-time tissue elastography is a marker of portal hypertension[J]. Radiology, 2011,261(3):960-968.
[19]OCHI H, HIROOKA M, KOIZUMI Y, et al. Real-time tissue elastography for evaluation of hepatic fibrosis and portal hypertension in nonalcoholic fatty liver diseases[J]. Hepatology, 2012,56(4):1271-1278.
[20]刘芳,李庭红,韩涛,等. 瞬时弹性成像在肝硬化门静脉高压中的临床评价[J]. 中华肝脏病杂志, 2013,21(11):840-844.
[21]STEFANESCU H, RADU C, PROCOPET B, et al. Non-invasive ménage à trois for the prediction of high-risk varices: stepwise algorithm using lok score, liver and spleen stiffness[J]. Liver International: Official Journal of the International Association for the Study of the Liver, 2015,35(2):317-325.
[22]COLECCHIA A, MONTRONE L, SCAIOLI E, et al. Mea-
surement of spleen stiffness to evaluate portal hypertension and the presence of esophageal varices in patients with HCV-related cirrhosis[J]. Gastroenterology, 2012,143(3):646-654.
[23]IMPERATRICE B, VENON W D, CHIAL C, et al. Liver stiffness-spleen size-to-platelet ratio risk score (LSPS) detects esophageal varices and HCC risk in HCV- and HBV-related cirrhosis responsive to DAA[J]. Digestive and Liver Disease, 2019,51:e48.
[24]KIM B K, HAN K H, PARK J Y, et al. A liver stiffness measurement-based, noninvasive prediction model for high-risk esophageal varices in B-viral liver cirrhosis[J]. The Ame-
rican Journal of Gastroenterology, 2010,105(6):1382-1390.
[25]WANG H Y,WEN B,CHANG X Y,等. 基于Baveno Ⅵ標准和脾硬度在病毒学抑制的乙型肝炎肝硬化患者中排除高风险静脉曲张的研究[J]. 临床肝胆病杂志, 2021,37(3):521.
[26]BOTA S, SPOREA I, SIRLI R, et al. Can ARFI elastography predict the presence of significant esophageal varices in newly diagnosed cirrhotic patients?[J]. Annals of Hepatology, 2012,11(4):519-525.
(本文编辑 马伟平)
