不可逆电穿孔和射频消融治疗原发性肝癌效果比较
2024-05-07赵孟杰邢恩涛董源金鹏飞孙景武
赵孟杰 邢恩涛 董源 金鹏飞 孙景武
[收稿日期]2023-06-05; [修訂日期]2023-12-20
[基金项目]河北省重点研发计划自筹项目(172777148)
[第一作者]赵孟杰(1982-),男,主治医师。
[通信作者]孙景武(1980-),男,硕士,主任医师。E-mail:119-5272448@qq.com。
[摘要] 目的
评价不可逆电穿孔技术治疗原发性肝癌的初步效果。
方法 2019年1月—2021年10月,采用前瞻性研究方法选择在河北中石油中心医院诊治的原发性肝癌病人102例为研究对象,按照随机数字表法分为2组,每组51例。观察组采用不可逆电穿孔技术治疗,对照组采用射频消融技术治疗。评估两组临床效果、术后并发症、6和12个月的生存率和复发率,以及甲胎蛋白(AFP)的转阴率。比较两组总胆红素(TBiL)、清蛋白(Alb)、丙氨酸氨基转移酶(ALT)、血清糖类抗原125(CA125)、癌胚抗原(CEA)和AFP等生化指标。
结果 观察组总体临床效果、6和12个月生存率、AFP转阴率均高于对照组(χ2=7.933、8.254,Log-rank χ2=8.254、8.541,P<0.05),术后并发症发生率、6和12个月复发率低于对照组(χ2=4.317,Log-rank χ2=6.331、7.256,P<0.05)。治疗后,观察组ALT、Alb、TBil、AFP、CEA和CA125等指标均低于对照组(t=8.660~40.741,P<0.05)。
结论 不可逆电穿孔技术治疗原发性肝癌的效果显著,对病人肝功能影响较小,能够有效降低病人血清ALT、Alb和TBil等指标的水平。
[关键词] 肝肿瘤;电穿孔;射频消融术;肝功能试验;生物标记,肿瘤;治疗结果
[中图分类号] R735.7;R446.113
[文献标志码] A
[文章编号] 2096-5532(2024)01-0110-05
doi:10.11712/jms.2096-5532.2024.60.006
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://link.cnki.net/urlid/37.1517.R.20240304.1750.001;2024-03-07 20:41:07
Efficacy of irreversible electroporation versus radiofrequency ablation for primary liver cancer
\ ZHAO Mengjie, XING Entao, DONG Yuan, JIN Pengfei, SUN Jingwu
\ (Department of Hepatobiliary Surgery, Hebei PetroChina Central Hospital, Langfang 065000, China)
\; [Abstract]\ Objective\ To preliminarily evaluatethe therapeutic effects of irreversible electroporation for primary liver cancer.
\ Methods\ From January 2019 to October 2021, we prospectivelyenrolled 102 patients with primary liver cancer who were treated at Hebei PetroChina Central Hospital, and assigned them using a random number tableto receive either irreversible electroporation (observation group) or radiofrequency ablation (control group), with 51 patients in each group. The two groups were compared in terms of clinical response, postoperative complications, survival and recurrence rates at 6 and 12 months, and the clea-
rancerate of alpha fetoprotein (AFP), as well as biochemical indicators including total bilirubin (TBil), albumin (Alb), alanine ami-
notransferase (ALT), carbohydrate antigen 125 (CA125), carcinoembryonic antigen (CEA), and AFP levels.
\ Results\ Compared with the control group, the observation group showed significantly higher overall clinical response rate, 6- and 12-month survival rates, and AFP clearance rate (χ2=7.933,8.254;Log-rank χ2=8.254,8.541;all P<0.05) and significantly lower incidence rate of postoperative complications and recurrence rates at 6 and 12 months (χ2=4.317;Log-rank χ2=6.331,7.256;all P<0.05). ALT, Alb, TBil, AFP, CEA, and CA125 levels in the observation group were significantly lower than those in the control group(t=8.660-40.741,all P<0.05).
\ Conclusion\ Irreversible electroporation has significant therapeutic effectsforpatients with primary liver cancer, and can effectively reduce serum ALT, Alb, and TBil levels, with less detrimental impact on liver function.
[Key words]\ liver neoplasms; electroporation; radiofrequency ablation; liver function tests; biomarkers, tumor; treatment outcome
原发性肝癌病人早期无症状,病人确诊时往往已达到中晚期,而且肿瘤细胞会对门静脉产生侵犯,进而造成门静脉癌栓,对病人生命安全造成较大的影响[1-3]。
我国原发性肝癌发病率和罹患病人总量位居世界前列,主要与乙型肝炎患病率高和人口基数大有关[4-6]。目前原发性肝癌的发病机制尚未完全明确,可能与致癌因子、肝炎病毒感染及遗传等因素有一定的关联[7-8]。
传统治疗方法主要为手术摘除,虽然能够取得一定疗效,但是对病人创伤性较大[9-10]。近年来伴随医疗技术发展,射频消融技术得到了较广泛应用,其主要机制是通过热消融杀伤肿瘤细胞[11-12]。不可逆电穿孔疗法也是新兴的一种技术,通过穿透组织的细胞膜在其表面产生不可逆的纳米级微穿孔,进而造成肿瘤细胞凋亡,是原发性肝癌的主要治疗方法[13-14]。目前,这两种治疗方法的疗效对比研究尚未有明确结论[15-17]。因此,本研究对不可逆电穿孔和射频消融治疗原发性肝癌的效果进行评价。
1 资料与方法
1.1 研究对象
1.1.1 样本量确定 2019年1月—2021年10月,选择河北中石油中心医院诊治的原发性肝癌病人为研究对象。样本量估计采用实验性两样本对比研究的公式n=2[(tα/2+tβ)s/δ]2进行估算。公式中n为样本量,t为统计量,s为总体标准差的估计值,δ为两均数差值;双侧α=0.05,β=0.1,查表tα/2=1.960,tβ=1.282;对病人临床指标预调查的最大估计值s/δ为1.479,最終得出每组最低样本量为46例,按此扩大10%样本量最终纳入102例病人。
1.1.2 纳入和排除标准 纳入标准:①无沟通障碍;②均经《临床肿瘤内科手册》和影像学检查确诊,均符合米兰标准[18],或经穿刺活组织病理检查诊断为原发性肝癌,且符合BCLC分期;③均自愿参与研究;④无门静脉侵犯和肝外转移;⑤糖类抗原125(CA125)>35 U/L,癌胚抗原(CEA)>10 μg/L,甲胎蛋白(AFP)>200 μg/L;⑥既往未接受手术、靶向治疗等抗肿瘤治疗,治疗依从性和随访依从性较高。排除标准:①存在慢性或急性感染;②哺乳期或妊娠期妇女;③合并其他基础疾病(如高血压、糖尿病等)、认知功能障碍、心脏传导阻滞、严重心律失常、其他部位恶性肿瘤;④病人中途退出本研究。本研究经医院伦理委员会审批通过。
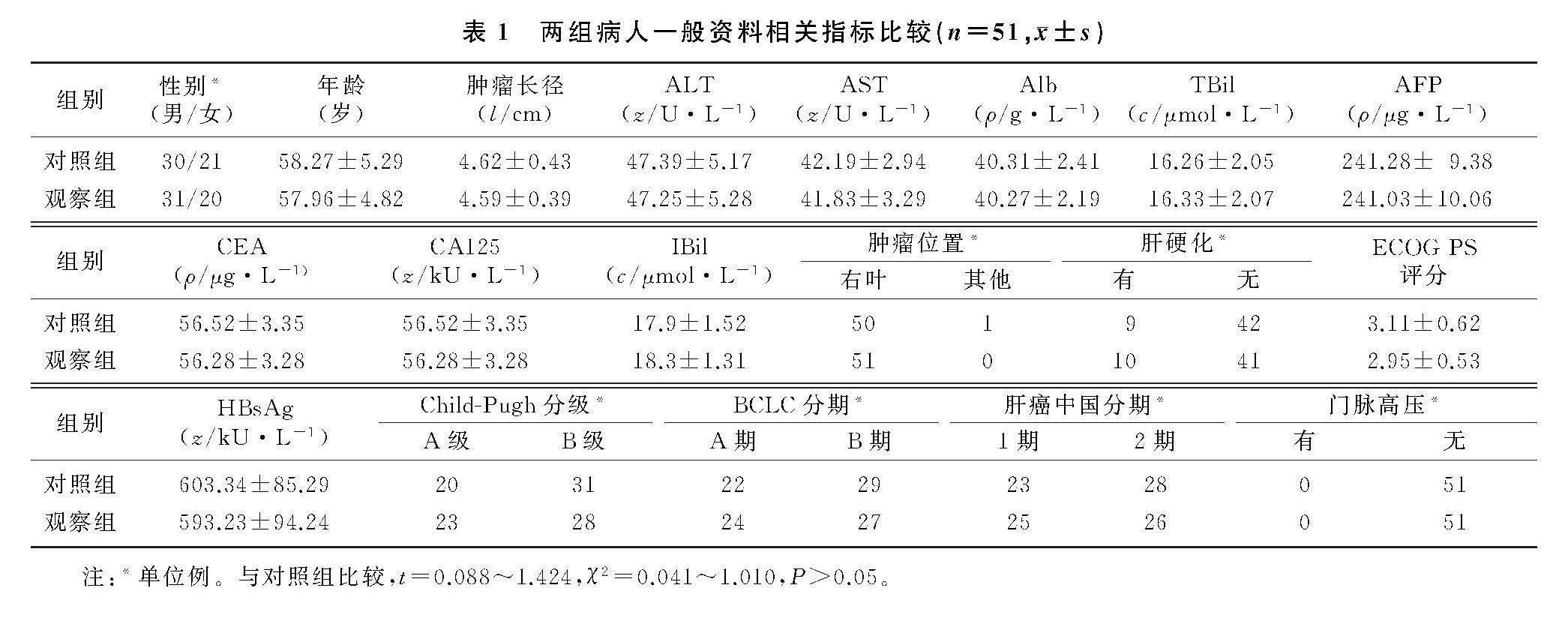
1.1.3 对象分组 将病人按照随机数字表法分为2组,每组51例,分别采用射频消融疗法(对照组)和不可逆电穿孔技术(观察组)治疗,两组病人由同一位医师完成手术。两组病人性别、年龄、肿瘤长径、血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、血清清蛋白(Alb)、总胆红素(TBil)、间接胆红素(IBil)、甲胎蛋白(AFP)、糖类抗原125(CA125)、癌胚抗原(CEA)、美国东部肿瘤协作组(ECOG) 活动状态(PS)评分、乙肝表面抗原(HBsAg)、Child-Pugh分级、BCLC分期、肝癌中国分期,以及肿瘤位置、肝硬化和门脉高压等一般资料相关指标比较,差异均无统计学意义(t=0.088~1.424,χ2=0.041~1.010,P>0.05)。见表1。
1.2 治疗方法
1.2.1 不可逆电穿孔术 病人禁食12 h,在全身麻醉下给予肌松药,确保肌肉松弛,术中进行心电和肌松监测。在GE Optima 620 CT扫描仪引导下穿刺,每个消融部位排布2~4支电极针,应用YTL-GM01高压陡脉冲治疗仪对病灶处进行消融(电压3 000 V),依据病灶大小给予10~60组输出脉冲。消融结束后,静脉注射80 mL碘海醇对比剂(注射流量为3 mL/s)并进行CT扫描,以评估消融范围,确保病灶消融完全。
1.2.2 射频消融术 病人经CT扫描后确定皮肤穿刺点,应用20 g/L利多卡因进行局部麻醉,由同一位与本研究无关的介入科医师,在超声引导下,应用Covidien 11c CTRF 220射频消融系统进行消融。根据肿瘤的大小、位置等参数,选择单针单点、单针多点和集束针治疗。针尖达肿瘤对侧边缘1 cm处,射频输出功率由90 W逐步增加至150 W,治疗时间设定为15 min,仪器自行测定组织的阻抗,治疗结束时测定局部温度,最后针道加热至99~100 ℃,以进一步烧灼及止血。对于多个病灶者予以逐一消
融,较大病灶者行多点穿刺消融。消融完成后行普美显(钆塞酸二钠)增强MR检查,以确认肿瘤已完全消融。
1.3 观察指标
1.3.1 临床观察指标 ①临床疗效:参考实体瘤治疗效果评估标准[19],主要分为进展(PD)、病情稳定(SD)、部分缓解(PR)和完全缓解(CR),其中总有效率(%)=(SD+PR+CR)/总人数×100%。②并发症:并发症包括便血、发热、胸腔积液、疼痛等。③生存率和复发率:记录治疗后6、12个月的生存率和复发率,其中肝外或肝脏出现转移灶、AFP>400 μg/L,即为复发。
1.3.2 实验观察指标 治疗前及治疗1周后采集病人空腹靜脉血,以3 000 r/min离心10 min取血清,进行相关指标检测。①AFP转阴率:以AFP<200 μg/L为阴性判断标准。②肝功能指标:应用全自动生化分析仪检测血清TBiL、Alb、ALT和AST等指标。③癌症标志物:应用酶联免疫吸附法对血清CA125、CEA和AFP等进行检测。
1.4 统计学处理
采用SPSS 17.0统计软件进行数据处理。计量资料数据采用±s表示,两组间均数的比较采用两独立样本t检验;计数资料数据采用例数(%)表示,组间比较采用χ2检验;两组间等级资料的比较采用Mann-Whitney U检验;两组间生存率和复发率的比较采用Log-rank检验。以P<0.05为差异有统计学意义。
2 结 果
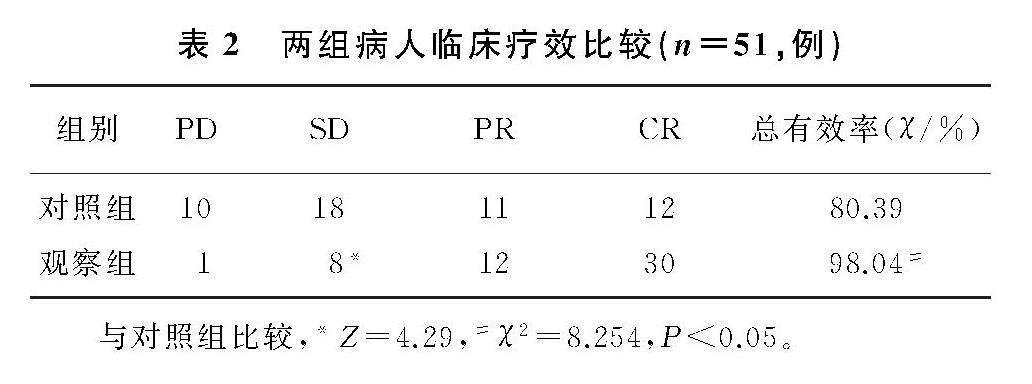
2.1 两组病人临床疗效比较
观察组病情稳定率明显优于对照组,差别有统计学意义(Z=4.29,P<0.05)。观察组总有效率明
显高于对照组,差别有统计学意义(χ2=8.254,P<0.05)。见表2。
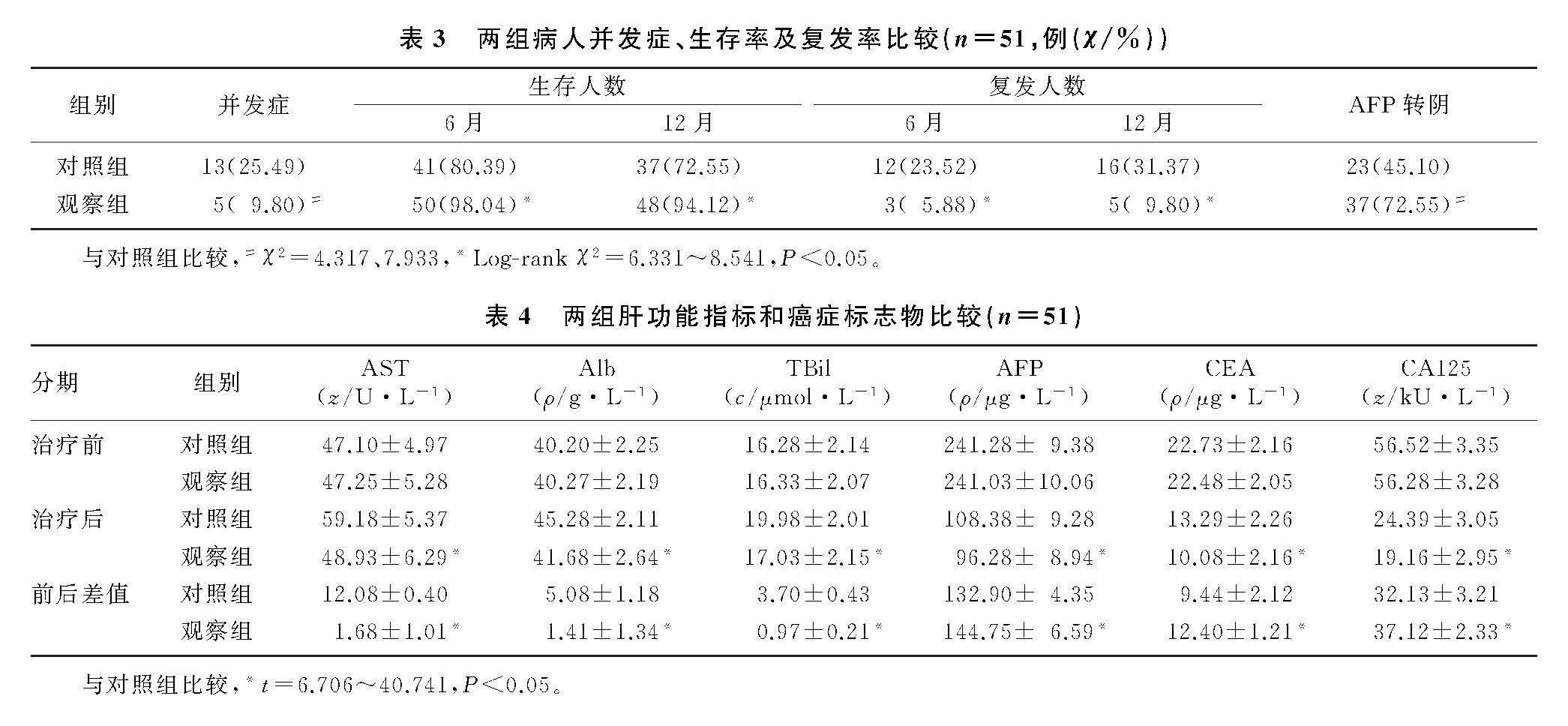
2.2 两组并发症、生存率及复发率比较
观察组出现胸腔积液2例、发热2例和腹痛1例,对照组出现胸腔积液4例、发热4例、腹痛3例和呕吐3例,观察组并发症发生率明显低于对照组(χ2=4.317,P<0.05)。观察组6和12个月生存率明显高于对照组(Log-rank χ2=8.254、8.541,P<0.05)。观察组6和12个月复发率明显低于对照组(Log-rank χ2=6.331、7.256,P<0.05)。观察组病人AFP转阴率明显高于对照组(χ2=7.933,P<0.05)。见表3。
2.3 两组肝功能指标和癌症标志物比较
治疗后观察组病人ALT、Alb、TBil、AFP、CEA和CA125等指标均明显低于对照组(t=6.706~8.802,P<0.05),且观察组ALT、Alb和TBil治疗前后差值明显低于对照组(t=14.679~40.741,P<0.05)。见表4。
3 讨 论
肝癌发病较为隐匿,在确诊时往往已经发展为
中晚期,部分病人还会出现转移[20-22]。肝癌主要的
治疗方法便是手术治疗,其治疗效果较好且能够延
长病人生存期[23]。但是有研究显示,肿瘤大小和位置对手术治疗有着较大的影响[24-25]。
经皮射频消融术能通过针型电极在肿瘤内部释放交流电磁波,震动肿瘤组织,进而产生摩擦热,促使肿瘤出血坏死,该方法操作较简单、安全性较高且有较高有效率[26-28]。但是,射频消融术的热效应会损伤肿瘤细胞周围正常组织[29-30]。不可逆电穿孔疗法作为一种新兴的非热消融技术,其能够通过较高电能量,致使细胞膜表面呈现不可逆的纳米级微孔,该微孔能够让细胞内外平衡受到破坏,进而会造成肿瘤细胞水肿和凋亡[31-32]。
本文研究结果表明,观察组和对照组的临床有效率分别为98.04%和80.39%,前者明显高于后者。并且,观察组病人6和12个月复发率、并发症发生率均低于对照组,观察组6和12月生存率和AFP转阴率高于对照组。本研究结果显示,不可逆电穿孔疗法的临床效果优于射频消融术,应用不可逆电穿孔技术治疗病人的复发率更低、AFP转阴率更高。这可能是因为射频消融技术会因“热沉效应”对邻近组织结构造成一定的损伤,因而治疗后复发率较高,而不可逆电穿孔技术是通过高压脉冲电场在细胞膜上形成不可逆纳米级微孔,不会对胆管结构或周围重要血管造成损害,具有较低的并发症发生率,安全性高,且恢复较快[33-35]。
本文结果还表明,观察组治疗后的ALT、Alb和TBil水平均低于对照组,这提示不可逆电穿孔疗法对肝脏的损伤程度要低于射频消融术。前期研究结果显示,正常人AFP水平较低,但是肝肿瘤病人中AFP水平会有明显升高,其在肝癌诊断中有着较广泛应用[36]。CEA作为一种酸性糖蛋白,在肝癌等肿瘤组织中呈现高表达,是一种非特异性肿瘤标志物[37]。CA125作为糖蛋白肿瘤相关抗原,其在肝癌、肺癌和乳癌等组织表达较高,且与肝癌转移相关[38]。本文研究结果显示,观察组治疗后的AFP、CEA和CA125水平均低于对照组。分析其原因可能是由于不可逆电穿孔治疗作用于细胞膜脂质双分子层,而对神经、胰胆管和血管组织的骨架成分不造成破坏,这确保了受伤正常组织能够快速修复[39]。同时,不可逆电穿孔技术不靠高热效应对肿瘤细胞产生杀伤作用,这确保了疗效不会受热沉效应影响,保证了胆管和血管周围肿瘤能够得到完全消融[40]。另外,不可逆电穿孔疗法的主要机制是诱导细胞凋亡而并不是促进蛋白质变性坏死,这能够在一定程度上保留肿瘤抗原,进而激活机体的对肿瘤免疫功能,最终达到最佳治疗效果[41-42]。但是,本研究因病人居住的地域限制,大多数以就近治疗为原则,未涉及其他地区、不同级别的医院,存在一定选择偏倚。此外,本研究样本量仅有102例,今后宜获取足够多的样本进行深入细致的分析。
综上所述,不可逆电穿孔疗法有着较好的临床效果,对病人肝功能损伤较小,能够抑制AFP、CEA和CA125等癌症标志物表达,延长病人生存时间,可在临床推广应用。
[参考文献]
[1]赵婧,魏巍,李会平,等. 丙型肝炎病毒感染者血清微小核糖核酸665和224的表达及其对肝癌的诊断价值[J]. 国际流行病学传染病学杂志, 2022,49(4):247-251.
[2]翟润,张海洋,厉冰,等. 入肝血流不同处理方式对肝癌手术患者的疗效及对其不良反应的影响分析[J]. 实用癌症杂志, 2022,37(11):1829-1832,1841.
[3]WU V, MCARTHUR M A, ALLEN A, et al. Rare primary hepatic malignancies: a case-based review[J]. Clin Imaging, 2021,69(1):196-204.
[4]周浩,刘文利,于丽娅,等. 2014—2019年辽宁省朝阳市城市居民肝癌死亡率年度趋势分析及灰色模型预测[J]. 现代预防医学, 2021,48(7):1293-1297.
[5]中华人民共和国卫生和计划生育委员会医政医管局. 原發性肝癌诊疗规范(2017年版)[J]. 中华消化外科杂志, 2017,16(7):635-647.
[6]SHI J F, CAO M, WANG Y, et al. Is it possible to halve the incidence of liver cancer in China by 2050[J]. Int J Cancer, 2021,148(5):1051-1065.
[7]TSAI J H, JENG Y M, LEE C H, et al. Molecular features of primary hepatic undifferentiated carcinoma[J]. Mod Pathol, 2022,35(5):680-687.
[8]GILLES H, GARBUTT T, LANDRUM J. Hepatocellular carcinoma[J]. Crit Care Nurs Clin North Am, 2022,34(3):289-301.
[9]LI Z H, KWON S M, LI D C, et al. Human constitutive androstane receptor represses liver cancer development and hepatoma cell proliferation by inhibiting erythropoietin signaling[J]. The Journal of Biological Chemistry, 2022,298(5):101885.
[10]洪晓明,纪任,刘春红,等. ALPPS手术治疗原发性肝癌的效果
及中期生存分析[J]. 肝胆胰外科杂志, 2023,35(3):164-167, 172.
[11]何子朋,唐华,蒋鹏程,等. 超微血管成像技术预测肝癌射频消融疗效的初步研究[J]. 中华肝胆外科杂志, 2021,27(9):663-666.
[12]周宇,耿进朝,韩雪,等. 射频消融治疗原发性肝癌患者疗效评价[J]. 实用肝脏病杂志, 2022,25(5):718-721.
[13]GUPTA P, MARALAKUNTE M, SAGAR S, et al. Efficacy and safety of irreversible electroporation for malignant liver tumors: a systematic review and meta-analysis[J]. European Radiology, 2021,31(9):6511-6521.
[14]张伟华,秦艳青,沈金杰. IRE联合NK细胞治疗原发性肝癌的安全性和临床疗效[J]. 肝脏, 2020,25(12):1272-1274.
[15]李学达,杨莉莉,张浩,等. 对比观察不可逆电穿孔与射频消融治疗肝癌[J]. 中国介入影像与治疗学, 2022,19(6):325-328.
[16]岑泽南,包家立,陈新华. 不可逆电穿孔肝癌消融临床应用的系统分析[J]. 中国医疗设备, 2021,36(3):11-17.
[17]陈水兵,贺辉,金诗湘,等. 原发性肝癌合并肝动静脉瘘患者经导管动脉化疗栓塞后早期联合射频消融治疗的临床研究[J]. 中国现代医学杂志, 2023,33(4):51-55.
[18]孙燕,周际昌. 临床肿瘤内科手册[M]. 4版.北京:人民卫生出版社, 2003.
[19]杨学宁,吴一龙. 实体瘤治疗疗效评价标准: RECIST[J]. 循证医学, 2004,4(2):85-90,111.
[20]谷佳,贺卫和,刘乐平,等. 基于网络药理学和分子对接探究二氢杨梅素调脂抗肝癌的作用[J]. 中南医学科学杂志, 2022,50(6):791-795.
[21]彭进,贾燕华,李宏. 原发性肝癌CT影像学特征与中医辨证分型的关系研究[J]. 四川中医, 2021,39(10):57-60.
[22]邢家利,金保,徐岗,等. 晚期不可切除肝癌的综合治疗[J]. 中华普通外科杂志, 2022,37(2):108-112.
[23]吕婷婷,秦丽莉,那民,等. 定量分析Gd-EOB-DTPA增强MRI对预测肝细胞肝癌的临床应用价值[J]. 中国CT和MRI杂志, 2021,19(5):63-66.
[24]LISSING M, VASSILIOU D, FLODERUS Y, et al. Risk of primary liver cancer in acute hepatic porphyria patients: a matched cohort study of 1244 individuals[J]. Journal of Internal Medicine, 2022,291(6):824-836.
[25]WANG J M, ZHANG L, SU Y L, et al. A novel fluorescent probe strategy activated by β-glucuronidase for assisting surgical resection of liver cancer[J]. Analytical Chemistry, 2022,94(19):7012-7020.
[26]XIA Y, LI J, LIU G, et al. Long-term effects of repeat hepatectomy vs percutaneous radiofrequency ablation among patients with recurrent hepatocellular carcinoma: a randomized clinical trial[J]. JAMA Oncol, 2020,6(2):255-263.
[27]JEON HJ, EUN HS, KWON IS, et al. Outcomes of laparoscopic radiofrequency ablation versus percutaneous radiofrequency ablation for hepatocellular carcinoma[J]. Surg Endosc, 2023,37(7):5176-5189.
[28]张贻庆,崔贵医,杨磊,等. 肝肿瘤切除术与射频消融术治疗原发性肝癌的疗效及其对血清AFP、CEA、CA125水平的影响[J]. 实用癌症杂志, 2022,37(8):1316-1319.
[29]刘松,王霆,靳剑. 射频消融术治疗早期原发性肝癌的近远期疗效及对血清AFP-L3、GP73、AFP、γ-GT的影响[J]. 医学综述, 2021,27(16):3309-3313.
[30]楚伟可,吴雪,张鹏,等. 炎症标志物对早期小肝癌行射频消融术预后的预测价值[J]. 临床肝胆病杂志, 2022,38(4):843-850.
[31]NARAYANAN G. Irreversible electroporation for treatment of liver cancer[J]. Gastroenterology & Hepatology, 2011,7(5):313-316.
[32]FANG C, KIBRIYA N, HEATON N D, et al. Safety and efficacy of irreversible electroporation treatment in hepatobiliary and pancreatic tumours: a single-centre experience[J]. Clinical Radiology, 2021,76(8):599-606.
[33]MEIJERINK M R, RUARUS A H, VROOMEN L G P H, et al. Irreversible electroporation to treat unresectable colorectal liver metastases (COLDFIRE-2): a phase Ⅱ, two-center, single-arm clinical trial[J]. Radiology, 2021,299(2):470-480.
[34]張炫,李晓辉. 肝动脉化疗栓塞联合射频消融治疗原发性肝癌的临床观察[J]. 解放军医药杂志, 2020,32(5):29-32.
[35]黎璐璐,何文平,谭龙,等. 超声引导下射频消融联合经导管动脉栓塞化疗对原发性肝癌患者肝功能及血流动力学的影响[J]. 癌症进展, 2023,21(5):557-560.
[36]栾珊,滕静,邵翠华. 甲胎蛋白异质体诊断原发性肝癌价值的Meta分析[J]. 青岛大学学报(医学版), 2020,56(2):203-206.
[37]张俊,姜登鸽,杨彩丰,等. CA199、CEA在肝癌中诊断价值及与LVD和MVD相关性分析[J]. 胃肠病学和肝病学杂志, 2022,31(11):1278-1283.
[38]周梅,吴菊,郭清萍,等. 血清AFP、CA125、CEA在原发性肝癌鉴别及肿瘤分期中的应用[J]. 海南医学, 2023,34(6):836-840.
[39]LI J, ZHANG X B, WANG J J, et al. Comparison between high-frequency irreversible electroporation and irreversible electroporation ablation of small swine liver: follow-up of DCE-MRI and pathological observations[J]. Chinese Medical Journal, 2021,134(17):2081-2090.
[40]ZAND E, SCHOTTROFF F, STEINACKER E, et al. Advantages and limitations of various treatment chamber designs for reversible and irreversible electroporation in life sciences[J]. Bioelectrochemistry, 2021,141:107841.
[41]许敏,许丹霞,蒋天安. 不可逆电穿孔技术在肝癌消融治疗中的应用[J]. 介入放射学杂志, 2022,31(5):511-514.
[42]李学达,杨莉莉,张浩,等. 对比观察不可逆电穿孔与射频消融治疗肝癌[J]. 中国介入影像与治疗学, 2022,19(6):325-328
(本文编辑 于国艺)