不同途径感染禽网状内皮组织增殖病病毒的动态监测
2024-05-06徐凤霞孙万里张亚文王一新
徐凤霞 , 孙万里 , 张亚文 , 常 爽 , 王一新 , 赵 鹏
(山东农业大学动物科技学院 , 山东 泰安 271018)
禽网状内皮组织增殖病(Reticuloendotheliosis,RE)是由禽网状内皮组织增殖病病毒(Reticuloendotheliosis virus,REV)感染引起的一种严重危害养禽业的常见肿瘤病之一[1],是以肝脏和法氏囊等器官组织出现大小不一的灰色结节和弥漫性病变为主要特征的一种病理综合征[2-3]。虽然鸡群感染REV一般不会直接导致死亡,但会引起患鸡发生严重免疫抑制,进而极易遭受其他病毒或细菌的侵害。近年来研究表明,REV易与其他病毒发生混合感染[4-5],并可通过污染的禽活疫苗进行传播[6-7],导致鸡群在接种污染的疫苗后不仅没有产生免疫保护效力,甚至增强了REV对无特定病原体(Specific pathogen free,SPF)鸡的致病作用。虽然Ren等[8]将提取的表面糖蛋白gp90与胞嘧啶-鸟嘌呤寡脱氧核苷酸(Cytosine phospho guanine oligodeoxynucleotide,CpG-ODN)佐剂一起用于种鸡免疫时,确定gp90蛋白疫苗诱导的母源抗体可有效保护大多数雏鸡免受REV感染,但迄今尚未有商品化疫苗或药物可用于RE防控,为最大程度降低REV感染带来的危害,有针对性的设计净化方案、完善净化程序并建立可靠的检测方法是有效控制该病的重要途径之一。为此,本试验利用不同的感染途径将REV感染鸡胚或雏鸡,运用反转录PCR(Reverse transcription PCR,RT-PCR)、实时荧光定量PCR(Real-time fluorescence quantitative PCR,RT-qPCR)和间接免疫荧光试验(Indirect immunofluorescence assay,IFA)3种检测方法分析感染鸡的排毒规律,为未来实施种源净化提供参考数据。
1 材料与方法
1.1 毒株和实验动物 REV毒株LN1201为2012年本实验室从某父母代肉种鸡场疑似感染REV的鸡血浆中分离得到,已完成全基因组测序(GenBank登录号:KU641115.1),经RT-qPCR鉴定无马立克氏病毒(Marek's disease virus,MDV)、传染性法氏囊病毒(Infectious bursal disease virus,IBDV)和鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)的污染,经酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)鉴定无禽白血病病毒(Avian leukosis virus,ALV)的污染。SPF鸡胚,购自山东济南斯帕法斯家禽有限公司,生产许可证号为SCXK(鲁)2018—0005,鸡胚经75%酒精消毒后在山东农业大学家禽肿瘤病与免疫抑制病实验室孵化箱内孵化至21日龄,之后饲养于山东农业大学南校区动物房负压隔离器内。LN1201毒株在鸡成纤维细胞系(Douglas foster-1,DF-1)上增殖后,按照Reed-Muench法测定其组织半数感染量(50% tissue culture infective dose,TCID50)。
1.2 主要试剂 FITC标记山羊抗小鼠IgG(H+L)抗体,购自北京全式金生物技术有限公司;病毒RNA提取试剂盒,购自美国OMEGA公司;Evo M-MLV 反转录试剂盒和SYBR Green ProTaqHS预混型qPCR试剂盒II,均购自湖南艾科瑞生物工程有限公司;REV特异性单克隆抗体11b118小鼠纯化腹水,由山东农业大学家禽肿瘤病与免疫抑制病实验室制备和保存,其效价为1∶8 000;4%多聚甲醛细胞固定液,购自上海碧云天生物技术有限公司。
1.3 主要仪器 PCR仪,购自德国 Eppendorf 公司;电泳槽,购自北京六一仪器公司;凝胶成像仪,购自BIO-RAD公司;荧光定量PCR仪,购自德国罗氏诊断有限公司;恒温水浴锅,购自英国Grant公司;超净台,购自加拿大Cabinets公司;核酸定量仪,购自Pharmacia Biotech公司;倒置荧光显微镜,购自日本NIKON公司。
1.4 试验设计 将140枚SPF鸡胚随机分为5个组,分别为卵黄囊感染组(50枚)、卵黄囊感染同居组(20枚)、腹腔感染组(30枚)、腹腔感染同居组(20枚)和空白对照组(20枚)。卵黄囊感染组于6胚龄经卵黄囊接种LN1201病毒液,接种剂量为1 500 TCID50/枚;卵黄囊感染同居组将6胚龄SPF鸡胚与卵黄囊感染组在同一孵化箱孵化出壳和饲养;腹腔感染组随机挑选正常孵化后的无REV、MDV、IBDV、CIAV和ALV污染的SPF鸡(阴性SPF鸡)20只,1日龄时经腹腔接种LN1201病毒液,接种剂量为2 000 TCID50/只;腹腔感染同居组随机挑选同期孵化的阴性SPF鸡10只与腹腔感染组共同饲养;以同期孵化阴性SPF鸡作为空白对照组。在为期10周的试验周期内,每隔7 d进行1次体重测定,并绘制体重增长曲线;观察鸡群死亡情况,计算死亡率并绘制生存曲线。动物试验经山东农业大学动物伦理委员会批准(SDAUA-2021-038),严格按照山东农业大学动物伦理委员会批准的伦理和生物安全准则进行。
1.5 样品采集 采集各组SPF鸡感染后第1、7、14、21、28、35、42、49、56、63、70天时的抗凝血,于3 000 r/min离心2 min分离血浆,无菌置于1.5 mL离心管中备用。
1.6 IFA检测病毒血症 DF-1细胞培养于24孔细胞板,待细胞密度为70%~80%时,每孔接种80 μL鸡血浆样品,于37 ℃恒温培养箱中培养4 h,更换含1%胎牛血清的维持液,继续培养6~7 d后弃去培养液;贴壁加入PBS以冲洗剩余培养液,缓慢贴壁加入4%多聚甲醛细胞固定液,25 ℃固定5~8 min后弃去固定液;贴壁加入PBS以冲洗剩余固定液,加入250 μL REV特异性单克隆抗体11b118小鼠纯化腹水,置于37 ℃恒温培养箱中孵育60 min;弃去单克隆抗体后以PBS冲洗3遍,加入FITC标记山羊抗小鼠IgG(H+L)抗体250 μL,置于37 ℃恒温培养箱中避光孵育60 min,PBS冲洗3遍后滴入50%甘油,置于倒置荧光显微镜下观察结果。
1.7 RT-PCR检测REV核酸阳性率 根据GenBank上发表的REV全基因组序列,使用Primer 6.0软件设计针对pol基因的RT-PCR引物(表1),用于检测血浆样品的REV核酸阳性率。参照病毒RNA提取试剂盒说明书提取分离血浆样品的病毒核酸进行RT-PCR检测。RT-PCR首先进行反转录,反应程序:37 ℃ 15 min,85 ℃ 5 s,置于4 ℃;然后进入PCR循环,反应程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火20 s,72 ℃延伸30 s,共40个循环;最后72 ℃延伸10 min,置于4 ℃。

表1 用于检测REV的RT-PCR引物
1.8 RT-qPCR检测REV核酸阳性率和病毒载量 根据GenBank上发表的REV全基因组序列,使用Primer 6.0软件设计针对pol基因的RT-qPCR引物(表2),用于检测血浆样品的REV核酸阳性率和病毒载量。参照病毒RNA提取试剂盒说明书提取分离血浆样品的病毒核酸进行RT-qPCR检测。RT-qPCR反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,共40个循环。
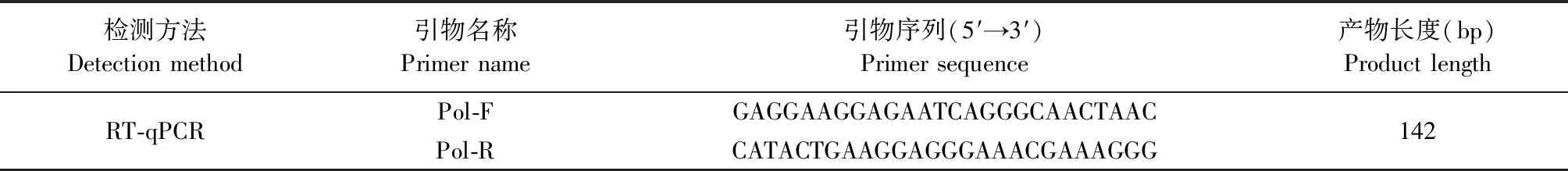
表2 用于检测REV的RT-qPCR引物
1.9 数据统计与分析 试验数据采用GraphPad Prism 9.0软件进行方差分析,P<0.05 认为差异显著,P>0.05认为差异不显著。
2 结果
2.1 不同感染方式对SPF鸡体重的影响 体重增长曲线如图2所示,与空白对照组相比,腹腔感染组和卵黄囊感染组的SPF鸡在感染后第21~70天体重增长均受到显著抑制(P<0.05),自感染后第28天起与空白对照组的体重差距呈现逐渐增大趋势;2种感染方式的同居感染组自感染后第56天起与空白对照组的体重差距呈现逐渐增大的趋势,但差异均不显著(P>0.05)。结果表明,SPF鸡感染REV可引起增重下降,卵黄囊感染组和腹腔感染组下降更为明显。
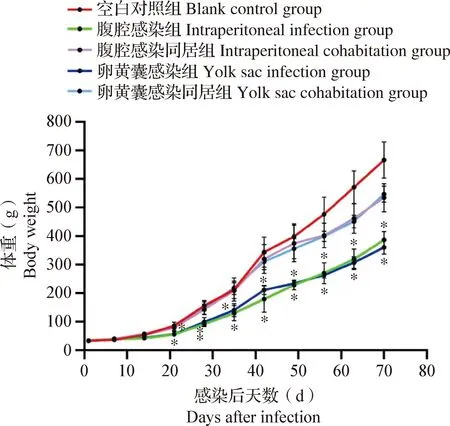
图1 各组SPF鸡的体重增长曲线
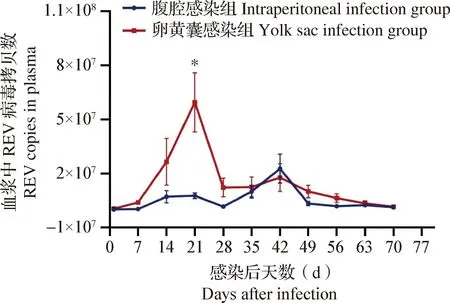
图2 各组SPF鸡血浆中REV病毒载量检测
2.2 不同感染方式对SPF鸡死亡率的影响 死亡率如表3所示,空白对照组SPF鸡未出现死亡,卵黄囊感染组SPF鸡在感染后第7天出现死亡,腹腔感染组SPF鸡在感染后第14天才开始出现死亡;与空白对照组相比,卵黄囊感染组SPF鸡的死亡率在感染后第49和63天显著升高(P<0.05),腹腔感染组SPF鸡的死亡率在感染后第42天显著升高,而2种感染方式的同居组SPF鸡死亡率与空白对照组相比均差异不显著(P>0.05)。结果表明,垂直传播感染REV更容易引起低日龄SPF鸡死亡。
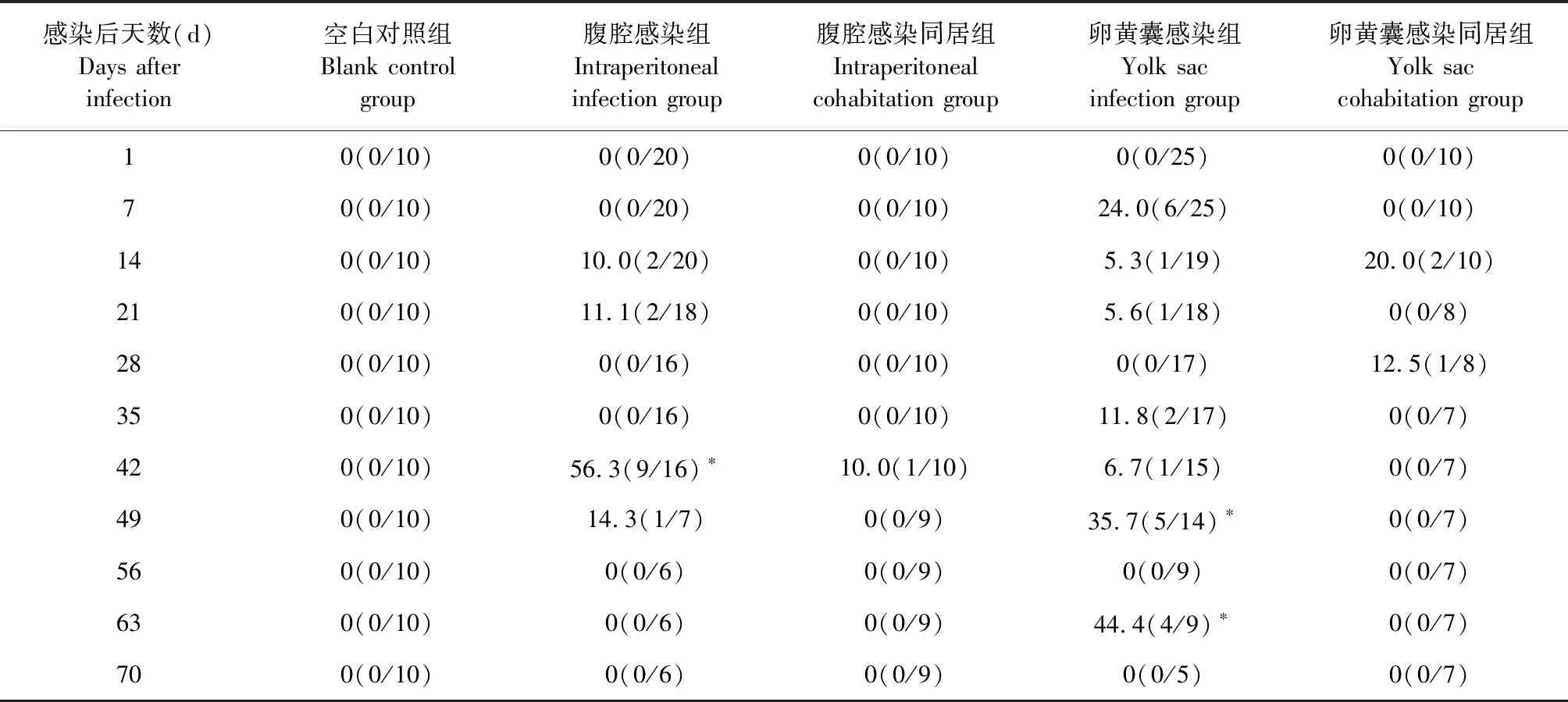
表3 各组SPF鸡的死亡率
2.3 不同感染方式对SPF鸡REV排毒情况的影响 IFA检测结果如表4所示,腹腔感染组SPF鸡在感染后第7天即可检测到病毒血症阳性,阳性率为15.0%(3/20),在感染后第14天时病毒血症阳性率高达100%;卵黄囊感染组SPF鸡病毒血症阳性率自感染后第1天开始即维持在89.5%~100%;而卵黄囊感染同居组的10只SPF鸡在同居的第7天,有2只SPF鸡呈病毒血症阳性;腹腔感染同居组的SPF鸡在同居的第21天才开始有病毒血症阳性出现,仅有1只SPF鸡呈病毒血症阳性。结果表明,通过垂直传播感染带毒的鸡更容易导致REV早期水平传播。
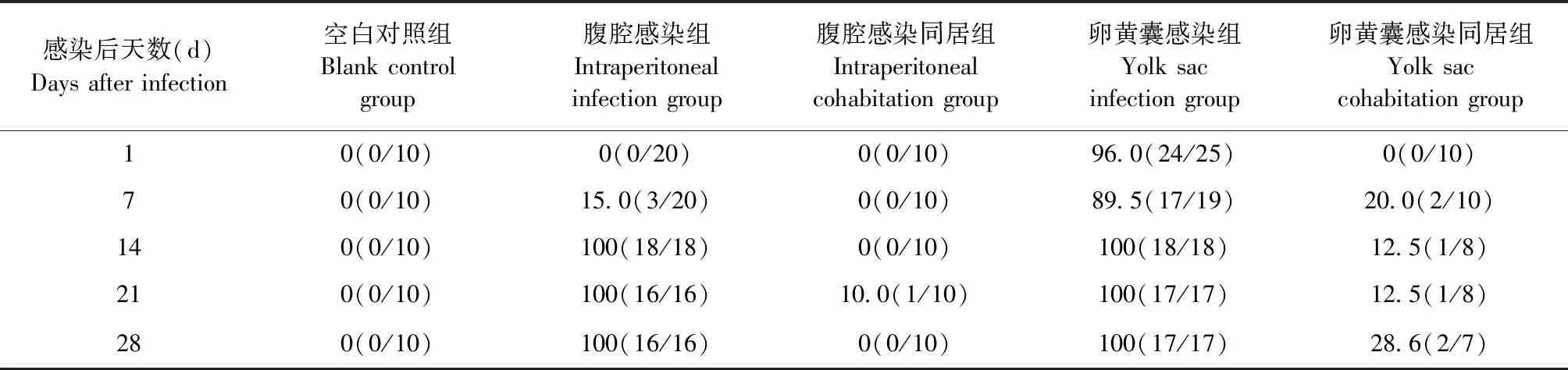
表4 各组SPF鸡的病毒血症阳性率
2.4 不同感染方式对SPF鸡血浆中REV阳性率的影响 RT-PCR检测结果如表5所示,卵黄囊感染组SPF鸡自出壳即能检测到血浆呈REV阳性,阳性率为36.0%;卵黄囊感染同居组SPF鸡在同居后第14天时可检测到血浆中REV核酸阳性,阳性率为12.5%;腹腔感染组SPF鸡在感染后第7天可检测到血浆中REV核酸阳性,阳性率为30.0%;腹腔感染同居组SPF鸡在同居后第42天可检测到血浆中REV核酸阳性,阳性率为11.1%。结果表明,早期感染REV的鸡,病毒会在体内不断增殖,形成持续的带毒和排毒状态。
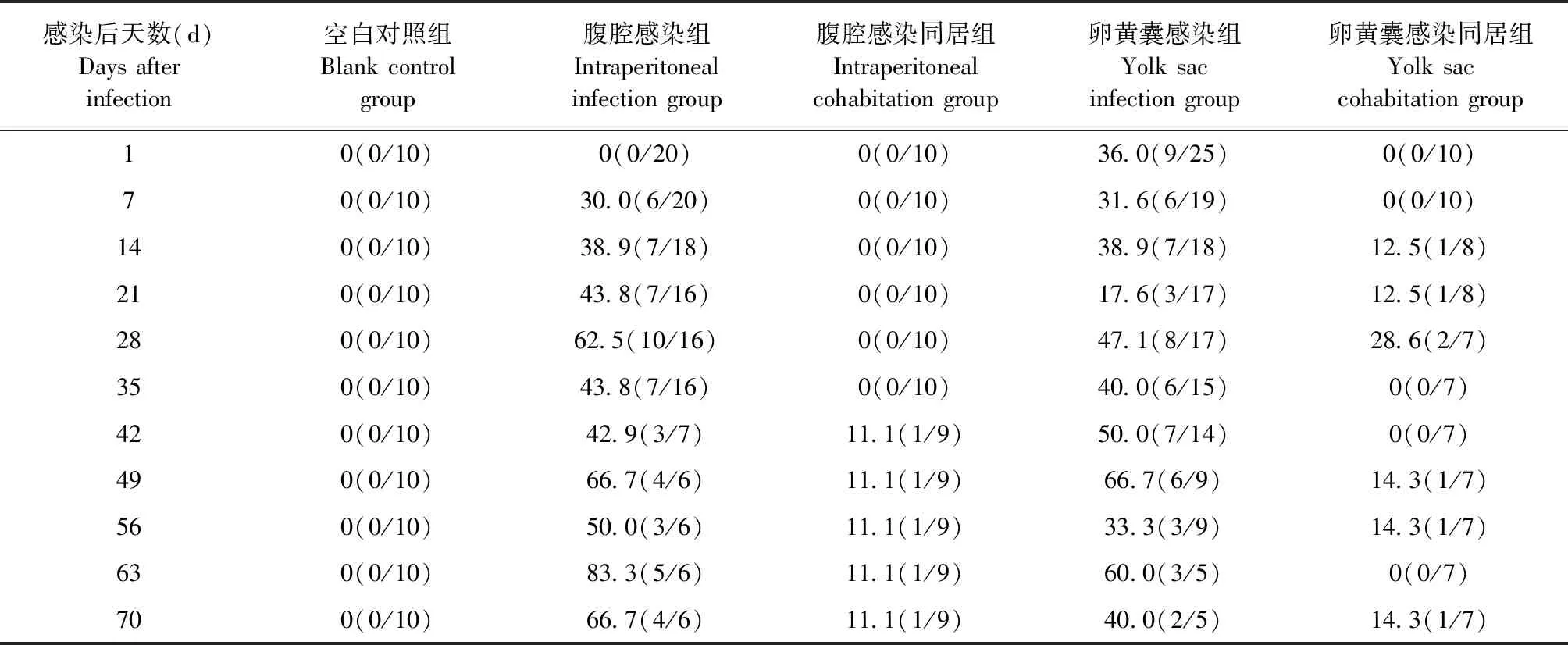
表5 各组SPF鸡血浆中REV阳性率
2.5 不同感染方式对SPF鸡血浆中REV阳性率和病毒载量的影响 RT-qPCR检测结果如表6和图2所示,卵黄囊感染组SPF鸡自出壳即为REV全部阳性,血浆中病毒载量在感染后第21天达到第1次高峰,随后逐渐下降;卵黄囊感染组SPF鸡血浆中REV病毒载量在感染后第21天显著高于腹腔感染组SPF鸡(P<0.05);卵黄囊感染同居组SPF鸡在同居后第7天可检测到血液中REV核酸阳性,阳性率为20.0%;腹腔感染组SPF鸡在感染后第7天可检测到血浆中REV核酸阳性,阳性率为80.0%,且血浆中病毒载量在感染后第42天达到高峰;腹腔感染同居组SPF鸡在同居后第21天可检测到血液中REV核酸阳性,阳性率为10.0%。

表6 各组SPF鸡血液中REV阳性率
3 讨论
RE作为禽类病毒性肿瘤病之一,其广泛流行给家禽业带来了严重经济损失[9-10]。鸡群感染本病后呈现食欲减退、精神倦怠等非特征性临床症状,常与禽白血病难以区分。研究表明,REV易感染低日龄禽类,引起禽类免疫功能紊乱[6]。该病目前尚无有效治疗措施,只能根据本病的感染方式和传播特点,定期对鸡群进行检测淘汰,从种源控制上降低本病的传播才能最大限度的发挥种禽生产性能。因此,系统了解不同途径感染REV后鸡群的病毒复制和排毒动态,对种禽企业科学制定REV净化方案有一定参考价值。
迄今为止,对鸡群通过垂直传播、自然感染和同居感染REV后的排毒规律仍缺乏系统的数据资料。本试验选择6胚龄SPF鸡胚和1日龄雏鸡感染2种方式分别建立了模拟REV垂直传播和水平传播感染的模型,同时还分别设置了2种感染方式的同居感染组,综合运用RT-PCR、RT-qPCR和IFA 三种检测技术,在系统的动物试验中对REV开展动态检测和比较分析。REV感染的危害具有明显的日龄相关性,越是低日龄的鸡感染发病越严重[11-12],而经垂直传播感染造成的危害是其中最严重的。本试验结果显示,与空白对照组相比,腹腔感染组和卵黄囊感染组SPF鸡体重增长在感染后第21~70天均受到显著抑制(P<0.05);卵黄囊感染组SPF鸡的死亡率在感染后第49和63天显著升高(P<0.05),腹腔感染组SPF鸡的死亡率在感染后第42天显著升高(P<0.05);而卵黄囊感染同居组和腹腔感染同居组SPF鸡体重增长和死亡率均无显著性差异。结果表明,与水平传播感染相比,REV更容易经垂直传播和早期腹腔感染而引起SPF鸡增重缓慢和死亡。
在对RE实施净化过程中,育雏过程中进行病毒分离是检测和淘汰REV阳性鸡的重要步骤之一[13]。本试验通过病毒分离观察了以不同方式感染REV后鸡群病毒血症情况,卵黄囊感染组SPF鸡自出壳就可检测到REV病毒血症阳性,阳性率维持在89.5%~100%,并自感染后第21天后一直维持100%阳性,这进一步证实了REV经鸡胚垂直传播容易形成持续性病毒血症。本试验腹腔感染组SPF鸡在感染后第7天时即可检测到REV病毒血症阳性,在感染后第14天时病毒血症阳性率可高达100%(18/18),且后续表现为持续性的病毒血症,这与崔帅[14]采用PCR结合核酸斑点杂交对腹腔接种REV的SPF鸡进行排毒情况的检测结果一致。可以看出,早期腹腔感染与垂直感染鸡的排毒规律类似,均显示持续性的病毒血症。本试验卵黄囊感染同居组的10只SPF鸡在感染后第7天时,有2只呈病毒血症阳性,但此后阳性率一直较低;腹腔感染同居组SPF鸡在感染后第21天时检出病毒血症阳性,与卵黄囊感染同居组一样维持较低阳性率。在连续10周的观察期内,卵黄囊感染同居组和腹腔感染同居组SPF鸡少部分出现一过性的病毒血症阳性,另一部分并未检测到REV。
与禽白血病病毒净化检测中存在内源性病毒核酸干扰的现象不同[15],通过核酸检测可以有效检出REV,目前已有应用RT-qPCR检测REV的相关报道[16-17],这为通过核酸检测REV进而实施净化工作提出了可能。本试验结合RT-qPCR、RT-PCR和IFA 三种检测方法对血液中的REV进行检测,结果显示,RT-qPCR与IFA的检测结果高度吻合,而RT-PCR的检出率显著低于另二者,表明鸡群感染REV后,可考虑联合应用RT-qPCR和IFA检测REV以提高净化淘汰效率。
综上所述,本试验通过多种检测技术分析经不同途径感染REV后鸡群血液中的带毒情况,发现早期腹腔感染与垂直感染鸡的排毒规律类似,均显示持续性的病毒血症,联合应用RT-qPCR和IFA检测REV适用性强,为将来制定REV净化方案提供了数据参考。
