从炎症反应和氧化应激观察参芎正瘫丸治疗缺血性脑卒中临床疗效及其作用机制
2024-04-30郭子华李丹张丹吴茜姬新颖
郭子华,李丹,张丹,吴茜,姬新颖
1. 开封市第二中医院脑病科,河南 开封 475004
2. 开封市中医院药学部,河南 开封 475000
3. 开封市中医院脑病科,河南 开封 475000
4. 河南大学河南省核蛋白基因调控国际联合实验室,河南 开封 475000
缺血性脑卒中除了局部性脑损伤以外,还会造成其他器官功能异常,卒中发生后的全身病理改变又反过来加重缺血性脑损伤[1]。在一系列病理改变中,由各种炎性细胞介导的炎性反应贯穿整个病理反应过程,且在缺血发生早期,脑细胞发生一系列化学反应,激活炎性因子表达,大量肿瘤坏死因子等有害物质聚集,加重脑缺血与神经元凋亡,故在急性期缺血性脑卒中病情发生与发展过程中,由炎性因子介导的炎性级联反应发挥至关重要的作用[2]。抑制核因子κB(NF-κB)在神经元、神经胶质细胞和脑血管内皮细胞中通常有较低量的表达。缺血时神经细胞、胶质细胞和脑血管内皮细胞中的NF-κB 被激活,活化的NF-κB 可促使白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等细胞因子表达上调,而这些因子反过来又可以激活NF-κB,从而使NF-κB活化在组织间不断扩散,加重了炎症反应[3]。当缺血性脑卒中发生时,活性氧(ROS)生成-消除平衡被破坏,使得ROS 过量产生,ROS 不仅能直接使膜脂质、蛋白质及脱氧核糖核酸(DNA)等大分子物质发生氧化损害而破坏细胞膜及其它细胞结构,还能通过抑制线粒体功能间接的激活凋亡信号通路,导致细胞发生死亡[4]。因此,当缺血性脑卒中发生时,通过降低ROS 的水平,会对缺血性脑卒中的治疗产生有益的影响。中医学认为,缺血性脑卒中的发生与各种病因引起的瘀血有关,开封市中医院研制的参芎正瘫丸对瘀血阻络型缺血性脑卒中有明显的优势,但其作用机制尚不明确,结合现代药理,推测其发挥疗效可能与调控氧化应激与炎性反应有关,故本研究基于血清分子水平研究其可能的作用机制及靶点[5]。
1 临床资料
1.1 纳入标准 符合西医急性缺血性脑卒中的诊断标准[6]。符合中医中风病瘀血阻络型的辨证标准[7],主症:半身不遂,言语謇涩或不语,口舌歪斜,偏身感觉异常。次症:头痛、痛处固定,眩晕,肢体麻木,饮水呛咳,目偏不瞬,肌肤甲错,口唇颜色紫暗。舌:苔薄白、白腻,质紫黯或见瘀点、瘀斑,舌底脉络粗大迂曲。脉:细涩或结代。具备主症2 项,或主症1 项、次症2 项及以上,结合舌脉即可辨证。发病时间≤72 h;40 岁≤年龄≤80岁;美国国立卫生院神经功能缺损量表(NIHSS)评分4~12 分;依从性良好,了解研究内容并签署相关知情同意书。
1.2 排除标准 进行血管内治疗者,如溶栓或者取栓等;疾病处于进展期以及心源性脑卒中;伴有消化道出血者;存在血液系统障碍、肝肾心肺等重要脏器功能严重受损以及恶性肿瘤疾病者;伴有精神疾病或认知障碍者;对试验研究药物过敏者。
1.3 脱落标准 需更换治疗方案;试验过程中因各种不可控因素停止或者更改治疗;中途失联;中医证候出现变化者;统计数据处理前核查与试验研究方案不符合者。
1.4 一般资料 选取2022 年1 月—2023 年3 月开封市中医院收治的83 例瘀血阻络型急性期缺血性脑卒中患者作为研究对象,以随机数字表法分为2组。治疗组42 例因个人原因停止服药脱落1 例,最后完成观察41 例。本研究最后共纳入患者82 例。对照组41例,男22例,女19例;年龄40~79岁,平均(71.93±2.18)岁;病程12~55 h,平均(38.15±1.21)h;基础疾病:高血压病35例,糖尿病22例,高脂血症10例。治疗组41 例,男19 例,女22 例;年龄41~80 岁,平均(72.11±2.51)岁;病程12~56 h,平均(39.46±1.38)h;基础疾病:高血压病32 例,糖尿病患者21 例,高脂血症13 例。2 组一般资料经统计学处理,差异均无统计学意义(P>0.05),具有可比性。本研究已经开封市中医院医学伦理委员会审核并批准,所有患者及其家属充分了解具体研究内容,并签署知情同意书。
2 治疗方法
2.1 对照组 给予常规西医治疗。给予吸氧、心电监护等;抗血小板聚集,予阿司匹林肠溶片(拜耳医药保健有限公司,国药准字J20171021,100 mg/片),每次0.1 g,每天1 次;调脂稳斑,予阿托伐他汀钙片(辉瑞制药有限公司,国药准字H20051408,20 mg/片),每次20 mg,每天1 次;根据患者情况给予降颅压、抗凝、降纤、改善侧枝循环、改善脑代谢等治疗,合并高血压病、糖尿病者给予控制血压、控制血糖治疗。
2.2 治疗组 在对照组治疗方案的基础上给予参芎正瘫丸(豫药制备字Z20200081000),每次6 g,每天2次。
2组均连续治疗2周。
3 观察指标与统计学方法
3.1 观察指标 ①凝血指标水平。分别于治疗前后检测并记录2组患者凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)、纤维蛋白原(FIB)水平。②相关炎性因子水平。分别于治疗前后采集2组患者清晨空腹静脉血3 mL,检测并记录2组血清NF-κB、TNF-α、IL-6 水平。③氧化应激指标水平。标本同上,检测并记录2组血清ROS水平。④不良反应发生情况以及药物安全性。记录2组在试验过程中出现的用药相关不良反应发生情况,治疗前后常规检测血常规、尿便常规、心电图以及肝肾功能。⑤中医证候疗效评估[8]。⑥临床疗效。
3.2 统计学方法 通过SPSS26.0 统计学软件分析数据,氧化应激、炎症因子指标等计量资料用均数±标准差()表示,等级资料采用秩和检验,其他指标数据首先进行正态性检验和方差齐性检验,在各组数据均正态分布且方差齐性的条件下,用One-way ANOVA 及t检验进行组间比较;方差不齐时采用非参数检验。以P<0.05为差异有统计学意义。
4 疗效标准与治疗结果
4.1 疗效标准 ①中医证候疗效评价标准。临床痊愈:治疗前后症状、体征消失或基本消失,95%≤证候积分减少幅度≤100%。显效:临床症状、体征明显改善,70%≤证候积分减少幅度<95%。有效:临床症状、体征均有所好转,30%≤证候积分减少幅度<70%。无效:临床症状、体征未见明显改善,证候积分减少幅度<30%。总有效率=[(临床痊愈例数+显效例数+有效例数)/总例数]×100%。②临床疗效标准。参考全国第四次脑血管病学术会议制定的疗效标准。基本痊愈:治疗前后比较,90%≤NIHSS 评分下降幅度≤100%;显著进步:46%≤NIHSS 评分下降幅度≤89%;进步:18%≤NIHSS评分下降幅度≤45%;无效:NIHSS 评分下降幅度<18%,或增加;恶化:NIHSS 评分增加>18%。显效率=[(基本痊愈例数+显著进步例数)/总例数]×100%,总有效率=[(基本痊愈例数+显著进步例数+进步例数)/总例数]×100%。
4.2 2 组治疗前后相关炎性因子指标水平比较 见表1。治疗前,2 组相关炎性因子指标水平比较,差异均无统计学意义(P>0.05),具有可比性。治疗后,2组NF-κB、TNF-α、IL-6 水平均较治疗前下降,且治疗组NF-κB、TNF-α、IL-6 水平均低于对照组,差异均有统计学意义(P<0.05)。
表1 2组治疗前后相关炎性因子指标水平比较()
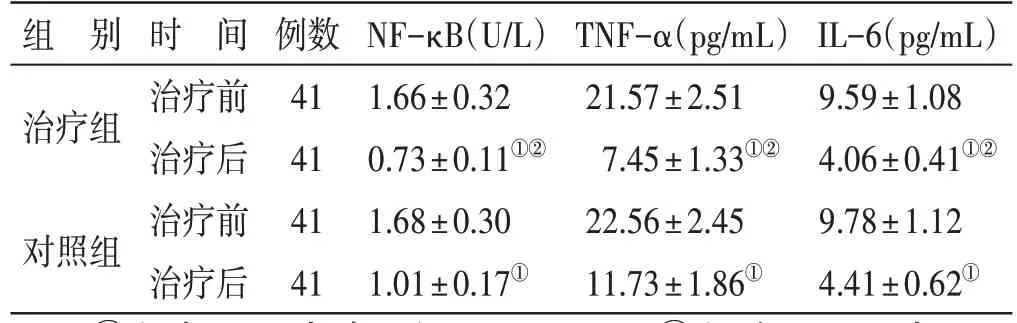
表1 2组治疗前后相关炎性因子指标水平比较()
注:①与本组治疗前比较,P<0.05;②与对照组治疗后比较,P<0.05
IL-6(pg/mL)9.59±1.08 4.06±0.41①②9.78±1.12 4.41±0.62①组 别治疗组对照组时 间治疗前治疗后治疗前治疗后例数41 41 41 41 NF-κB(U/L)1.66±0.32 0.73±0.11①②1.68±0.30 1.01±0.17①TNF-α(pg/mL)21.57±2.51 7.45±1.33①②22.56±2.45 11.73±1.86①
4.3 2 组氧化应激指标水平及凝血功能指标水平比较 见表2。治疗前,2 组氧化应激指标水平及凝血功能指标水平比较,差异均无统计学意义(P>0.05),具有可比性。治疗后,2 组PT、APTT 及SOD 水平均较治疗前升高,ROS 及FIB 水平均较治疗前降低,且治疗组PT、APTT、SOD 水平均高于对照组,ROS 及FIB 水平均低于对照组,差异均有统计学意义(P<0.05)。
表2 2组氧化应激指标水平及凝血功能指标水平比较()
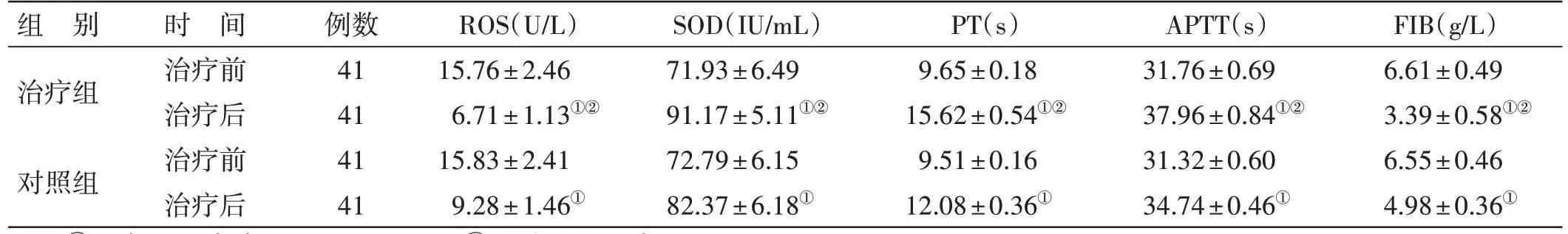
表2 2组氧化应激指标水平及凝血功能指标水平比较()
注:①与本组治疗前比较,P<0.05;②与对照组治疗后比较,P<0.05
FIB(g/L)6.61±0.49 3.39±0.58①②6.55±0.46 4.98±0.36①组 别治疗组对照组时 间治疗前治疗后治疗前治疗后例数41 41 41 41 ROS(U/L)15.76±2.46 6.71±1.13①②15.83±2.41 9.28±1.46①SOD(IU/mL)71.93±6.49 91.17±5.11①②72.79±6.15 82.37±6.18①PT(s)9.65±0.18 15.62±0.54①②9.51±0.16 12.08±0.36①APTT(s)31.76±0.69 37.96±0.84①②31.32±0.60 34.74±0.46①
4.4 2 组中医证候疗效比较 见表3。中医证候疗效总有效率治疗组95.12%,对照组80.49%,2 组中医证候疗效比较,差异有统计学意义(P<0.05)。

表3 2组中医证候疗效比较 例(%)
4.5 2组临床疗效比较 见表4。治疗后,临床疗效显效率治疗组53.66%,对照组31.71%,2 组比较,差异有统计学意义(P<0.05);总有效率治疗组87.80%,对照组78.05%,2组总有效率比较,差异无统计学意义(P>0.05)。

表4 2组临床疗效比较 例(%)
4.6 2 组不良反应发生率比较 在研究过程中,对照组发生1 例腹泻,1 例皮疹,3 例食欲减退,总不良反应发生率12.20%(5/41);治疗组发生1 例皮疹,2 例食欲减退,1 例腹胀,总不良反应发生率9.76%(4/41),症状轻微,未经特殊处理,休息或对症处理后症状消失,其余心电图、血尿便常规、肝肾功能均未出现明显异常。2 组总不良反应发生率比较,差异无统计学意义(P>0.05)。
5 讨论
缺血性脑卒中属中医中风范畴。中医学认为,瘀血是导致中风发生的主要病理因素,在疾病发生发展过程中起重要作用,且贯穿疾病始终。除了中医宏观上的瘀血阻滞、血行不畅,还能延伸至微循环障碍、微血栓,现代医学也认为缺血性脑卒中发病的主要病理基础就是血栓形成、血管闭塞,故应用活血化瘀通络之法是中风病的主要治疗原则之一[9]。现代研究发现,血瘀证的差异代谢产物与炎症反应、氧化应激等多条信号通路有关,急性期缺血性卒中血瘀证的严重程度与IL-6 等炎症因子水平呈正相关,临床早期监测这些指标可评估病情严重程度,能更好地指导活血化瘀类中药的应用[10-11]。参芎正瘫丸由丹参、川芎、水蛭、全蝎四味药组成,药物精简,具有活血祛瘀、疏通经络的功效,治疗缺血性脑卒中确有明显的优势,经过临床应用,取得了较好的疗效反馈。
脑卒中病位在脑窍,素体正气亏虚,或因年长脏腑因虚衰导致功能下降及失调,导致气血津液代谢异常,加之情志、饮食等外界因素影响,气滞、气虚导致血行不畅,阴液亏虚导致血液黏滞,留而成瘀,瘀血阻滞经络,络脉瘀阻,发为中风[12]。本研究结果示,治疗组显效率、中医证候总有效率均高于对照组,凝血方面可见治疗组PT及APTT水平均较对照组高,FIB 水平则低于对照组,提示参芎正瘫丸联合常规西医治疗能有效提高临床疗效,改善血液高凝状态,效果优于单纯西药治疗。
参芎正瘫丸中君以丹参活血化瘀,祛瘀生新,丹参专走血分,擅通行血脉,广泛应用于各种瘀血病症。臣以水蛭、全蝎破血逐瘀,通络止痛。水蛭破血之力峻猛,全蝎熄风镇痉通络,二者相须为用,协同丹参加强活血通络之功。佐以川芎行气活血,川芎性擅走窜,乃血中气药,上可至头目,下可行血海,一往直前,走而不守。诸药合用,共奏活血祛瘀、疏通经络之功。在脑卒中的用药规律及配伍探索中发现,川芎是缺血性卒中治疗中使用频次最高的,丹参-川芎也是使用频次很高的核心配伍组合,水蛭、全蝎在虫类药治疗缺血性中风中出现频率最高,且经常作为药对使用,用以增强疗效,与活血类药物配伍使用能够加大活血化瘀通络之力,改善血液高凝状态[13-14]。
2 组总不良反应发生率比较,差异无统计学意义(P>0.05),不良反应发生率相当,表明与常规西医治疗相比较,增加参芎正瘫丸治疗未增加不良反应发生风险。有研究表明,性期脑卒中后给药时机过早有引发神经系统并发症的风险,活血化瘀等药物可能会导致组织产生类似再灌注损伤的效应,应用需要慎重[15],本研究结果证明了参芎正瘫丸的安全性,但是急性期用药时机的严格把控也是需要重视的问题,日后可针对此方面进行进一步的研究探讨。
脑缺血损伤与炎症反应密切相关,NF-κB 属于转录因子家族成员之一,是主导炎症发生、发展的关键因子,当NF-κB信号通路激活后,会诱导TNF-α mRNA、IL-6 mRNA 转录,从而影响TNF-α 及IL-6因子含量,扩大炎症反应形成恶性循环[16]。本研究结果表明,脑梗死治疗后NF-κB、TNF-α、IL-6 水平均较治疗前降低,且治疗组水平低于对照组,提示常规治疗联合参芎正瘫丸能有效降低炎症因子水平,效果优于单纯西医治疗。现代药理研究表明,川芎、水蛭的提取物能通过抑制NF-κB蛋白二聚体p65的表达,阻止p65 与DNA 结合,从而有效抑制促炎因子mRNA 表达水平,抑制NF-κB 通路减少炎症介质释放,NF-κB 作为细胞内的重要转录因子,影响着包括黏附分子、细胞因子等在内的炎症和免疫反应基因的转录,脑缺血发生后多种黏附分子,如P-选择素、细胞间黏附分子等的表达均显著提高,而这些黏附分子的基因中均有NF-κB的结合位点,水蛭酶解提取物能够降低内皮细胞对单核细胞的黏附率和迁移率,抑制NF-κB 信号通路的活化,达到抗炎的目的[17-18];全蝎有效成分槲皮素、山奈酚能作用于丝裂原活化蛋白酶、磷脂酰肌醇3 激酶/蛋白激酶B(PI3K/Akt)、IL-6/mIL-6R 等信号通路靶点,也能直接下调NF-κB基因表达,有效调节炎症介质表达水平,抑制相关炎症因子TNF-α、IL-6 的分泌,调节促炎酶活性,从而有效抑制炎症的产生[19]。
生物环境中,ROS 是正常氧气代谢的副产品,当缺血性脑卒中发生时,机体受到刺激,ROS 生成-消除平衡被破坏,使得ROS 含量急剧升高,这些ROS 不仅能直接使膜脂质、蛋白质及DNA 等大分子物质发生氧化损害而破坏细胞膜及其它细胞结构,还能通过抑制线粒体功能间接激活凋亡信号通路,导致细胞发生死亡[20];核因子红细胞系2 相关因子2(Nrf2)是抗氧化调节的重要蛋白,当机体受损时,Nrf2 迅速进入细胞核与DNA 启动子相结合,启动抗氧化蛋白的转录,SOD 就是其下游蛋白,通过清除氧自由基发挥抗氧化作用[21]。研究结果可见,2 组治疗后SOD 水平较治疗前升高,ROS 水平均较治疗前降低,且治疗组SOD 水平高于对照组,ROS 低于对照组,提示常规西药治疗联合参芎正瘫丸能有效提升SOD 表达,清除ROS,效果优于单纯西药治疗。研究表明,丹参具有抗血小板聚集的作用,其提取物丹参酮ⅡA可能是通过激活Nrf2调节通路,调节果糖二磷酸醛缩酶C 的(ALDOC)表达从而调控糖酵解及自噬,对海马神经元放射性损伤起到保护作用,同时能够通过缓解脂质过氧化引发的细胞膜损伤,从而预防动脉粥样硬化斑块破裂[22-23];丹参-川芎药对中,川芎嗪与丹参酮ⅡA能减少氧化型低密度脂蛋白(ox-LDL)产生,氧化应激反应中,ox-LDL 等能诱导ROS 的产生,促进氧化应激反应、诱导炎症反应,损伤血管内皮功能,血管内皮功能受损是心脑血管病的启动环节,连接氧化应激与炎症的关键通路即NF-κB,TNF-α 通过NF-κB 相关信号通路诱导血管炎症标志蛋白正五聚蛋白3(PTX3)的表达,丹参酮ⅡA 能通过抑制该通路,降低PTX3 蛋白水平,从而减少内皮炎症反应,共同发挥抗炎、抗氧化应激的作用;同时,丹参-川芎药对与PI3K/Akt 信号通路也密切相关,能降低Caspase-3 蛋白表达,实现超氧化物产生的功能[24-25];水蛭酶解物也可以通过影响自噬过程来抑制ox-LDL 的氧化损伤过程,显著提升总超氧化物歧化酶(T-SOD)活性,提高SOD 含量,抑制自由基损伤,从而发挥减轻脑水肿、保护脑组织的作用[26]。
综上所述,参芎正瘫丸能通过调控ROS、NF-κB相关信号通路,降低相关炎性因子水平及炎性因子基因表达,提高SOD,减少ROS,调整体内氧化与抗氧化失衡状态,改善血液高凝状态,防止脑缺血后的神经功能恶化,从而有效发挥治疗缺血性脑卒中的作用,临床疗效确切,且未增加不良反应发生风险。
