达格列净对ApoE-/-小鼠单核巨噬细胞系统及动脉粥样硬化的影响
2024-04-29李宵王丹丹马巍李兵贾俊栋王泰然赵季红
李宵 王丹丹 马巍 李兵 贾俊栋 王泰然 赵季红


摘要 目的:研究达格列净对载脂蛋白E基因敲除(ApoE-/-)小鼠动脉粥样硬化(AS)斑块的影响,探讨其抗AS作用的可能机制。方法:16只8周龄雄性ApoE-/-小鼠高脂饮食喂养8周形成AS模型后,随机分为对照组和实验组,每组8只,实验组予达格列净干预,对照组予同等剂量的生理盐水,两组干预4周后取材。油红O染色检测主动脉及主动脉瓣AS斑块面积比例;流式细胞术分析循环中单核细胞亚群的比例(Ly6G-CD11b+Ly6Chi和 Ly6G-CD11b+Ly6Clo);免疫荧光染色和共聚焦显微镜成像检测斑块内的巨噬细胞和增殖的巨噬细胞(F4/80和Ki67双阳性细胞);酶联免疫吸附法(ELISA)检测血清中总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)的水平。结果:实验组与对照组比较有降低主动脉及主动脉瓣斑块负荷的作用,降低循环中Ly6Chi单核细胞比例,降低斑块内增殖巨噬细胞比例,降低LDL-C水平,且具有升高HDL-C作用。结论:达格列净可减轻ApoE-/-小鼠AS负荷的作用,可能与调节单核细胞亚群和血脂代谢相关。
关键词 动脉粥样硬化;达格列净;单核细胞亚群;增殖巨噬细胞;血脂;实验研究
doi:10.12102/j.issn.1672-1349.2024.03.012
基金项目 邯郸市科学技术研究与发展计划项目(No.21422083111)
作者单位 1.邯郸市中心医院(河北邯郸056001),E-mail:lixiao130406@163.com;2.华北医疗健康集团峰峰矿区总医院;3.武警特色医学中心/天津市心血管重塑与靶器官损伤重点实验室
引用信息 李宵,王丹丹,马巍,等.达格列净对ApoE-/-小鼠单核巨噬细胞系统及动脉粥样硬化的影响[J].中西医结合心脑血管病杂志,2024,22(3):470-474.
动脉粥样硬化(atherosclerosis,AS)是导致心血管疾病的主要病理生理基础,其发病机制有多种学说,包括脂质浸润学说、慢性炎症学说等[1],其特征是动脉壁内膜发生明显的慢性炎症反应,而单核巨噬细胞系统参与了炎症反应的过程,在AS的进程中发挥了重要作用[2]。达格列净作为钠-葡萄糖协同转运体2(sodium glucose co-transporters 2,SGLT2)抑制剂,是用于治疗糖尿病相对新的一类抗高血糖药物。国外一些临床研究已经证实,达格列净可以降低糖尿病病人心血管疾病的发生率。有临床研究也证实,达格列净能够通过降低核苷酸结合寡聚化结构域样受体蛋白-3的活化,减少白细胞介素-1β(interleukin 1β,IL-1β)、白细胞介素-18(interleukin 18,IL-18)等炎性因子的产生和释放,发挥抗AS形成的功效[3],而单核巨噬细胞系统的变化参与了炎症反应会直接影响动脉粥样硬化的进展[4]。因此,设想达格列净是否能通过单核巨噬细胞系统发挥抗炎作用,进而影响动脉粥样硬化进程。为了验证该假设,本研究通过给载脂蛋白E基因敲除(ApoE-/-)小鼠喂食高脂饲料构建AS模型,并观察达格列净对单核巨噬细胞系统及AS的影响。
1 材料与方法
1.1 主要仪器与试剂
油红O购自Sigma公司,USA;酶联免疫吸附法(ELISA)试剂盒购自北京艾然生物有限公司;流式细胞仪(Cytomics FC 500,Beckman Coulter,USA);荧光显微镜(ECLIPSE 80i,Nikon,Japan);激光扫描共聚焦显微镜(TCS SP8,Leica,Germany);冰冻切片机(CM7500,Leica,Germany);抗CD11b-PE、抗Ly6G-PerCP/Cy5.5和抗Ly6C-FITC均购自Biolegend公司,USA;抗F4/80、抗Ki67均购自Abcam公司,USA;FITC标记山羊抗小鼠二抗、TRITC标记山羊抗兔二抗均购自ImmunoReagents公司,USA;Mounting medium with DAPI,购自中杉金桥公司,中国;其余国产试剂均为分析纯;高脂饲料及正常饲料购自江苏省南通特洛菲饲料科技有限公司。
1.2 实验动物
16只8周龄ApoE-/-小鼠,雄性,体质量22~25 g,购自北京维通利华实验动物技术有限公司,许可证号为 SCXK(京)2102-0001,实验前均经 DNA 检测为纯合子。
1.3 动物模型的制备、标本的采集和处理
将小鼠高脂饮食喂养8周形成AS后,随机分为对照组和实验组,每组8只。实验组喂食达格列净剂量为1 mg/(kg·d),对照组给予同等剂量的生理盐水。喂养4周后,麻醉并通过摘眼球取血,第1滴血用于检测单核细胞亚群,剩余血液制备血清检测总胆固醇(total cholesterol,TC)、三酰甘油(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)的水平,留取主动脉及主动脉瓣进行病理染色。本实验小鼠的饲养、模型制备、标本采集及处理均在天津市心血管重塑与靶器官损伤重点实验室进行。
1.4 油红O染色
主动脉和主动脉瓣进行油红O染色,在光学显微镜下观察主动脉和主动脉瓣的斑块及斑块负荷。具体方法参照本实验室前期研究[5],采用图像分析软件(Image Pro Plus,IPP)计算主动脉斑块的面积、主动脉的面积、主动脉瓣斑块面积和血管横断面面积,主动脉斑块负荷=主动脉斑块面积/主动脉面积,主动脉瓣斑块负荷=主动脉瓣斑块面积/血管横断面面积。
1.5 流式细胞术检测循环Ly6G-CD11b+Ly6Chi单核细胞亚群比例
参照本实验室前期建立的方法进行检测[5],具体步骤:取100 μL抗凝全血加入 Ly6G-PerCP/Cy 5.5,Ly6C-FITC,CD11b-PE,cell staining buffer吹打混匀,室温避光孵育15 min,加入600 μL红细胞裂解液,上机检测,FlowJo 7.6.1软件分析流式细胞术结果。
1.6 免疫荧光染色
参照本实验室前期建立的方法进行免疫荧光染色[5],将冷冻的主动脉瓣切片于室温解冻,1%的TritonX-100破膜20 min,山羊血清封闭20 min,加入大鼠抗小鼠单抗F4/80(1∶100)和兔抗小鼠多抗Ki67(1∶300)4 ℃孵育过夜,次日加入山羊抗兔IgG,TRITC 和山羊抗大鼠Ig G,FITC,室温孵育1 h,含DAPI的防淬灭封片剂封片。巨噬细胞和增殖巨噬细胞密度计算如下,采用图像分析软件IPP计算荧光显微镜拍摄视野内巨噬细胞和增殖巨噬细胞(F4/80和Ki67双阳性细胞)个数和斑块面积,增殖巨噬细胞比例=增殖巨噬细胞密度/巨噬细胞密度。
1.7 血清血脂水平测定
按照本实验室前期建立的方法[5],取出血清复温后,按照试剂盒说明书进行实验操作,ELISA分析TC、TG、LDL-C、HDL-C水平。
1.8 统计学处理
采用Graph Pad Prism6进行统计学分析,符合正态分布的定量资料以均数±标准差(x-±s)表示,组间比较采取独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
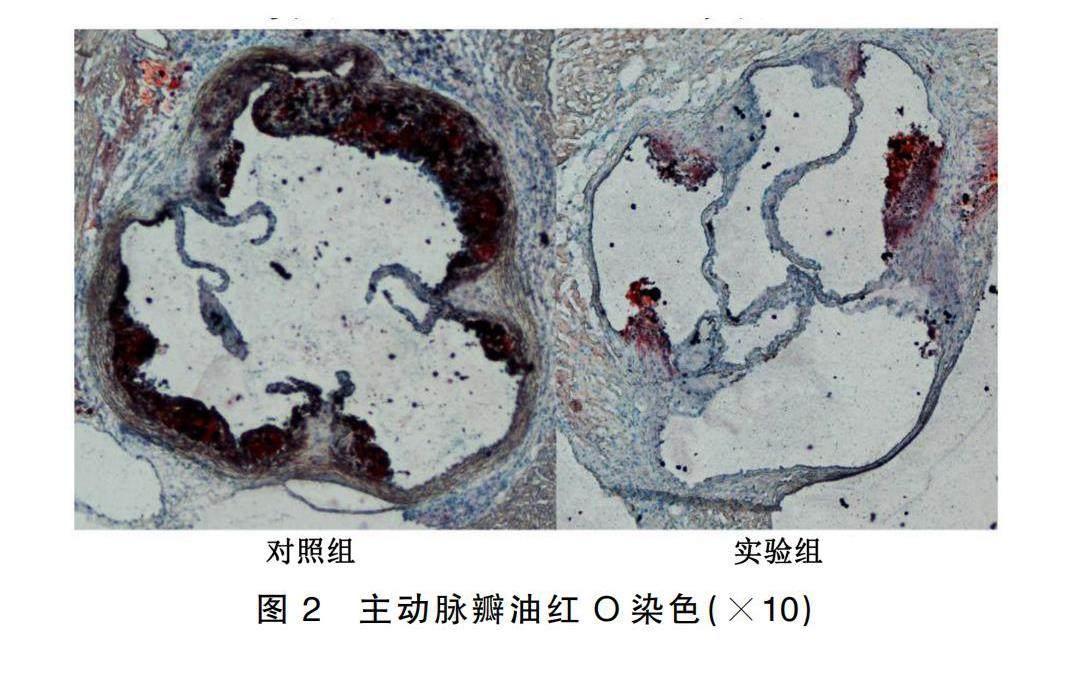
2.1 各组油红O染色结果
主动脉经油红O染色,红色即为AS斑块区域(见图1),实验组与对照组比较,主动脉内斑块负荷量减轻,差异有统计学意义(0.150±0.007与 0.121±0.007,P=0.010)。主动脉瓣经油红O染色,红色即为AS斑块区域(见图2);经统计学分析后提示,实验组主动脉瓣的斑块负荷较对照组降低,差异有统计学意义(0.329 9±0.009 0 与 0.270 0±0.012 5,P=0.001 6)。详见图3。
2.2 循环中单核细胞亚群比值结果
循环中单核细胞亚群的设门策略详见图4,通过 FlowJo 7.6.1 软件分析数据,实验组与对照组比较,循环中Ly6Chi比例下降,差异有统计学意义(0.3299±0.009 0 与 0.270 0±0.012 5,P=0.001 6)。详见图5。
2.3 主动脉瓣AS斑块内增殖巨噬细胞比例
主动脉瓣经免疫荧光染色后,通过激光共聚焦观察,其中蓝色为DAPI标记细胞核所激发荧光,绿色为FITC标记F4/80所激发荧光,红色为TRITC标记Ki67所激发荧光,结果所示DAPI和FITC双阳性表示巨噬细胞(蓝色和绿色共存),DAPI、FITC和TRITC三色标记同时在一个细胞则证明为增殖的巨噬细胞(粉色和绿色共存,见图6)。实验组与对照组比较,斑块内增殖巨噬细胞比例下降,差异有统计学意义(0.3500±0.022 4 与 0.273 8±0.024 6,P=0.037 9)。详见图7。
2.4 小鼠血清中血脂比较
实验组与对照组比较,血清中TG水平下降,差异有统计学意义[(3.61±0.17)mmol/L与(0.29±0.22)mmol/L,P=0.021],HDL-C的水平升高,差异有统计学意义[(2.72±0.16)mmol/L与(3.15±0.13)mmol/L,P=0.048],但TC[(24.06±0.99)mmol/L与(23.16±0.95)mmol/L,P=0.525]及LDL-C[(22.68±0.79)mmol/L与(21.10±1.11)mmol/L,P=0.262]水平下降,两组比较差异无统计学意义。详见图8。
3 讨 论
AS是心血管疾病、外周动脉及脑血管疾病发病的基础,动脉血管内皮下斑块的形成导致血管腔明显狭窄,引起组织缺血缺氧,大部分心肌梗死是由于AS斑块破裂导致自发血栓形成阻塞血管引起的,这也是全球最常见的死因[6]。AS的药物治疗非常有限主要是抗血小板聚集、调脂稳斑、降低心肌耗氧量、抑制心室重塑,近年来,有研究发现,达格列净可以降低大鼠心肌组织中的肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1β、单核细胞趋化因子-1(MCP-1)的水平,延缓心室重塑进程[7];也有研究发现,达格列净可通过抑制炎性因子 IL-1β、IL-18 的产生和释放,降低糖尿病ApoE-/-小鼠主动脉及主动脉瓣区AS斑块负荷[3],2021年《老年人慢性心力衰竭诊治中国专家共识(2021)》中推荐SGLT-2抑制剂可有效降低心力衰竭病人死亡率,适用于美国纽约心脏病协会(NYHA) 心功能分级Ⅱ~Ⅳ级射血分数降低的心力衰竭(HFrEF)病人[8],达格列净对心血管保护作用的证据越来越多。
本研究发现,达格列净可以降低主动脉及主动脉瓣斑块的负荷,存在抑制AS进程的作用。单核巨噬细胞系统可以影响AS的进程,小鼠循环中单核细胞通过Ly6C的表达量不同可分为Ly6Chi和Ly6Clo两种亚型,发挥不同的功能,健康小鼠的单核细胞中50%~60%为Ly6Chi亚型,机体发生炎症反应的状态下,骨髓和脾脏中单核细胞的生成增加,使Ly6Chi单核细胞亚型明显升高,发挥抗炎作用[9]。通过单核细胞亚群结果的柱状图,发现达格列净可降低Ly6Chi亚型的比例,抑制炎症反应。传统的观点认为单核细胞通过血液循环到达局部组织分化为巨噬细胞,但是近些年有研究证实了巨噬细胞在局部有增殖的现象,并且增殖巨噬细胞在动脉粥样硬化斑块进展过程中发挥了重要作用[10],具体机制可能是平滑肌细胞和内皮细胞分泌的巨噬细胞集落刺激因子刺激局部巨噬细胞的自我增殖[11]。本课题组前期研究通过免疫荧光染色技术证明了斑块内增殖巨噬细胞的存在[12],提示达格列净存在降低主动脉瓣斑块内增殖巨噬细胞比例的作用,存在抑制AS的进程。由此分析,达格列净可能通过调节单核巨噬细胞系统发挥抑制AS进展的作用。
脂质代谢紊乱是AS的主要危险因素,目前文献报道SGLT2抑制剂对血脂谱的影响尚无定论,但多为改善或中性结局,也有研究表明可升高LDL-C水平,但具体机制目前尚未明确[13-14]。本研究发现,在达格列净有降低TG和升高HDL-C水平的作用,说明达格列净有调节血脂代谢的作用,这也可能是其发挥抗AS作用的潜在机制。
综上所述,达格列净可能通过影响单核巨噬细胞系统及血脂代谢发挥抗AS的作用,为AS的治疗提供了新的思路,但具体的分子机制仍需进一步探索。
参考文献:
[1] PEDRO-BOTET J,CLIMENT E,BENAIGES D.Atherosclerosis and inflammation.New therapeutic approaches[J].Med Clin,2020,155(6):256-262.
[2] LASZLO G,KEATING SAMUEL T,JOOSTEN LEO A B,et al.Monocyte and macrophage immunometabolism in atherosclerosis[J].Seminars in Immunopathology,2018,40(2):203-214.
[3] LENG W L,OUYANG X S,LEI X T,et al.The SGLT-2 inhibitor dapagliflozin has a therapeutic effect on atherosclerosis in diabetic ApoE-/-mice[J].Mediators of Inflammation,2016,2016:6305735.
[4] LIU J X,LI X,JI W J,et al.The dynamics of circulating monocyte subsets and intra-plaque proliferating macrophages during the development of atherosclerosis in ApoE-/-mice[J].International Heart Journal,2019,60(3):746-755.
[5] 李宵,周欣,姬文婕,等.载脂蛋白E基因敲除小鼠动脉粥样硬化病变进展过程中循环单核细胞亚群和斑块内增殖巨噬细胞的动态变化[J].中国动脉硬化杂志,2015,23(1):24-28.
[6] WOLF D,LEY K.Immunity and inflammation in atherosclerosis[J].Circulation Research,2019,124(2):315-327.
[7] LEE T M,CHANG N C,LIN S Z.Dapagliflozin,a selective SGLT2 Inhibitor,attenuated cardiac fibrosis by regulating the macrophage polarization via STAT3 signaling in infarcted rat hearts[J].Free Radical Biology & Medicine,2017,104:298-310.
[8] 中华医学会老年医学分会心血管疾病学组,《老年慢性心力衰竭诊治中国专家共识》编写组.老年人慢性心力衰竭诊治中国专家共识(2021)[J].中华老年医学杂志,2021,40(5):550-561.
[9] DENNEY L,KOK W L,COLE S L,et al.Activation of invariant NKT cells in early phase of experimental autoimmune encephalomyelitis results in differentiation of Ly6Chiinflammatory monocyte to M2 macrophages and improved outcome[J].Journal of Immunology,2012,189(2):551-557.
[10] ROBBINS C S,HILGENDORF I,WEBER G F,et al.Local proliferation dominates lesional macrophage accumulation in atherosclerosis[J].Nature Medicine,2013,19(9):1166-1172.
[11] SINHA S K,MIIKEDA A,FOULADIAN Z,et al.Local M-CSF(macrophage colony-stimulating factor)expression regulates macrophage proliferation and apoptosis in atherosclerosis[J].Arteriosclerosis,Thrombosis,and Vascular Biology,2021,41(1):220-233.
[12] LI T,WANG W,LI Y X,et al.Pseudolaric acid B attenuates atherosclerosis progression and inflammation by suppressing PPARγ-mediated NF-κB activation[J].International Immunopharmacology,2018,59:76-85.
[13] SA-NGUANMOO P,TANAJAK P,KERDPHOO S,et al.SGLT2-inhibitor and DPP-4 inhibitor improve brain function via attenuating mitochondrial dysfunction,insulin resistance,inflammation,and apoptosis in HFD-induced obese rats[J].Toxicology and Applied Pharmacology,2017,333:43-50.
[14] CHA S A,PARK Y M,YUN J S,et al.A comparison of effects of DPP-4 inhibitor and SGLT2 inhibitor on lipid profile in patients with type 2 diabetes[J].Lipids in Health and Disease,2017,16(1):58.
(收稿日期:2022-04-12)
(本文编辑 王雅洁)
