小麦芽期和苗期耐盐鉴定方法的适用性评价
2024-04-28陈家婷谷雨杰张潇文郭慧娟常利芳张树伟张晓军冯瑞云畅志坚乔麟轶
陈家婷 白 欣 谷雨杰 张潇文 郭慧娟 常利芳 陈 芳 张树伟 张晓军 李 欣 冯瑞云 畅志坚 乔麟轶
小麦芽期和苗期耐盐鉴定方法的适用性评价
陈家婷 白 欣 谷雨杰 张潇文 郭慧娟 常利芳 陈 芳 张树伟 张晓军 李 欣 冯瑞云 畅志坚 乔麟轶*
山西农业大学农学院 / 作物遗传与分子改良山西省重点实验室 / 农业农村部有机旱作农业重点实验室(部省共建), 山西太原 030031
耐盐鉴定是筛选种质和选育耐盐小麦品种的前提。小麦室内耐盐鉴定方法较多, 涉及不同生育时期和组织器官。为了评估这些方法在生产上的适用性, 本研究选用北方冬麦区5个耐盐品种和5个盐敏感品种为试验材料, 对基于芽期和苗期的7种耐盐鉴定方法(涉及27个测试指标)进行实用性评价。结果显示, 利用小麦种子的发芽相对盐害率不能区分参试耐盐品种和盐敏感品种, 而小麦苗期的叶部盐害指数、根部Na+和K+流速以及根尖数、根径、叶片K+含量的相对盐害率在耐盐和盐敏感品种之间差异显著。综合回归分析结果和可操作性, 明确叶部盐害指数是北方冬麦区适用性较高的耐盐鉴定方法, 可结合根尖数相对盐害率、叶片K+含量相对盐害率或根部Na+和K+流速用于种质筛选或品种选育。本研究从适用程度方面解析和评价了耐盐鉴定方法, 为小麦耐盐育种工作提供参考信息。
小麦; 耐盐鉴定; 方法评价; 芽期; 苗期
小麦作为我国主粮作物, 其产量与国家粮食安全和人民生活水平密切相关。土壤盐渍化是小麦生产中面临的主要非生物胁迫之一[1]。以我国北方冬麦区为例, 该区小麦种植面积及总产通常占全国总量的60%以上[2], 然而, 小麦生产区域和滨海盐碱区(100.5万公顷)、黄淮海盐碱区(67万公顷)等土壤盐渍化区域存在大面积重叠[3-4], 小麦产量受到严重影响。选育小麦耐盐品种对于充分利用盐化土地、保障小麦高产稳产意义重大。
耐盐鉴定是筛选耐盐种质、选育耐盐品种的前提。育种工作中通常将小麦在盐渍化土地中的产量或产量组分作为评价指标, 并成功用于品种选育。但是, 该方法测试周期较长, 试验田的盐分在空间(分布不均匀)和时间上(受降水和地下水位影响)都存在变异, 在快速、精确鉴定种质耐盐性方面具有局限性[5-7]。因此, 室内受控环境条件下的评估结果被认为更有效[8]。
迄今为止, 国内外育种家用于评价小麦种质的室内耐盐鉴定方法有10余种, 涉及小麦不同生育时期和组织器官[9-12], 然而, 利用上述方法筛选出的耐盐种质在育种或生产中的适用性普遍不高。由于小麦有Na+外排、组织耐受和氧化胁迫清除等多种耐盐机制[13], 某种鉴定方法可能选择出只具有单一耐盐机制的种质, 而该机制在特定大田环境下只能产生有限的耐盐表型, 从而降低种质利用价值。例如, 利用芽期鉴定方法筛选出的耐盐种质在伴随干旱的盐碱地中可能无法存活[9]; Na+外排能力强的耐盐种质在低盐分盐碱地中表现出很好的耐盐性, 但在高盐分盐碱地中, 该类种质耐盐性并不明显[14]。因此, 一些育种家开始利用当地种质对部分室内鉴定方法开展适用性评价, 如Genc等[15]发现耐盐碱种质MW#293中的叶片Na+浓度远高于不耐盐小麦, 据此不推荐将叶片Na+水平作为育种耐盐鉴定标准; Cuin等[16]利用耐盐品种Kharchia 65测试了将根部Na+外排作为鉴定方法的有效性。
在我国, 豆昕桐等[17]以北方冬麦区耐盐品种济麦22和盐敏感品种河农6425为材料, 测试了2个品种受盐胁迫后在叶绿体荧光参数和抗氧化酶活力等方面的变化及差异, 为小麦耐盐生理鉴定方法提供了评价依据。然而, 该研究涉及的种质数目较少, 也未鉴定根部或叶部相关的盐害表型。据此, 本研究选用北方冬麦区5个耐盐品种和5个不耐盐的品种[17-26], 对基于芽期和苗期的7种耐盐鉴定方法进行比较和评价, 以期筛选出适用性较好的室内鉴定指标, 为北方冬麦区耐盐育种工作提供参考信息。
1 材料与方法
1.1 试验材料
10个北方冬麦区育成品种(表1)用于耐盐鉴定。试验于2022年9月至2023年9月在作物遗传与分子改良山西省重点实验室完成。
1.2 芽期耐盐鉴定
每份材料取30粒种子置于培养皿中, 处理组加入350 mmol L–1NaCl溶液, 对照组加入等量去离子水, 在20℃恒温、12 h光/2 h暗条件下萌发7 d后统计种子发芽数, 发芽标准为胚根长≥种子长、胚芽长1/2种子长。试验重复3次。计算每份材料的发芽相对盐害率[27]: RSIR-G (relative salt-injury rate for germination, %) = (CK–T)/CK×100%, 式中CK表示对照组发芽率平均值,T表示处理组发芽率平均值。
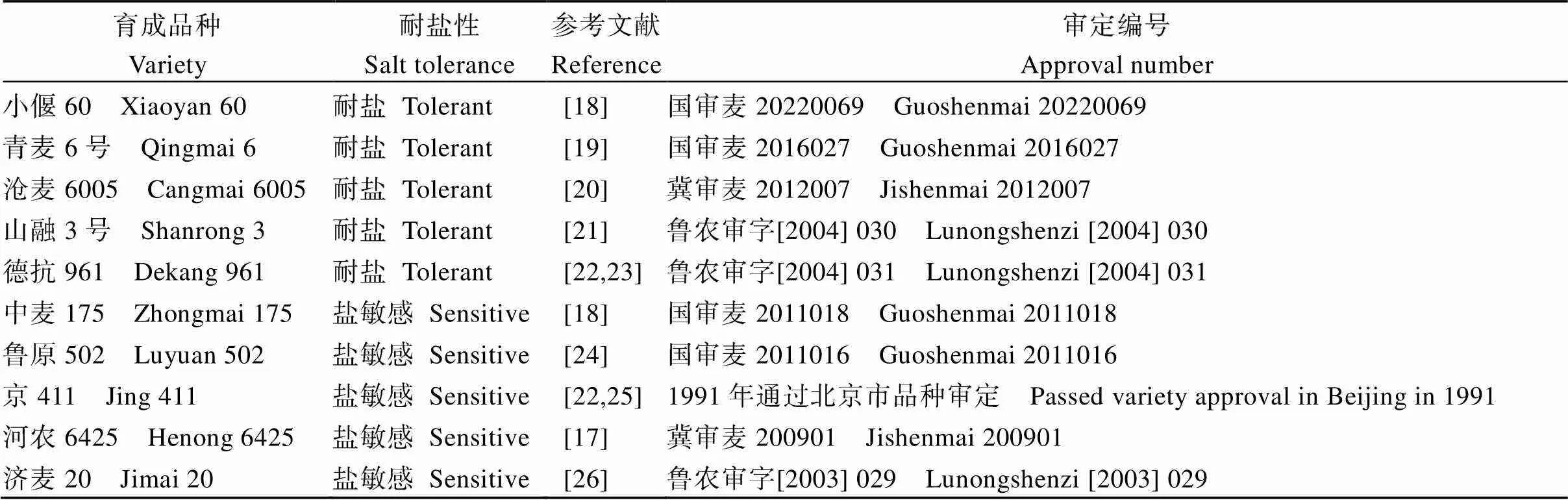
表1 10个已报道耐盐性的中国北方冬麦区育成品种
1.3 苗期根部盐害鉴定
每份材料于室温萌发后, 挑选胚根约3 cm的种子移入底部剪空的96孔PCR板, 置于培养箱中1/2霍格兰氏营养液生长, 设置16 h光/8 h暗、22℃/16℃;在幼苗二叶一心期进行盐胁迫, 设置处理组(含250 mmol L–1NaCl的1/2霍格兰氏营养液)和对照组(1/2霍格兰氏营养液)。7 d后, 每份材料选10株长势一致的小麦植株, 使用MICROTEK根系扫描仪(中晶科技, 上海)扫描小麦根系, 利用whiRHiZO根系分析系统获得总根长(RtL)、总表面积(RsA)、总体积(RV)、根径(RD)、根尖数(RTN)和根分叉数(RFN)。试验重复3次。计算每份材料的根部相对盐害率: RSIR-RP (RSIR for root phenotypes, %) = (CK–T)/CK×100%。
1.4 苗期根部离子流速鉴定
利用非损伤微测技术(non-invasive micro-test technology, NMT)活体工作站(旭月, 北京)测定小麦根部分生区的Na+和K+流速[28]。将盐胁迫7 d后的小麦幼苗固定根尖后浸入测试液; 利用液态离子交换剂(LIX)制作Na+或K+微传感器, 将其调整至距根尖2 μm处; 使用非损伤离子流速检测软件imFluxes V2.0在Na+或K+模式下测定对应的根尖离子流速, 持续15 min; 记录、保存后10 min数据。每份种质测定3个单株。
1.5 苗期叶部盐害鉴定
根据盐害表型将盐胁迫7 d后的小麦幼苗叶片划分为0~4级。0级: 生长正常, 无盐害症状; 1级: 生长基本正常, 有2~3片绿叶, 叶尖变黄、青枯或萎蔫; 2级: 生长受到抑制, 剩2片绿叶或有2片半黄叶; 3级: 生长受害, 仅剩1片绿叶或整株叶片中仅存小部分绿色; 4级: 叶片接近或已经死亡。计算每份材料的盐害指数[29]: SI-L (salt-injury index of leaf, %) = ∑(0×0+1×1+2×2+3×3+4×4)×100/(4×16),式中0~4分别指0~4级的植株数目, 16指本研究中每个品种所测植株数目。试验重复3次, 取SI-L平均值。
1.6 苗期植株生物量鉴定
每份材料取处理组和对照组7 d后的小麦幼苗各10株, 使用电子天平称取植株地上部(shoot)鲜重(FW-S)和根鲜重(FW-R), 并计算根冠鲜重比(FW- R/S); 再将地上部和根于105℃杀青15 min、65℃烘干至恒定重量后称重, 得到地上部干重(DW-S)、根干重(DW-R)和根冠干重比(DW-R/S)。计算每份材料特定生物量的相对盐害率: RSIR-B (RSIR for biomass,%) = (CK–T)/CK×100%。
1.7 苗期植株离子含量鉴定
称取每份小麦材料在处理组和对照组7 d后的根(root)、茎(stem)、叶(leaf)烘干样本粉末各0.1 g, 加入10 mL硝酸消解后在120℃下烘干, 用水定容至50 mL制成试样溶液; 利用原子吸收光谱仪(JENA, 德国)绘制标准曲线后测定试样溶液Na+或K+的吸光值, 并换算为离子浓度(mg g–1)。试验重复3次。计算每份材料的离子含量相对盐害率: RSIR-IC (RSIR for ion content, %) = (CK–T)/CK×100%。
1.8 苗期植株脯氨酸含量鉴定
使用茚三酮比色法试剂盒(梦犀生物, 苏州)测定小麦材料在处理组和对照组7 d后的根(root)和叶(leaf)脯氨酸含量。称取0.1 g组织样本加入1 mL提取液于90℃水浴10 min, 取上清冷却后加入测试液。使用分光光度计在520 nm波长下测定吸光度, 并换算为脯氨酸含量(μg g–1)。试验重复5次。计算每份材料的脯氨酸含量相对盐害率: RSIR-P (RSIR for proline content, %) = (T–CK)/T×100%。
1.9 统计分析
采用Microsoft Excel 2010软件进行数据处理和作图。利用LSD法分析处理组和对照组之间差异的显著性, 设<0.05为显著,<0.01为极显著。利用回归分析法评价各个鉴定标准之间的相关性。
2 结果与分析
2.1 发芽相对盐害率
参试5个耐盐品种与5个盐敏感品种在对照处理下的发芽率无明显差异(图1-a); 在受到盐胁迫后, 耐盐和盐敏感品种的发芽率均显著降低(<0.01), 但两类品种之间仍无明显差异(图1-a)。进一步分析结果显示, 耐盐品种和盐敏感品种之间的发芽相对盐害率差异不显著(图1-b)。
2.2 根部盐害表型及其相对盐害率
参试耐盐品种与盐敏感品种在对照处理下的6个根部指标无明显差异(图2-a~f); 在受到盐胁迫后, 参试品种根部指标数值均呈下降趋势, 其中, 耐盐品种的总根长(RtL,<0.05, 图2-a)、根表面积(RsA,<0.05, 图2-b)、根体积(RV,<0.01, 图2-c)、根尖数(RTN,<0.05, 图2-e)和根分叉数(RFN,<0.01, 图2-f)差异变化显著或极显著, 盐敏感品种的根尖数(RTN,<0.05, 图2-e)和根分叉数(RFN,<0.05, 图2-f)差异变化显著, 但两类品种之间无明显差异(图2-a)。相对盐害率计算结果显示(图2-g), 耐盐品种和盐敏感品种之间的根径(<0.05)和根尖数(<0.05)差异显著。

图1 耐盐与盐敏感品种在盐胁迫下的发芽结果比较
(a) GR: 发芽率; **:<0.01; ****:<0.0001。(b) RSIR-G: 发芽相对盐害率; T: 耐盐品种; S: 盐敏感品种。
(a) GR: germination rate; **:<0.01; ****:<0.0001. (b) RSIR-G: the relative salt-injury rate for germination; T: tolerant varieties; S: sensitive varieties.
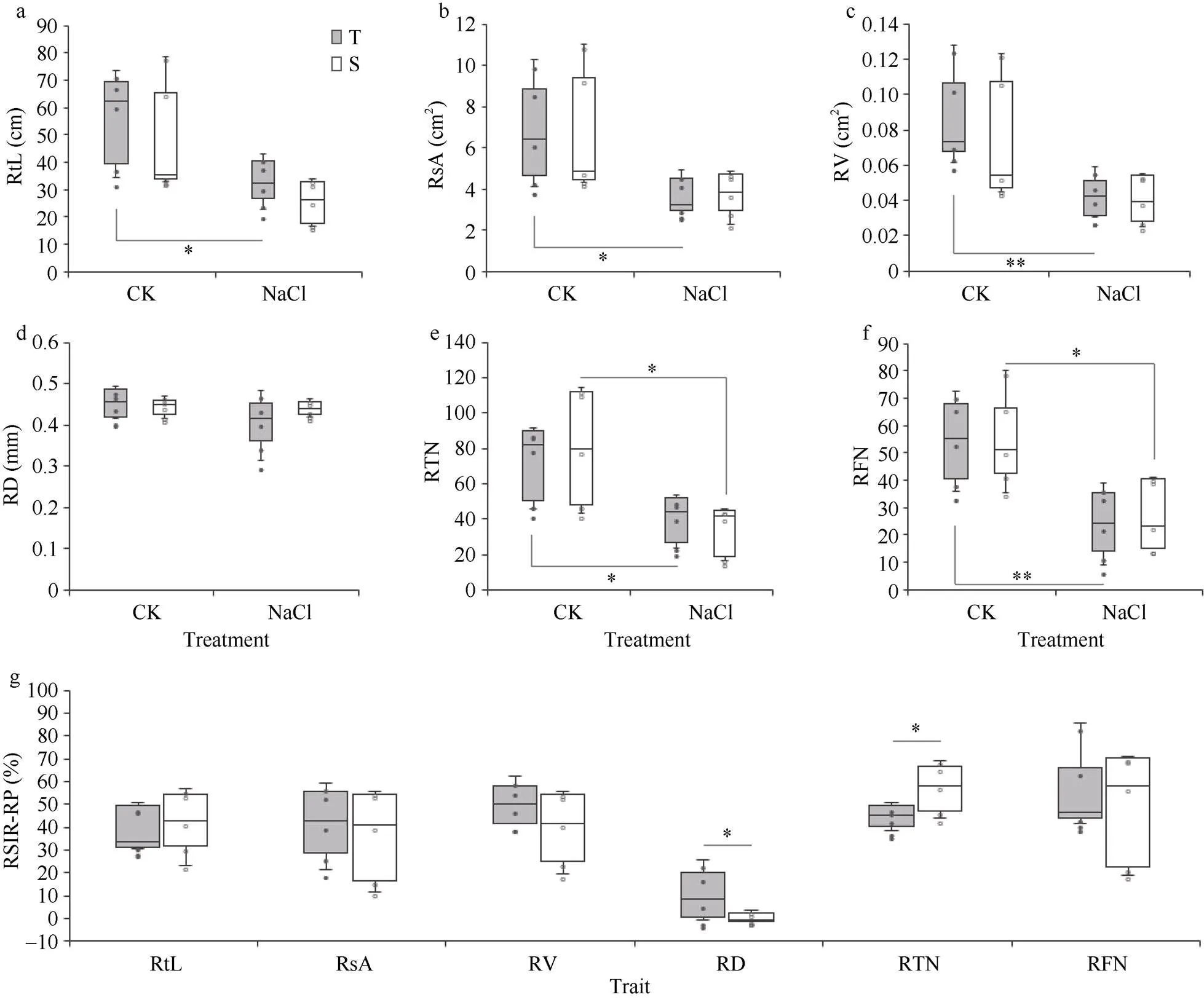
图2 耐盐与盐敏感品种苗期根部盐害表型比较
RtL: 总根长; RsA: 根表面积; RV: 根体积; RD: 根径; RTN: 根尖数; RFN: 根分叉数; RSIR-RP: 根部表型相对盐害率。*:< 0.05; **:< 0.01; T: 耐盐品种; S: 盐敏感品种。
RtL: root total length; RsA: root surface area; RV: root volume; RD: root diameter; RTN: root tips number; RFN: root forks number; RSIR-RP: the relative salt-injury rate for root phenotypes. *:< 0.05; **:< 0.01; T: tolerant varieties; S: sensitive varieties.
2.3 根部Na+和K+流速
受盐胁迫7 d后, 参试品种除河农6425外, 其余品种根部都不同程度的外排Na+(图3-a), 其中,京411和山融3号的Na+外排能力较强; 此外, 所有品种根部的K+都不同程度的内流(图3-b), 青麦6号和京411对K+的吸收能力较强。从整体来看, 参试耐盐品种根部的Na+外排能力(<0.001, 图3-c)和K+吸收能力(<0.0001, 图3-d)均极显著高于盐敏感品种。
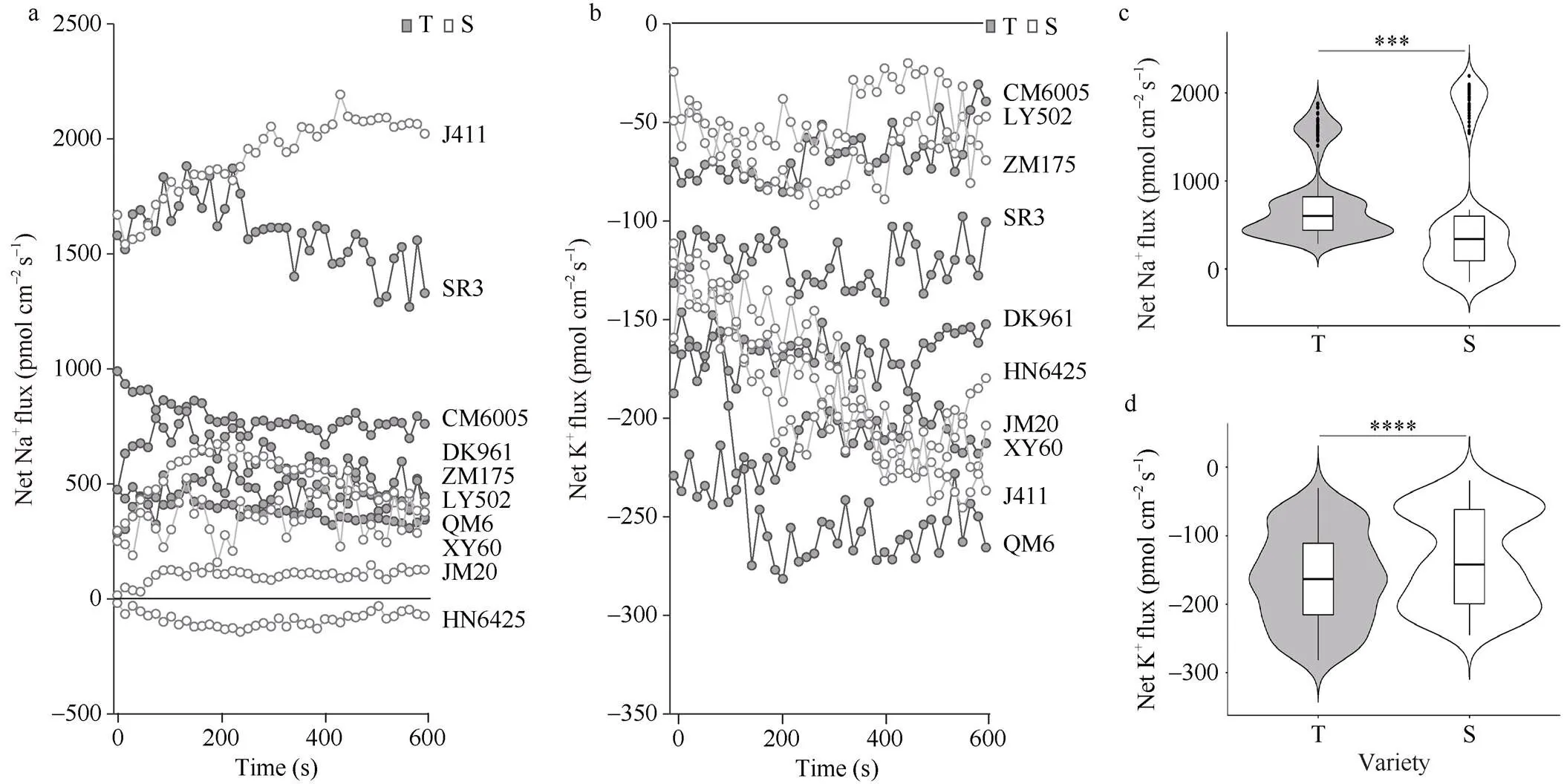
图3 耐盐与盐敏感品种在苗期盐胁迫下的根部离子流速比较
***:< 0.001; ****:< 0.0001; T: 耐盐品种; S: 盐敏感品种。
***:< 0.001, ****:< 0.0001; T: tolerant varieties; S: sensitive varieties.
2.4 叶部盐害指数
参试品种的苗期叶部盐害指数测试结果显示(附表1), 耐盐品种盐害指数分别为沧麦6005 (22.50%)、德抗961 (39.19%)、山融3号(40.54%)、青麦6号(42.09%)和小偃60 (51.61%), 平均盐害指数为39.19%; 盐敏感品种盐害指数分别为鲁原502 (43.75%)、济麦20 (55%)、京411 (57.61%)、河农6425 (58.22%)和中麦175 (58.79%), 平均盐害指数为54.674。耐盐品种和盐敏感品种之间的叶部盐害指数差异显著(<0.05, 图4)。
2.5 根与地上部的生物量及其相对盐害率
参试耐盐品种与盐敏感品种在对照处理下的6个生物量指标无明显差异(图5-a~f); 在受到盐胁迫后,参试品种根和地上部的鲜重和干重数值均呈下降趋势, 其中, 耐盐品种的差异变化极显著(<0.01, 图5-a, b, d, e), 盐敏感品种的地上部鲜重(FW-S,<0.05, 图5-b)差异变化显著; 而鲜重和干重的根冠比则呈上升趋势(图5-c~f)。受盐胁迫后, 两类品种之间的生物量指标及其相对盐害率(图5-g)无显著差异。
2.6 根、茎、叶中的Na+和K+含量及其相对盐害率
如图6所示, 参试耐盐品种的叶片K+含量显著低于盐敏感品种(<0.05, 图6-c), 在受到盐胁迫后极显著升高(<0.01), 与盐敏感品种盐胁迫后的叶片K+含量无差异; 两类品种的其余指标, 如根、茎、叶的Na+含量(图6-d~f)或K+/Na+含量比(图6-g~i)等, 则没有显著差异。耐盐品种和盐敏感品种之间的叶片K+含量相对盐害率差异显著(<0.05, 图6-j)。
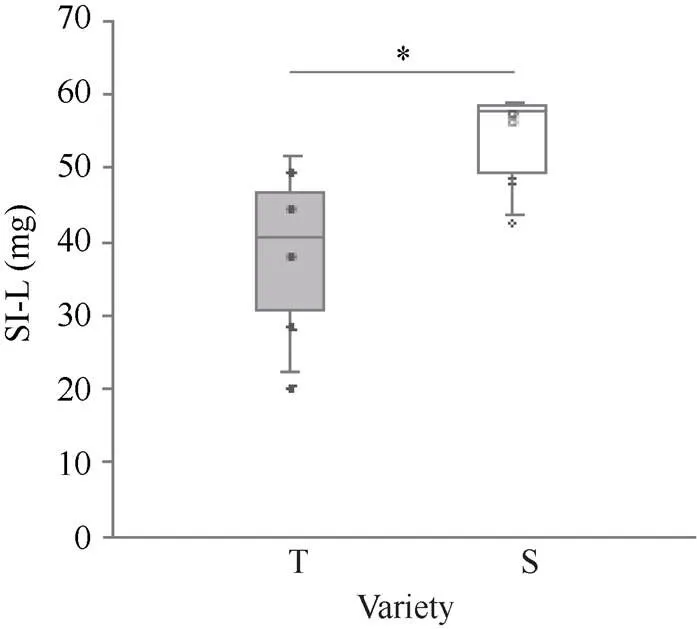
图4 耐盐与盐敏感品种叶部盐害指数测定比较
*:< 0.05; T: 耐盐品种; S: 盐敏感品种。
*:< 0.05; T: tolerant varieties; S: sensitive varieties.
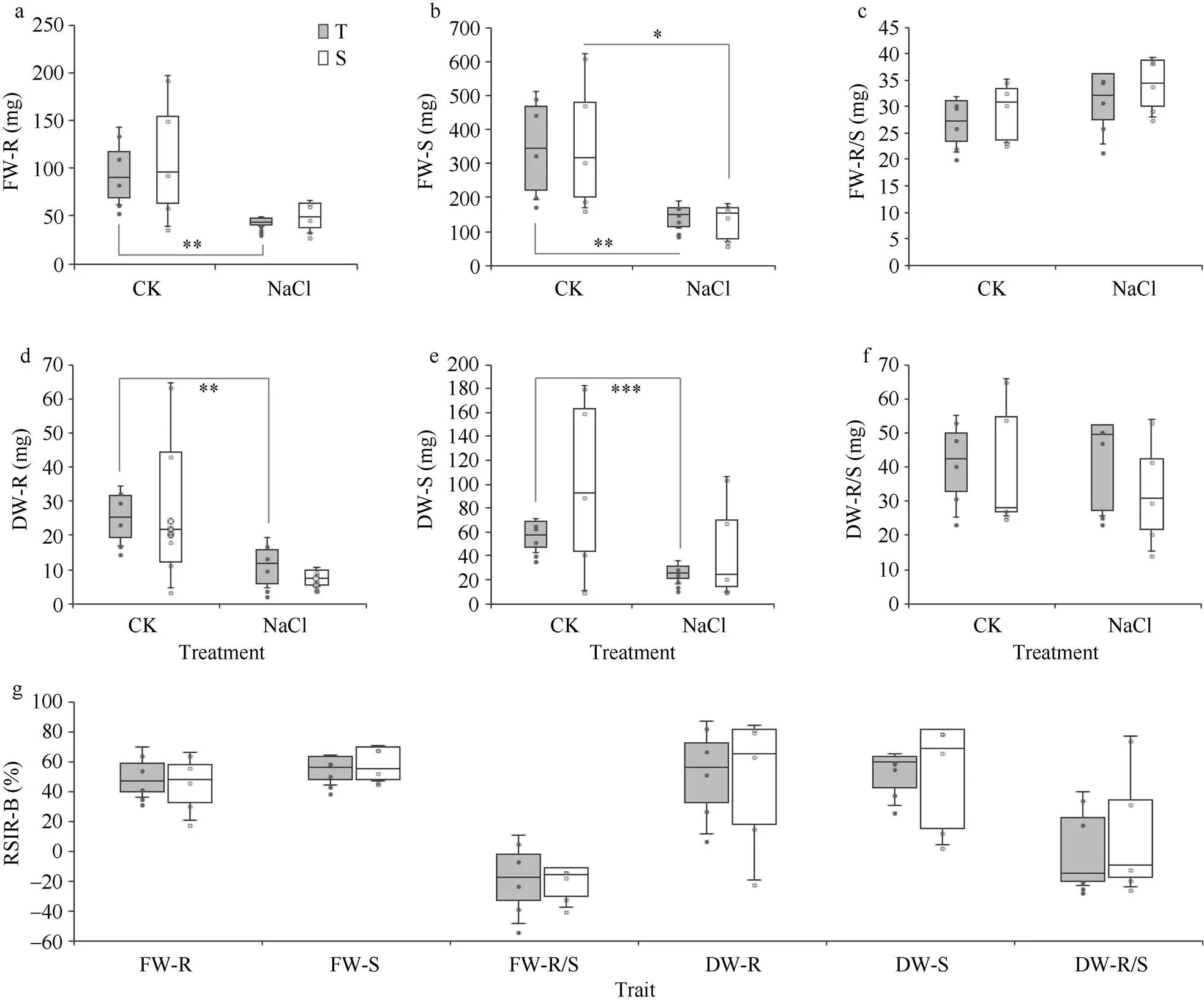
图5 耐盐与盐敏感品种在苗期盐胁迫下的生物量比较
FW-R: 根鲜重; FW-S: 地上部鲜重; FW-R/S: 鲜重根冠比; DW-R: 根干重; DW-S: 地上部干重; DW-R/S: 干重根冠比; RSIR-B: 生物量相对盐害率。*:< 0.05, **:< 0.01, ***:< 0.001; T: 耐盐品种; S: 盐敏感品种。
FW-R: fresh weight of root; FW-S: fresh weight of shoot; FW-R/S: the ratio of FW-R/FW-S; DW-R: dry weight of root; DW-S: dry weight of shoot; DW-R/S: the ratio of DW-R/DW-S; RSIR-B: the relative salt-injury rate for biomass. *:< 0.05; **:< 0.01; ***:< 0.001; T: tolerant varieties; S: sensitive varieties.

(图6)
a~c: 根、茎、叶中的K+含量; d~f: 根、茎、叶中的Na+含量; g~i: 根、茎、叶中K+与Na+的含量比; j: 离子含量相对盐害率。*:< 0.05; **:< 0.01; T: 耐盐品种; S: 盐敏感品种。
a–c: K+contents in root, stem, and leaf; d–f: Na+contents in root, stem, and leaf; g–i: ratio of K+and Na+contents in root, stem, and leaf; j: the relative salt-injury rate for ion content (RSIR-IC). *:< 0.05; **:< 0.01; T: tolerant varieties; S: sensitive varieties.
2.7 根、叶中的脯氨酸含量及其相对盐害率
参试耐盐品种与盐敏感品种在对照处理下的根部和叶部脯氨酸含量无明显差异; 在受到盐胁迫后, 参试品种根部脯氨酸含量极显著上升(<0.01, 图7-a), 叶部脯氨酸含量也显著上升(<0.05, 图7-b), 但耐盐与盐敏感品种之间的脯氨酸相对盐害率无显著差异(图7-c)。
3 讨论
3.1 耐盐指标相关性评价
合适的耐盐鉴定方法可以提高种质筛选或品种选育的效率。本研究对7种主要的小麦室内耐盐鉴定方法进行评价, 所选种质均为北方冬麦区审定品种, 与农家种或野生种相比, 参试品种之间在产量或农艺性状方面的差异较小, 其耐盐性在生产上也已得到验证, 有助于利用其评估耐盐鉴定方法的适用性。在设置对照组的5种鉴定方法(涉及23个测定指标)中, 参试耐盐品种与盐敏感品种的22个表型指标(占96%)在未受到盐胁迫时无显著差异(附表1),表明各品种之间的遗传背景差异对研究结果影响很小。在施加盐处理7 d后, 参试品种出现预期盐害表型, 如发芽率下降、叶片发黄、根长度/面积/体积减少、植株总体生物量减少、鲜重根冠比增加、脯氨酸含量增加等, 并且大部分表型之间显示出正常的相关性, 如根部各盐害表型之间、地上部与地下部生物量之间、根/茎/叶Na+和K+含量之间, 以及茎部与叶部的Na+含量、植株生物量与Na+含量等(图8), 这表明本研究中的耐盐鉴定体系可靠, 测定的数值以及据此计算出的盐害指数或盐害率可信。
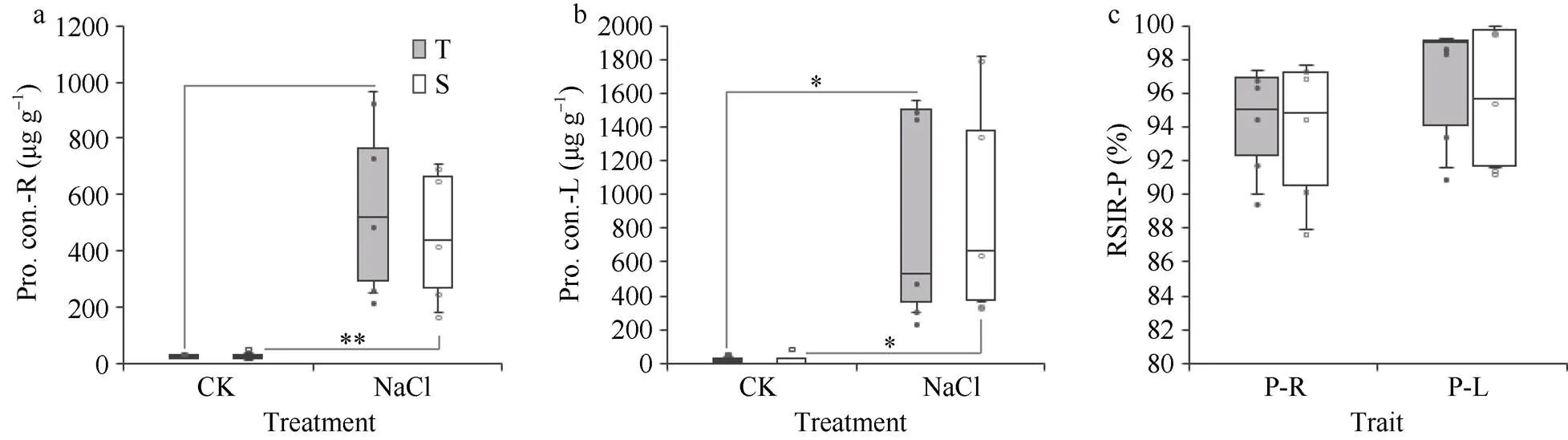
图7 耐盐与盐敏感品种在苗期盐胁迫下的不同组织脯氨酸含量比较
a: 根中的脯氨酸含量; b: 叶中的脯氨酸含量; c: 根、叶中脯氨酸含量相对盐害率(RSIR-P)。*:< 0.05; **:< 0.01; T: 耐盐品种; S: 盐敏感品种。
a: proline contents in root; b: proline contents in leaf; c: RSIR-P in root and leaf. *:< 0.05; **:< 0.01; T: tolerant varieties; S: sensitive varieties.
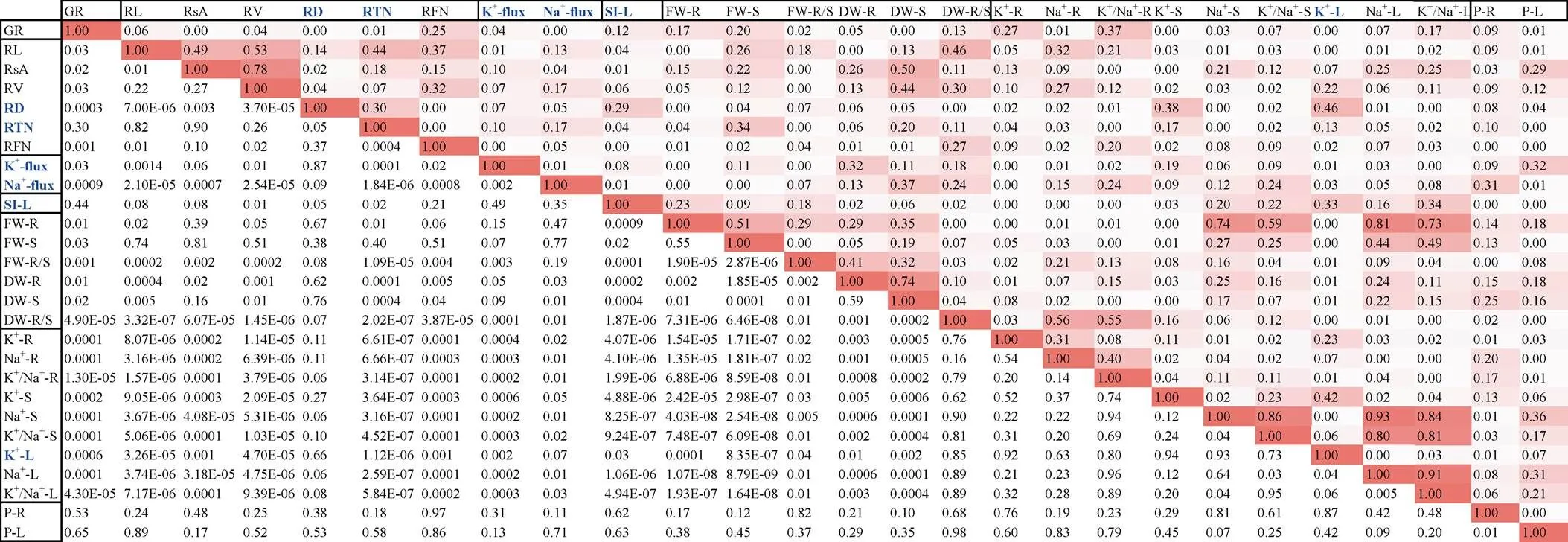
图8 参试表型之间的回归分析
左下角为值, 右上角为决定系数2值, 用红色填充; 在参试耐盐和盐敏感品种间差异显著的表型用蓝色标注。
The numbers in the lower left corner are the-values, and the numbers in the upper right corner are the coefficient of determination2values which filled in red. Parameters with significant differences between salt-tolerant and -sensitive varieties tested in this study are marked in blue.
3.2 芽期耐盐鉴定评价
发芽率测定是批量筛选耐盐种质最为简单、快速的鉴定方法。然而, 本研究评价结果显示, 利用发芽相对盐害率指标不能很好地区分参试耐盐和盐敏感品种, 即品种发芽率与其在生产上的耐盐表现无关。这可能是因为种子萌发和幼苗生长期间的主要生理机制不同, 发芽过程中胚根、胚芽的伸长很大程度上是一个吸水膨胀的物理化学过程, 而随后的植株生长则是分子生物学过程。所以, 某些种质即使能够在300 mmol L–1以上的NaCl胁迫中发芽, 但其胚根在这种浓度下无法进一步生长[6]。另外, 北方冬麦区常在每年10月上旬播种小麦, 该时期常有降雨, 或者会在播种之前灌溉耕地来保障底墒, 这能暂时降低盐渍土中的盐分, 使耕地的土壤溶液电导率不超过20 dS m–1(大致相当于200 mmol L–1NaCl),种子可以保持较好的发芽率。因此, 对于北方冬麦区而言, 小麦出苗后在盐渍化土壤中存活可能比种子发芽更为重要, 仅以发芽率作为耐盐评价指标是不合适的。
3.3 苗期根部盐害表型鉴定评价
根是最早感知盐胁迫的器官, 根部盐害表型也被用于评价种质耐盐性。本研究分析了小麦苗期根系的6个指标, 发现有2个指标的相对盐害率在参试品种之间差异显著(图2-g), 两者决定系数2= 0.30 (图8)。第一个是根尖数, 与耐盐品种相比, 盐敏感品种在盐胁迫后根尖数显著变小, 意味着根数严重减少; 第二个是根径, 参试盐敏感品种受盐胁迫后根部直径减小的程度显著小于耐盐品种, 其中, 盐敏感品种京411、中麦175和济麦20的根径相对盐害率为负值, 即这3个品种的根径在盐胁迫后变大。在一些木本植物中也观察到了盐胁迫后根系变粗的现象[30-32], 在禾本科作物中则暂无此类报道。然而, 有研究表明盐分对植株地上部的影响比对根系的影响更为严重, 因为根系会通过外排Na+或将其运送到地上部来保持相对恒定的NaCl水平, 因此更应该关注根部在盐胁迫中的功能, 而不是其表型[33]。本研究结果也显示了这点, 根系鲜重与根Na+含量几乎无关(2=0.01,<0.0001), 但与茎和叶Na+含量的2值分别高达0.74 (<0.0001)和0.81 (< 0.0001) (图8)。结合本文结果和已报道的研究, 我们建议仅将根尖数相对盐害率作为种质耐盐鉴定的参考指标。
3.4 苗期根部Na+和K+流速鉴定评价
根部Na+和K+流速最早由澳大利亚研究人员用于鉴定小麦耐盐性, 大量研究显示小麦种质外排Na+能力与耐盐性之间具有很好的相关性[16,34-36]。一般而言, 如果某个种质在长时间盐胁迫后仍能保持良好的根部外排Na+能力, 则能缓解地上部尤其是叶片受到的离子毒害和氧化胁迫; 同时, 根部会增加对K+的吸收, 并将其作为胞质和液泡中的主要离子渗透物[37], 用以对抗根外部的高盐渗透胁迫。此外, 每份种质根部Na+和K+流速特性都是相对稳定的, 不易受根系温度和蒸腾速率影响[6], 这保证了测试结果的稳定性。本研究中, 参试品种受盐胁迫后, 耐盐品种根部的Na+外排能力和K+吸收能力均极显著高于盐敏感品种, 证实了该方法的适用性。其中, 盐敏感品种河农6425对Na+和K+的净流速均表现为内吸, 原因可能是在经过7 d盐胁迫后, 其根部表皮细胞膜的完整性已被破坏。此外, 另1份盐敏感品种京411的Na+外排和K+吸收能力强于大部分耐盐品种, 这表明不能完全依赖于离子流速测定结果来判定耐盐性。
3.5 苗期叶部盐害指数评价
苗期叶部盐害指数测定是一种较为直观和简便的鉴定方法, 由植株受盐胁迫后的叶片损伤级别分值经过加权计算获得。叶片损伤(发黄、萎蔫或干枯)可能由多种原因引起, 首先, 土壤中的高盐环境会对根系产生渗透胁迫, 造成植株生理性干旱, 导致叶片萎蔫、枯黄; 其次, 土壤中Na+通过非选择性阳离子通道(non-selective cation channel, NSCC)进入根系, 随后受蒸腾拉力作用再进入叶片富集。高浓度Na+会与K+等阳离子竞争生化反应结合位点, 导致叶绿素降解, 并抑制大多数酶和蛋白质的正常功能[6,38-39], 造成叶片营养失衡、叶色变黄; 第三, 在受盐胁迫一段时间后, 叶片内会产生大量的活性氧(ROS), 致使膜结构的完整性被破坏, 生物大分子反应受到影响, 生理代谢紊乱, 加速了叶片衰老枯黄[13]。受长期盐胁迫后叶片仍能保持绿色、维持正常生长状态的小麦种质, 往往具有较强的Na+外排能力, 或者较好的Na+耐受性和氧化修复能力。因此, 叶部盐害指数涉及了Na+外排、组织耐受和氧化胁迫清除这3种主要的小麦耐盐机制[13], 据其筛选的耐盐种质在大田环境下可能更为适应。在本研究中, 参试耐盐和盐敏感品种之间的叶部盐害指数差异显著, 证实了该鉴定方法具有很好的适用性。除此之外, 叶部盐害指数还具有较高遗传力, 已被用于正向遗传学中的群体表型鉴定[40-41]。
3.6 苗期植株生物量盐害鉴定评价
生物量相对盐害率是反映种质耐盐性的重要指标。在大田环境下, 小麦生物量受到盐胁迫后显著下降[7,42-43], 而且盐敏感种质生物量要比耐盐种质下降的更多, 即生物量相对盐害率更高。本研究中参试品种受到盐胁迫后, 根和地上部的鲜重和干重数值均呈下降趋势, 与前人已报道的田间鉴定结果相符; 各类生物量的相对盐害率之间大致呈正相关(图7), 然而, 这些相对盐害率在参试耐盐和盐敏感品种之间无显著差异, 这可能是由于用于鉴定的小麦植株苗龄较小(二叶一心), 并且盐胁迫时间较短(7 d), 致使植株生物量未能表现出显著差异。有研究选择了在长期盐胁迫下生物量差异显著的品种, 对其开展1周左右的短期盐胁迫, 然而不同品种之间的地上部生物量几乎没有差异[6,44]。盐处理3~4周被认为是比较合适的胁迫时间[6], 但水培条件下的小麦植株受长时间高盐胁迫可能无法生存, 因此可以用土培或沙培方式进行低盐胁迫。最近有研究对种在花盆基质中的小麦幼苗用150 mmol L–1NaCl溶液胁迫4周, 最终耐盐和盐敏感种质之间的地上部干重指标显示出显著差异[11], 可借鉴该胁迫方法来测定生物量相对盐害率。
3.7 苗期植株Na+和K+含量鉴定评价
植株不同组织中的Na+和K+含量情况较为复杂。由于NSCC和蒸腾拉力, Na+会进入根部并被运送地上部, 最终在叶片中富集。以往研究显示小麦耐盐种质地上部Na+含量比盐敏感种质低[43,45]。一般情况下, 叶片Na+含量较低的耐盐种质, 其同为地上部的茎秆中的Na+含量也较低, 而根部则会相对独立地维持Na+稳态; K+含量则与之相反, 植株会通过“排钠保钾”来维持较高的K+/Na+含量比值, 这被认为是耐盐性的一个关键特征[11,33,46-47]。然而, 也有很多研究显示不同组织K+、Na+含量及其比值与种质耐盐性并不相关[15,48-50]。出现不同结论的原因之一就是液泡对Na+的区室化。一些种质的组织器官(特别是叶片)虽然Na+含量很高, 但过量Na+会被液泡膜上的Na+/H+逆向转运蛋白(NHX)利用质子泵(H+-PPase)封存到液泡内[51], 从而缓解高盐浓度对细胞的离子毒性, 使植株表现出耐盐性。这就会导致在差异性分析中, Na+和K+含量与耐盐性相关性不高。本研究中, 参试品种叶片和茎秆的Na+含量、叶片和茎秆的K+/Na+含量比值均呈强相关性, 决定系数分别为0.93和0.81 (图7), 整体趋势基本正常, 但耐盐品种和盐敏感品种之间仅有叶片K+含量相对盐害率(RSIR-K+-L)差异显著, 表明有的参试品种可能对Na+具有较好的液泡封存能力。由于K+与液泡膜PPase活性以及有害离子区室化密切相关[51], 并涉及响应盐胁迫相关的多个生理生化反应[6,38-39], 因此, 可将RSIR-K+-L作为小麦耐盐性评价的参考指标。
3.8 苗期植株脯氨酸含量鉴定评价
脯氨酸是调节植物抗逆能力的重要分子, 具有调节细胞渗透压、清除活性氧等作用[52]。在小麦耐盐基因功能研究中, 过表达或编辑植株与野生型的脯氨酸含量变化是重要检测指标之一[28,52-53]。在种质筛选方面, 不同小麦品种的脯氨酸含量在受盐胁迫后均会有不同程度的提高, 然而, 这种含量变化与耐盐性不存在显著相关性[12,14], 与本文研究结果一致。此外, 有研究人员认为, 通过提高脯氨酸含量来增强小麦品种耐盐性并不是一个理想措施, 因为植株合成高浓度的脯氨酸需要消耗大量能量和有机物, 这会降低籽粒营养物质的积累, 最终影响小麦产量[15,54-55]。因此, 不建议将脯氨酸含量做为筛选小麦耐盐种质的评价指标。
综上所述, 每种耐盐鉴定方法都有其特定优势, 但也存在局限性。其中, 苗期叶部盐害指数是小麦3种主要耐盐机制的综合反映, 利用该方法筛选的种质在大田环境中的适应性应该较好, 其测定方法也比较简便, 适合评价或筛选大量小麦种质。此外, 根尖数(RTN)和叶片K+含量(K+-L)的相对盐害率、根部Na+和K+流速可以作为参考指标。
4 结论
小麦根尖数、根径、叶片K+含量的相对盐害率, 叶部盐害指数以及根部Na+和K+流速在参试耐盐和盐敏感品种之间差异显著, 叶部盐害指数是在北方冬麦区适用性较高的耐盐鉴定方法, 可结合根尖数相对盐害率、叶片K+含量相对盐害率或根部Na+和K+流速用于种质筛选或品种选育。
致谢 河北省农业科学院张业伦副研究员提供了沧麦6005种质, 山东省农业科学院刘成研究员提供了山融3号和德抗961种质, 太原师范学院张笑博士在NMT活体工作站操作方面给予了指导, 谨致谢忱。
[1] Safdar H, Amin A, Shafiq Y, Ali A, Yasin R, Shoukat A, Hussan M U, Sarwar M I. A review: impact of salinity on plant growth., 2019, 1: 34–40.
[2] 赵广才. 中国小麦种植区划研究(一). 麦类作物学报, 2010, 30: 886–895. Zhao G C. Study on Chinese wheat planting regionalization (I)., 2010, 30: 886–895 (in Chinese with English abstract).
[3] 杨劲松, 姚荣江. 我国盐碱地的治理与农业高效利用. 中国科学院院刊, 2015, 30(增刊1): 162–170. Yang J S, Yao R J. Management and efficient agricultural utilization of salt-affected soil in China., 2015, 30(S1): 162–170 (in Chinese with English abstract).
[4] 邢锦城, 陈超, 董静, 刘冲, 朱小梅, 洪立洲. 长江中下游及黄淮冬麦区小麦主栽品种耐盐性评价. 大麦与谷类科学, 2017, 34(6): 8–13. Xing J C, Chen C, Dong J, Liu C, Zhu X M, Hong L Z. Evaluation of salt tolerance of main wheat cultivars planted in the middle and lower reaches of the Yangtze River and Huang Huai area., 2017, 34(6): 8–13 (in Chinese with English abstract).
[5] Richards R A. Should selection for yield in saline conditions be made on saline or non-saline soils., 1983, 32: 431–438.
[6] Munns R, James R A. Screening methods for salinity tolerance: a case study with tetraploid wheat., 2003, 253: 201–218.
[7] El-Hendawy S E, Hassan W M, Al-Suhaibani N A, Refay Y, Abdella K A. Comparative performance of multivariable agro- physiological parameters for detecting salt tolerance of wheat cultivars under simulated saline field growing conditions., 2017, 8: 435.
[8] Flowers T J, Yeo A R. Breeding for salinity resistance in crop plants: where next., 1995, 22: 875–884.
[9] Yu S Z, Wu J H, Wang M, Shi W M, Xia G M, Jia J Z, Kang Z S, Han D J. Haplotype variations in QTL for salt tolerance in Chinese wheat accessions identified by marker-based and pedigree-based kinship analyses., 2020, 8: 1011–1024.
[10] Genc Y, McDonald G K, Tester M. Reassessment of tissue Na+concentration as a criterion for salinity tolerance in bread wheat., 2007, 30: 1486–1498.
[11] Tao R, Ding J, Li C, Zhu X, Guo W, Zhu M. Evaluating and screening of agro-physiological indices for salinity stress tolerance in wheat at the seedling stage., 2021, 12: 646175.
[12] Masarmi A G, Solouki M, Fakheri B, Kalaji H M, Mahgdingad N, Golkari S, Telesiński A, Lamlom S F, Kociel H, Yousef A F. Comparing the salinity tolerance of twenty different wheat genotypes on the basis of their physiological and biochemical parameters under NaCl stress., 2023, 18: e0282606.
[13] Wang M, Xia G M. The landscape of molecular mechanisms for salt tolerance in wheat., 2018, 6: 42–47.
[14] Tavakkoli E, Fatehi F, Rengasamy P, McDonald G K. A comparison of hydroponic and soil-based screening methods to identify salt tolerance in the field in barley., 2012, 63: 3853–3867.
[15] Genc Y, Taylor J, Lyons G, Li Y, Cheong J, Appelbee M, Oldach K, Sutton T. Bread wheat with high salinity and solidity tolerance., 2019, 10: 1280.
[16] Cuin T A, Bose J, Stefano G, Jha D, Tester M, Mancuso S, Shabala S. Assessing the role of root plasma membrane and tonoplast Na+/H+exchangers in salinity tolerance in wheat: in planta quantification methods., 2011, 34: 947–961.
[17] 豆昕桐, 王英杰, 王华忠, 岳洁瑜. 耐盐和盐敏感型小麦品种对NaCl胁迫的生理响应及耐盐性差异. 生态学报, 2021, 41: 4976–4992. Dou X T, Wang Y J, Wang H Z, Yue J Y. Physiological response and tolerance difference of two wheat varieties to NaCl stress., 2021, 41: 4976–4992 (in Chinese with English abstract).
[18] Luo Q L, Teng W, Fang S, Li H W, Li B, Chu J F, Li Z S, Zheng Q. Transcriptome analysis of salt-stress response in three seedling tissues of common wheat., 2019, 7: 378–392.
[19] Zhang Y, Liu Z, Khan A A, Lin Q, Han Y, Mu P, Liu Y, Zhang H, Li L, Meng X, Ni Z, Xin M. Expression partitioning of homeologs and tandem duplications contribute to salt tolerance in wheat (L.)., 2016, 6: 21476.
[20] Yu L, Wang W W, Niu L Y, Wang W, Lu L, Wang F Z, Wang L P, Wang Y, Zang X J. A new cultivation technique of Cangmai 6005 for high yield in Cangzhou dry-alkali land., 2018, 10: 68–70.
[21] Shan L, Li C, Chen F, Zhao S, Xia G. A Bowman-Birk type protease inhibitor is involved in the tolerance to salt stress in wheat., 2008, 31: 1128–1137.
[22] Wang Z Y, Qin X H, Li J H, Fan L F, Zhou Q, Wang Y Q, Zhao X, Xie C J, Wang Z Y, Huang L. Highly reproducible periodic electrical potential changes associated with salt tolerance in wheat plants., 2019, 160: 120–130.
[23] 梁超, 王超, 杨秀风, 张秀田, 王玮. ‘德抗961’小麦耐盐生理特性研究. 西北植物学报, 2006, 26: 2075–2082. Liang C, Wang C, Yang X F, Zhang X T, Wang W. Salt-tolerant physiological characters of wheat variety Dekang 961., 2006, 26: 2075–2082 (in Chinese with English abstract).
[24] Ma Q, Zhou H J, Sui X Y, Su C X, Yu Y C, Yang H B, Dong C H. Generation of new salt-tolerant wheat lines and transcriptomic exploration of the responsive genes to ethylene and salt stress., 2021, 94: 33–48.
[25] Guo G F, Ge P, Ma C Y, Li X H, Lü D W, Wang S L, Ma W J, Yan Y M. Comparative proteomic analysis of salt response proteins in seedling roots of two wheat varieties., 2012, 75: 1867–1885.
[26] Xiong H, Guo H, Xie Y, Zhao L, Gu J, Zhao S, Li J, Liu L. RNAseq analysis reveals pathways and candidate genes associated with salinity tolerance in a spaceflight-induced wheat mutant., 2017, 7: 2731.
[27] 马雅琴, 翁跃进. 引进春小麦种质耐盐性的鉴定评价. 作物学报, 2005, 31: 58–64. Ma Y Q, Weng Y J. Evaluation for salt tolerance in spring wheat cultivars introduced from abroad., 2005, 31: 58–64 (in Chinese with English abstract).
[28] Wang W, Wang W, Wu Y, Li Q, Zhang G, Shi R, Yang J, Wang Y, Wang W. The involvement of wheat U-box E3 ubiquitin ligase TaPUB1 in salt stress tolerance., 2020, 62: 631–651.
[29] 乔麟轶, 张潇文, 李世姣, 陈芳, 李欣, 郭慧娟, 张树伟, 常利芳, 张晓军, 畅志坚. 小偃麦渗入系苗期耐盐鉴定与分子标记评价. 山东农业科学, 2021, 53(5): 69–73. Qiao L Y, Zhang X W, Li S J, Chen F, Li X, Guo H J, Zhang S W, Chang L F, Zhang X J, Chang Z J. Salt-tolerance identification at seedling stage and molecular marker evaluation of wheat-introgression lines., 2021, 53(5): 69–73 (in Chinese with English abstract).
[30] Kamiab F, Talaie A, Javanshah A, Khezri M, Khalighi A. Effect of long-term salinity on growth, chemical composition and mineral elements of pistachio (cv. Badami-Zarand) rootstock seedlings., 2012, 3: 5545–5551.
[31] Soda N, Ephrath J E, Dag A, Beiersdorf I, Presnov E, Yermiyahu U, Ben-Gal A. Root growth dynamics of olive (L.) affected by irrigation induced salinity., 2017, 411: 305–318.
[32] Tan J L, Ben-Gal A, Shtein I, Bustan A, Dag A, Erel R. Root structural plasticity enhances salt tolerance in mature olives., 2020, 179: 104224.
[33] Tester M, Davenport R. Na+tolerance and Na+transport in higher plants., 2003, 91: 503–527.
[34] Ashraf M, O’Leary J W. Responses of newly developed salt- tolerant genotype of spring wheat to salt stress: yield components and ion distribution., 1996, 176: 91–101.
[35] Rashid A, Querishi R H, Hollington P A, Jones R G W. Comparative responses of wheat cultivars to salinity at the seedling stage., 1999, 182: 199–207.
[36] Poustini K, Siosemardeh A. Ion distribution in wheat cultivars in response to salinity stress., 2004, 85: 125–133.
[37] Walker D J, Leigh R A, Miller A J. Potassium homeostasis in vacuolate plant cells., 1996, 93: 10510–10514.
[38] Isabelle C, Cécile L, Martin B, Hervé S. Molecular mechanisms involved in plant adaptation to low K+availability., 2013, 3: 833–848.
[39] Anschütz U, Becker D, Shabala S. Going beyond nutrition: regulation of potassium homeostasis as a common denominator of plant adaptive responses to environment., 2014, 171: 670–687.
[40] 张潇文, 李世姣, 张晓军, 李欣, 杨足君, 张树伟, 陈芳, 常利芳, 郭慧娟, 畅志坚, 乔麟轶. 小麦品系CH7034中耐盐QTL定位. 作物学报, 2022, 48: 2646–2654. Zhang X W, Li S J, Zhang X J, Li X, Yang Z J, Zhang S W, Chen F, Chang L F, Guo H J, Chang Z J, Qiao L Y. QTL mapping for salt tolerance in wheat line CH7034., 2022, 48: 2646–2654 (in Chinese with English abstract).
[41] 周升辉, 吴秋红, 谢菁忠, 陈娇娇, 陈永兴, 傅琳, 王国鑫, 于美华, 王振忠, 张德云, 王令, 王丽丽, 张艳, 梁荣奇, 韩俊, 刘志勇. 小麦燕大1817×北农6号重组自交系群体在正常和盐胁迫水培条件下苗期性状的QTL定位. 作物学报, 2016, 42: 1764–1778. Zhou S H, Wu Q H, Xie J Z, Chen J J, Chen Y X, Fu L, Wang G X, Yu M H, Wang Z Z, Zhang D Y, Wang L, Wang L L, Zhang Y, Liang R Q, Han J, Liu Z Y. Mapping QTLs for wheat seedling traits in RILs population of Yanda 1817 × Beinong 6 under normal and salt-stress conditions., 2016, 42: 1764–1778 (in Chinese with English abstract).
[42] Richards R A, Dennett C W, Qualset C O, Epstein E, Norlyn J D, Winslow M D. Variation in yield of grain and biomass in wheat, barley, and triticale in a salt-affected field., 1987, 15: 277–287.
[43] Houshmand S, Arzani A, Maibody S A M, Feizi M. Evaluation of salt-tolerant genotypes of durum wheat derived from in vitro and field experiments., 2005, 91: 345–354.
[44] Weimberg R. Solute adjustment in leaves of two species of wheat at two different stages of growth in response to salinity., 1987, 70: 381–388.
[45] Chen Z, Zhou M, Newman I A, Mendham N J, Zhang G, Shabala S. Potassium and sodium relations in salinized barley tissues as a basis of differential salt tolerance., 2007, 34: 150–162.
[46] Cuin T A, Betts S A, Chalmandrier R, Shabala S. A root’s ability to retain K+correlates with salt tolerance in wheat., 2008, 59: 2697–2706.
[47] Oyiga B C, Sharma R C, Baum M, Ogbonnaya F C, Léon J, Ballvora A. Allelic variations and differential expressions detected at quantitative trait loci for salt stress tolerance in wheat., 2018, 41: 919–935.
[48] Davenport R, James R A, Zakrisson-Plogander A, Tester M, Munns R. Control of sodium transport in durum wheat., 2005, 137: 807–818.
[49] Santa-Maria G E, Epstein E. Potassium/sodium selectivity in wheat and amphiploid cross wheat ×., 2001, 160: 523–534.
[50] Meneguzzo S, Navari-Izzo F, Izzo R. NaCl effects on water relations and accumulation of mineral nutrients in shoots, roots and cell sap of wheat seedling., 2000, 156: 711–716.
[51] Gaxiola R A, Rao R, Sherman A, Grisafi P, Alper S L, Fink G R. Theproton transporters, AtNhx1 and Avp1, can function in cation detoxification in yeast., 1999, 96: 1480–1485.
[52] Qiu D, Hu W, Zhou Y, Xiao J, Hu R, Wei Q, Zhang Y, Feng J, Sun F, Sun J, Yang G, He G. TaASR1-D confers abiotic stress resistance by affecting ROS accumulation and ABA signalling in transgenic wheat., 2021, 19: 1588–1601.
[53] Rong W, Qi L, Wang A, Ye X, Du L, Liang H, Xin Z, Zhang Z. The ERF transcription factor TaERF3 promotes tolerance to salt and drought stresses in wheat., 2014, 12: 468–479.
[54] Cuin T A, Tian Y, Betts S A, Chalmandrier R, Shabala S. Ionic relations and osmotic adjustment in durum and bread wheat under saline conditions., 2009, 36: 1110–1119.
[55] Raven J A. Regulation of pH and generation of osmolarity in vascular plants: a cost-benefit analysis in relation to efficiency of use energy, nitrogen and water., 1985, 101: 25–77.
附表1 10个参试品种的耐盐表型数据
Table S1 Phenotype data for salt tolerance of ten tested varieties used in this study

表型Phenotype耐盐品种 Salt-tolerant varieties盐敏感品种 Salt-sensitive varieties 小偃60XY60青麦6号QM6沧麦6005CM6005山融3号SR3德抗961DK961中麦175ZM175鲁原502LY502京411J411河农6425HN6425济麦20JM20 发芽率CK (%)97.0098.00100.00100.00100.00100.00100.00100.0083.75100.00 Germination rateNaCl (%)53.6141.3174.4262.3161.7762.6238.3641.0619.1483.75 RSIR (%)44.7357.8525.5837.6938.2337.3861.6458.9477.1516.25 总根长CK (cm)73.6434.2645.2365.8462.4433.1535.2334.2652.6778.66 Root total lengthNaCl (cm)37.7622.6230.9132.5643.2022.3016.6726.2731.5733.99 RSIR (%)48.7233.9831.6550.5430.8132.7552.6823.3140.0756.79 根表面积CK (cm2)7.535.146.4510.254.134.334.904.597.7711.00 Root surface areaNaCl (cm2)3.052.954.084.923.253.822.303.604.604.83 RSIR (%)59.5242.6836.7151.9721.4411.8253.0621.6540.8956.03 根体积CK (cm3)0.080.060.070.130.070.050.050.050.090.12 Root volumeNaCl (cm3)0.030.030.040.060.040.030.030.040.050.06 RSIR (%)62.4450.0541.8553.7542.0230.1053.3319.5941.9255.43 根径CK (mm)0.420.480.460.500.420.420.450.430.470.45 Root diameterNaCl (mm)0.420.410.420.480.310.420.430.440.460.45 RSIR (%)7.7314.058.332.3525.99–1.113.73–1.051.57–0.40 根尖数CK91.5056.0045.6089.2082.3043.2053.0079.60109.60114.40 Root tips numberNaCl53.3230.6023.6644.0050.3521.2416.2044.6245.6041.40 RSIR (%)41.7345.3648.1150.6738.8250.8469.4343.9558.3963.81 根分叉数CK63.5245.3335.8072.8055.3149.2035.6753.0051.0080.00 Root forks numberNaCl9.0124.4018.9539.0032.1914.9015.0039.4041.2023.40 RSIR (%)95.8146.18–21.2346.4341.80–37.6857.9425.6619.2270.75 离子流速Ions-fluxK+-flux(pmol cm–2 s–1)–215.06–240.00–67.11–120.38–166.78–46.65–67.03–176.05–181.43–195.29 Na+-flux(pmol cm–2 s–1)607.06448.07792.541589.41385.65523.28347.251922.13–89.79102.16 叶部盐害指数Salt-injury index of leaves (%)51.6142.0922.5040.5439.1958.7943.7557.6158.2255.00 根鲜重CK (mg)76.9861.44142.5790.9392.9839.9496.3385.70111.04196.58 Fresh weight of rootNaCl (mg)43.6239.2243.4748.5647.5131.7349.9043.0661.2866.26 RSIR (%)43.3436.1769.5146.6048.9020.5648.2049.7544.8166.29 地上部鲜重CK (mg)251.52194.36512.82422.36345.26171.30230.67338.74315.58621.13 Fresh weight of shootNaCl (mg)120.98108.78190.32151.66152.8690.7369.60153.30159.23183.51 RSIR (%)51.9044.0362.8964.0955.7347.0469.8354.7449.5470.46 鲜重根冠比CK (%)30.6131.7725.4621.5127.3423.1930.9224.3135.2131.47 Ratio of FW-R/FW-SNaCl (%)36.0536.3222.8132.0332.1631.9634.4828.0939.2738.48 RSIR (%)–17.79–14.3310.41–48.90–17.65–37.83–11.50–15.54–11.51–22.28 根干重CK (mg)28.8034.5816.8521.6725.484.6123.9320.1221.8064.66 Dry weight of rootNaCl (mg)12.334.457.3719.1611.965.515.009.087.6010.43 RSIR (%)57.1887.1356.2611.5853.04–19.5179.1154.8765.1483.87 地上部干重CK (mg)71.4042.7166.4851.3757.9910.7192.67142.5578.05182.83 Dry weight of shootNaCl (mg)24.9317.2225.3135.5626.4610.2117.80106.4024.5233.96 RSIR (%)65.0859.6861.9330.7854.374.6780.7925.3668.5881.43
(续附表1)
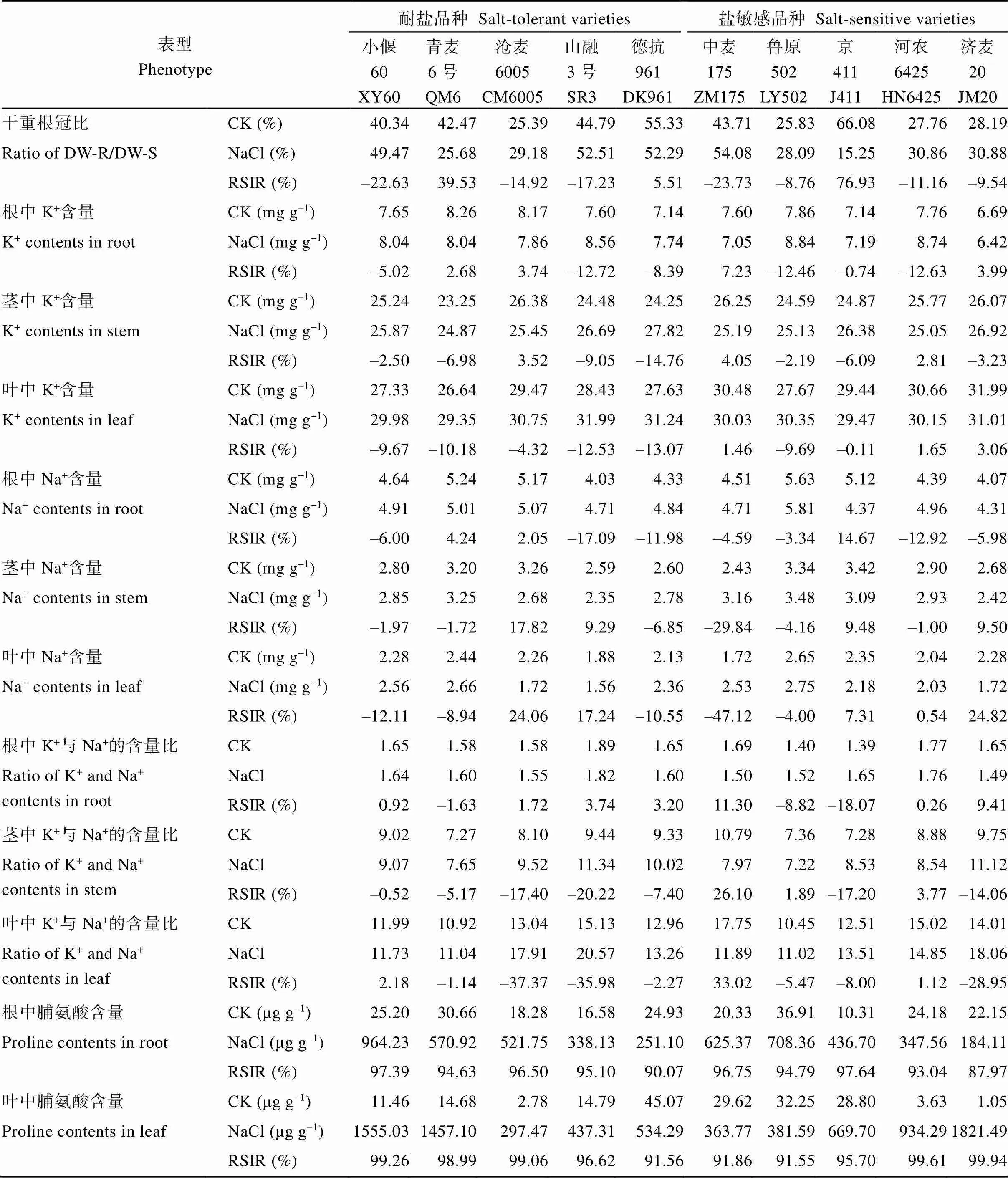
表型Phenotype耐盐品种 Salt-tolerant varieties盐敏感品种 Salt-sensitive varieties 小偃60XY60青麦6号QM6沧麦6005CM6005山融3号SR3德抗961DK961中麦175ZM175鲁原502LY502京411J411河农6425HN6425济麦20JM20 干重根冠比CK (%)40.3442.4725.3944.7955.3343.7125.8366.0827.7628.19 Ratio of DW-R/DW-SNaCl (%)49.4725.6829.1852.5152.2954.0828.0915.2530.8630.88 RSIR (%)–22.6339.53–14.92–17.235.51–23.73–8.7676.93–11.16–9.54 根中K+含量CK (mg g–1)7.658.268.177.607.147.607.867.147.766.69 K+ contents in rootNaCl (mg g–1)8.048.047.868.567.747.058.847.198.746.42 RSIR (%)–5.022.683.74–12.72–8.397.23–12.46–0.74–12.633.99 茎中K+含量CK (mg g–1)25.2423.2526.3824.4824.2526.2524.5924.8725.7726.07 K+ contents in stemNaCl (mg g–1)25.8724.8725.4526.6927.8225.1925.1326.3825.0526.92 RSIR (%)–2.50–6.983.52–9.05–14.764.05–2.19–6.092.81–3.23 叶中K+含量CK (mg g–1)27.3326.6429.4728.4327.6330.4827.6729.4430.6631.99 K+ contents in leafNaCl (mg g–1)29.9829.3530.7531.9931.2430.0330.3529.4730.1531.01 RSIR (%)–9.67–10.18–4.32–12.53–13.071.46–9.69–0.111.653.06 根中Na+含量CK (mg g–1)4.645.245.174.034.334.515.635.124.394.07 Na+ contents in rootNaCl (mg g–1)4.915.015.074.714.844.715.814.374.964.31 RSIR (%)–6.004.242.05–17.09–11.98–4.59–3.3414.67–12.92–5.98 茎中Na+含量CK (mg g–1)2.803.203.262.592.602.433.343.422.902.68 Na+ contents in stemNaCl (mg g–1)2.853.252.682.352.783.163.483.092.932.42 RSIR (%)–1.97–1.7217.829.29–6.85–29.84–4.169.48–1.009.50 叶中Na+含量CK (mg g–1)2.282.442.261.882.131.722.652.352.042.28 Na+ contents in leafNaCl (mg g–1)2.562.661.721.562.362.532.752.182.031.72 RSIR (%)–12.11–8.9424.0617.24–10.55–47.12–4.007.310.5424.82 根中K+与Na+的含量比CK1.651.581.581.891.651.691.401.391.771.65 Ratio of K+ and Na+contents in rootNaCl1.641.601.551.821.601.501.521.651.761.49 RSIR (%)0.92–1.631.723.743.2011.30–8.82–18.070.269.41 茎中K+与Na+的含量比CK9.027.278.109.449.3310.797.367.288.889.75 Ratio of K+ and Na+contents in stemNaCl9.077.659.5211.3410.027.977.228.538.5411.12 RSIR (%)–0.52–5.17–17.40–20.22–7.4026.101.89–17.203.77–14.06 叶中K+与Na+的含量比CK11.9910.9213.0415.1312.9617.7510.4512.5115.0214.01 Ratio of K+ and Na+contents in leafNaCl11.7311.0417.9120.5713.2611.8911.0213.5114.8518.06 RSIR (%)2.18–1.14–37.37–35.98–2.2733.02–5.47–8.001.12–28.95 根中脯氨酸含量CK (μg g–1)25.2030.6618.2816.5824.9320.3336.9110.3124.1822.15 Proline contents in rootNaCl (μg g–1)964.23570.92521.75338.13251.10625.37708.36436.70347.56184.11 RSIR (%)97.3994.6396.5095.1090.0796.7594.7997.6493.0487.97 叶中脯氨酸含量CK (μg g–1)11.4614.682.7814.7945.0729.6232.2528.803.631.05 Proline contents in leafNaCl (μg g–1)1555.031457.10297.47437.31534.29363.77381.59669.70934.291821.49 RSIR (%)99.2698.9999.0696.6291.5691.8691.5595.7099.6199.94
RSIR: 相对盐害指数。
RSIR: relative salt-injury rate for germination.
Applicability evaluation of screen methods to identify salt tolerance in wheat at germination and seedling stages
CHEN Jia-Ting, BAI Xin, GU Yu-Jie, ZHANG Xiao-Wen, GUO Hui-Juan, CHANG Li-Fang, CHEN Fang, ZHANG Shu-Wei, ZHANG Xiao-Jun, LI Xin, FENG Rui-Yun, CHANG Zhi-Jian, and QIAO Lin-Yi*
College of Agriculture, Shanxi Agricultural University / Shanxi Key Laboratory of Crop Genetics and Molecular Improvement / Key Laboratory of Sustainable Dryland Agriculture (co-construction by Ministry and Province), Ministry of Agriculture and Rural Affairs, Taiyuan 030031, Shanxi, China
Salt tolerance identification is the premise of screening germplasm and breeding salt-tolerant wheat varieties. There are many methods for testing salt tolerance of wheat indoor, involving different growth stages and tissues or organs. In order to evaluate the applicability of these methods in production, we selected five salt-tolerant varieties and five salt-sensitive varieties from the Northern Winter Wheat Production Area of China to compare seven identification methods (involving 27 parameters) for the responses to salt stress of wheat at germination and seedling stages. The results showed that the relative salt-injury rate for germination of grains could not distinguish the tolerant- and sensitive-varieties, while the salt-injury index of leaf, the Na+and K+fluxes of root, and the relative salt-injury rates for root tip number, root diameter as well as leaf K+content of seedlings were significantly different between the tolerant- and sensitive-varieties. Based on the results of regressive analysis and operability, the salt-injury index of leaf was considered to be an appropriate method for identifying salt tolerance that with high applicability in the Northern Winter Wheat Production Area, which can be used for germplasm screening or variety breeding by integrating the relative salt-injury rate for root tip number or leaf K+content, and the Na+or K+flux of root. This study analyzed and evaluated the salt tolerance identification methods from the aspect of application, and provide reference information for salt tolerance breeding in wheat.
wheat; salt-tolerance identification; method evaluation; germination stage; seedling stage
10.3724/SP.J.1006.2024.31049
本研究由中央引导地方科技发展资金项目(YDZJSX2022A046), 山西省回国留学人员科研资助项目(2021-070)和山西农业大学博士科研启动项目(2021BQ39)资助。
This study was supported by the Science and Technology Development Foundation of Central Guides Local Government Project (YDZJSX2022A046), the Research Project Supported by Shanxi Scholarship Council of China (2021-070), and the Shanxi Agricultural University Research Project for Doctor (2021BQ39).
乔麟轶, E-mail: linyi.qiao@sxau.edu.cn
E-mail: chenjiating111@126.com
2023-08-31;
2024-01-12;
2024-01-29.
URL: https://link.cnki.net/urlid/11.1809.S.20240126.1749.002
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
