大豆根茎过渡区弯曲突变体Mrstz的鉴定与基因定位
2024-04-28王业杏SoltaniMuhammadYOUSOF许竞好吴传磊李佳佳王晓波邱丽娟
苗 龙 舒 阔 李 娟 黄 茹 王业杏 Soltani Muhammad YOUSOF 许竞好 吴传磊 李佳佳 王晓波,* 邱丽娟
大豆根茎过渡区弯曲突变体M的鉴定与基因定位
苗 龙1,**舒 阔1,**李 娟1黄 茹1王业杏1Soltani Muhammad YOUSOF1许竞好1吴传磊1李佳佳1王晓波1,*邱丽娟2,*
1安徽农业大学农学院, 安徽合肥 230036;2中国农业科学院作物科学研究所/ 农业农村部作物基因资源与遗传改良重大科学工程/ 农业农村部作物基因资源与种质创制重点实验室, 北京 100081
植物根茎过渡区(root-stem transition zone, RSTZ)将根和茎相互连接, 其发育形态决定了大豆的地上部株型和抗倒伏潜力。本研究通过EMS诱变获得一个RSTZ弯曲或旋转的大豆突变体M, 其形态特征能够稳定遗传, 是探究大豆茎秆发育规律的特异材料。将该突变体和栽培大豆中黄13杂交构建重组自交系群体, 对群体中直立和弯曲型后代的RSTZ进行解剖结构比较, 发现弯曲型株系比直立型株系的维管形成层较宽、次生木质部细胞层数较多、细胞形状不规则, 表明维管组织分化可能是导致RSTZ形态发生差异的重要因素之一。进一步对化学组分测定发现, 木质素和粗纤维含量越高越不易弯曲。选取RIL群体中弯曲型和直立型2种极端株系进行BSA-Seq, 采用SNP-index和InDel-index关联分析方法鉴定到调控RSTZ形态的关联区域Chr19: 43030943~45849854, 该区间共含有319个基因。结合生物信息学分析、基因注释信息和表达丰度分析筛选到7个候选基因, 分别为、、、、、、。其中,、和在大豆驯化中潜在影响RSTZ形态建成。本研究为解析大豆RSTZ组织形成及其遗传基础提供了材料基础, 并为挖掘调控大豆茎秆发育基因提供新的见解。
大豆; 根茎过渡区; 突变体; BSA-seq; 候选基因
为了适应外界环境, 植物在不同发育阶段会不断形成新器官, 并通过调整自身的生长方式来维持正常发育[1]。大豆植株可分为地上部和地下部, 地下部分主要由根系构成、地上部主要由茎、叶、花、果荚、种子等构成。在大豆萌发过程中胚芽和胚根逐渐发育为茎和根, 而胚轴是连接胚根和胚芽的部位, 随着豆苗的不断形成逐步发育为连接根和茎的根茎过渡区(root-stem transition zone, RSTZ), 根和茎的维管束分化形式存在很大差异, 因此RSTZ也被称为维管束过渡区。从根到茎的转变不仅意味着形态上的变化, 而且意味着从运输和支撑到储存过程中的功能变化, 因此RSTZ的形态结构是衡量大豆株型的重要依据, 同时与植株对环境的适应性密切相关[2-3]。大豆的根系在吸收土壤水分和其他营养物质的同时也对植株起支撑作用, 同时茎秆的粗细展现了植株的健壮程度, 茎秆粗壮的植株不易发生倒伏, 具有丰产性[4-5]。根据大豆倒伏时期和倒伏程度的不同, 减产程度在10%~60%不等, 倒伏越重、越早, 减产幅度越大, 也间接加大了田间管理和病虫草害防治的难度, 因而倒伏是制约大豆高产和经济收入的重要因素[6]。茎倒伏是因为作物植株过高、茎秆细长、基部组织强度差所导致的, 比如遇到外因大风、暴雨, 引起茎秆不同程度的倾斜或弯曲, 也会出现根茎弯曲现象, 导致植物生长不良并造成经济损失。因此, 探究大豆RSTZ的形态建成及其关键调控基因的功能, 对了解大豆植株抗倒伏能力和培育大豆理想株型具有重要意义。
木质部和韧皮部是主要的植物维管组织, 水和溶质矿物的运输主要通过木质部完成, 而韧皮部负责光合产物和各种信号分子的分配[7-8]。从细胞学角度看, 茎秆的物理结构由机械组织、维管束、木质化薄壁细胞的特征所决定, 这些结构能够在茎秆的支撑、运输以及抗倒伏功能中发挥关键性作用[9]。一般来说, 根茎过渡区的机械组织、维管束、皮层等解剖结构受外界影响较小, 其中维管形成层的纺锤状原始细胞通过平周分裂产生新的木质部和韧皮部[10-11]。通常情况下, 朝向木质部一侧的平周分裂速率较快, 从而产生较多的木质部细胞, 而韧皮部细胞较少, 如果形成层各处产生的木质部和韧皮部均维持在一个相对恒定的比例, 那么植物茎秆发育基本呈现圆柱型, 即使发生微小的改变, 最终会严重影响茎秆形态及植株抗倒伏能力[12-13]。在双子叶植物中, 顶端分生组织在根、茎的伸长方面发挥重要作用, 而维管形成层主要负责促进茎和根加粗, 其中维管干细胞的增殖分化产生次生木质部和次生韧皮部, 不仅能够运输水分和光合产物, 而且起到支撑植物直立生长的作用[14]。前人在不同玉米品种研究中, 发现硬皮组织厚度、单位面积的维管束数目、维管束鞘厚度是玉米茎秆抗倒伏能力的基础[15-17]。罗茂春等[18]、Duan等[19]和袁新捷等[20]对水稻抗倒伏植株研究也证实了茎秆强度与茎秆组织中的维管束数目存在极显著正相关。由此可见, 维管组织形态和细胞排列情况是评价植株抗倒伏能力的重要指标之一。
大豆茎秆的主要化学成分为纤维素、半纤维素、木质素、粗纤维等, 这些化学成分的含量与茎秆机械强度以及茎秆形态息息相关。对玉米茎秆化学成分与其形态结构特征的研究中发现木质素、纤维素等物质含量增加时, 茎秆的抗折能力增加, 表明纤维素和木质素含量与茎秆抗倒伏能力呈显著正相关[21-24]。Silva等[25]研究发现抗倒伏性小麦品种的茎秆木质素含量越高, 抗倒伏能力越强。Vigols等[26]在玉米突变体中证实基因的突变会抑制木质素单体合成, 进而导致植株抗倒伏能力下降。目前, 越来越多的报道表明茎秆的化学组分, 包括木质素含量、纤维素含量对作物抗倒伏性具有重要作用。然而, 关于RSTZ形态及其化学组分变化影响植物的生理及发育研究较少。
随着新一代测序技术的发展, 前人通过BSA- seq技术对作物抗病性、株型以及高产等农艺性状开展重要功能基因挖掘, 被广泛应用于水稻、小麦、大豆等多个物种中。蒋家焕等[27]利用BSA-Seq方法, 在粳稻早衰突变体的F2分离群体中选择隐性和显性各100个单株构建混池, 最终定位到影响水稻早衰相关基因。崔彦芹等[28]基于BSA-seq技术对冀航芝1号和DW607的株高性状进行基因定位, 在NC026152.1和NC026156.1两条连锁群上关联到4个显著关联区域, 并鉴定到18个参与生长素响应的候选基因。在大豆中, Zhong等[29]通过该方法在3号染色体上定位到疫霉病抗性基因。本研究利用大豆根茎过渡区弯曲突变体与栽培大豆中黄13杂交构建重组自交系(recombinant inbred lines, RIL)群体, 通过对亲本和2个极端表型子代混合池进行BSA全基因组重测序及关联分析, 结合生物信息学分析、基因注释信息、基因表达丰度及荧光定量分析, 挖掘调控大豆根茎过渡区形态的遗传位点及候选基因。本研究为解析大豆RSTZ组织形成及其遗传基础提供了理论依据, 并为完善和培育大豆抗倒伏株型品种奠定了基础。
1 材料与方法
1.1 试验材料
通过EMS诱变大豆中品661获得突变体材料M, 该突变体表现为根茎过渡区(RSTZ)长度约为3 cm的组织呈现弯曲或旋转的特点, 并能够稳定遗传。将大豆骨干亲本中黄13与M杂交获得由120个株系构成的重组自交系群体。自2019—2021年连续3年种植于安徽农业大学高新技术产业园和海南南繁基地(F7至F10代), 行播, 行长2 m、行距45 cm、株距15 cm, 常规进行田间管理与表型鉴定。将大豆突变体M杂交后代材料按照不同的茎秆形态进行分类, 主要分为RSTZ部位弯曲型和直立型植株。
1.2 试验方法
1.2.1 根茎过渡区的解剖结构分析 大豆生育期间, 随着光合产物的积累和株高增加, 抗倒伏系数呈现U型变化, 在R5~R6期表现为最易发生倒伏, 且R5时期的主根和侧根生长最为健壮[30-31]。为比较大豆直立型与弯曲型RSTZ的细胞解剖结构差异, 在R5期分别取2种类型植株的RSTZ组织, 切成1~2 cm小段, 置于FAA固定液中固定并保存。制成石蜡切片后用番红固绿染色1~2 h, 然后在显微镜下观察次生韧皮部、维管形成层及次生木质部形态结构, 每种性状类型分别取3 株重复。
1.2.2 大豆M弯曲型和直立型茎秆的化学组分分析 对重组自交系群体分离后代成熟后脱粒, 并保留植株的RSTZ组织部位。采用茎秆切割器(北京昆捷玉成设备有限公司, KQS-400型), 将干燥后的RSTZ组织切成小段, 随后利用植物秸秆粉碎机(杭州绿博机械设备制造有限责任公司, FSD-100A)研磨粉碎, 通过18目筛子过滤杂质后装袋。使用DA7200型近红外成分测定仪测量茎秆中木质素、纤维素、粗纤维的含量。每种类型株系各40份, 每份样品重复检测3次, 结果用于后续分析。
1.2.3 BSA-Seq测序 根据在田间对中黄13 (父本)、突变体材料M(母本)以及RIL群体后代表型的鉴定, 选取来自分离群体的30株RSTZ弯曲型和30株RSTZ直立型植株以及2个亲本并提取DNA用于文库构建。利用Illunima Casava 1.8进行碱基识别分析, 采用150 bp双末端测序, 试验流程按照南京集思慧远生物科技有限公司的测序标准执行。根据各样品混池比对到大豆参考基因组Wm82.a2.v1的结果, 对混池中具有差异性的SNP位点进行汇总。使用GATK软件工具的HaplotypeCaller (局部单体型组装)算法进行SNP和InDel变异检测, 每个样本先各自生成gVCF, 再进行群体Joint-genotype。过滤并得到最终的变异位点集, 为对基因型数据进行质量控制, 最终保留了最大缺失位点、杂合位点小于20%且最小等位基因频率大于1%的标记, 利用SnpEff软件进行变异位点注释和预测变异效应。
1.2.4 候选基因挖掘 采用SNP-index和InDel- index方法进行全基因组关联分析, 以置信度99%为筛选阈值, 挖掘调控大豆RSTZ形态的遗传位点。通过大豆基因组公共数据库Soybase检索显著关联区间内的所有基因, 并借助BLAST软件对定位区间内的编码基因进行多个数据库(NR、GO、KEGG、COG、Pfam)注释分析。利用Phytozome数据库检索显著关联区间内所有基因在大豆各组织中的表达水平, 筛选在根或茎中特异高表达的基因作为候选基因。
1.2.5 荧光定量分析 为比较候选基因在弯曲型和直立型株系中的表达水平, 在突变体M后代分离群体中选取不同类型植株V5时期的RSTZ组织, 分别提取RNA。使用Prime Script RT Master Mix kit (TaKaRa, 日本)作为反转录酶合成cDNA, 所有cDNA样品稀释至相同浓度后用于qRT-PCR分析。
本试验使用Primer Premier 5.0设计候选基因荧光定量引物, 并在NCBI (www.ncbi.nlm.nih.gov)网站检测引物特异性, 选取()作为内参基因, 采用2-DDCt法计算各类型样品中候选基因的相对表达水平, 每个类型株系进行3个生物学重复。
1.2.6 数据处理与统计分析 利用SPSS 22.0统计软件进行数据描述性统计分析和检验, 差异显著水平< 0.05。
2 结果与分析
2.1 弯曲型与直立型株系的根茎过渡区解剖学特征比较
将中黄13与突变体M杂交后代按照不同的形态进行分类, 分为RSTZ弯曲型和直立型植株, 其中弯曲型表现为根和茎连接部位弯曲或旋转等特点(图1-A)。植物维管组织中, 形成层细胞的分化能够影响茎秆侧向形态建成, 为比较RSTZ维管结构在2种类型株系中的差异, 本研究进一步探究弯曲型和直立型大豆的RSTZ细胞学解剖结构特征, 发现弯曲型株系维管形成层较宽、次生木质部细胞层数较多、细胞形状不规则(图1-B), 表明不同类型株系RSTZ维管形成层分化可能是导致形态发生差异的重要因素。
2.2 弯曲型与直立型株系的根茎过渡区化学组分比较
为探究大豆茎秆化学组分与RSTZ形态特征之间的关系, 对2种类型各40份大豆茎秆的粗纤维、纤维素和木质素含量进行检测。结果表明,M杂交后代中大豆茎秆的粗纤维含量分布于45%~57%, 纤维素含量分布于46%~57%, 木质素含量分布于9%~ 15% (图2)。将直立型和弯曲型植株的木质素、纤维素、粗纤维按其含量范围进行划分, 2种表型RSTZ的粗纤维含量集中分布在49%~55%, 其中直立株系的粗纤维含量较弯曲型植株更高(图2-A); 77%的直立型RSTZ组织中纤维素含量高于50%, 而70%的弯曲型RSTZ组织中纤维素含量低于50% (图2-B); 此外, 直立型RSTZ组织中木质素含量高于11%的占77%, 而在弯曲型中仅占32% (图2-C)。RSTZ部位的直立型与弯曲型茎秆中粗纤维与木质素含量呈现显著差异, 纤维素没有明显差异(图2-D~F)。表明大豆的RSTZ形态与其茎杆的化学组分密切相关, 且木质素、粗纤维含量高的植株RSTZ不易发生弯曲。
2.3 大豆根茎过渡区形态的遗传定位
2.3.1 BSA-seq数据质量评估 选取RIL群体中30个直立型和30个弯曲型株系分别提取DNA并构建混池, 与2个亲本中黄13和突变体M在Illumina测序平台进行测序。对初始测序数据进行质量评估, 样品的测序数据质量评估如表1所示。过滤后的碱基数量为85.53 Gbps, 检测各样品的插入片段大小分布情况符合正态分布, 4个混池测序文库中碱基质量值高于30的百分比分别为94.85%、94.54%、94.54%和94.56%, 即Q30>94.54%, GC含量在35.10%以上, 将获得的高质量测序数据比对到大豆参考基因组上(Wm82.a2.v1), 平均比对率为97.99%, 基因组覆盖度为95.00% (至少1个碱基覆盖)。这些参数说明本次测序得到的数据数量和质量均可达到后续分析的要求, 为进一步开展大豆RSTZ形态性状候选基因的挖掘提供可靠位点信息。

图1 根茎过渡区直立型与弯曲型植株及其解剖结构比较
A: VC、V6、R5、R8时期根茎过渡区直立型与弯曲型大豆植株; B: R5时期直立型与弯曲型株系下胚轴解剖结构。Vc: 维管形成层; Sx: 次生木质部; Sp: 次生韧皮部。A图标尺表示2 cm, B图标尺表示50 μm。VC: 子叶期; V6: 六叶期; R5: 始粒期; R8: 完熟期。
A: soybean plants with vertical or curved RSTZ at the VC, V6, R5, and R8 stages; B: the anatomical structure of hypocotyl for vertical and curved lines at R5 stage; Vc: vascular cambium; Sx: secondary xylem; Sp: secondary phloem. Bar: 2 cm (A) and 50mm (B). VC: at cotyledon stage; V6: at six leaves stage; R5: at beginning seed stage; R8: at maturity stage.

图2 弯曲型与直立型根茎过渡区的化学组分分布及比较
A、B、C分别为弯曲型与直立型根茎过渡区中粗纤维、纤维素、木质素化学组分分布图; D、E、F柱状图代表平均值±标准差(*:< 0.05, **:< 0.01,检验)。
A, B, and C are the distribution maps of chemical components of crude fiber, cellulose, and lignin in the vertical and curved root-stem transition zone, respectively; D, E, F: histogram represents mean ± SD (*:< 0.05, **:< 0.01,-test).
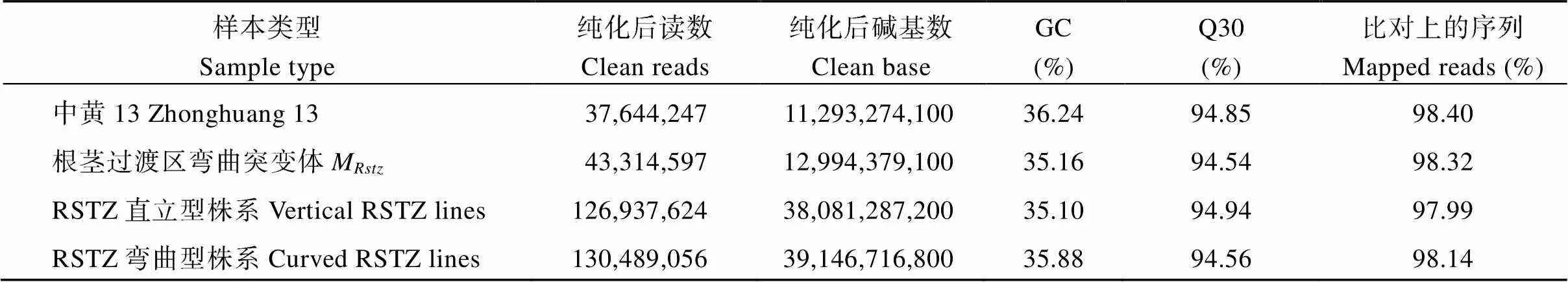
表1 样品测序数据的质量评估
2.3.2 大豆根茎过渡区形态的关联分析 通过GATK软件获取不同文库间的SNP及InDel变异信息, 在亲本样品池中共鉴定到2,116,251个SNP和376,054个Indel; 2个混合池中共鉴定到395,607个SNP和87,769个Indel。采用delta-SNP-index方法进行基因组关联分析, 以99%置信度为筛选阈值在19号染色体上关联到1个候选区域, 总长为3.01 Mb (物理位置Chr19: 43,030,943~46,037,125 bp), 共包含346个基因(图3-A和表2)。采用delta-InDel-index方法进行基因组关联分析, 以99%置信度为筛选阈值在19号染色体上定位到1个候选区域, 总长为2.87 Mb (物理位置Chr19:42,975,089~45,849,854 bp), 共包含323个基因(图3-B和表2)。2种关联分析方法定位到的候选区域与Soybase中已收录的5个倒伏候选位点重合, 分别是、、、和, 表明该候选区域具有较高的可信度, 可用于候选基因挖掘。
2.4 大豆根茎过渡区形态的候选基因挖掘
使用GO数据库将一致性区间内319个候选基因按照生物过程(biological process)、细胞成分(cellular component)和分子功能(molecular function)进行基因功能分类。结果显示, 大部分基因参与细胞壁/膜的生物合成、辅酶的运输与代谢、碳水化合物的转运与代谢以及对植物激素激活等信号通路(图4)。基于基因功能注释以及生物信息学分析, 筛选参与细胞分化、调控纤维素合成、木质素分解代谢、粗纤维合成相关途径, 鉴定到4个候选基因, 分别为参与纤维素生物合成过程、向重力性以及正向调节细胞增殖的(GO:0016570); 参与细胞壁大分子代谢过程、木质部发育的(GO:0008152); 参与纤维素代谢过程的(GO:0001557)以及编码细胞壁果胶酯酶合成基因(GO:0042545)。这些代谢过程已被证明与根茎组织的形态变化以及茎秆的生长习性相关[33], 表明候选基因可能在调控大豆RSTZ形态结构变异中发挥重要作用。
本研究利用Phytozome数据库中已收录大豆不同组织部位RNA-Seq数据, 分析一致性关联区间内319个基因的组织表达特点, 结果显示6个基因在大豆茎或根中表达高并聚类到相同分枝上(图5), 它们分别是、、、、、, 也可能是调控RSTZ形态的候选基因。

图3 SNP-index和InDel-index关联值在染色体上的分布
RSTZ两种类型的delta-SNP-index (A)和delta-InDel-index (B)拟合图; 横坐标表示染色体的位置, 黑色曲线表示相应的关联值, 最上侧的红线代表置信度为99%的阈值线, 红色箭头指示定位的候选区域。
Delta-SNP-index (A) and delta-InDel-index (B) fitting plots for two types of RSTZ. The abscissa indicates the position of chromosomes and the black curve represents the associated values of each site, while the top red line indicates the threshold line with the confidence level of 99%. The red arrow points to the candidate region for positioning.
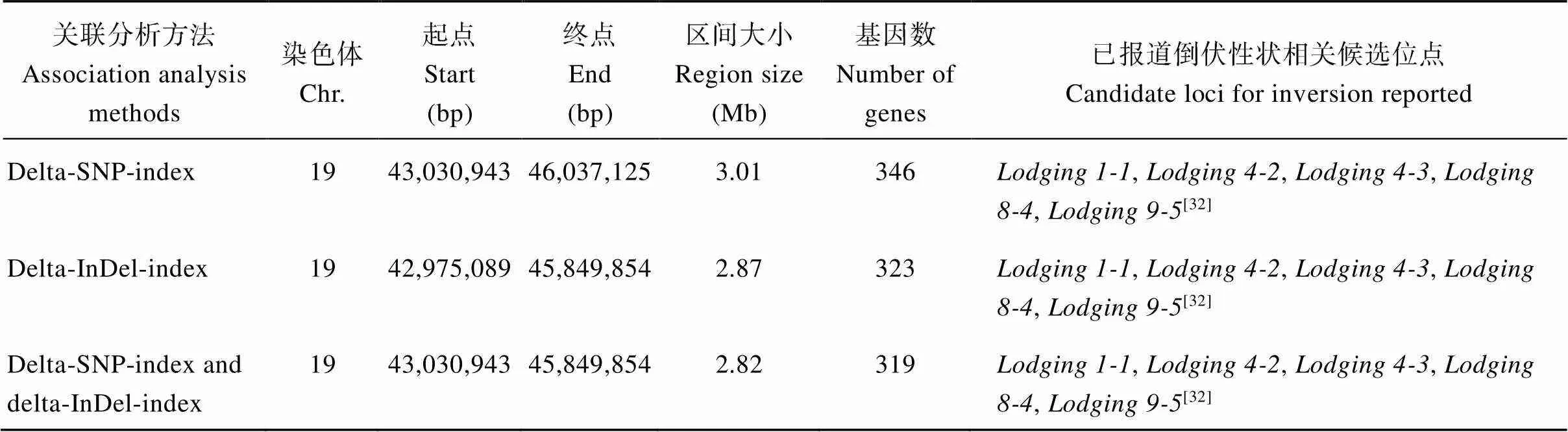
表2 BSA-seq关联分析获得大豆根茎过渡区形态的候选区域

图4 候选区域内基因GO注释分类
横坐标为GO各分类内容, 纵坐标左边和右边分别表示基因数目所占百分比和基因数目。
The horizontal axis indicates the GO classification terms, while the left and right of the vertical axis represent the percentage of genes and the number of genes, respectively.

图5 一致性关联区间内所有基因在不同大豆组织中的表达水平聚类热图
为进一步鉴定以上候选基因在后代中的表达水平, 取RSTZ组织弯曲型和直立型株系, 通过qRT-PCR分析上述10个候选基因的表达水平(图6)。以直立型植株中的表达水平作为对照, 结果显示,、、在弯曲型株系中的表达水平显著上调。、、、在弯曲型株系中的表达水平显著下调。综合以上分析结果, 最终得到7个可能调控大豆RSTZ形态的候选基因, 分别为、、、、、、。
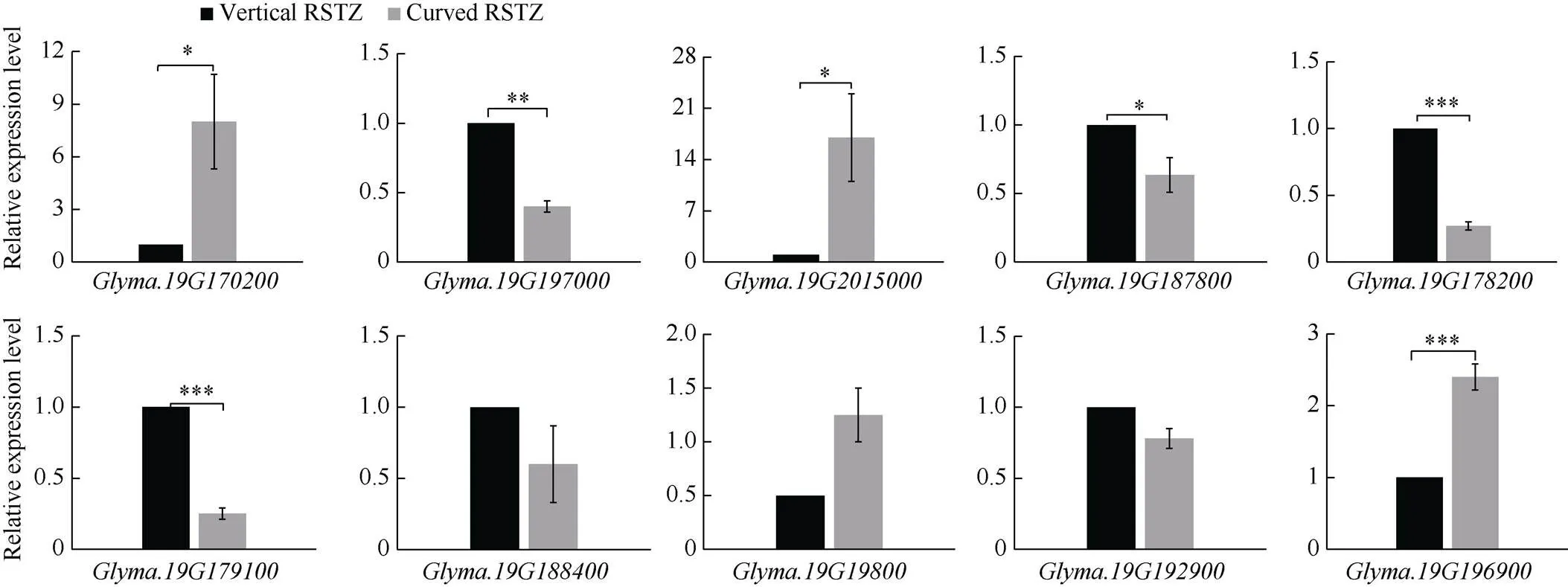
图6 根茎过渡区弯曲型和直立型株系中候选基因表达水平比较
用作内参, 候选基因在不同株系中的相对表达量进行检验(*:< 0.05; **:< 0.01; ***:< 0.001)。
The relative expression levels of candidate genes in different lines were tested by-test (*:< 0.05, **:< 0.01, and ***:< 0.001) usingas the internal reference.
2.5 大豆根茎过渡区形态候选基因的遗传多样性分析
利用大豆基因组数据库(https://yanglab.hzau. edu.cn/SoyGVD/#/)已收录的588份野生大豆、1253份地方品种和2573份育成品种的变异信息对候选基因进行遗传多样性及进化分析[34]。发现来自于全球的4414份大豆材料中,、、、、、、分别具有7种、7种、4种、10种、3种、3种和5种不同单倍型(表3)。其中, 候选基因的hap0单倍型在地方品种中分布频率为0.737, 在选育品种中分布频率为0.862, 且hap3单倍型在地方品种和育成品种中均不存在, 而野生大豆中的4种不同单倍型均匀分布, 该基因的核苷酸多态性(π)在野生大豆群体中为0.00373, 栽培大豆群体中为0.00173, 两群体间的遗传分化指数(ST)为0.26, 表明可能是大豆早期抗倒伏能力驯化的关键事件, 其中hap0为大豆较高抗倒伏能力提升的优异单倍型。候选基因的hap4单倍型在野生大豆中分布频率为0.811, 在地方品种和育成品种中分布频率分别为0.002、0.003, 该基因π值在野生大豆群体中为0.00170, 栽培大豆群体中为0.001,07, 野生大豆与栽培大豆群体间的ST值为0.32, 结果分析表明可能是野生大豆RSTZ形态驯化的关键事件。候选基因的hap0单倍型在地方和育成品种中分布频率分别为0.437、0.512, 在野生品种中分布频率为0.05, 该基因的π值在野生大豆群体中为0.00195, 栽培大豆群体中为0.00123, 两群体间的ST值为0.28, 该基因和候选基因分析一致, 表明也可能是大豆早期选择影响RSTZ形态的关键事件, 且hap0单倍型植株被选择性保留。
3 讨论
3.1 大豆根茎过渡区形态特征与其解剖结构的关系
维管组织由木质部和韧皮部组成, 在植物整个生命周期中不断形成新的组织和器官, 并在它们之间运输各种分子, 对植物的生长和发育至关重要[35-37]。大豆根和茎作为营养物质运输的主要途径, 并对植株起支撑作用, 其中衔接植株根和茎的过渡区域(RSTZ)也被称为维管束过渡区。从根到茎的转变, RSTZ会伴随着维管组织的分化, 维管柱变粗, 同时木质部的位置和方向也发生转变, 经过一系列的细胞分裂和分化, 最终将二者结构紧密连接起来。前人对野生大豆和栽培大豆营养器官和生殖器官进行解剖学结构分析, 发现野生型大豆初生维管组织系统的连接, 以子叶节为中心, 具有一个过渡区和一个连接区, 在面对不同的生长环境和生理条件下, 维管组织中木质部、韧皮部表现较高重塑性[38-39]。因此了解维管组织随茎秆形态结构的变化, 对其解剖结构进行分析, 有利于预测和维持植株未来的生长和产量情况。本试验比较大豆根茎过渡区弯曲型与直立型的解剖结构的特点发现, RSTZ表型变化与根茎组织中形成层密度、木质部细胞层数密切相关。
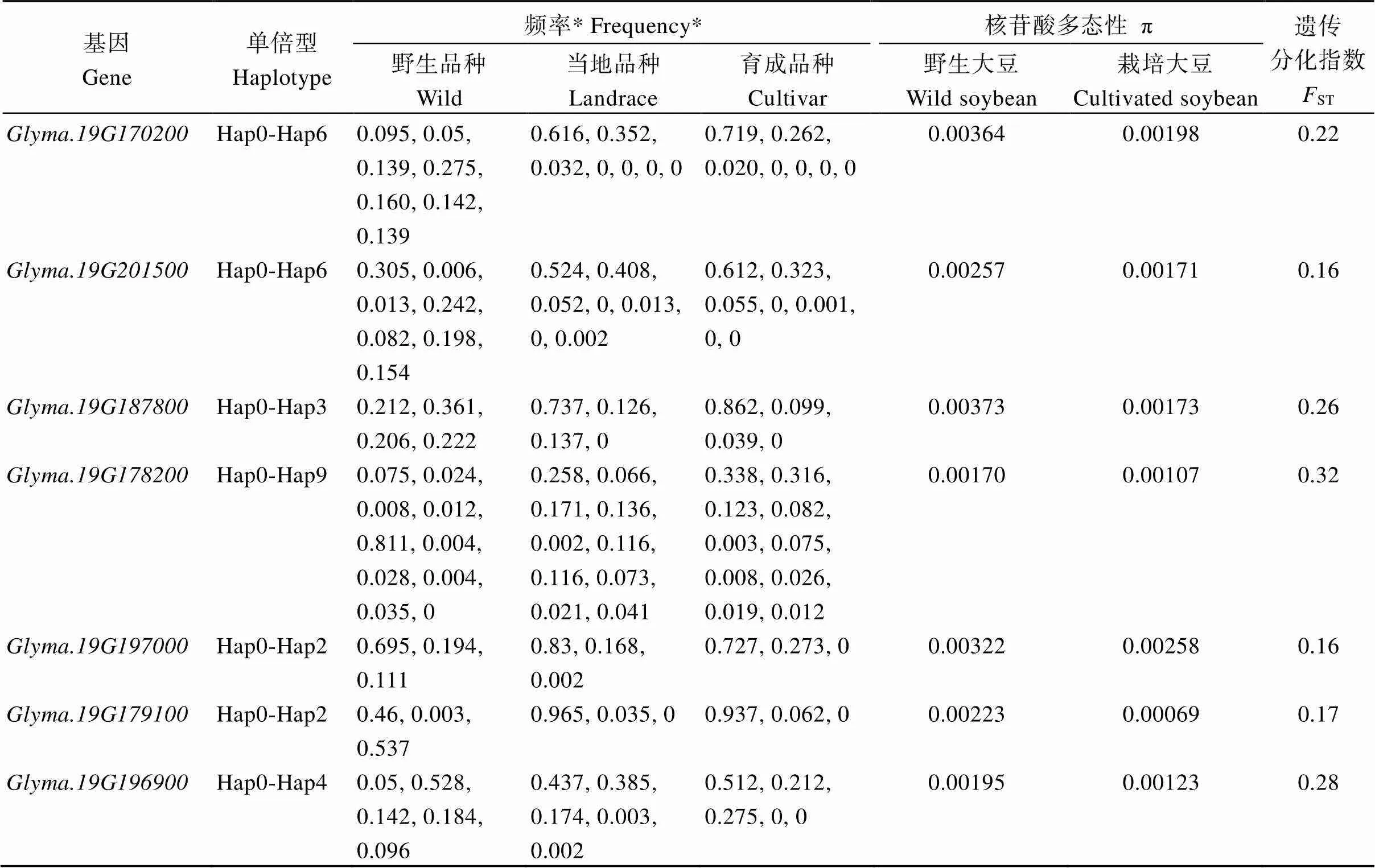
表3 大豆根茎过渡区形态候选基因的遗传多样性分析
*表示候选基因不同单倍型分别在野生品种、地方品种和育成品种中的分布频率。π中表示核苷酸多态性,ST: 遗传分化指数。
*: the distribution frequency of candidate genes different haplotypes in wild, landraces, and cultivar; π: the nucleotide diversity,ST: genetic differentiation index.
3.2 大豆根茎过渡区形态特征与其化学组分的关系
木质素是一种光敏酚类化合物, 也是植物细胞壁的骨架物质, 能够提高细胞壁硬度、机械支持力、抗压强度, 还能促进机械组织形成, 因此木质素含量的增加可显著增强茎秆抗压和抗倒伏能力[21-24,40-42]。木质素合成途径涉及到许多酶促作用, 是一个非常复杂的过程。由于木质素重要的生物学功能, 近年来有关木质素合成途径中的机制研究越来越多, 不仅研究水平逐渐深入, 而且还涉及植物体内的多条途径, 有关基因表达调控和基因功能分析的报道逐渐增多。最近一项研究遮荫对茎秆中木质素代谢的影响表明, 木质素含量减少会导致茎秆变细、较脆弱。遮荫降低了参与木质素生物合成的苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)、过氧化物酶(peroxidase, POD)、4-香豆酸辅酶A连接酶(4-coumaric acid coenzyme aligase, 4-CL)和肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase, CAD)的代谢活性, 茎的维管束和厚壁组织细胞中木质素沉积减少, 引起茎弯曲和生长迟缓, 其中、和为小麦茎秆木质素代谢的关键酶基因[43-46];、、、为油菜茎秆木质素代谢的关键酶基因, 其表达量与木质素含量呈显著正相关;、、和为亚麻木质部木质素代谢的关键酶基因[45]。通过探究大豆茎秆化学组分与RSTZ形态特征之间的关系, 分析2种类型茎秆中粗纤维、纤维素、木质素的含量。本研究发现RSTZ直立型植株的3种化学组分含量显著高于弯曲型植株, 表明大豆的RSTZ形态特征与其茎杆的化学组分密切相关。本研究中, 在筛选影响RSTZ形态特征的候选基因中, 其中和主要是参与茎秆次生细胞壁纤维与细胞壁相关组分的合成和代谢过程。结合实时荧光定量结果和化学组分分析可知,、可能在参与木质素、纤维素合成中起到负调控作用。植物细胞壁的强大纤丝网状结构可为细胞及整个植物体提供机械支持作用, 而且纤维素和木质素是细胞壁的主要成分, 纤维素和木质素对维持茎秆强度具有明显的促进作用, 进而对保持茎秆形态稳定有一定的优势, 最终表现出植株对不良环境更强的适应性[39,47]。因此,和候选基因为探究化学组分影响RSTZ形态建成提供新的思路。
3.3 大豆根茎过渡区与倒伏相关候选基因分析
对影响倒伏相关基因的挖掘一直是大豆生物学领域的热点[48]。Hwang等[48]利用Harosoy和Clark杂交群体进行大豆抗倒伏QTL定位, 结果在大豆遗传图谱上鉴定到88个潜在QTL。通过对16个显著的QTL聚类, 其中14个在2个或2个以上的定位群体中或在不同环境条件下的单个群体中得到了证实,被认为是最稳定的QTL[49]。刘硕等[50]对已经报道过的QTL信息进行整合, 鉴定出了6个重演性较好的QTL区间, 分别位于6号、13号和19号染色体上, 进一步筛选获得了一个稳定性较高的分子标记Satt277,为大豆抗倒伏分子标记和抗倒伏基因挖掘提供参考。本研究对控制RSTZ弯曲相关基因进行初步定位, 鉴定到19号染色体上与RSTZ弯曲显著相关的QTL, 并与Soybase中已收录的多个倒伏候选位点(、、、和)物理位置重合, 进一步鉴定到7个候选基因。其中,和分别功能注释为参与纤维素生物合成、木质素分解代谢过程, 通过不同类型的RSTZ化学组分分析发现直立型株系中粗纤维与木质素含量显著高于弯曲型株系, 然而表达水平显著低于弯曲型株系(图2和图6), 表明、可能在参与木质素、纤维素合成中起到负调控作用。编码果胶甲酯酶(pectin methylesterase, PME), 催化果胶去酯化为果胶酸盐和甲醇。果胶是植物细胞壁的主要成分之一, 在植物生长、形态和植物防御中具有重要作用[51]。研究发现, PME能够参与细胞壁的纤维素和果胶加工过程, 通过影响茎的伸长调控植物生长发育[52]。拟南芥突变体中果胶甲酯酶活性降低, 导致茎倒伏, 表明PME活性参与调节植株抗倒伏能力[53]。根据注释信息,与植物细胞的氧化还原酶活性相关,参与细胞壁大分子代谢过程、木质部发育,潜在参与植物器官形态发生以及分生组织生长,功能注释与细胞壁生物发生、葡糖醛酸木聚糖代谢过程、木聚糖生物合成过程相关。通过序列比对, 发现上述7个候选基因的启动子和编码区在双亲中无变异位点。进一步对自然群体4414份大豆材料的遗传多样性分析, 可知、和在大豆驯化中存在选择性清除现象, 其中的hap0单倍型、的hap4单倍型、的hap0单倍型可能在大豆驯化中参与RSTZ形态建成, 对于大豆抗倒伏能力提升发挥重要作用。
已有研究报道表明miRNAs在次生生长中至关重要, 其中过表达导致木质素沉积减少, 木质部导管和纤维次生细胞壁厚度减小[54]。Zhao等[55]介绍了miR857调控拟南芥转录, 进而影响次生木质部细胞壁中木质素的含量。结合细胞学解剖特征分析(图1), 这些基因可能与miRNAs共同参与木质素的合成代谢, 通过调控单位面积的维管束数目、维管束鞘厚度影响RSTZ的发育, 进而影响大豆生长过程中RSTZ组织的形态变化。
4 结论
本研究对大豆根茎过渡区(RSTZ)进行解剖结构和化学组分鉴定, 并利用BSA-seq技术定位到19号染色体上与其表型显著相关的2.87 Mb区间。结合生物信息学和转绿组数据以及荧光定量分析, 最终得到7个可能调控大豆RSTZ形态的候选基因、、、、、和。其中,、和在大豆驯化中潜在影响RSTZ形态建成。本研究结果为解析大豆RSTZ组织形成及其遗传基础提供理论依据, 并为完善大豆抗倒伏株型提供新的见解。
[1] 杨红燕, 沈会权, 胡哲, 栾海业, 乔海龙, 臧慧, 徐肖, 张英虎.黄淮海地区大豆品种蛋白质、油脂含量和百粒质量的表型分析及籽粒蛋白质含量的改良. 江苏农业科学, 2021, 49(22): 84–87. Yang H Y, Shen H Q, Hu Z, Luan H Y, Qiao H L, Zang H, Xu X, Zhang Y H. Phenotypic analysis of protein, oil content and 100-grain weight of soybean varieties in Huanghuaihai area and improvement of grain protein content., 2021, 49(22): 84–87 (in Chinese with English abstract).
[2] 倪福太. 植物根-茎过渡区的研究现状. 吉林师范大学学报(自然科学版), 2004, (1): 51–53. Ni F T. The present conditions of research of root-stem transition region.(Nat Sci Edn), 2004, (1): 51–53 (in Chinese with English abstract).
[3] 谷安根, 王立军, 汪牟, 谷颐. 被子植物根-茎过渡区研究的新进展. 植物研究, 1991, (3): 85–90. Gu A G, Wang L J, Wang M, Gu Y. Advances in the study of root-stem transition region of the angiosperm., 1991, (3): 85–90 (in Chinese with English abstract).
[4] 张东来, 徐瑶, 王家睿, 刘博, 张锐, 龚振平. 大豆生育期间抗倒伏性状变化规律的研究. 作物杂志, 2016, (2): 112–117. Zhang D L, Xu Y, Wang J R, Liu B, Zhang R, Gong Z P. Studies on the regulation of lodging traits variation during soybean growth stages., 2016, (2): 112–117 (in Chinese with English abstract).
[5] 胡珀, 韩天富. 植物茎秆性状形成与发育的分子基础. 植物学通报, 2008, 25(1): 1–13. Hu P, Han T F. Molecular basis of stem trait formation and development in plants., 2008, 25(1): 1–13 (in Chinese with English abstract).
[6] Raza A, Asghar M A, Ahmad B, Bin C, Iftikhar Hussain M, Li W, Iqbal T, Yaseen M, Shafiq I, Yi Z, Ahmad I, Yang W, Liu W. Agro-techniques for lodging stress management in maize- soybean intercropping system: a review.(Basel), 2020, 9: 1592.
[7] 杨菁, 董忠民. 双子叶植物出土幼苗根茎转变区维管组织发育动态. 西北植物学报, 2003, 23: 1111–1115. Yang J, Dong Z M. Vascular development in the transition region of dicotyledonary epigeal seedlings., 2003, 23: 1111–1115 (in Chinese with English abstract).
[8] 牛佳田. 根-茎间“过渡区”及其维管组织的转变与联系. 生物学通报, 1997, 32(4): 12–13. Niu J T. The “transition zone” between root and stem and the transformation and connection of its vascular tissue., 1997, 32(4): 12–13 (in Chinese with English abstract).
[9] 赵翠兰, 王丕武, 秦迪, 潘丽丹, 刘婷婷, 曲静. 拔节期玉米自交系茎秆纤维素合成酶基因的表达及其与抗倒伏的关系. 吉林农业大学学报, 2017, 39: 513–517. Zhao C L, Wang P W, Qin D, Pan L D, Liu T T, Qu J. Correlation between expression of cellulose synthetase genes and lodging resistance at elongation stage in maize inbred lines., 2017, 39: 513–517 (in Chinese with English abstract).
[10] Esau K, Cheadle V I. Significance of cell divisions in differentiating secondary phloem., 1955, 4: 348–357.
[11] Spicer R, Groover A. Evolution of development of vascular cambia and secondary growth., 2010, 186: 577–592.
[12] 陈华华, 李俊, 万洪深, 王玲玲, 彭正松, 杨武云. 实心小麦86-741茎秆的解剖分析及壁厚特性的SSR标记. 作物学报, 2008, 34: 1381–1385. Chen H H, Li J, Wan H S, Wang L L, Peng Z S, Yang W Y. Microsatellite markers for culm wall thickness and anatomical features of solid stem wheat 86-741., 2008, 34: 1381–1385 (in Chinese with English abstract).
[13] 王芬娥, 黄高宝, 郭维俊, 张锋伟, 吴建民, 赵多佳. 小麦茎秆力学性能与微观结构研究. 农业机械学报, 2009, 40(5): 92–95. Wang F E, Huang G B, Guo W J, Zhang F W, Wu J M, Zhao D J. Mechanical properties and micro-structure of wheat stems.,2009, 40(5): 92–95 (in Chinese with English abstract).
[14] Omary M, Gil-Yarom N, Yahav C, Steiner E, Hendelman A, Efroni I. A conserved super locus regulates above- and belowground root initiation., 2022, 375: eabf4368.
[15] 刘东尧, 闫振华, 陈艺博, 杨琴, 贾绪存, 李洪萍, 董鹏飞, 王群. 增温对玉米茎秆生长发育、抗倒性和产量的影响. 中国农业科学, 2021, 54: 3609–3622. Liu D Y, Yan Z H, Chen Y B, Yang Q, Jia X C, Li H P, Dong P F, Wang Q. Effects of elevated temperature on maize stem growth, lodging resistance characters and yield., 2021, 54: 3609–3622 (in Chinese with English abstract).
[16] 马青美, 许荣荣, 赵美爱, 宋希云, 裴玉贺. 玉米茎秆抗倒伏相关生理生化指标及关键酶基因的表达分析. 植物生理学报, 2019, 55: 1123–1132. Ma Q M, Xu Y Y, Zhao M A, Song X Y, Pei Y H. Physiological and biochemical indexes related to lodging resistance of maize stalk and expression analysis of key enzyme genes., 2019, 55: 1123–1132 (in Chinese with English abstract).
[17] 王群瑛, 胡昌浩. 玉米茎秆抗倒特性的解剖研究. 作物学报, 1991, 17: 70–75. Wang Q Y, Hu C H. Studies on the anatomical structures of the stalks of maize with different resistance to lodging., 1991, 17: 70–75 (in Chinese with English abstract).
[18] 罗茂春, 田翠婷, 李晓娟, 林金星. 水稻茎秆形态结构特征和化学成分与抗倒伏关系综述. 西北植物学报, 2007, 27: 2346–2353. Luo M C, Tian C T, Li X J, Lin J X. Relationship between morpho-anatomical traits together with chemical components and lodging resistance of stem in rice (L.)., 2007, 27: 2346–2353 (in Chinese with English abstract).
[19] Duan C, Wang B, Wang P, Wang D, Cai S. Relationship between the minute structure and the lodging resistance of rice stems., 2004, 35: 155–158.
[20] 袁新捷, 刘潇, 陈国兴. 水稻核心种质资源茎秆抗倒伏性研究.华中农业大学报, 2021, 40(1): 147–153. Yuan X J, Liu X, Chen G X. Stem lodging resistance of rice core germplasm., 2021, 40(1): 147–153 (in Chinese with English abstract).
[21] 邹俊林, 刘卫国, 袁晋, 蒋涛, 叶素琴, 邓榆川, 杨晨雨, 罗玲,杨文钰. 套作大豆苗期茎秆木质素合成与抗倒性的关系. 作物学报, 2015, 41: 1098–1104. Zou J L, Liu W G, Yuan J, Jiang T, Ye S Q, Deng Y C, Yang C Y, Luo L, Yang W Y. Relationship between lignin synthesis and lodging resistance at seedlings stage in soybean intercropping system., 2015, 41: 1098–1104 (in Chinese with English abstract).
[22] Yu M, Wang M, Gyalpo T, Basang Y. Stem lodging resistance in hulless barley: transcriptome and metabolome analysis of lignin biosynthesis pathways in contrasting genotypes., 2021, 113: 935–943.
[23] Wang X, Shi Z, Zhang R, Sun X, Wang J, Wang S, Zhang Y, Zhao Y, Su A, Li C, Wang R, Zhang Y, Wang S, Wang Y, Song W, Zhao J. Stalk architecture, cell wall composition, and QTL underlying high stalk flexibility for improved lodging resistance in maize., 2020, 20: 515.
[24] 张丰转, 金正勋, 马国辉, 万宜珍, 刘海英, 徐美兰. 水稻抗倒性与茎秆形态性状和化学成分含量间相关分析. 作物杂志, 2010, (4): 15–19. Zhang F Z, Jin Z X, Ma G H, Wan Y Z, Liu H Y, Xu M L. Correlation analysis between lodging resistance and morphological characters of physical and chemical components in Rice's Culms., 2010, (4): 15–19 (in Chinese with English abstract).
[25] Silva B R S, Batista B L, Lobato A K S. Anatomical changes in stem and root of soybean plants submitted to salt stress.(Stuttg), 2021, 23: 57–65.
[26] Vignols F, Rigau J, Torres M A, Capellades M, Puigdomènech P. The() mutation in maize occurs in the gene encoding caffeic acid O-methyltransferase., 1995, 7: 407–416.
[27] 蒋家焕, 朱永生, 陈丽萍, 郑艳梅, 蔡秋华, 谢华安, 王爱荣, 张建福. 利用BSA-Seq方法定位一个水稻早衰相关基因. 福建农业学报, 2022, 37(2): 131–137. Jiang J H, Zhu Y S, Chen L P, Zheng Y M, Cai Q H, Xie H A, Wang A R, Zhang J F. Using BSA-Seq method to locate a rice progeria related gene., 2022, 37(2): 131–137 (in Chinese with English abstract).
[28] 崔彦芹, 郭元章, 侯少锋, 李思达, 关中波, 徐桂珍. 基于BSA-seq技术挖掘芝麻株高相关候选基因. 华北农学报, 2021, 36(增刊1): 8–15. Cui Y Q, Guo Y Z, Hou S F, Li S D, Guan Z B, Xu G Z. Mining of sesame plant height-related candidate genes based on BSA-seq technology., 2021, 36(S1): 8–15 (in Chinese with English abstract).
[29] Zhong C, Sun S, Li Y, Duan C, Zhu Z. Next-generation sequencing to identify candidate genes and develop diagnostic markers for a novel phytophthora resistance genein soybean., 2018, 131: 525–538.
[30] 张东来, 徐瑶, 王家睿, 刘博, 张锐, 龚振平. 大豆生育期间抗倒伏性状变化规律的研究. 作物杂志, 2016, (2): 112–117. Zhang D L, Xu Y, Wang J R, Liu B, Zhang R, Gong Z P. Study on the variation of lodging resistance during soybean growth period., 2016, (2): 112–117 (in Chinese with English abstract).
[31] Nleya T, Sexton P, Gustafson K, Moriles Miller J. Soybean growth stages. In: Clay D E, Carlson C G, Clay S A, Wagner L, Deneke D, Hay C, eds. I. Grow soybean: Best Management Practices for Soybean Production. South Dakota State University, SDSU Extension, Brookings, SD, USA, 2013. pp 3–34.
[32] 尹振功, 王强, 孟宪欣, 郭怡璠, 魏淑红. 基于物理图谱的大豆倒伏性状QTL整合及元分析. 黑龙江农业科学, 2018, 291(9): 1–5. Yin Z G, Wang Q, Meng X X, Guo Y F, Wei S H. QTL integration and meta-analysis of physical mapping-based traits for backwardness in soybean., 2018, 291(9): 1–5 (in Chinese with English abstract).
[33] Bao A, Chen H, Chen L, Chen S, Hao Q, Guo W, Qiu D, Shan Z, Yang Z, Yuan S, Zhang C, Zhang X, Liu B, Kong F, Li X, Zhou X, Tran LP, Cao D. CRISPR/Cas9-mediated targeted mutagenesis ofgenes alters plant architecture in soybean., 2019, 19: 131.
[34] Yang Z, Wang S, Huang Y, Luo C, Fang C, Liu B, Yang Q Y, Kong F. 4kSoyGVP provides a referenced variation map for genetic research in soybean., 2023: 8.
[35] Kong X, Liu G, Liu J, Ding Z. The root transition zone: a hot spot for signal crosstalk., 2018, 23: 403–409.
[36] Langer M, Speck T, Speck O. Petiole-lamina transition zone: a functionally crucial but often overlooked leaf trait.(Basel), 2021, 10: 774.
[37] Shah A N, Tanveer M, Abbas A, Yildirim M, Shah A A, Ahmad M I, Wang Z, Sun W, Song Y. Combating dual challenges in maize under high planting density: stem lodging and kernel abortion., 2021, 12: 699085.
[38] 贾燕杰, 油清波, 赵为, 郭葳, 沈欣杰, 李祥, 张永兴, 周蓉, 赵剑, 周新安, 矫永庆. 野生大豆() YD63和栽培大豆() ZD19茎秆解剖结构比较. 中国油料作物学报, 2018, 40: 199–208. Jia Y J, You Q B, Zhao W, Guo W, Shen X J, Li X, Zhang Y X, Zhou R, Zhao J, Zhou X A, Jiao Y Q. Comparison of stem anatomical structure between wild soybean () YD63 and cultivated soybean () ZD19., 2018, 40: 199–208 (in Chinese with English abstract).
[39] 任梦露, 刘卫国, 刘婷, 杜勇利, 邓榆川, 邹俊林, 袁晋, 杨文钰. 荫蔽胁迫下大豆茎秆形态建成的转绿组分析. 作物学报, 2016, 42: 1319–1331. Ren M L, Liu W G, Liu T, Du Y L, Deng Y C, Zou J L, Yuan J, Yang W Y. Transcriptome analysis of stem morphogenesis under shade stress in soybean., 2016, 42: 1319–1331 (in Chinese with English abstract).
[40] 杨伟林. 腐木和玉米秸秆降解菌的筛选及转基因菌1-5功能初步分析. 南阳师范学院硕士学位论文, 河南南阳, 2018. Yang W L. Screening of Decomposing Bacteria from Rotten Wood and Corn Stalk and Preliminary Analysis of 1-5 Function of Transgenic Bacteria. MS Thesis of Nanyang Normal University, Nanyang, Henan, China, 2018 (in Chinese with English abstract).
[41] Turner S R, Somerville C R. Collapsed xylem phenotype ofidentifies mutants deficient in cellulose deposition in the secondary cell wall., 1997, 9: 689–701.
[42] Lewis N G, Yamamoto E. Lignin: occurrence, biogenesis and biodegradation., 1990, 41: 455–496.
[43] Zhang Y, Wang J L, Du J J, Zhao Y X, Lu J X, Wen W L, Gu S H, Fan C J, Wang Y C, Wu S, Wang Y J, Liao S J, Zhao J, Guo X Y. Dissecting the phenotypic components and genetic architecture of maize stem vascular bundles using high-throughput phenotypic analysis., 2021, 19: 35–50.
[44] Hussain S, Liu T, Iqbal N, Brestic M, Pang T, Mumtaz M, Shafiq I, Li S, Wang L, Gao Y, Khan A, Ahmad I, Allakhverdiev S I, Liu W, Yang W. Effects of lignin, cellulose, hemicellulose, sucrose and monosaccharide carbohydrates on soybean physical stem strength and yield in intercropping., 2020, 19: 462–472.
[45] 胡丹, 刘星贝, 汪灿, 杨浩, 李鹤鑫, 阮仁武, 袁晓辉, 易泽林.不同抗倒性甜荞茎秆木质素合成关键酶基因的表达分析. 中国农业科学, 2015, 48: 1864–1872. Hu D, Liu X B, Wang C, Yang H, Li H X, Ruan R W, Yuan X H, Yi Z L. Expression analysis of key enzyme genes in lignin synthesis of culm among different lodging resistances of common buckwheat., 2015, 48: 1864–1872 (in Chinese with English abstract).
[46] 周蓉, 王贤智, 陈海峰, 张晓娟, 单志慧, 吴学军, 蔡淑平, 邱德珍, 周新安, 吴江生. 大豆倒伏性及其相关性状的QTL分析. 作物学报, 2009, 35: 57–65. Zhou R, Wang X Z, Chen H F, Zhang X J, Shan Z H, Wu X J, Cai S P, Qiu D Z, Zhou X A, Wu J S. QTL analysis of lodging and related traits in soybean., 2009, 35: 57–65 (in Chinese with English abstract).
[47] 向达兵, 郭凯, 雷婷, 于晓波, 罗庆明, 杨文钰. 磷钾营养对套作大豆茎秆形态和抗倒性的影响. 中国油料作物学报, 2010, 32: 395–402. Xiang D B, Guo K, Lei T, Yu X B, Luo Q M, Yang W Y. Effects of phosphorus and potassium on stem characteristics and lodging resistance of relay cropping soybean., 2010, 32: 395–402 (in Chinese with English abstract).
[48] Hwang S, Lee T G. Integration of lodging resistance QTL in soybean., 2019, 9: 6540.
[49] Lee S H, Bailey M A, Mian M A, Shipe E R, Ashley D A, Parrott W A, Hussey R S, Boerma H R. Identification of quantitative trait loci for plant height, lodging, and maturity in a soybean population segregating for growth habit., 1996, 92: 516–523.
[50] 刘硕, 郭勇, 罗玲, 邱丽娟. 大豆倒伏性相关QTL的整合及Overview分析. 植物遗传资源学报, 2014, 15: 137–143. Liu S, Guo Y, Luo L, Qiu L J. Integration and overview analysis of QTLs related to lodging in soybean ()., 2014, 15: 137–143 (in Chinese with English abstract).
[51] Caffall K H, Mohnen D. The structure, function, and biosynthesis of plant cell wall pectic polysaccharides., 2009, 344: 1879–1900.
[52] Assefa T, Otyama P I, Brown A V, Kalberer S R, Kulkarni R S, Cannon S B. Genome-wide associations and epistatic interactions for internode number, plant height, seed weight and seed yield in soybean., 2019, 20: 527.
[53] Hongo S, Sato K, Yokoyama R, Nishitani K. Demethylesterification of the primary wall by PECTIN METHYLESTERASE35 provides mechanical support to thestem., 2012, 24: 2624–2634.
[54] Wang C Y, Zhang S, Yu Y, Luo Y C, Liu Q, Ju C, Zhang Y C, Qu L H, Lucas W J, Wang X, Chen Y Q. MiR397b regulates both lignin content and seed number invia modulating a laccase involved in lignin biosynthesis., 2014, 12: 1132–1142.
[55] Zhao Y, Lin S, Qiu Z, Cao D, Wen J, Deng X, Wang X, Lin J, Li X. MicroRNA857 is involved in the regulation of secondary growth of vascular tissues in, 2015, 169: 2539–2552.
Identification and gene mapping of soybean mutantMin root-stem transition zone
MIAO Long1,**, SHU Kuo1,**, LI Juan1, HUANG Ru1, WANG Ye-Xing1, Soltani Muhammad YOUSOF1, XU Jing-Hao1, WU Chuan-Lei1, LI Jia-Jia1, WANG Xiao-Bo1,*, and QIU Li-Juan2,*
1College of Agriculture, Anhui Agricultural University, Hefei 230036, Anhui, China;2Institute of Crop Sciences, Chinese Academy of Agricultural Sciences / the National Key Facility for Crop Gene Resources and Genetic Improvement (NFCRI), the Ministry of Agriculture and Rural Affairs / Key Laboratory of Crop Gene Resource and Germplasm Enhancement, the Ministry of Agriculture and Rural Affairs, Beijing 100081, China
Root-stem transition zone (RSTZ) connects roots and stems, and its morphology modifies the structure of aerial part and lodging resistance potential in soybean. In this study, a soybean mutantM,appearing with curved or rotated RSTZ, was obtained by EMS mutagenesis. Its morphological characteristics were stably inherited and could provide specific sources for exploring the development patterns of soybean stems. Therefore, this mutant was crossed with Zhonghuang 13 to construct a recombinant inbred line population. By comparing the anatomical structure of vertical RSTZ and curved RSTZ, the wider vascular cambium, more secondary xylem cell layers and irregular cell shape were identified in curved lines, indicating that vascular cambium differentiation may be one of the important factors leading to the difference of RSTZ morphology. Subsequently, the chemical compositions of lines with vertical RSTZ or curved RSTZ were determined, respectively. It was found that the higher lignin and crude fiber content in the RSTZ, the more difficult to bend. The RSTZ with curved or vertical lines were further selected for BSA-seq. SNP-index and InDel-index methods were employed to mine a significant association region, Chr. 19: 43,030,943-45,849,854 containing 319 genes, which may regulate RSTZ morphology. Combined bioinformatics analysis, gene annotation information and expression abundance analysis, seven candidate genes (,,,,,,) were screened. Among them,,, andpotentially affected RSTZ morphogenesis in soybean domestication. This study not only provides germplasm resources for the understanding of soybean RSTZ tissue formation and its genetic basis, but also provides new insights for further exploration of genes regulating soybean stalk development.
soybean; root and stem transition zone; mutant; BSA-seq; candidate genes
10.3724/SP.J.1006.2024.34142
本研究由国家重点研发计划项目(2021YFD1201605), 安徽省自然科学基金项目(2308085MC88, 2108085QC114)和安徽农业大学自然科学基金项目(k2031005)资助。
This study was supported by the National Key Research and Development Program of China (2021YFD1201605), the Natural Science Foundation of Anhui Province (2308085MC88, 2108085QC114), and the Natural Science Foundation Project of Anhui Agricultural University (k2031005).
王晓波, E-mail: wxbphd@163.com; 邱丽娟, E-mail: qiulijuan@caas.cn
**同等贡献(Contributed equally to this work)
苗龙, E-mail: lmiao5@163.com; 舒阔, E-mail: 1125974604@qq.com
2023-07-20;
2024-01-12;
2024-02-08.
URL: https://link.cnki.net/urlid/11.1809.S.20240205.1150.004
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
