小鼠卵母细胞减数分裂中心粒蛋白SAS-6的表达和亚细胞分布
2024-04-26李静宇杨晓葵
宋 可,宋 柯,李静宇,马 伟*,杨晓葵*
1.首都医科大学附属北京妇产医院/北京妇幼保健院 生殖医学科,北京 100026;2.首都医科大学 基础医学院 组织学与胚胎学教研室,北京 100069
卵母细胞减数分裂(oocyte meiosis)是哺乳动物产生单倍体配子的重要生理过程。减数分裂异常导致的配子发生障碍或质量低下是引发不孕不育的重要原因。在卵母细胞减数分裂成熟过程中,纺锤体牵引染色体运动和分离。因此,纺锤体的正确组装对于染色体的精确分离具有重要意义。在哺乳动物卵子发生早期中心粒就退化了,卵母细胞内缺乏中心体结构,减数分裂纺锤体的形成有赖于与中心体发挥相似功能的无中心粒微管组织中心 (microtubule organizing centers, MTOCs)[1]。MTOCs是由结构蛋白质、微管释放蛋白质和调节蛋白质构成的。其中结构蛋白质包括Pericentrin和Cep192等,它们发挥脚手架功能,形成其他蛋白质锚定的平台。微管成核蛋白质主要是γ-tubulin,能够催化α,β-tubulin二聚体聚合成微管。调节蛋白质主要包括某些蛋白激酶,如aurora-A等,在减数分裂恢复时加入MTOCs,调节其功能成熟[2]。卵母细胞内纺锤体在形成后立即向皮质区迁移,由此实现胞质分裂的非对称性,保证形成体积极大的卵子和极小的极体,以使卵子尽可能地保留母源的信息和营养物质。纺锤体的迁移依赖于胞质中动态的F-actin网络,其机动性取决于囊泡外向型输送及其与细胞膜之间的融合[3]。
纺锤体异常组装蛋白6(spindle assembly abnor-mal protein 6, SAS-6)是体细胞内中心粒的核心构建蛋白,它是由N端球形结构域,一段卷曲的结构域和C端构成的。SAS-6通过螺旋卷曲的方式形成二聚体结构[4],并进一步寡聚化,有助于中心粒的组装[5-6]。有研究发现人类SAS-6(human SAS-6, HsSAS-6)通过与γ-微管蛋白环复合物(γ-tubulin ring complex, γ-TuRC)相互作用,在微管的形成中起着至关重要的作用[7]。研究[8]发现骨肉瘤细胞系U2OS中siRNA介导的HsSAS-6的失活消除了使用阿非迪霉素(aphidicolin)处理后中心体的过度复制,并干扰了正常的中心体复制周期,表明SAS-6对于中心体的形成发挥了关键作用,但其潜在的影响机制尚未完全阐明。
本文研究了SAS-6在体细胞和小鼠卵母细胞中的亚细胞定位及其与中心体、MTOCs和囊泡之间的关系,为进一步探究其功能和潜在作用机制奠定了理论基础。
1 材料与方法
1.1 材料
本实验使用21日龄SPF级雄性C57BL/6与雌性BALB/C杂交所生产的F1代小鼠,记为CB6F1[北京维通利华实验动物技术有限公司,许可证编号为SCXK(京)2012-0001];中国仓鼠卵巢细胞系 (Chinese hamster ovary cell, CHO);MEM Alpha(1×)(Gibco公司);MEM(1×)+ GlutaMAX TM-Ⅰ(Gibco公司);兔抗SAS-6抗体(Genetex公司);鼠抗中心粒周围蛋白Pericentrin(BD公司);鼠抗高尔基体基质蛋白GM130(BD公司);注射用血促性腺激素(pregnant mare serum gonadotropin, PMSG)(宁波第二激素厂);米力农milrinone(Selleck公司);牛血清白蛋白(bovine serum albumin, BSA)(中国北京索莱宝科技有限公司);正常山羊血清(normal goat serum, NGS)(Sigma-Aldrich公司);含4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)封片剂(Vector Lab公司);PVP粉末(Sigma-Aldrich公司);细胞裂解液(Laemmli buffer)(Bio-Rad公司);蛋白酶抑制剂(protease inhibitor cocktail)(Bio-Rad公司);PAGE凝胶快速制备试剂盒(中国雅酶公司);PVDF膜(Millipore公司);Super ECL plus蛋白质印迹超敏发光液(中国南京诺唯赞生物科技有限公司)。
1.2 方法
1.2.1 小鼠卵母细胞收集和体外培养:首先向出生3周的雌性CB6F1小鼠给予腹腔注射10 UI的PMSG进行超促排卵,在44~48 h后处死小鼠,使用低速二氧化碳窒息法以减轻小鼠的痛苦。随后戳破卵泡,释放卵丘-卵母细胞复合体(cumulus-oocyte complex, COC),将释放出的COC收集到另一个37 ℃提前预热的HEPES缓冲液中,后转移至MEM(minimum essential medium)培养基中。于体外培养0、2、8和16小时,分别对应减数分裂过程中的几个关键时期进行收样。
1.2.2蛋白质免疫印迹(Western blot):每组样本收集50个卵母细胞,在预热的PVP溶液中瞬洗3次后,将其加入含有蛋白酶抑制剂的细胞裂解液中,在水浴锅中100 ℃煮10 min,之后用聚丙烯酰胺凝胶SDS-PAGE电泳进行分离,得到的蛋白凝胶转移至甲醇激活的PVDF膜上。随后室温下使用脱脂牛奶封闭膜1 h,将PVDF膜浸泡在一抗稀释液中,4 ℃旋转孵育过夜,使用1×TBST漂洗后再浸泡于相应的二抗中,室温下孵育1 h,用1×TBST漂洗干净,最后按照1∶1的比例配制发光液进行曝光。抗体主要包括:兔抗SAS-6(1∶1 000);兔抗GAPDH(1∶5 000);辣根酶标记山羊抗兔IgG(1∶5 000)。
1.2.3免疫荧光染色(immunofluorecent staining, IF):将培养至相应时期的卵母细胞放入提前配制的1% paraformaldehyde + 0.5% Triton X-100中固定渗透45 min,使用0.2% PBST漂洗3次,每次5 min,随后室温下在含10%山羊血清中封闭1 h,于96孔板中用封闭液稀释一抗,细胞在稀释的一抗液中4 ℃孵育过夜。0.2% PBST漂洗细胞3次,每次15 min,之后使用相应标记的二抗室温下避光孵育1 h,再用0.2% PBST漂洗细胞3次,每次15 min,漂洗干净后转移至盖玻片上,最后按照1∶1的比例用含DAPI的封片剂封片。得到的样品用荧光显微镜观察并分析有丝分裂和减数分裂各阶段中SAS-6和Pericentrin的时空分布相关性,以及MⅠ期SAS-6与囊泡标志物GM130的定位关系。抗体主要包括: 兔抗SAS-6(1∶100),小鼠抗Pericentrin(1∶3 000)和小鼠抗GM130(1∶100)。
1.3 统计学分析

2 结果
2.1 SAS-6在小鼠卵母细胞减数分裂过程中的蛋白表达水平
Western blot结果显示SAS-6在小鼠卵母细胞减数分裂生发泡期(germinal vesicle, GV)、生发泡破裂期(germinal vesicle breakdown, GVBD)、第1次减数分裂中期(metaphase Ⅰ, MⅠ)和第2次减数分裂中期(metaphase Ⅱ, MⅡ)均稳定高表达,且表达量差异无统计学意义(图1),这表明SAS-6在减数分裂中可能发挥相关作用。

Western blot showed that SAS-6 was stably expressed at all stages of oocyte meiosis; Each sample contained 50 oocytes.
2.2 SAS-6在体细胞有丝分裂中的亚细胞定位(图2)及其与Pericentrin的相关性分析
免疫荧光分析显示在体细胞有丝分裂间期,团状的染色质周围出现了SAS-6的红色信号,并且空间上与中心粒周围蛋白Pericentrin共定位(图2d);在分裂前期染色质逐渐缩短变粗,形成棒状染色体,两个中心体也逐渐分开移向相对的两极,此时SAS-6依然分布于Pericentrin标记的中心体上(图2h);随着有丝分裂进展至中期,每条染色体的着丝点都排列在细胞中央的一个平面上,即赤道板(图2i),SAS-6和 Pericentrin同时高度聚集,呈点状分布于染色体排列区域的两侧,即纺锤体的两极(图2l);直至有丝分裂后期,姐妹染色单体发生分离,SAS-6和 Pericentrin的信号仍旧保持高度重叠(图2p)。SAS-6和 Pericentrin在体细胞中心体的这种共定位模式提示SAS-6极有可能参与中心体的组装过程。
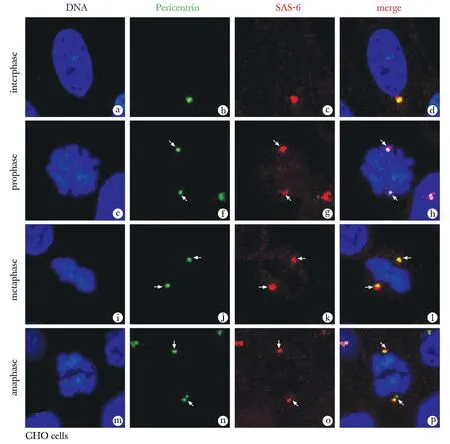
Blue showed DNA, green showed pericentrin, red showed SAS-6 and yellow showed the superposition of SAS-6 and pericentrin signals; Arrows showed pericentrin, SAS-6 and their co-location signals; IF showed that SAS-6(g,k,o, arrow) and pericentrin(f,j,n, arrow) always showed co-localization characteristics(d,h,i,p, arrow) during somatic cell (CHO) mitosis; GV.germinal vesicle; GVBD.germinal vesicle breakdown; MⅠ.metaphase Ⅰ; TⅠ.telophase Ⅰ; MⅡ.metaphase Ⅱ.
2.3 SAS-6在卵母细胞减数分裂中的亚细胞定位(图3)及其与GM130阳性囊泡的相关性分析
结果显示在减数分裂GV期,MTOC外周蛋白质形成点状结构,此时SAS-6并不与Pericentrin存在空间关联性(图3Ad),而是呈现不规则的点片状分布于一个广泛的区域(图3Ac);在减数分裂GVBD期,染色质凝集,Pericentrin离开生发泡,并在染色体周围由单一点状裂解为扩大的片状聚集(图3Af),而SAS-6呈现散在的点状囊泡样结构分布于胞质内(图3Ag),此时SAS-6与Pericentrin不存在相似的空间定位;随着进展至MⅠ期所有染色体整齐排列在赤道板上,Pericentrin聚集形成MTOCs两极,然而SAS-6还是呈点状散在弥漫分布于整个胞质,并不与Pericentrin的信号重合(图3Al);同样的,在第1次减数分裂末期(telophase Ⅰ, TⅠ),Pericentrin逐渐向两极分离,SAS-6与Pericentrin依然没有共定位(图3Ap);直至MⅡ期,第一极体排出(图3Aq),SAS-6与Pericentrin的分布也并无关联,提示在减数分裂过程中,SAS-6与MTOCs没有相关性。
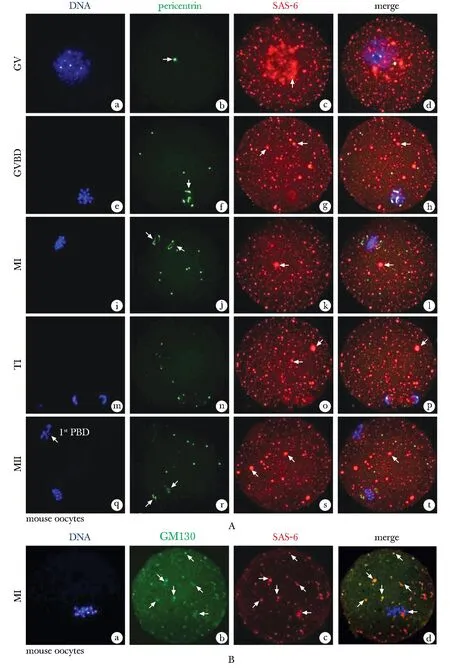
A.immunofluorescence staining(IF) of SAS-6 and pericentrin during GV, GVBD, MⅠ, TⅠ and MⅡ phases in mouse oocyte meiosis; B.immunofluorescence staining of SAS-6 and GM130-positive vesicles in MⅠ phase of mouse oocyte meiosis; a, b showed DNA was labeled in blue, GM130 or pericentrin in green, SAS-6 in red, and the superposition of SAS-6 and GM130 signals in yellow; IF showed that SAS-6 appeared different scales of dotted aggregation-vesicles (Ac,g,k,o,s; Bc, arrow), and the Golgi matrix protein GM130 showed tight colocalization characteristics (Bb-d, arrow), SAS-6 and microtubule organizing centers(MTOCs) protein pericentrin (Ab,f,j,n,r, arrow) did not coincide; Aq.the arrow was shown as the first polar body (1st PBD); GV.germinal vesicle; GVBD.germinal vesicle breakdown; MⅠ.metaphase Ⅰ; TⅠ.telophase Ⅰ; MⅡ.metaphase Ⅱ.
由于SAS-6呈现出不同规模的点片状聚集,因此针对MⅠ期卵母细胞进行了SAS-6与囊泡标志物GM130的免疫荧光染色实验,结果如图3B显示,SAS-6的荧光信号与GM130阳性囊泡完全重合,表明与体细胞不同,SAS-6没有聚集于Pericentrin阳性的MTOCs上,而是聚集在GM130阳性的囊泡中,提示该分子可能通过调节囊泡而参与纺锤体的趋皮质区迁移。
3 讨论
SAS-6作为一种中心粒生物发生早期支架的车轮组装的中心蛋白,新生中心粒是车轮结构,由堆叠的9层对称SAS-6环状聚合物组成[9],SAS-6参与调节体细胞有丝分裂进程中中心粒的生物发生、中心体的复制和组装等多个事件[10-11],其活性异常或表达缺失会直接损害中心体的结构形成和复制周期。研究证实在大多数细胞中,缺乏SAS-6蛋白会导致中心粒形成失败。在衣单胞菌和果蝇中,失活突变SAS-6蛋白表现出有缺陷的中心粒和异常数量的三重微管[12]。在哺乳动物卵子发生的早期中心粒退化,卵母细胞内没有中心粒也不组装成典型的中心体结构,而中心粒的结构成分在卵母细胞中的存在形式和功能一直是未解之谜。本研究发现在小鼠卵母细胞中SAS-6均衡表达于减数分裂的各个阶段,说明SAS-6仍旧存在于卵母细胞中。SAS-6在体细胞有丝分裂过程中聚集在中心体,即与Pericentrin共定位,而该蛋白在卵母细胞减数分裂过程中并没有定位于MTOCs,而是聚集在胞质中的囊泡上。据报道,Rab蛋白在囊泡运输中发挥关键的调节作用,Rab11a阳性囊泡可以驱动小鼠卵母细胞中肌动蛋白网络动力学,促进不对称的纺锤体定位,以保证卵母细胞完成不对称分裂[13]。也有研究证实了Rab8a调控肌动蛋白丝组装的ROCK/LIMK通路,进而影响了卵母细胞减数分裂过程中高尔基体分布相关的GM130的募集、纺锤体的迁移和极体挤压[14]。这些研究均表明纺锤体的趋皮质区迁移与囊泡的功能和作用密切相关。
本研究中SAS-6的这种分布定位提示其在卵母细胞内的主要功能并不是参与MTOCs调节的纺锤体组装,而是可能通过调节囊泡的形态或机动性而参与F-actin所驱动的纺锤体趋皮质区迁移过程。本研究初步涉及SAS-6在小鼠卵母细胞中的亚细胞定位模式及其与GM130阳性囊泡的相关性,SAS-6影响纺锤体迁移的具体机制尚需深入研究,从而为认识卵母细胞减数分裂成熟质量的确保机制,以及提高卵母细胞质量提供新的证据。
