褪黑素抑制H2O2诱导的人脐静脉内皮细胞氧化应激及凋亡标志蛋白质的表达
2024-04-26杨瀚毅宁佳怡汪小兰张益萌谢婷珂1陈奕玄1
杨瀚毅,宁佳怡,汪小兰,张益萌,谢婷珂1,,陈奕玄1,,韩 静*
1.西安医学院 眼科学教研室,陕西 西安 710068;2.空军军医大学第二附属医院 眼科,陕西 西安 710038
糖尿病视网膜病变(diabetic retinopathy, DR)是一种导致失明的严重并发症,是成人失明的主要原因[1],但其发病机制尚不清楚。目前,氧化应激(oxidative stress, OS) 导致内皮受损被认为是DR中血管功能异常的重要因素[2]。H2O2是一种常见的氧活性物质(reactive oxygen species, ROS),其可以在内皮细胞(endothelial cells,ECs)中产生或外源性添加[3]。H2O2可以诱导ECs的氧化应激,这导致了一系列的负面结果,如ECs的凋亡、坏死、老化、增殖受抑制、黏附分子表达增加、一氧化氮合成减少等[4-5]。褪黑素(melatonin,MT)具有很强的抗氧化作用,可以清除ROS和氮活性物质(reactive nitrogen species, RNS),保护细胞免受氧化物的侵害[6]。MT调节氧化应激在衰老疾病中已经有广泛研究[7],有研究表明MT可能通过超氧化物歧化酶2(superoxide dismutase,SOD2)发挥抗氧化功能[8],但MT对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)中氧化应激的调控的机制研究还尚未见报道。因此,该研究旨在探究MT抑制H2O2诱导的HUVECs氧化应激的机制,以及对凋亡标志蛋白质表达的影响,从而为探索糖尿病视网膜病变的新治疗靶点提供理论基础和实验依据。
1 材料与方法
1.1 材料
人脐静脉内皮细胞系(HUVECs)(美国标准生物品收藏中心);DMEM/F12 培养基、胎牛血清、青霉素和链霉素(Gibico公司);CCK8试剂盒、活性氧物质(reactive oxygen species,ROS)染色试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase, CAT)检测试剂盒和丙二醛(malondialdehyde,MDA) 检测试剂盒(上海碧云天生物技术有限公司); p65抗体、p-p65抗体、cleaved-caspase3抗体(Cell Signaling Technology公司);SOD2抗体(武汉三鹰生物技术有限公司);β-actin抗体(北京中杉金桥生物技术有限公司);BCA 试剂盒和酶标仪(Thermo Fisher Scientific公司)和MT(Cayman chemical公司)。
1.2 方法
1.2.1 细胞的分组及处理:将细胞分为分为对照组(control),H2O2组:先用CCK8法确定H2O2损伤细胞的浓度依赖曲线,选用400 mmol/L处理48 h,和MT干预H2O2组:同时加入1 mmol/L MT[9]。HUVECs单层培养于含 10%胎牛血清和双抗的DMEM/F12 培养基中,培养箱温度为 37 ℃、CO2浓度为 5%。当细胞处于对数增殖期时(汇合度大约为 80% ~90%),进行传代和铺板。
1.2.2 CCK8法检测细胞活性:将 6×103细胞接种在 96 孔板中一个孔内,等待细胞密度达到约 80%后进行实验:用 H2O2(100、200、300、400、600、700 mmol/L)的不同浓度处理48 h后,换上完全培养基培养 24 h,根据IC50,确定模型浓度,实验结束后,在每孔中加入 10 μL CCK-8,37 ℃孵育2 h,在酶标仪中以450 nm波长测定吸光度(A)值。每组设置5个复孔,重复3次。
1.2.3 光学显微镜观察细胞形态:倒置显微镜(上海尼康精机有限公司)观察control组和H2O2组细胞形态与生长状态,并进行镜下拍照。
1.2.4 Western blot检测各蛋白质表达水平:将各组细胞培养和处理后,用含有蛋白酶抑制剂和磷酸酶抑制剂的中性裂解液在冰上裂解细胞,用BCA法测定蛋白质浓度,每组取30 μg蛋白质进行SDS-PAGE电泳和转膜操作,用5%牛奶封闭膜后,在4 ℃过夜孵育一抗( p-p65、p65、SOD2、cleaved-caspase 3和β-actin均为1∶ 1 000)。第2天,用TBST洗膜3次,每次8 min,再用相应的二抗在室温下孵育1.5 h。洗膜后,用ECL显色液检测信号,重复实验3次。
1.2.5 ROS染色检测细胞内活性氧的含量和分布情况:将各组细胞在共聚焦皿中培养和处理后,去除培养基,用PBS洗涤3次,加入无血清培养基稀释的DCFH-DA探针(最终浓度为10 μmol/L),在细胞培养箱中孵育25 min,再用PBS洗涤3次,进行荧光观察。实验重复3次。
1.2.6 试剂盒检测SOD活性和MDA、CAT浓度:将各组细胞在10 cm培养皿中培养和处理后,收集各组细胞蛋白质,并按照相应试剂盒的操作说明进行处理。用酶标仪设定不同波长(SOD:450 nm;MDA:532 nm;CAT:520 nm),读取各孔的A值,并计算结果。
2 结果
2.1 H2O2诱导HUVECs氧化应激损伤模型的浓度
如图1所示,CCK8结果显示,与对照组相比,100 mmol/L(88.30±8.48)、200 mmol/L(72.35±8.50)、300 mmol/L(69.09±7.24)、400 mmol/L(47.88±5.88)、500 mmol/L(47.88±5.88)、600 mmol/L(16.91±1.01)和700 mmol/L(13.82±1.32)的H2O2造成HUVECs的活性呈浓度依赖性的降低。根据IC50416.8,选择400 mmol/L的浓度进行造模(图1)。
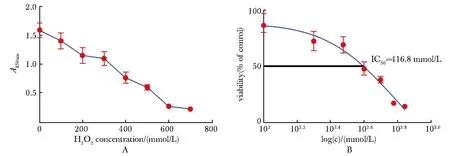
A.measure the absorbance values of HUVECs treated with different concentrations of H2O2 at 450 nm, the x-axis represents the concentration of H2O2, and the y-axis represents the absorbance value at 450 nm; B.the x-axis represents the logarithm of the H2O2 concentration, and the y-axis represents the cell survival rate.
2.2 H2O2诱导HUVECs形态变化
与对照组相比,在用400 mmol/L H2O2处理48 h后,HUVECs形态发生了变化,明显回缩,由铺路石样变为梭形和长条形。同时,活细胞的比例也显著下降,漂浮细胞明显增多(图2)。
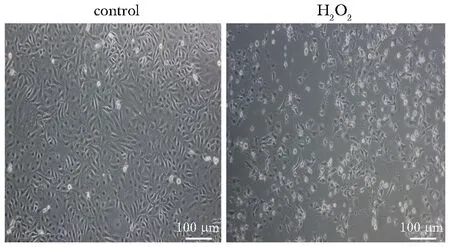
Control group; H2O2 group: 400 mmol/L H2O2 treatment for 48 hours.
2.3 MT降低了H2O2诱导的氧化应激反应与凋亡标志物的表达
H2O2组细胞中p-p65/p65(1.15±0.02)、cleaved-caspase 3(0.91±0.04)的表达水平明显高于对照组(p-p65/p65:0.81±0.03,cleaved-caspase 3:0.60±0.03 )(P<0.001),而SOD2(0.66±0.01)的表达水平明显低于对照组(0.84±0.10)(P<0.05)。相较于H2O2组,H2O2+MEL组细胞中SOD2(1.02±0.06)的表达水平显著上升(P<0.001),而p-p65/p65(0.73±0.04)(P<0.001)、cleaved-caspase 3(0.69±0.04)(P<0.01)的表达水平显著下降(图3)。

The expression of p-p65, p65, SOD2 and cleaved-caspase 3 in control, H2O2 and H2O2+MT group; The expression of p-p65/p65 in control and H2O2 group; **P<0.001 compared with control group; The expression of p-p65/p65 in H2O2 and H2O2+MT group; ##P<0.001 compared with H2O2 group; The expression of SOD2 in control and H2O2 group; *P<0.05 compared with control group; The expression of SOD2 in H2O2 and H2O2+MT group; ##P<0.001 compared with H2O2 group; the expression of cleaved-caspase 3 in control and H2O2 group; **P<0.001 compared with control group; The expression of cleaved-caspase 3 in H2O2 and H2O2+MT group; #P<0.01 compared with H2O2 group.
2.4 MT降低了H2O2引起的ROS含量增多
H2O2组(6.38±2.25)细胞中绿色荧光的强度明显高于对照组(38.99±3.27)(P<0.001),说明细胞内活性氧的含量显著增加。而MT处理(4.47±1.11)能有效降低绿色荧光的强度(P<0.001),表明MT能减少细胞内活性氧的产生(图4)。

Fluorescence staining was used to detect the ROS levels in control, H2O2 and H2O2+MT group; The ROS levels in control and H2O2 group; *P<0.001 compared with control group; The ROS levels in H2O2 and H2O2+MT group; #P<0.001 compared with control group.
2.5 MT处理氧化应激损伤的HUVECs后检测SOD活性和CAT、MDA浓度
与对照组相比, H2O2组的SOD活性(0.20±0.02)(P<0.001)和CAT浓度(2.72±0.68)(P<0.01)明显低于对照组(SOD:0.55±0.03,CAT:5.86±0.56),MDA浓度(6.12±0.23)明显高于对照组(2.57±0.24)(P<0.001)。而相较于H2O2组,MT处理能够有效改善氧化应激状态,提高SOD活性(0.42±0.03)(P<0.001)与CAT浓度(4.62±0.93)(P<0.05),降低MDA浓度(3.20±0.40)(P<0.001)(图5)。

Detection of SOD activity, MDA, and CAT content using kits in control group, H2O2 group and H2O2+MT group; The SOD activity in control and H2O2 group; **P<0.001 compared with control group; The SOD activity in H2O2 and H2O2+MT group; ##P<0.001 compared with control group; The MDA concentration in control and H2O2 group; **P<0.001 compared with control group; The MDA concentration activity in H2O2 and H2O2+MT group; ##P<0.001 compared with control group; The CAT concentration in control and H2O2 group; *P<0.01 compared with control group; The CAT concentration activity in H2O2 and H2O2+MT group; #P<0.05 compared with control group.
3 讨论
糖尿病视网膜病变目前仍是全球劳动适龄人口失明的主要原因之一。由于其发病机制尚未明确,目前的治疗手段也存在诸多局限性,主流的注射抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物的治疗手段可能会由于内皮细胞突变和血管重塑等原因导致一部分患者对其产生耐药[10]。因此,研究新的有效的靶点及药物治疗手段不仅能够为患者提供新的治疗选择,也对进一步明确糖尿病视网膜病变的发病机制具有重要意义。
氧化应激导致的血管受损严重影响着眼部血管的健康,特别是在糖尿病视网膜病变中发挥重要的作用[11]。MT已经在衰老疾病领域中展现出不俗的抗氧化能力。有研究表明,MT能够改善枫糖尿病中神经系统氧化应激引起的记忆障碍[12]。同时,MT也能够抑制凋亡相关因子的释放和表达,达到抗凋亡的目的[13]。但是,MT对氧化应激的作用机制还尚未明确,以及MT调控HUVECs中氧化应激的机制也鲜有报道。该研究用MT处理H2O2介导的氧化应激损伤的HUVECs,观察其氧化应激水平以及相关标志蛋白质的表达情况。研究结果表示,MT能够上调H2O2介导的氧化应激SOD2的表达降低以及减少ROS的含量。SOD2作为一种重要的抗氧化剂,能直接在线粒体内清除ROS,避免线粒体受到氧化应激损伤。因此,MT介导的ROS含量减少可能是通过增加SOD2的表达实现的,除此之外,试剂盒检测总SOD、MDA和CAT结果表示,MT能增加总SOD的活性以及CAT浓度,并减少MDA浓度。这些因子中,MDA在一定程度上反应氧化应激的水平,而CAT则是一种重要的抗氧化酶。该结果更说明了MT有强大的抗氧化能力。同时,MT减少了H2O2介导的p-p65/p65和cleaved-caspase表达升高。p-p65/p65能够反应NF-κB通路的活性,其与炎性反应有着密切关系[14],而caspase 3是一种关键的凋亡执行因子,它可以被激活并裂解为cleaved-caspase 3发挥作用,促进细胞凋亡。总之,H2O2通过减少SOD2的表达,介导HUVECs的氧化应激损伤,同时增加了NF-κB通路的活性以及凋亡因子cleaved-caspase 3的表达,而MT能够抑制这一过程。因此,MT有望成为糖尿病视网膜病变和其他氧化应激损伤和凋亡相关血管疾病的潜在治疗方法。
