利用不同方法将小分子NADPH 转染进入细胞的比较
2024-04-26李皓玥杜文静
李皓玥,杜文静,李 薇
中国医学科学院基础医学研究所 北京协和医学院基础学院 细胞生物学系 重大疾病共性机制研究全国重点实验室,北京 100005
烟酰胺腺嘌呤二核苷酸磷酸 (nicotinamide adenine dinucleotide phosphate, NADPH) 是还原性辅酶Ⅱ,分子量为0.745 ku,非生物大分子,是一个由两个位于中心位置的磷酸基团组成的小分子物质[1]。NADPH是细胞抗氧化系统中的关键辅助因子,也是许多酶促反应和生物合成反应(例如核苷酸合成、脂质合成和脂肪酸链延长)中重要的电子供体[2]。癌细胞中高水平的活性氧(reactive oxygen species,ROS)会对DNA等大分子造成损伤,导致细胞凋亡和线粒体通透性增加,而NADPH可以中和ROS,因此NADPH对癌细胞的生长和存活至关重要[3-4]。此外,最近研究还发现 NADPH作为内源组蛋白去乙酰化酶3(histone deacetylase 3,HDAC3)的抑制剂,在调控表观遗传和基因表达方面的非代谢作用[5]。越来越多的证据表明,研究细胞内NADPH的功能可能为肿瘤的治疗提供一些新思路。同时,研究细胞内NADPH的功能需要改变细胞内NADPH水平,然而,NADPH本身不能穿过细胞膜[6]。虽然可以通过过表达相关代谢酶来增加其细胞内水平,但这也可能会导致除NADPH之外的诸多变化。因此,迫切需要开发一种可以直接提高细胞内NADPH水平的方法。
基因和蛋白质可以通过核酸转染试剂转染进入细胞,转染试剂在核酸转染系统中具有很高的使用率[7]。但却很少用于转染小分子物质,本文试图找到一种通过转染试剂将NADPH转染进入细胞的方法,在这里评估了3种转染试剂,包括:LipofectamineTM2000(Lipo2000),LipofectamineTMRNAiMAX(RNAiMAX)和X-tremeGENETMHP DNA transfection reagent (X-tremeGENE)。Lipo2000和RNAiMAX均是通过阳离子脂质体将目的基因转染进入细胞,是最具有代表性、应用最广泛、被引用最多的转染试剂[8-10]。X-tremeGENE是一种多组分转染试剂,虽然其成分尚不清楚,但是最近的科学研究中已经成功的转染了各种昆虫细胞和难以转染的细胞系[7,11]。本文基于研究结果开发了一种使用X-tremeGENE将外源NADPH转染到U2OS和3T3L1细胞的方法。该方法简单、方便、高效,对今后NADPH在细胞内的研究具有重要意义。
1 材料与方法
1.1 材料
1.1.1 细胞:人骨肉瘤细胞系U2OS和小鼠胚胎成纤维细胞系3T3L1(ATCC细胞库)。
1.1.2 主要试剂:NADPH粉末、油红O(Oil Red O)、地塞米松(dexamethasone)、异丁基甲基黄嘌呤(3-isobutyl-1-methylanxthine,IBMX)、罗格列酮(rosiglitazone)、胰岛素(Sigma-Aldrich公司);DMEM培养基和胎牛血清(Gibco公司);胰蛋白酶(北京细工生物科技有限公司);LipofectamineTM2000、LipofectamineTMRNAiMAX、Opti-MEM(Invitrogen公司);X-treme GENE(Roche公司);BCA蛋白质定量试剂盒(上海翌圣生物科技有限公司);4% 多聚甲醛(武汉赛维尔生物科技有限公司);PicoProbeTM NADPH 定量试剂盒(BioVision公司)。
1.2 方法
1.2.1 细胞的培养:3T3L1前脂肪细胞系在含10% 小牛血清的DMEM培养基中培养。U2OS细胞系在含10% 胎牛血清的DMEM培养基中培养。将细胞放入37 ℃ 5% CO2的培养箱中。所有细胞均在无抗生素的条件下培养。将2×105个处于对数期的U2OS细胞或5×104个处于对数期的3T3L1细胞接种到无菌的六孔板中,加入2 mL生长培养基,转染时U2OS细胞汇合度约为70%~90%,3T3L1细胞融合度约为30%~40%。
1.2.2 NADPH溶液配制:称取114.2 mg NADPH粉末于1.5 mL 离心管中,加入100 μL ddH2O溶解混匀,即得到1 mol/L NADPH母液。
1.2.3 NADPH转染:制备NADPH/Opti-MEM混合物,将10 μmol/L NADPH与200 μL Opti-MEM加入1.5 mL离心管中,上下轻轻吹打数次。随后分别将10 μL X-tremeGENE、Lipo2000和RNAiMAX加入到不同的NADPH/Opti-MEM混合物管中,并立即混合,得到转染复合物。然后将转染复合物在室温(~25 ℃)下孵育15~30 min,再添加到每个孔中并轻轻晃动2~3次。
1.2.4 检测NADPH含量
1.2.4.1 细胞体积的测量与计算:将1×103个细胞加入1 mL培养基重悬,取20 μL细胞悬液置于细胞计数板的小室内,利用Countstar高通量细胞计数仪得到细胞的直径,根据细胞体积的计算公式计算出细胞的体积。
1.2.4.2 NADPH检测试剂盒:使用NADPH定量检测试剂盒分析细胞内NADPH水平。将细胞用200 μL NADPH提取缓冲液匀浆,并在冰上孵育10 min。将裂解液10 000×g4 ℃离心5 min,收集上清液。为了检测NADPH,需要在反应前分解NADP+。将上清液在60 ℃水浴中加热30 min,使 NADP+完全分解。在冰上冷却上清液,短暂离心后取50 μL上清液转移至96孔板中。每孔添加100 μL反应混合物,其中包含:NADPH循环缓冲液97 μL、NADPH循环酶混合物2 μL、PicoProbeTM1 μL。室温60 min后,测量荧光(Ex/Em=535/587 nm)。同时,使用BCA试剂盒分析蛋白质浓度,绘制NADPH标准曲线,并通过细胞体积计算细胞中的NADPH浓度。
1.2.4.3 LC-MS测定细胞中NADPH含量:为了提取细胞内代谢物,用预冷PBS洗涤细胞3次,将1 mL预冷的80% HPLC级甲醇添加到含有细胞的1.5 mL离心管中,并置于干冰上30 min。随后15 000×g4 ℃离心15 min。将含有细胞代谢物的上清液转移至干净的1.5 mL离心管中。使用400 mL预冷的 80% HPLC 级甲醇重复提取代谢物。使用氮气流蒸发器在37 ℃下干燥水相。将蛋白质沉淀重悬于100 mL 1% SDS 缓冲液中进行 BCA 测定。使用三重四极杆LC/MS系统分析提取物。
1.2.5 诱导脂肪细胞分化:转染NADPH 24 h后,根据标准方案将3T3L1前脂肪细胞诱导为脂肪细胞。去除转染培养基,加入含有500 μmol/L IBMX、1 μmol/L 地塞米松、1 μmol/L 罗格列酮、1 μg/mL 胰岛素和10% FBS 的DMEM 诱导培养基,诱导脂肪细胞分化。诱导培养基每2 d更换一次。4 d后,将诱导培养基更换为含有1 μg/mL胰岛素的DMEM(含10% FBS)维持培养基,再培养1 d。然后将细胞在含有10% FBS的正常DMEM培养基中再培养1 d,然后进行实验分析。
1.2.6 油红O染色:用PBS洗涤3T3L1细胞,并用4% 多聚甲醛在室温下固定30 min。然后用ddH2O短暂洗涤细胞3次,用70% 异丙醇洗涤1次。将细胞在油红O工作溶液中于室温下孵育10~30 min。弃去油红O工作液,用ddH2O短暂冲洗细胞4次,直至拍照。然后通过添加异丙醇溶解油红O,并在450 nm处测量脂质含量。
1.3 统计学分析

2 结果
2.1 X-tremeGENE可以将NADPH转染进入细胞
实验使用这3种不同的转染试剂(X-tremeGENE、RNAiMAX和Lipo2000)配制NADPH转染试剂复合物,并在细胞转染24 h后检测细胞内NADPH水平。 结果发现使用X-tremeGENE转染NADPH可有效提高U2OS和3T3L1细胞内NADPH水平,而用RNAiMAX或Lipo2000 转染试剂转染则不会(图1A,B)。此外,根据细胞体积测量了细胞内NADPH的浓度,用X-tremeGENE转染NADPH增加了U2OS和3T3L1细胞中 NADPH的浓度(图1C)。为了进一步验证该方法的有效性,采用液相色谱-质谱法(liquid chromatography-mass spectrometry,LC-MS)测量了细胞内NADPH的含量。与之前的结果一致,用X-tremeGENE HP DNA 转染试剂转染NADPH确实有效增加了细胞内NADPH含量(图1D)。
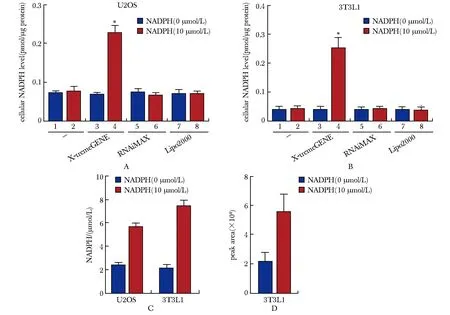
A, B.U2OS (A) and 3T3L1 (B) preadipocytes were transfected with NADPH (10 μmol/L) using X-tremeGENE, RNAiMAX or Lipo2000; Cellular NADPH was determined by NADPH Quantitation Fluorometric Assay Kit; C.U2OS and 3T3L1 preadipocytes were transfected with NADPH (10 μmol/L) using X-tremeGENE.NADPH was determined by NADPH Quantitation Fluorometric Assay Kit, and NADPH concentration in cell was calculated by cell volume; D.3T3L1preadipocytes were transfected with NADPH (10 μmol/L) using X-tremeGENE.NADPH was determined by LC-MS; *P<0.001 compared with 0 μmol/L NADPH.
2.2 细胞中NADPH水平随NADPH转染量增加呈剂量依赖性增加
使用X-tremeGENE将不同浓度的NADPH转染到U2OS和3T3L1细胞中。转染后24 h后发现,随着转染NADPH剂量的增加,细胞中的NADPH水平呈剂量依赖性增加(图2A)。在3T3-L1细胞中观察到相同的结果(图2B),证明使用X-tremeGENE将NADPH转染到细胞中是可靠且有效的。
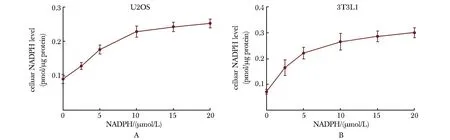
A, B.U2OS and 3T3L1 preadipocytes were transfected using X-tremeGENE with increasing amounts of NADPH as indicated for 24 h; cellular NADPH levels were determined.
2.3 转染后24 h内细胞中NADPH水平随时间逐渐升高
细胞中的NADPH水平是动态的,在转染后的不同时间点(0、3、6、12、24、48和72 h)测量细胞内NADPH水平。结果发现,用X-tremeGENE转染NADPH后,细胞内NADPH水平随着时间逐渐升高,并在12~24 h达到峰值,然后下降(图3A,B)。
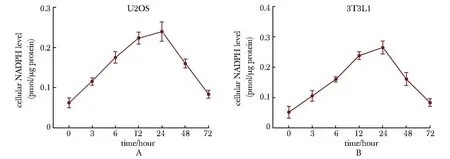
A, B.U2OS and 3T3L1 preadipocytes were transfected with 10 μmol/L NADPH using X-tremeGENE.Cellular NADPH levels were determined at different time points after transfection.
2.4 转染的NADPH可增加脂肪细胞分化和脂质合成
使用3种转染试剂分别将NADPH转染到3T3L1前脂肪细胞中24 h后,诱导3T3L1前脂肪细胞分化为脂肪细胞。油红O染色显示,使用 X-tremeGENE转染NADPH的细胞比对照细胞含有更多的脂质(图4A)。与对照相比,使用 RNAiMAX/Lipo2000试剂转染NADPH的细胞中脂质含量没有增加(图4A),这与它们不增加细胞内NADPH含量的结果一致(图1B)。然后添加异丙醇以溶解油红O,并在510 nm处测量吸光度A(值)以量化脂质含量。同样,用X-tremeGENE转染 NADPH可有效增加分化的3T3-L1细胞中的脂质积累(图4B)。而因为 RNAiMAX和Lipo2000都无法将NADPH 转染进入细胞,因此细胞内脂质积累没有变化(图4B)。
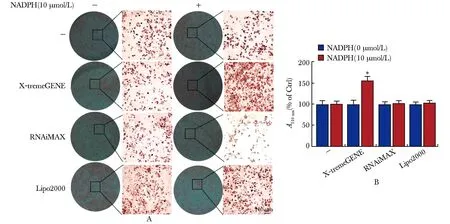
A.3T3L1 preadipocytes were transfected with 10 μmol/L NADPH using different transfection reagents as indicated for 24 h, then stimulated to differentiate into adipocytes, after induction for 7 d, cells were fixed and stained with Oil Red O; B.images were shown,Oil Red O staining was quantified; *P<0.001 compared with 0 μmol/L NADPH.
3 讨论
为了探究NADPH的功能,可改变细胞中NADPH的水平来研究相应的表型,一般采用降低或者过表达产生NAPDH的代谢酶来改变细胞中NADPH水平。然而,代谢酶除产生NADPH之外还有其他功能,因此直接调控细胞内NADPH水平是研究NADPH功能的关键。由于NADPH不能穿过细胞膜[6],为此需找到一种将外源NADPH直接转染到细胞中的有效方法。本实验,通过使用3种转染试剂(X-tremeGENE、RNAiMAX和Lipo2000)发现只有X-tremeGENE可以有效地将NADPH转染到细胞中。同时,实验室之前的研究发现,使用X-tremeGENE转染NADPH,并不影响NADPH生成酶(MEs、G6PD)的表达[5]。但由于利益冲突,试剂公司仅告知转染试剂(X-tremeGENE)是脂质混合物,其他具体信息无法提供。一般来说,这些阳离子脂质体传递底物的潜在机制可能取决于它们的生物学性质,例如,头基的组成和方向、烷基链的长度及其饱和度、连接疏水锚点和阳离子头基的连接基团的性质,以及“辅助”脂质的组成,这些脂质是中性带电的脂质,均有助于转染过程[12]。已知上述所有参数都可能会影响转染活性,并可解释NADPH能够有效转染的机制。关于Lipo2000和RNAiMAX,目前只知道它们是基于脂质的转染试剂。由于这3种试剂都是以脂质为基础的,而只有X-tremeGENE能够将NADPH转移到细胞中,可能是由于转染试剂中的其他特定成分所致,而脂质化学结构的多样化和复杂性也可能是另一个促成因素[13-14]。虽然还不知道其确切原因,但实验结果表明,X-tremeGENE HP DNA 转染试剂确实可以成功地将外源NADPH转染进入细胞内,并且通过该方法增加的细胞内NADPH具有功能性,能够促进3T3L1脂肪细胞的分化和脂质积累,进一步说明了该方法的有效性。该方法简单方便,为进一步研究NADPH在细胞中的功能提供了理论依据。
