基于GEO 数据库分析睡眠剥夺影响肝脏代谢的核心基因及关键通路
2024-04-25许文琳谭晓婵孙丹红潘旭初
许文琳 姜 硕 谭晓婵 孙丹红 潘旭初 王 红 王 聪
失眠属睡眠障碍范畴,发病率逐年上升,我国成年人失眠发病率约为19.6%[1]。长期失眠会导致代谢性疾病的发生,如肥胖症、血脂异常、2 型糖尿病、高血压等[2]。研究发现,青少年总睡眠时间减少与超重或肥胖具有显著相关性[3]。研究显示,睡眠不足可导致包括胰岛素敏感性降低、葡萄糖耐量降低、夜间皮质醇浓度升高、胃生长激素释放激素升高、瘦素水平降低在内的众多内分泌失调性疾病[4]。肝脏主要参与脂肪、糖、蛋白质等物质代谢,对维持机体代谢至关重要。研究发现,睡眠剥夺(sleep deprivation)可上调肝脏脂肪生成酶从而诱导脂肪变性和胰岛素抵抗[5]。睡眠剥夺可引起模型小鼠肝脏中谷胱甘肽代谢、果糖和甘露糖以及丙酮酸代谢紊乱[6]。但睡眠对肝脏代谢影响的核心基因及关键通路仍未知晓。本研究基于基因表达综合数据库(gene expre-ssion omnibus,GEO),对睡眠剥夺条件下模型小鼠肝脏组织进行基因及通路筛选,探讨失眠对肝脏代谢影响的生物学机制,报道如下。
1 材料与方法
1.1 基因芯片数据的获取 本研究以GEO 数据库为数据源,设定“sleep deprivation”为搜索词,获取GSE92913 数据集,该数据集基于GPL16570 平台(Affymetrix Mouse Gene 2.0 ST Array)。将原始资料分为睡眠剥夺组及对照组,利用高通量测序检测两组小鼠肝脏中的基因表达水平。
1.2 差异基因(differentially expressed genes,DEGs)的筛选 下载GSE92913 数据集,使用R 语言对芯片原始数据进行探针转化,剔除无对应基因及重复探针数据。采用GEO 数据库自带的在线分析工具GEO2R(https://www.ncbi.nlm.nih.gov/geo/geo2r)进 行DEGs 分析,设置筛选条件为:调整P 值(adj.P)<0.05且|log2FC|≥1(FC 为fold change,差异倍数)。
1.3 DEGs 的功能富集分析 DAVID 平台数据库(https://david.ncifcrf.gov/tools.jsp)提供大量基因、蛋白的生物功能信息,是进行功能富集分析的常用数据库。将DEGs 上传到DAVID 平台,设置物种为“Mus musculus(小鼠)”,选择生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF) 进 行 基 因 本 体(gene ontology,GO)富集分析;选择Pathways 进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。设置设定筛选标准为P<0.05,使用R 语言(ggplot2 包)将结果进行可视化。
1.4 蛋白互作网络(protein-protein Interaction,PPI)和枢纽基因的构建 将DEGs 上传至STRING 平台(https://www.string-db.org/),设置生物种类“Mus musculus”,最小相互作用阈值设定成“最高置信度(highest confidence)”为0.4,构建PPI,预测差异表达基因编码的蛋白质之间的相互作用。导出TSV 格式资料,将其导入Cytoscape3.8.2 软件中,运用cytohubba插件进一步分析,采用degree 算法选择出排名前10的枢纽基因。
2 结 果
2.1 睡眠剥夺组与对照组DEGs 的筛选 GSE92913数据集共包含睡眠剥夺组样本7 个和正常对照组样本7 个,正常对照组样品编号分别为GSM2440309、GSM2440312、GSM2440313、GSM2440314、GSM24403 16、GSM2440317、GSM2440319,睡眠剥夺组样品编号分别为GSM2440306、GSM2440307、GSM2440308、GSM2440310、GSM2440311、GSM2440315、GSM24403 18。根据上述条件进行筛选,共有54 个DEGs 发生变化,基因上调的有34 个,下调的有20 个,见图1。利用R 语言(pheatmap 包)对54 个DEGs 进行层次聚类分析,并绘制基因热图,见图2。
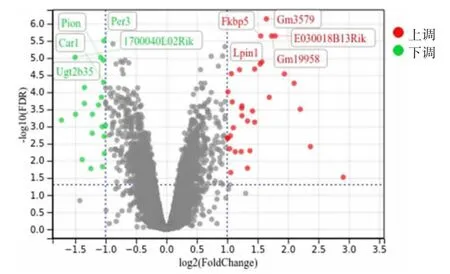
图1 睡眠剥夺小鼠肝脏差异基因火山图

图2 睡眠剥夺小鼠肝脏差异基因热图
2.2 DEGs 的GO 功能和KEGG 代谢通路富集分析将54 个DEGs 导入DAVID 数据库进行分析,共得到54 条GO 条目,按照P<0.05 的显著性富集筛选标准,得到36 条显著意义的条目,其中21 条(58.33%)聚集在BP,包括脂质代谢、类固醇代谢、三酰甘油合成正调节、昼夜节律、胆固醇调节元件结合蛋白(sterol-regulatory element binding proteins,SREBP)信号通路等众多生物学过程;共有6 条(16.67%)聚集在CC,包括细胞内膜结合的细胞器、内质网膜、内质网、高尔基体等多种复杂细胞组分;9 条(25.0%)聚集在MF,包括氧化还原酶活性、血红素结合、铁离子结合、跨膜信号受体活性等,见表1。KEGG 信号通路富集分析发现,差异基因参与氧化物酶体增殖物激活受体(peroxisome proliferators activated receptor,PPAR)信号通路、类固醇激素生物合成、癌症中的转录失调、视黄醇新陈代谢4 条信号通路,见表2。
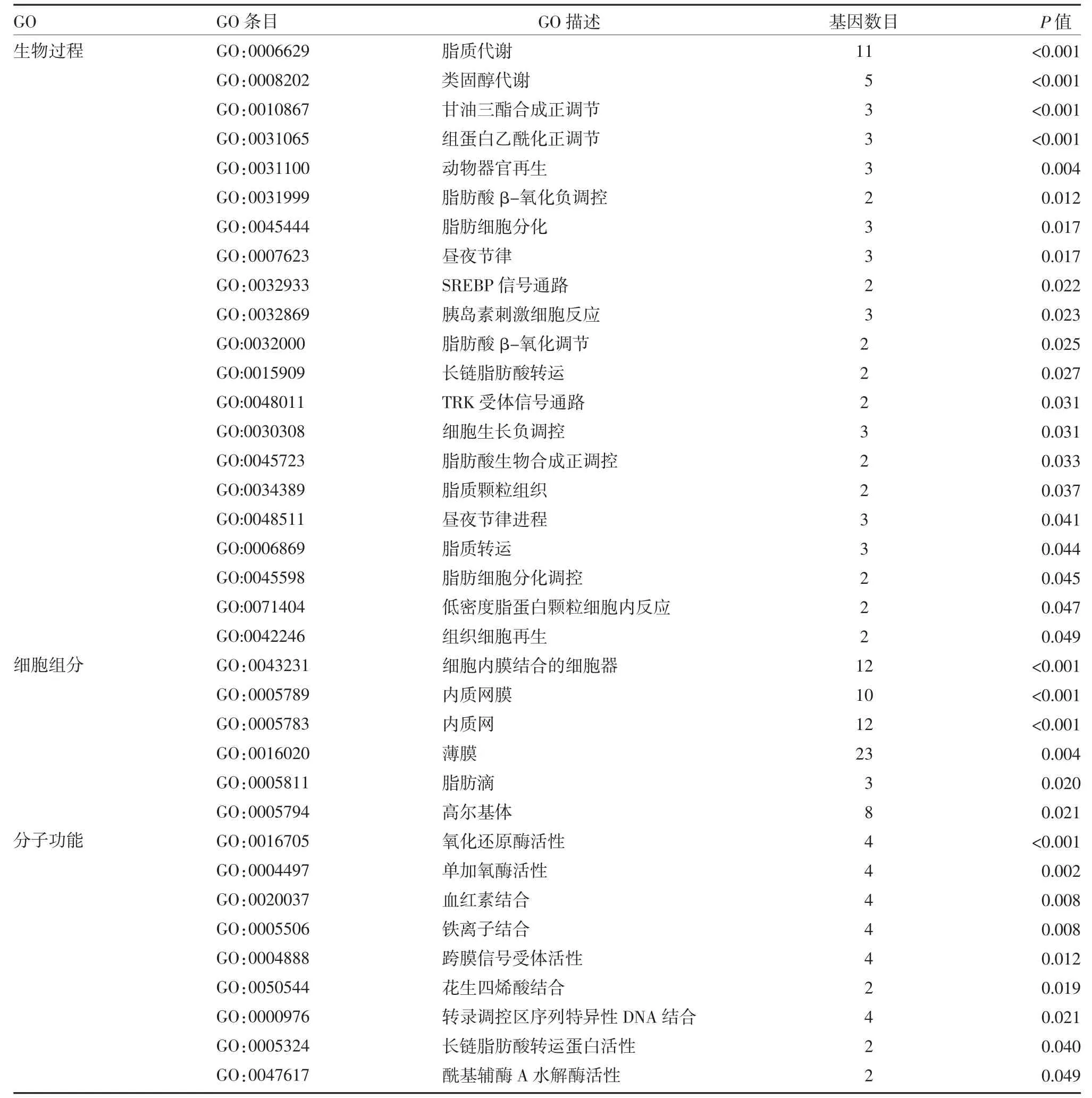
表1 睡眠剥夺小鼠肝脏DEGs 的GO 富集分析

表2 睡眠剥夺小鼠肝脏DEGs 的KEGG 富集分析
2.3 蛋白互作网络和枢纽基因筛选结果 将DEGs上传至STRING 平台构建PPI 网络,通过Cytoscape3.8.2 进行网络可视化,运用cytohubba 插件进一步分析,cytohubba 算法显示PPARγ、甾醇调节元件结合转录因子1(sterol regulatory bind factors1,SREBF1)、成纤维细胞生长因子21(fibroblast growth factors21,FGF21)、花生四烯酸细胞色素P450ω 羟化酶(arachidonic acid cytochrome P450 ω hydroxylase14,Cyp4a14)、细胞死亡诱导DFFA 样效应蛋白C(cell death induced DFFA-like effector protein C,Cidec)、芳基烃受体核转位因子样蛋白1(aryl hydrocarbon receptor nuclear translocation factor -like protein 1,Arntl)、磷脂酸磷脂酶1(phosphatidic acid phospholipase 1,Lpin1)、细 胞 色 素 酶2b10(cytochrome,Cyp2b10)、胰岛素诱导基因2(insulin induced genes 2,Insig2)、脂滴包被蛋白5(perilipin5,Plin5)为睡眠剥夺所涉及的关键基因,见图3。
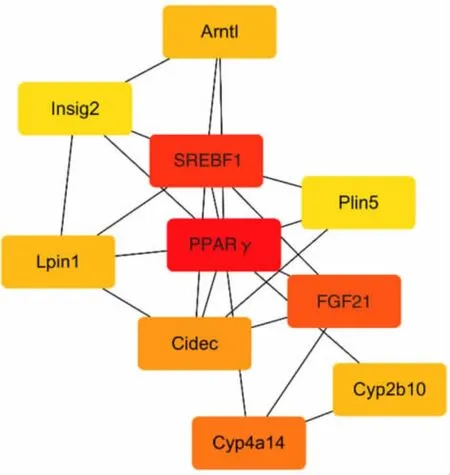
图3 睡眠剥夺小鼠肝脏差异基因蛋白互作网络图
3 讨 论
失眠为临床常见病、多发病,我国失眠患病率远高于世界水平并呈现逐年增长的趋势[7]。失眠与代谢关系密切,而肝脏主要参与糖、脂肪、蛋白质等物质代谢过程,因此睡眠与肝脏功能密不可分。本研究基于GEO 数据库通过对微阵列数据进行生物信息学分析,识别出睡眠剥夺组和正常睡眠组之间的差异基因,并通过进行GO、KEGG 富集分析、PPI 和枢纽基因筛选,揭示DEGs 的功能,以探究失眠的发病机制与肝脏代谢的关系。
运用KEGG 通路分析得出影响失眠发病的信号通路为PPAR 信号通路。PPAR 信号通路属于核受体超家族,在抑制神经炎症、延缓神经退行性变、抗氧化过程中均发挥着重要作用[8-9]。有研究[10]表明,通过激活PPAR 信号通路可极化M2 型小胶质细胞,改善中枢神经功能。有研究[11]显示,中药天王补心丹的有效成分可通过特定位点与PPAR 信号通路中特定的蛋白靶点结合,进而通过调节机体内能量代谢而发挥睡眠调节作用。此外,本研究发现类固醇激素生物合成通路、癌症转录失调通路和视黄醇新陈代谢通路也参与了睡眠剥夺下的肝脏代谢途径,这些通路均与肝脏物质代谢有关。
本研究中PPI 和枢纽基因筛选结果提示,PPARγ为睡眠剥夺过程中参与肝脏代谢的关键基因。PPARγ功能主要涉及诱导脂肪细胞分化、维持脂代谢稳态[12]。此外PPARγ 还具有维持糖代谢平衡的功能,进而能够改善胰岛素抵抗状态,PPARγ 通过直接调控携带有PPREs 的糖代谢相关基因的表达,上调脂肪细胞分泌因子,下调肿瘤坏死因子α(TNF-α)和Resistin 等的表达来提高胰岛素敏感性。PPARγ 还可以通过促进肌肉中葡萄糖的利用,并减少肝脏中葡萄糖的生成达到控制糖代谢的作用[13]。PPARγ 亦有神经保护功能,有研究显示可通过促进PPARγ 的核转位并激活PPARγ来缓解神经损害[14]。PPARγ 也能够调节睡眠-觉醒过程,在啮齿类动物下丘脑注射PPARγ 激动剂可减少慢波睡眠并提高觉醒量,而PPARγ 拮抗剂则产生相反效果,在小鼠模型中也可以观察到类似结果[15]。可见PPARγ 为影响睡眠与肝脏代谢的关键基因。
SREBF1 基因也是睡眠剥夺过程中肝脏代谢所涉及的关键基因。SREB1 属于固醇调节元件结合蛋白SREBPs 的主要编码基因,可以启动脂质生物合成和摄取,并且在肝脏脂质合成中起作用,其表达失常与胰岛素抵抗、肥胖症、糖尿病、脂肪肝等肝脏代谢性疾病关系密切[16-17]。在限制饮食所造成的睡眠-觉醒昼夜节律紊乱动物模型中发现,由SREBF1 基因调控的SREBPs蛋白表达失常会造成睡眠-觉醒昼夜节律紊乱[18]。基于人体的研究发现,在睡眠剥夺受试者中SREBF1 基因表达水平明显下降,而这种下降程度与睡眠剥夺敏感程度相关[19]。在睡眠剥夺人群中,SREBF1 基因表达的昼夜节律性明显失调[20]。这些结果均提示SREBF1 基因为连接睡眠与肝脏代谢的重要基因。
FGF21 是肝细胞分泌的细胞因子,可以作为机体内代谢调节剂,对机体内脂质和葡萄糖内稳态具有多效调节作用[21]。FGF21 可通过诱导产生抗应激剂或酮体来影响睡眠-觉醒,导致机体对社会压力的恢复[22]。临床研究显示,健康成年人急性睡眠不足导致FGF21 节律性水平升高[23]。LPIN1 也是睡眠剥夺所涉及的关键基因,在脂质合成中起关键作用,同时作为转录辅助活化因子对脂质代谢过程起效[24]。部分LPIN1 突变患者表现为脂代谢紊乱、体脂含量异常,在脂肪组织和骨骼肌组织中表现尤为明显[25]。在一项机制研究[26]中发现,睡眠剥夺引起的肝脏脂肪变性和肝脏胰岛素抵抗是通过上调LPIN1 等脂肪生成酶介导的,足见其与失眠关系紧密。此外,Cyp4a14、Cidec、Arntl、Cyp2b10、Insig2、Plin5 基因也是睡眠剥夺影响肝脏代谢的关键基因。
因此,睡眠剥夺影响机体肝脏代谢的诸多过程,涉及众多信号通路,此过程可能与神经炎症、抗氧化、癌症转录失调、视黄醇新陈代新等生物途径密切相关。此外,本研究通过分析预测了睡眠剥夺相关疾病影响代谢的可能机制并筛选出参与其中的核心基因,提示PPARγ、SREBF1、FGF21、Insig2、Plin5 等基因表达失调与此过程紧密相关,这可能为治疗睡眠类和代谢失调性疾病提供分子靶标和诊断标志物,为失眠等睡眠障碍的基础研究与临床诊治提供新的思路。本研究具有一定的局限性,本研究完全基于GEO 数据库中的数据,筛选出的核心基因仍需后期进一步通过实验验证。
