生物炭对咸水滴灌棉田土壤细菌群落的调控效应
2024-04-24叶扬向贵琴郭晓雯闵伟郭慧娟
叶扬,向贵琴,郭晓雯,闵伟,郭慧娟
(石河子大学农学院,新疆生产建设兵团绿洲生态农业重点实验室,新疆石河子 832003)
0 引言
新疆地处于西北干旱区,淡水资源短缺问题日益严峻[1],是限制干旱区农业发展的重要原因之一[2]。但咸水资源较为丰富[3],在持续的咸水灌溉条件下,土壤中的盐不能被带到地下水中去,必定会造成盐分在土壤表层积累,增加土壤盐渍化的风险[1],最终会导致土壤肥力急剧下降,不利于农业可持续发展[4]。咸水灌溉会增加土壤表面Na+含量,影响土壤质地,从而使土壤养分的有效性下降[5]。盐分和土壤微生物之间关系密切,土壤盐分的增加会严重影响微生物活动[6]。在一定范围内,土壤盐分可以增加微生物的活性,但是土壤盐浓度达到一定的界限,会降低微生物胞外的渗透势,抑制土壤微生物的数量[7]。土壤微生物可以衡量土壤质量以及健康程度[8],在保持土壤生态平衡方面起着关键作用[9]。土壤微生物中数量最高,丰度最大的是细菌,其在土壤物质转化,有机质降解等方面发挥着重要功能[10]。因此,当前热点问题为如何有效调控长期咸水灌溉给土壤细菌群落结构带来的不利影响。
施加生物炭是改善土壤盐渍化的重要措施之一,作为一种对环境较为友好的土壤改良剂,已被广泛应用于盐碱地土壤的改良[11]。生物炭的施用能够稳定土壤碳库,达到优化土壤的质量的目的[12-13]。在土壤中施加生物炭会显著改变土壤细菌群落的物种组成成分[14]。施用生物炭可提高可还原N2O 细菌的活性,促使一氧化二氮向氮气转化[15]。前人研究发现,氮肥的施用可以促进土壤微生物的增值,尤其土壤中细菌的含量,在改良土地质量方面具有重要作用[16],但同时不合理的施用也对全球生态环境产生严重威胁[17]。例如在氮肥投入不足的地区会导致农作物品质下降,出现土壤氮素肥力耗竭的情况[18]。但氮肥的过量使用会显著增加土壤中水溶性氮的含量,导致土壤氢离子浓度增加以及大量的一氧化二氮排放[19],最终影响作物品质。且土壤中多余的氮肥会大量损失到水体和大气中[20],会严重破环自然生态环境。土壤理化性质的变化势必会影响土壤微生物群落[21]。因此,探究生物炭和氮肥如何对农田土壤进行调控以及作物增产等方面成为当前研究热点。
目前,已探明咸水灌溉会对土壤理化性质产生不利影响[22-23],进而降低土壤细菌群落的多样性[23-24],但是在长期咸水灌溉下生物炭对棉田土壤细菌群落的调控效果尚未明晰。因此,为探究生物炭对咸水滴灌棉田土壤细菌群落的调控效应,通过长期咸水灌溉田间定位试验,对土壤理化性质和细菌群落结构进行综合分析,以期为干旱区土壤地力提升和提高农业生产力提供科学依据。
1 材料与方法
1.1 试验材料
试验地点:石河子大学农学院试验站,供试土壤类型:灰漠土,质地:壤土,供试作物:棉花,品种:‘新陆早52号’。在2009年(试验开展前)测得土壤耕层基础理化性质如表1。

表1 土壤基础理化性质
1.2 试验设计
本试验在已连续实施了11 年(2009-2019 年)咸水灌溉试验的基础上进行,灌溉水盐度为8.04 dS/m,由NaCl和CaCl2按比例1:1配制而成。于2019年开始施加生物炭。本试验共设置3 个处理:不施氮肥(N0)、施加氮肥(N360)、施加氮肥和生物炭(BC)。采用完全随机区组试验,各处理均重复3次,共9个试验小区,每个小区试验面积为25 m2。
棉花种植采用干播湿出法,于每年4 月中旬播种,9 月下旬收获。栽培技术为覆膜栽培,一膜3 管6行,行距配置为(60+10) cm,株距为10 cm,播种密度22.2 万株/hm2。在每年播种前将生物炭一次性加入,其用量为3.7 t/hm2,施入后将其混匀于0~20 cm 土层。播种后滴出苗水30 mm。在棉花生长的整个生育期内一共需要灌水9次,灌水时间从6月中旬开始,每7~10 d灌水一次,灌水定额为450 mm。施肥区施加的氮肥为尿素,全部做追肥,尿素氮含量大于等于46.4%,用量为360 kg/hm2,分5 次随水滴施,钾肥(K2O)和磷肥(P2O5)用量分别为60、105 kg/hm2,全部用做基肥。其他田间管理措施依照当地大田生产。
1.3 样品采集
2021 年在棉花的花铃期,采集耕层(0~20 cm)土壤,每个试验小区随机选取3个样点,将3个点的土样混匀并去除杂物和细根。一部分新鲜的土样置于冰盒,即刻带回实验室,放于-80℃冰箱保存,用来测定土壤细菌群落结构的多样性。另一部分装到自封袋,带回晾干,研磨过筛(1 mm),最后用于测定土壤理化性质。
1.4 样品测定
1.4.1 测定土壤理化性质土壤理化性质的测定方法均参照《土壤农化分析》[25]。土壤EC1:5和pH测定(水土比为2.5:1)分别采用MP522 型电导率仪和pH 仪;土壤全碳和全氮分别采用Multi N/C 2100 TOC/TN 仪和凯氏定氮仪测定;速效磷和速效钾含量分别采用NaHCO3浸提—钼锑抗比色法和醋酸铵浸提—火焰光度法测定。
1.4.2 测定土壤细菌多样性细菌群落多样性交由北京诺禾致源科技股份有限公司测定[21]。将放置于-80℃冰箱保存的土样取出,称取样品于OMEGA Soil DNA Kit (D5635-02)提取试剂盒(Norcross GA USA 公司)中,用于提取细菌总DNA,用紫外可见分光光度计测定DNA的数量。细菌16S rDNA引物主要基于V3-V4区,PCR 扩增的正反向引物分别为:338F(5′-barcode+ACTCCTACGGGAGGCAGCA- 3′ ) 和 806R (5′-GGACTACHVGGGTWTCTAAT-3′)。反应条件为:98℃5 min,98℃30 s,53℃30 s,72℃45 s,循环25次,72℃5 min,在12℃下保存。PCR 扩增结束后对其进行纯化和定量处理,最后用Illumina HiSeq 2500 PE250进行高通量测序[26]。
1.5 数据分析
通过SPSS 软件(Version SPSS.26.0)对数据进行方差分析和相关性分析,显著性水平为0.05。各处理间的多重比较用邓肯法(P<0.05)。用Microsoft Excel 2019 软件处理数据和绘图。通过使用Qiime(Version 1.9.1)软件分析细菌样品α多样性指数,并将样品所含序列数进行标准化处理。使用R (Version 3.1.0)软件对细菌群落进行热图分析。使用R(Version 2.15.3)软件对细菌群落进行RDA 分析。使用LEfSe 软件(Version 1.0)对细菌群落进行组间差异分析。文中数据均为平均值±标准差。
2 结果与分析
2.1 各处理土壤理化性质
与N0处理相比,N360处理显著增加土壤电导率和全氮的含量(表2),分别增加36.8%和9.2%,显著降低土壤pH 和速效磷的含量,分别降低了3.2%和39.6%;BC处理显著增加土壤含水量、电导率、pH、全碳、全氮和速效钾的含量,分别增加13.7%、60.0%、1.8%、25.8%、14.5%和110.6%。
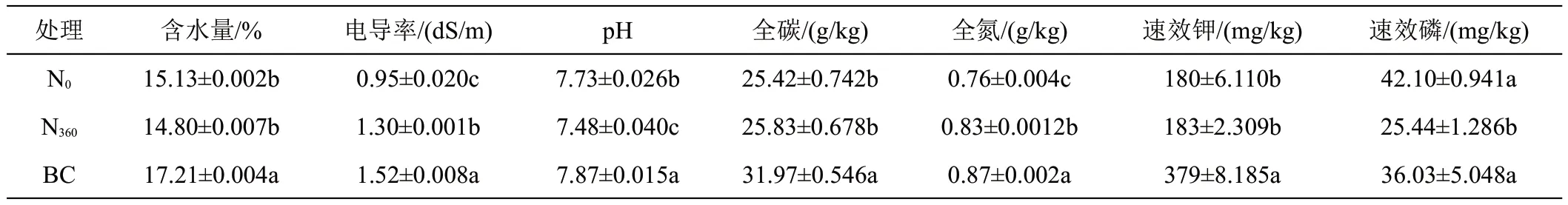
表2 不同处理对土壤理化性质的影响
2.2 各处理对土壤细菌α多样性影响
不同处理的土壤样品OTUs覆盖了98%以上的土壤细菌,说明此次测序的数据量能够真实的反映土壤细菌群落的组成。从表3 可以看出,较N0处理相比,N360处理的Shannon 和Simpson 指数均有不同程度的降低,Chao 1和ACE指数均有不同程度的增加;BC处理的Shannon、Simpson、Chao 1 和ACE 指数均有不同程度的降低。
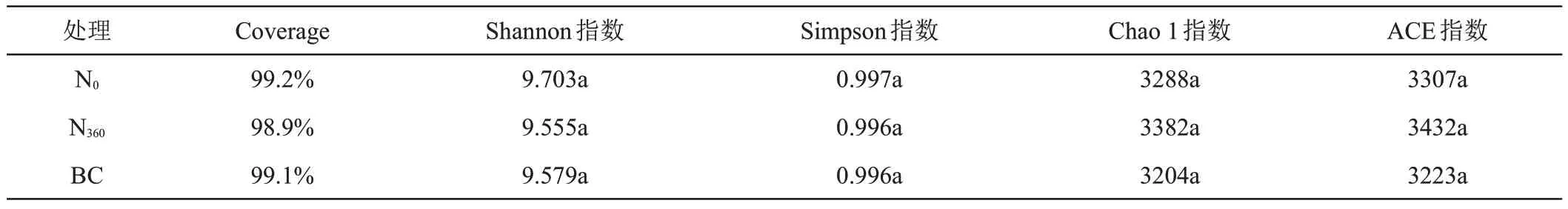
表3 土壤细菌群落的α多样性
从图1 可以看出,N0、N360和BC 处理的总OTUs 数为5820,各处理所共有的OTUs 数为2780,占总OTUs数的百分比为47.8%。N0处理具有独特的OTUs 个数为699,占总OTUs 数的百分比为12.0%;N360处理具有独特的OTUs 个数为622,占总OTUs 数的百分比为10.7%;BC处理具有独特的OTUs数为553,占总OTUs数的百分比为9.5%。Berkelbacteria 和GAL15 是N360和BC处理所特有的菌门。说明施加氮肥以及生物炭配施氮肥均会降低细菌物群落数量,改变土壤细菌群落群落组成。
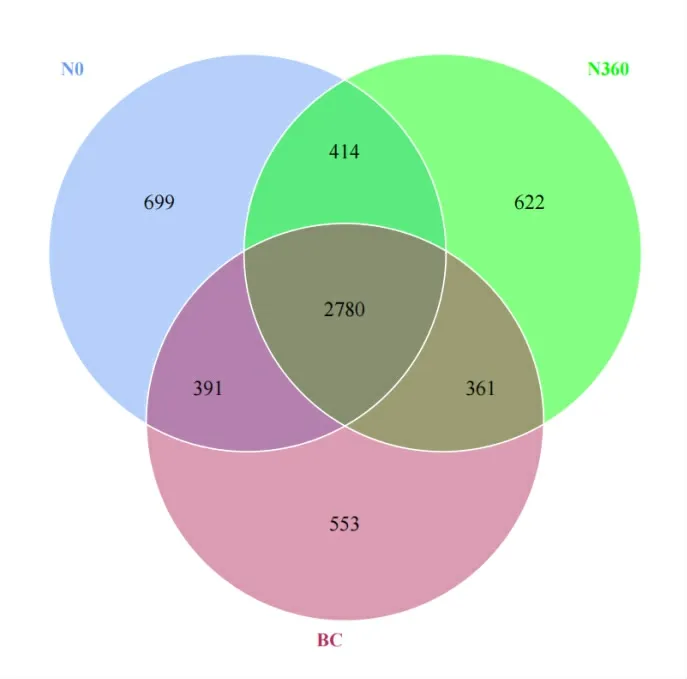
图1 各处理土壤细菌群落韦恩图
2.3 各处理对土壤细菌β多样性影响
如图2 所示,PC1 轴对土壤样本组成差异贡献值为41.6%,PC2轴为18.11%,共解释59.71%。PC2可以将N360和其他处理分隔开,说明N360处理与其他处理相比有显著差异。N0和BC处理在第2主成分上有交叉,说明他们之间存在相似性。
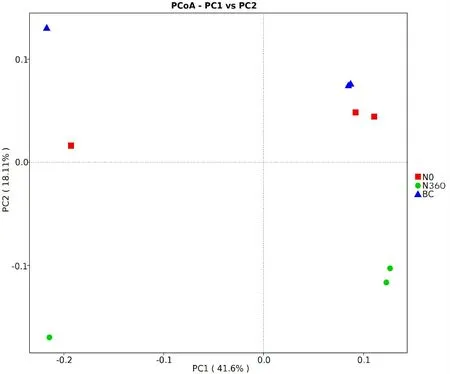
图2 土壤细菌群落PCoA分析
2.4 不同处理对土壤细菌门和属水平群落结构的影响
在门水平上,前10种土壤细菌群落相对丰度如图3 所示。其中酸杆菌门(Acidobacteriota)、变形菌门(Proteobacteria)和放线菌门(Actinobacteriota)的相对丰度均大于11%,为优势菌门,其占总序列的41.49%(36.85% ~46.70% )。 其 次 是 热 原 体 菌 门(Thermoplasmatota)、拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobiota)和绿弯菌门(Chloroflexi)其相对丰度均大于1%,其他菌门的平均相对丰度为19.22%。
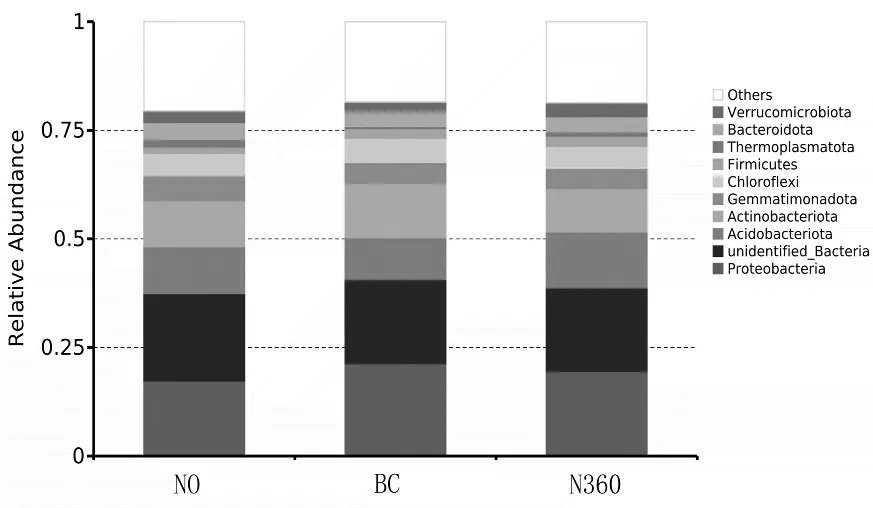
图3 各处理门水平前10种土壤细菌群落的相对丰度
施加氮肥和生物炭均会不同程度影响土壤细菌门水平群落结构(图4)。N360较N0处理增加了酸杆菌门(Acidobacteriota)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)等的相对丰度,但是降低了芽单胞菌门(Gemmatimonadetes)、热原体菌门(Thermoplasmatota)和 放 线 菌 门 (Actinobacteriota)、浮 霉 菌 门(Planctomycetota)和拟杆菌门(Bacteroidota)等的相对丰度。总体上N360处理较N0处理呈现降低趋势,说明施加氮肥会降低土壤细菌门水平上的相对丰度。

图4 土壤细菌群落门水平热图
与N0处理相比,BC 处理增加了放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、蛭弧菌门(Bdellovibrionota)和硝基螺门(Nitrospirota)等的相对丰度,但是降低了拟杆菌门(Bacteroidota)、疣微菌门(Verrucomicrobiota)和酸杆菌门(Acidobacteriota)等的相对丰度。总体上BC 处理较N0处理呈现降低趋势,说明生物炭配施氮肥会降低土壤细菌门水平上的相对丰度。
在属水平上,前10种土壤细菌群落相对丰度如图5 所示。通过序列对比这10 种菌属,发现前7 个菌属分别为RB41、亚硝化螺旋菌属(Nitrosospira)、鞘脂单胞菌属(Sphingomonas)、斯克尔曼氏菌属(Skermanella)、Subgroup_10、 芽 单 胞 菌 属(Gemmatimonas)和类固醇杆菌属(Steroidobacter),平均相对丰度均大于1%,占样本总序列的12.71%(10.00%~15.27%)。其次是UTCFX1、泛菌属(Pantoea)和Candidatus_Nitrocosmicus。

图5 各处理属水平前10种土壤细菌群落的相对丰度
施加氮肥和生物炭均会不同程度影响土壤细菌属水平群落结构(图6)。与N0处理相比,N360处理增加了RB41、亚硝化螺旋菌属(Nitrosospira)、UTCFX1、不动杆菌属(Acinetobacter)、乳酸菌属(Lactobacillus)、Haliangium、Gaiella、泛菌属(Pantoea)、狭义梭菌属(Clostridium_sensu_stricto_1) 和 邻 单 胞 菌 属(Plesiomonas)等的相对丰度。但是降低了鞘脂单胞菌属(Sphingomonas)、芽单胞菌属(Gemmatimonas)、海洋杆菌属(Pontibacter)、Candidatus_Nitrocosmicus和未鉴定噬甲基菌属(unidentified_Methylophilaceae)的相对丰度。总体上,N360处理较N0处理呈现降低趋势,说明施加氮肥会降低土壤细菌属水平上的相对丰度。

图6 土壤细菌群落属水平热图
与N0相比,BC处理增加了泛菌属(Pantoea)、亚硝化螺旋菌属(Nitrosospira)、斯克尔曼氏菌属(Skermanella)、UTCFX1、海洋杆菌属(Pontibacter)、Gaiella、邻单胞菌属(Plesiomonas)、乳酸菌属(Lactobacillus) 和狭义梭菌属(Clostridium_sensu_stricto_1)的相对丰度。但是降低了RB41、鞘脂单胞菌属(Sphingomonas)、Subgroup_10、Candidatus_Nitrocos micus、Haliangium、不动杆菌属(Acinetobacter)、未鉴定噬甲基菌属(unidentified_Methylophilaceae)和藓杆菌属(Bryobacter)的相对丰度。总体上BC处理较N0处理呈现降低趋势,说明生物炭配施氮肥会降低土壤细菌属水平上的相对丰度。
2.5 土壤细菌群落的LEfSe差异分析
如图7 所示,通过LEfSe (LDA>2.5,P<0.05)对比分析,共检测到土壤细菌中有25 个显著差异种群,其中N0处理有13 个,N360处理有8 个,BC 处理有4 个。N0处理的差异物种有:门水平上:Halobacterota 和Deinococcota;纲水平上:Polyangia、Halobacteria 和Deinococci;目水平上:PAUC26f、Granulosicoccales、Halobacterales 和JTB23;科水平上:Trueperaceae 和Haloferacaceae; 属 水 平 上 :Truepera和Haloferacaceae。N360处理的差异物种有:门水平上:unidentified_Archaea;目水平上:Phycisphaerales;科水平上:Rhodocyclaceae和Phycisphaeraceae。BC处理的差异物种有:纲水平上:Leptospirillia;目水平上:Caldilinealesl 和Leptospirillales;科水平上:LWQ8、Caldilineaceae 和 Leptospirillaceae;属水平上 :Leptospirillum;种水平上:Nitrospira_bacterium_SG8_3。
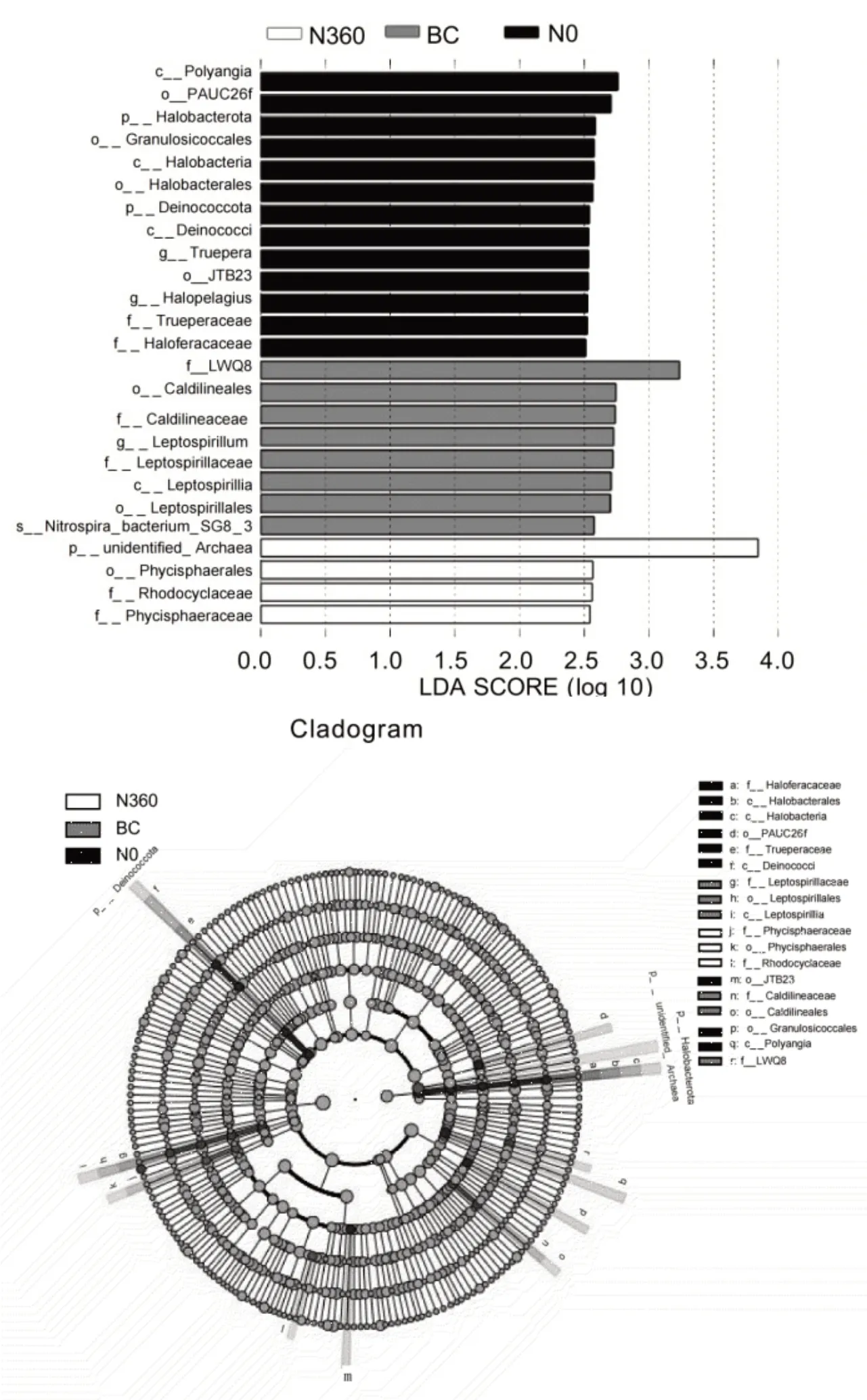
图7 不同处理土壤细菌群落的LEfSe差异分析
2.6 RDA分析
RDA 结果显示(图8a),轴一解释变异量为46.95%,轴二解释变异量为28.56%,解释总变异量为75.51%。环境因子方面,EC与TN、AK、TC成锐角,为正相关关系,但与pH和AP成钝角,为负相关关系;土壤细菌群落与理化性质方面,厚壁菌门(Firmicutes)与TC、EC 和TN 锐角,为正相关关系,与AP 和pH 成钝角,为负相关关系。细菌群落门水平结构与全氮(解释度1.2%,P=0.043)和速效钾(解释度1.9%,P=0.050)存在显著相关关系。
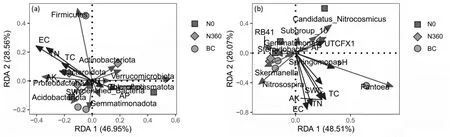
图8 土壤细菌群落门和属水平与土壤理化性质之间的RDA分析
如图8b 结果显示,轴一解释变异量为48.51%,轴二解释变异量为26.07%,解释总变异量为74.58%。环境因子方面,pH 与AP 成锐角,为正相关关系;土壤细菌群落与理化性质方面,泛菌属(Pantoea)与pH、TC和AP 呈锐角,为正相关关系;亚硝化螺旋菌属(Nitrosospira)与AP 呈锐角,为正相关关系,与EC 和AK呈钝角,为负相关关系。
3 结论
(1)氮肥施用显著降低土壤速效磷和pH,但是会显著增加土壤电导率和全氮的含量;生物炭配施氮肥处理能明显提高土壤含水量、全碳、pH、电导率、全氮和速效钾的含量。
(2)生物炭配施氮肥降低细菌群落的丰富度和多样性。氮肥和生物炭配施氮肥处理细菌相对丰度均有降低趋势。施加氮肥增加土壤酸杆菌门、厚壁菌门以及变形菌门的相对丰度,但抑制放线菌门、热原体菌门以及芽单胞菌门的相对丰度;生物炭配施氮肥增加放线菌门、硝基螺门和绿弯菌门等的相对丰度,但降低疣微菌门、酸杆菌门以及拟杆菌门的相对丰度。土壤TN和AK是影响细菌群落物种构成成分的主要驱动因子。
4 讨论
4.1 不同处理对土壤理化性质的影响
长期的咸水灌溉导致土壤盐分随毛管水上升至地表积聚[27-28],使土壤理化性质趋于恶化,增加土壤盐渍化危害的风险[29],最终影响农作物的正常生长发育[30]。氮素在作物的生长发育中必不可少,经济施氮量会缓解盐分对作物生长发育的负面影响[31-32]。施用生物炭能够改善土壤状况,从一定程度上恢复土壤生态平衡。生物炭配施氮肥既有利于土壤有机碳的积累[33-34],还可提升土壤氮素的供应能力[35]。生物炭被认为是氮、磷等营养物质的额外来源,可以提高养分的有效性[36]。本研究中,生物炭配施氮肥显著增加全碳和全氮的含量,是因为生物炭配施氮肥后会降低土壤碳氮比,使土壤有机质中的碳被释放,促进土壤中微生物的增长以及有机质大量分解,影响土壤氮素的供应[37-38]。速效钾含量的显著增加可能是因为生物炭中的灰分中含有大量钾盐,以促进养分的有效化,提升土壤速效钾含量。土壤电导率增加可能是因为生物炭吸附了大量盐分离子导致电导率显著增加。有研究发现,生物炭可以有效改良酸性土壤pH,但对碱性土壤的改良作用并不明显[39]。
4.2 不同处理对土壤细菌群落的影响
施加氮肥或生物炭均能影响土壤理化性质,从而会对土壤微生物的群落物种组成成分造成影响[40]。本研究发现,施加氮肥后,土壤细菌群落Chao 1 和ACE 指数均有不同程度的增加趋势,香浓指数和辛普森指数会降低,说明施加氮肥土壤细菌群落的丰富度会增加,而多样性会降低。本研究也发现,生物炭配施氮肥后,土壤细菌群落的Shannon、Simpson、Chao 1 和ACE 指数均有不同程度的降低趋势,说明生物炭配施氮肥,细菌群落的丰富度和多样性均会降低。原因可能是生物炭将大量盐分吸附于孔隙中,抑制土壤细菌的生长和繁殖,从而减少了棉田细菌群落的多样性以及丰富度。
土壤微生物中细菌的含量最多、丰度最高,具有丰富的遗传多样性,能够促进营养物质释放、有机质的分解,还参与碳、氮等物质循环过程[41]。施加氮肥或生物炭也会显著影响土壤细菌的群落物种构成成分[23]。本研究发现,各个处理土壤细菌优势菌门为酸杆菌门、变形菌门和放线菌门,这与前人[42-44]研究结果一致。放线菌门和变形菌门耐盐性较好,是盐土中丰富的嗜盐细菌代表[45],其中变形菌门为土壤中的优势门类,与碳利用有关[46]。有大量研究结果表明,土壤酸杆菌门具有嗜酸性的特点,可作为土壤贫瘠的评价指标[47]。本研究还发现,生物炭配施氮肥后,棉田土壤细菌绿弯菌门的相对丰度增加,但拟杆菌门的相对丰度会降低。绿弯菌门已被证实具有较多的病原拮抗菌,是土壤健康的标志性微生物种群[48-49]。拟杆菌门的丰度通常与土壤全氮含量成负相关[50],因此氮会抑制拟杆菌门的菌群丰度,这与前人研究相一致[51]。疣微菌门在土壤中广泛存在,且发挥着重要功能[52],有研究表明,疣微菌门存在大量的非核糖体肽合成酶系统可能会合成部分抗生素[53]。本研究中,疣微菌门的相对丰度在施加氮肥时有下降趋势,但是在生物炭配施氮肥后又有增加趋势。说明追施氮肥,可能会抑制抗生素的生成,而施加生物炭又可以增加抗生素的合成,从而增强棉花的抗病性。本研究中,各个处理的土壤细菌优势菌属为RB41、亚硝化螺旋菌属和鞘脂单胞菌属,其中RB41属于酸杆菌门,施加氮肥会显著增加其相对丰度。亚硝化螺旋菌属参与土壤氮循环[54],施加氮肥以及生物炭配施氮肥均增加了亚硝化螺旋菌属的相对丰度,可能是因为氮肥与生物炭对土壤氮素循环产生了一定的影响。本研究中,施加氮肥或生物炭均会降低细菌群落潜在生物标志物的数量,可能是因为氮肥和生物炭可以为细菌提供良好的生存环境,直接影响细菌群落的生长与繁殖,也可能是因为通过影响土壤理化环境,从而影响影响细菌的群落结构[55]。
