O-GlcNAc糖基化修饰在免疫系统中的作用
2024-04-23薛俊杰
薛俊杰, 孙 慧
(武汉大学生命科学学院生物化学与分子生物学系,过敏及免疫相关疾病湖北省重点实验室, 武汉 430072)
糖是重要的生物大分子,其除了与蛋白质或脂质等分子复合构成生物结构组分、充当细胞能源物质外,还作为蛋白质的翻译后修饰。蛋白质的糖基化修饰是真核细胞中最为丰富和多样化的翻译后修饰,参与影响细胞信号转导,调控细胞的生长、增殖和分化[1-4]。根据糖与蛋白质连接方式的不同主要可以分为N-糖基化和O-糖基化。N-糖基化修饰多发生在分泌蛋白质和细胞膜蛋白质的天冬酰胺(Asn,N)残基上,而O-糖基化修饰通过丝氨酸(Ser,S)、苏氨酸(Thr,T)或酪氨酸(Tyr,Y)残基的羟基末端与糖链共价连接[1]。O连接的α-N-乙酰半乳糖胺(O-linkedα-N-acetylgalactosamine,O-GalNAc)糖基化修饰(O-GalNAcylation)与O连接的β-N-乙酰葡糖胺(O-linkedβ-N-acetylglucosamine,O-GlcNAc)糖基化修饰(O-GlcNAcylation)是2种常见的O-糖基化修饰,二者都因在癌症、自身免疫失调等疾病中高度上调而受到关注[5-6]。其中,O-GalNAc糖基化修饰广泛分布在黏蛋白质上(故也被称为黏蛋白型O-糖基化修饰),并被延伸成更为复杂的糖链。与此不同的是,O-GlcNAc糖基化修饰发生在细胞内蛋白质上,靶蛋白质的丝氨酸/苏氨酸残基上仅连接1个GlcNAc单元后便不再延伸。由于其结构简单且修饰动态可逆,O-GlcNAc糖基化修饰可以快速响应外界信号,灵活地调控细胞内诸多信号通路[7]。这与磷酸化修饰类似,因此,2种修饰在靶蛋白质同一修饰位点上通常存在潜在的竞争关系,二者的相互作用对于细胞信号通路的精细调控具有重要意义[8, 9]。值得注意的是,O-GlcNAc糖基化修饰在真核细胞内分布广泛,大约有数千乃至上万种蛋白质上存在该修饰,包括转录因子、激酶和磷酸酶等[7]。由于O-GlcNAc糖基化修饰深度参与了细胞生长发育、营养代谢和机体免疫反应等诸多基础性的生理过程,细胞内O-GlcNAc糖基化修饰水平的异常变化通常与癌症、心血管疾病、糖尿病和神经退行性疾病等[10-13]病理状态密切关联。
免疫系统是维护机体内稳态、对抗感染和疾病的重要组成部分。越来越多的证据表明,O-GlcNAc糖基化修饰水平的紊乱会导致免疫系统失调,免疫细胞的生理功能普遍受到该修饰的调控。本文为此综述了O-GlcNAc糖基化修饰在免疫系统以及相关疾病中的调控作用,重点介绍O-GlcNAc糖基化修饰影响巨噬细胞、T细胞和B细胞的活化、分化以及功能发挥的分子机制,以期更为系统且深入地理解O-GlcNAc糖基化修饰对免疫系统的影响。
1 O-GlcNAc糖基化修饰的动态调控
O-GlcNAc糖基化修饰水平的稳态对于细胞维持正常的生理功能至关重要。这种平衡的维持受到葡萄糖代谢、可变剪切、酶的协调表达、底物识别等多种方式调控。
不同于蛋白质的磷酸化和去磷酸化由多种激酶和磷酸酶参与,胞内蛋白质O-GlcNAc糖基化修饰的添加和去除分别由O-GlcNAc糖基转移酶(O-GlcNAc transferase,OGT)和O-GlcNAc糖苷酶(O-GlcNAcase,OGA)2个酶完成[14]。这对酶在从线虫到人类等高等真核生物中高度保守,OGT的基因敲除和OGA功能丧失在小鼠中均会产生胚胎致死性表型[15, 16]。OGT通过催化底物尿苷二磷酸(uridine diphosphate,UDP)-N-乙酰葡糖胺(UDP-GlcNAc)与靶蛋白质特定丝氨酸/苏氨酸上的羟基发生酰胺结合而实现O-GlcNAc糖基化修饰。UDP-GlcNAc是己糖胺生物合成途径(hexosamine biosynthesis pathway,HBP)的终产物,其含量与葡萄糖代谢水平相关联,进入细胞的葡萄糖大约有2%-5%会通过HBP途径代谢[17]。高糖条件下,细胞内UDP-GlcNAc含量上升,对应于高水平的O-GlcNAc糖基化修饰[18]。因此,细胞内O-GlcNAc糖基化修饰水平受环境营养水平影响较大,可以作为细胞营养状态的感受器。此外,O-GlcNAc糖基化修饰可与哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex1,mTORC1)的葡萄糖感知和激活机制偶联,复合物的Raptor蛋白亚基上T700位点的O-GlcNAc糖基化修饰促使mTORC1向溶酶体募集,从而激活mTORC1介导的细胞代谢通路,促进细胞增殖[19]。
除了受葡萄糖代谢影响外,细胞通过多条途径协调OGT与OGA的表达和活性,维持细胞内O-GlcNAc糖基化修饰水平。研究发现,细胞采用内含子保留的剪接方式决定是否产生功能性的转录本,进而从转录水平调控OGT与OGA的相对表达量,以应对O-GlcNAc糖基化修饰水平的急剧变化[20]。也有研究指出,在肺癌细胞中,OGA的表达调控主要发生在转录水平,而OGT的表达调控主要受翻译控制[21]。目前,我们对于OGT识别数量庞大的底物的具体机制仍不明确。一些结构分析表明,OGT识别底物蛋白质依赖其含有34肽重复序列(tetratricopeptide repeat,TPR)的N端结构域[22-24],并且催化的O-GlcNAc糖基化修饰倾向于发生在底物蛋白质S/T富集的区域[25]。值得注意的是,OGT与OGA也会被O-GlcNAc糖基化修饰,这暗示两者可能在翻译后层面上相互调控各自的活性和稳定性。在两者形成的OGT-OGA复合物冷冻电镜结构中,OGT形成了剪刀形二聚体,一个长而灵活的OGA片段占据了OGT的底物结合槽,从而阻止OGT修饰其他底物。同时,OGT破坏OGA的功能性二聚化并阻断其活性位点,导致其他底物无法进入。这种OGT和OGA之间的相互抑制可能限制了无效的O-GlcNAc糖基化循环,并有助于维持O-GlcNAc糖基化修饰水平的稳态[26]。总之,为了微调细胞内O-GlcNAc糖基化修饰水平以维持稳态,OGT与OGA的功能效应可能受多层反馈机制控制。
2 O-GlcNAc糖基化修饰与先天免疫
先天免疫的主要功能为抗感染,其构成了抵御入侵病原体的第一道防线。当宿主受到感染,先天免疫细胞通过模式识别受体(pattern recognition receptors,PRRs)识别病原体相关分子模式(pathogen-associated molecular patterns,PAMPs),启动一系列的炎症反应。参与先天免疫反应的细胞主要包括巨噬细胞、中性粒细胞、自然杀伤细胞(natural killer cell,NK cell)和树突状细胞(dendritic cell,DC)等[27]。O-GlcNAc糖基化修饰通过葡萄糖代谢,修饰转录因子以及影响重要信号通路等途径发挥作用,介导先天免疫细胞的分化、信号转导、基因表达以及炎症反应的调控。O-GlcNAc糖基化修饰参与先天免疫在巨噬细胞中已有较好的阐释,下文将主要对此进行概述。
2.1 O-GlcNAc糖基化修饰与巨噬细胞
2.1.1O-GlcNAc糖基化修饰参与巨噬细胞分化与稳态维持 巨噬细胞存在两种不同功能的表型:促进炎症的M1型与抑制炎症而促进组织修复的M2型[28],巨噬细胞的分化和表型维持受O-GlcNAc糖基化修饰调控。对人单核细胞白血病(THP-1)细胞进行基因筛选发现,OGT是巨噬细胞向M2型极化的新介质,OGT基因敲除后不利于THP-1细胞向IL4/IL13诱导的M2型极化,与M1型相关的基因表达反而上调[29]。在肿瘤微环境中,葡萄糖通量的增加通过上调肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)中O-GlcNAc糖基化修饰水平来促进巨噬细胞向M2表型转变[30]。有研究认为,刺猬(Hedgehog,Hh)信号对于调节巨噬细胞极化的代谢回路至关重要。抑制M2型巨噬细胞中Hh信号通路降低了UDP-GlcNAc的合成,导致STAT6的O-GlcNAc糖基化修饰减少,从而减轻M2型巨噬细胞的免疫抑制能力[31]。O-GlcNAc糖基化修饰还可以通过调节诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)活性导致IL-1β、IL-6和IL-12等促炎细胞因子的升高,维持炎性巨噬细胞稳态[32]。此外,核糖体蛋白S6激酶β-1(ribosomal protein S6 kinase beta-1,S6K1)能够作为OGT底物被O-GlcNAc糖基化修饰,该修饰阻碍了其自身的磷酸化激活,进而影响mTORC1/S6K1信号通路活性,抑制巨噬细胞的活化[33]。
通过改变转录因子的活性调节细胞因子等基因的转录是O-GlcNAc糖基化修饰影响免疫细胞功能的重要作用形式。核因子κB(nuclear factor kappa-B,NF-κB)、活化的T细胞核内因子(nuclear factor of activated T cells,NFAT)和信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)是调控免疫相关基因表达的关键转录因子。OGT可与NF-κB共定位在启动子上并催化其RELA原癌基因(RELA proto-oncogene,RelA,即p65)亚基T305位点发生O-GlcNAc糖基化修饰,继而增强RelA赖氨酸310位点的乙酰化,使NF-κB的转录能力在肿瘤坏死因子(tumor necrosis factor,TNF)刺激下充分发挥[34]。此外,NF-κB的p65亚基在S536位点附近的O-GlcNAc糖基化修饰可以增强其与核因子κB抑制蛋白(inhibitor of NF-κB,IκB)的结合,推动巨噬细胞向M2型转变,减轻炎症反应[35]。STAT3是介导免疫抑制和组织修复的调节因子[36]。STAT3上T717位点的O-GlcNAc糖基化修饰阻碍其再被磷酸化激活,从而降低IL-10的表达,促进炎症的发生[37]。这些结果体现出OGT底物选择的多样性,既有代谢信号通路中的关键蛋白质,也包括酶和多种转录因子,并且O-GlcNAc糖基化修饰的分布和巨噬细胞的分化选择与表型维持很可能受到营养条件的影响。
2.1.2O-GlcNAc糖基化修饰参与巨噬细胞免疫应答 Toll样、NOD样等受体介导的信号通路是先天免疫信号传导主要途径。OGT通过修饰参与这些通路的关键蛋白质,影响免疫细胞对病原体的应答能力。例如TAK1(TGF-beta activated kinase 1)是若干细胞因子介导的先天免疫信号转导通路中必不可少的激酶。IL-1诱导的TAB1(TGF-beta activated kinase 1 binding protein 1)S395位点上O-GlcNAc糖基化修饰,是TAK1和NF-κB活化以及最终产生IL-6和TNF-α所必需的[38]。当巨噬细胞受到脂多糖刺激时,OGT被去亚硝基化(OGT的催化活性受S-亚硝基化修饰的抑制),继而增强p65的O-GlcNAc糖基化修饰,提高一氧化氮和IL-1β水平[39]。但同时也有研究指出,脂多糖诱导的O-GlcNAc糖基化修饰参与了抗炎信号通路,OGT对受体相互作用蛋白激酶3(receptor-interacting protein kinase 3,RIPK3)T467的O-GlcNAc糖基化修饰抑制了巨噬细胞下游先天免疫信号传导,相反,OGT的缺失会增强先天免疫和炎症[40],反映出该修饰系统调控炎症反应的复杂性。NOD样受体X1(NOD-like receptor X1,NLRX1)被OGT催化修饰后会促使NLRX1被泛素化,从而降低NLRX1的稳定性,增强NLRX1竞争性地与核因子κB激酶-α抑制蛋白(inhibitor of nuclear factor kappa B kinase-α,IKK-α)结合,抑制NF-κB信号和促炎细胞因子IL-1β的产生[41]。越来越多的研究表明,O-GlcNAc糖基化修饰在免疫系统抵抗病毒感染过程中扮演了重要角色[42]。巨噬细胞中HBP通路和下游蛋白质O-GlcNAc糖基化修饰水平会在受到泡疹性口炎病毒(vesicular stomatitis virus,VSV)攻击后增强,OGT敲低的人和小鼠细胞,在面对VSV感染时则表现出抗病毒免疫反应缺陷[43]。此外,在感染甲型流感病毒(influenza A virus,IAV)的人外周血单核细胞中检测到干扰素调节因子-5(interferon regulatory factor 5,IRF5)S430位点发生O-GlcNAc糖基化修饰,从而激活炎症因子表达,产生细胞因子风暴[44]。线粒体抗病毒信号蛋白(mitochondrial antiviral signaling proteins,MAVS)是干扰素信号通路的关键蛋白质,在病毒识别时迅速产生[45]。MAVS蛋白上O-GlcNAc糖基化修饰是其在病毒诱导条件下发生泛素化所必需的,由此促进IRF3活化和IFN-β的产生,其O-GlcNAc糖基化修饰的缺失使得宿主对于病毒更为易感[46]。在肺泡巨噬细胞中的研究发现,该过程还受到泛素E3连接酶重要组分Cullin5(CUL5)的调节,其促使OGT被泛素化并通过蛋白酶体途径降解,进而影响MAVS蛋白O-GlcNAc糖基化修饰,损害机体的抗病毒能力[47]。这些研究提示,O-GlcNAc糖基化修饰能够通过影响转录因子和免疫信号通路关键蛋白质活性调控炎症因子的产生,从而在控制炎症反应的强度和持续时间上发挥作用。
2.2 O-GlcNAc糖基化修饰与其他先天性免疫细胞
O-GlcNAc糖基化修饰在其他先天免疫细胞,例如中性粒细胞、NK细胞和DC细胞中同样发挥了重要的免疫调控作用。例如,细胞因子IL-2和IL-15刺激的NK细胞会导致细胞内蛋白质的O-GlcNAc糖基化修饰水平升高[48]。当使用OGT的抑制剂OSMI-1抑制O-GlcNAc糖基化修饰时,NK细胞中TNF-α、IFN-γ、颗粒蛋白和穿孔素等抗肿瘤蛋白质表达降低,进而减弱NK细胞对癌细胞的细胞毒性[48]。Zeste增强子同源物2(enhancer of zeste homolog 2,EZH2)上S75位点的O-GlcNAc糖基化修饰,参与调节NK细胞发育和EZH2蛋白的稳定性与功能[49, 50]。O-GlcNAc糖基化修饰水平的升高促进中性粒细胞中p38和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)的活化,从而增强中性粒细胞的迁移能力[51]。此外,体外研究表明,抑制OGT会影响单核细胞来源的DC细胞分化和功能发挥[52]。
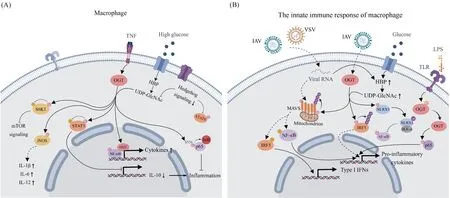
Fig.1 The regulatory role of O-GlcNAcylation in macrophages (A) The polarization and phenotypic maintenance of macrophages is regulated by O-GlcNAcylation, which is performed by OGT. Diverse substrates are glycosylated, including enzymes (iNOS, S6K1) and transcription factors (NF-κB, STAT3 and p65), resulting in different effects on macrophage activation and inflammation (cytokines production). Meanwhile, O-GlcNAcylation is affected by the hexosamine biosynthesis pathway (HBP) and hedgehog (Hh) signaling pathway, which influence the production of UDP-GlcNAc, the donor of GlcNAc. (B) The immune response of macrophage is also regulated by O-GlcNAcylation. When infected by RNA viruses, the protein that detect viral RNA, MAVS, is glycosylated by OGT, which in turn leads to the activation of transcription factors (NF-κB and IRF3), promoting cytokines production. IRF5 and NLRX1 are also glycosylated. When stimulated by lipopolysaccharide (LSP), OGT is denitrosylated, resulting in the glycosylation of p65 and subsequent cytokines transcription. Meanwhile, O-GlcNAcylation is affected by the HBP. ‘G’ in pink circle stands for O-GlcNAcylation, ‘P’ in orange circle stands for phosphorylation, ‘Ub’ in purple circle stands for ubiquitination and ‘SNO’ in orange oval stands for S-nitrosylation
3 O-GlcNAc糖基化修饰与适应性免疫
适应性免疫包括细胞免疫和体液免疫2种方式,主要由T淋巴细胞和B淋巴细胞承担[53]。在T细胞和B细胞的活化、分化和功能效应的发挥中,O-GlcNAc糖基化修饰同样扮演了重要角色。
3.1 O-GlcNAc糖基化修饰与T细胞
关于O-GlcNAc糖基化修饰在T细胞中的功能已有较为全面的报道[54]。条件性敲除小鼠造血干细胞中Oga基因导致祖细胞显著减少,干细胞自我更新受损,再生能力几乎完全丧失,且早期T细胞对Oga缺失尤为敏感[55]。早在1991年,Kearse等发现,T细胞的活化导致细胞核内蛋白质的O-GlcNAc糖基化修饰水平迅速增加,同时胞质蛋白质的修饰水平显著下降,表明O-GlcNAc糖基化修饰参与调节T细胞的早期活化过程[56]。与此相一致的是,通过T细胞受体(T cell receptor,TCR)激活人原代T细胞会导致O-GlcNAc水平和OGT表达的升高,而不影响OGA水平[57]。初始CD4+T细胞通过表面受体识别抗原呈递细胞提呈的抗原肽段后会发生代谢转变,增加葡萄糖转运蛋白1(glucose transporter 1,GLUT1)的表达[58],并提高对葡萄糖和谷氨酰胺的摄入水平,以维持自身的大量增殖[59]。由于葡萄糖和谷氨酰胺是OGT催化底物UDP-GlcNAc的前体,因而免疫激活的T细胞含有更高水平的UDP-GlcNAc和O-GlcNAc糖基化修饰。与巨噬细胞类似,许多转录因子的O-GlcNAc糖基化修饰也参与了T细胞活化的调节。NF-κB和NFAT的O-GlcNAc糖基化修饰促使其从胞质向细胞核移位,驱动了T细胞的增殖[60]。OGT的下调导致NFAT功能受损并抑制IL-2的产生[60]。NF-κB亚基c-Rel上S350位点的O-GlcNAc糖基化修饰是其DNA结合和转录激活所必需的,该位点的突变降低了响应TCR活化的NF-κB下游靶标(包括细胞因子IL-2和IFNγ)的表达[61]。此外,c-Myc是一种与细胞代谢相关联的重要转录因子[62],其在T细胞扩增期间被O-GlcNAc糖基化修饰而稳定,c-Myc的敲除损害了T细胞活化后葡萄糖和谷氨酰胺转运蛋白的表达[62],并阻碍细胞内TCR介导的O-GlcNAc糖基化修饰[63]。这些数据表明,c-Myc的存在对于维持T细胞中蛋白质O-GlcNAc糖基化修饰至关重要。OGT介导的O-GlcNAc糖基化修饰对于T细胞活化和细胞因子产生是必需的。
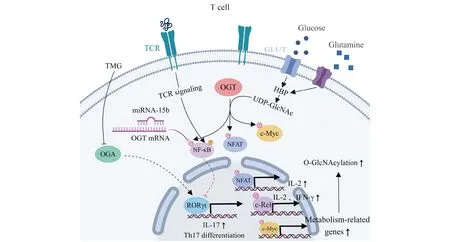
Fig.2 The regulatory role of O-GlcNAcylation in T cells The activation and differentiation of T cells are regulated by O-GlcNAcylation. Transcription factors such as NF-κB, NFAT and c-Myc are glycosylated, which initiates transcription of cytokines and metabolism-related genes. The differentiation of T cell to Th17 is also regulated by miRNA-15b and RORγt. Meanwhile, O-GlcNAcylation is affected by the hexosamine biosynthesis pathway (HBP).‘G’ in pink circle stands for O-GlcNAcylation, ‘P’ in orange circle stands for phosphorylation
除了参与T细胞的活化,O-GlcNAc糖基化修饰还会影响T细胞分化和细胞亚型的维持。根据TCR所接收信号和环境的不同,初始T细胞活化后可以分化成相应的效应T细胞亚群,包括辅助性T细胞(helper T cell,如Th1、Th2、Th17)、调节性T细胞(regulatory T cell,Treg)[53]以及细胞毒性T细胞(cytotoxic T cell,CTL)[64]。不同的T细胞亚型在免疫系统发挥着特定的功能。例如,辅助性T细胞Th1、Th2及Th17通过释放各类细胞因子强化免疫反应。IL-17是Th17细胞分泌的一种主要促炎细胞因子,使用OGA抑制剂Thiamet G处理脾CD4+T细胞后,IL-17的分泌水平显著提升,并且视黄酸受体相关孤儿受体γt(retinoic acid receptor-related orphan receptor gamma-t,RORγt,Th17谱系定型的关键转录因子[65])与IL-17启动子区和增强子区的结合增加,进一步促进炎症反应[66]。miRNA-15b结合OGT的mRNA,介导其表达沉默并抑制Th17分化,这可能是通过阻断NF-κB的O-GlcNAc糖基化修饰降低RORγt的表达所致[67]。另一方面,Treg细胞负责调控自身免疫耐受和体内免疫稳态,转录因子FOXP3的持续表达是此类细胞的重要标志[68],其免疫调控功能依赖于T细胞受体信号传导和IL-2/STAT5信号通路的激活。研究发现,O-GlcNAc糖基化修饰缺陷导致Treg细胞中该信号传导减弱,FOXP3表达轻度降低,谱系稳定性和效应功能却严重受损,最终使小鼠发生致命的自身免疫病[69]。O-GlcNAc糖基化修饰是Treg细胞和Th17细胞的分化和稳态维持所必须,暗示其对于T细胞分化的精细调控具有重要意义。
3.2 O-GlcNAc糖基化修饰与B细胞
相较于T细胞,O-GlcNAc糖基化修饰在B细胞中的研究较少。B淋巴细胞主要通过分泌抗体参与体液免疫。早期B淋巴细胞通过B细胞受体(B cell receptor,BCR)介导的活化和增殖也需要OGT参与[60]。Src家族酪氨酸激酶LYN上S19的O-GlcNAc糖基化修饰促使该激酶活化,进而招募脾酪氨酸激酶SYK传导BCR信号,OGT的缺失不仅会导致BCR信号激活的严重缺陷,而且还会通过促进成熟B细胞的凋亡来扰乱B细胞稳态,最终使抗体水平降低[70]。此外,多种转录因子的O-GlcNAc糖基化修饰对B细胞的活化和免疫稳态维持有重要作用。c-Myc的稳定性受O-GlcNAc糖基化修饰调节,敲低OGT会伴随c-Myc水平的下调,进而抑制A型和E型细胞周期蛋白(cyclins)的表达,影响前B细胞的增殖[71]。在前B细胞急性淋巴细胞白血病中,O-GlcNAc糖基化修饰通过PI3K/Akt/c-Myc途径促进病程发展[72],而c-Myc的O-GlcNAc糖基化修饰位点T58是人淋巴瘤的突变热点[73],有望作为前B细胞白血病的治疗靶点。此外,高水平的O-GlcNAc糖基化修饰通过与磷酸化和乙酰化的相互作用活化NF-κB信号通路。p65在T305和S319的O-GlcNAc糖基化修饰可以通过激活p65在赖氨酸310位点的乙酰化来增强CREB-结合蛋白/p300依赖性,并促进NF-κB转录激活[74]。B细胞中免疫球蛋白基因重排的随机性使其具有多达1011种不同的特异性,从而确保对多种抗原的反应性。然而,如此巨大的多样性有一定概率会产生自身抗体,生成自身反应性B细胞。免疫系统采用凋亡机制在这些自身反应性细胞获得免疫能力之前使其沉默[75]。淋巴细胞特异性蛋白1(lymphocyte-specific protein 1,Lsp1)是一种介导抗IgM抗体诱导B细胞凋亡的磷酸化蛋白质[76]。该蛋白质上S209位点的O-GlcNAc糖基化修饰促使其激酶PKC-β1募集,并催化Lsp1上S243位点磷酸化,从而导致ERK蛋白活化以及BCL-2、BCL-xL表达下调,促进活化B细胞凋亡[77]。总的来说,O-GlcNAc糖基化修饰及与磷酸化之间的动态相互作用参与了B细胞活化和凋亡的调控,控制着体内免疫稳态的维持。

Fig.3 The regulatory role of O-GlcNAcylation in B cells The activation and proliferation of B cells are regulated by O-GlcNAcylation. Transcription factors such as NF-κB, NFAT, c-Myc and subunit p65 are glycosylated, which initiate transcription of related genes, thus promoting activation and proliferation of B cells. The progress can be regulated by BCR signaling and affected by hexosamine biosynthesis pathway (HBP). Apoptosis of B cells is also regulated by O-GlcNAcylation as key kinases in the apoptotic pathway are glycosylated by OGT.‘G’ in pink circle stands for O-GlcNAcylation, ‘P’ in orange circle stands for phosphorylation and ‘Ac’ in crimson circle stands for acetylation
4 O-GlcNAc糖基化修饰与免疫相关疾病
O-GlcNAc糖基化修饰的异常与多种免疫相关疾病的发生发展密切相关。炎症反应是免疫系统对外界刺激的一种保护性反应,但过度或长期的炎症反应会导致组织损伤和疾病发展[78]。近年来的研究发现,O-GlcNAc糖基化修饰扮演着促炎和抗炎的两面性。异常的O-GlcNAc糖基化修饰水平与炎症细胞的活化、细胞因子的产生以及免疫耐受的破坏有关。这些变化可能导致免疫系统过度激活,攻击自身组织,引发疾病。例如骨关节炎就与软骨细胞中高水平的O-GlcNAc糖基化修饰水平相关,IL-1α刺激导致软骨细胞中O-GlcNAc糖基化修饰以及OGT和OGA合成迅速增加[79]。如前所述,IL-17是由Th17细胞分泌的炎性细胞因子,而IL-17的产生与初始CD4+T细胞中蛋白质O-GlcNAc糖基化修饰水平的升高相关联[66]。持续的炎症可能会诱导出现自身免疫疾病,这是一种由免疫系统损害自身组织的慢性病症[80],在系统性红斑狼疮女性患者体内,T细胞表现出OGT表达水平升高和OGT基因去甲基化的特点[81]。
慢性炎症是癌症发生的重要诱因之一。值得注意的是,肿瘤细胞通常表现出异常高水平的O-GlcNAc糖基化修饰,以此增强肿瘤细胞的增殖、存活和免疫逃逸[82]。例如,O-GlcNAc糖基化修饰通过影响肿瘤细胞中程序性细胞死亡配体1(programmed cell death 1 ligand 1,PD-L1)在细胞内的转运,阻碍PD-L1的溶酶体途径降解,以此增强肿瘤免疫逃逸[83]。另一方面,肿瘤细胞主动释放包含OGT的外泌体,提高邻近CD8+T细胞中OGT含量,促进CD8+T细胞上程序性细胞死亡受体1(programmed cell death 1,PD-1)的表达,从而使自身免于CD8+T细胞毒性伤害[84]。一些关键转录因子上O-GlcNAc糖基化修饰状态的改变往往促进肿瘤的发生。例如转录因子叉头框A1(forkhead box A1,FOXA1)上的O-GlcNAc糖基化修饰促进了其与染色质的组装,通过协调多种转移调节因子的转录来促进乳腺癌转移[85]。肿瘤细胞还会在特定细胞因子刺激下改变自身代谢状态,以维持自身增殖或实现迁移。IL-8刺激的结肠癌和肺癌细胞对葡萄糖的摄取,以及葡萄糖转运蛋白3、葡萄糖胺果糖-6-磷酸转氨酶(fructose-6-phosphate aminotransferase,GFAT)的表达相应增强,从而提高肿瘤干细胞中的O-GlcNAc糖基化修饰水平,维持其干性[86]。转化生长因子β1通过增强GFAT的稳定性诱导染色质重塑酶MORC家族CW锌指蛋白2(MORC family CW-type zinc finger 2,MORC2)被O-GlcNAc糖基化修饰,介导乳腺癌细胞迁移和侵袭[87]。此外,肿瘤微环境中的免疫细胞,如巨噬细胞,也会受到O-GlcNAc糖基化修饰的调控,进而影响它们对肿瘤的识别和清除[88]。高糖条件下,巨噬细胞中O-GlcNAc糖基化修饰水平的增加驱动其极化为支持肿瘤发展的M2样表型[30],并促进组织蛋白酶B(cathepsin B)在溶酶体中的成熟,从巨噬细胞释放到肿瘤微环境,促进肿瘤细胞的转移[89]。这些结果表明,肿瘤细胞利用O-GlcNAc糖基化修饰作为免疫逃避的直接手段,肿瘤微环境中的高O-GlcNAc糖基化水平对免疫细胞的抗肿瘤反应是明显不利的。
5 问题与展望
O-GlcNAc糖基化修饰在免疫细胞的活化、增殖和分化过程中,以及在肿瘤免疫和炎症反应中的调节,仍使我们对此缺乏系统性的认识,有些关键问题值得深入探究:(1)该修饰在不同细胞类型及环境刺激下表现出多样的调控效果,表明O-GlcNAc糖基化修饰可能是一种组织和细胞特异性的修饰形式。在以往的研究中,研究人员多从OGT催化底物的O-GlcNAc糖基化修饰,进而影响信号转导的角度解释了许多免疫响应的分子机制,而对于OGT/OGA自身表达和活性的调控缺乏认识。面对不同的免疫信号分子,O-GlcNAc糖基化修饰的蛋白质组发生怎样的动态变化,以及细胞如何协调OGT/OGA表达或酶活以维持O-GlcNAc糖基化修饰水平的稳态;(2)OGT/OGA在不同时空靶向众多蛋白质底物的识别机制;(3)O-GlcNAc糖基化修饰与其他蛋白质翻译后修饰之间的相互串扰对于调控免疫反应具有重要意义,这些串扰的潜在机制有待探索。例如O-GlcNAc糖基化修饰何时占据主导,如何调节与磷酸化、泛素化等修饰的平衡等。
由于O-GlcNAc糖基化修饰本身分子量小且不带电荷,在质谱检测中容易被打断导致信号丢失,而且O-GlcNAc糖基化修饰具有瞬时性和动态性,致使其更加难以富集和捕捉。近年来发展出的一些有效的O-GlcNAc糖基化修饰富集和鉴定方法[90-92],将有助于我们对于O-GlcNAc糖基化修饰在免疫系统中的作用机制进行深入研究。总而言之,O-GlcNAc糖基化修饰作为一种重要的翻译后修饰,其广泛参与到了免疫反应的各个环节。深入研究O-GlcNAc糖基化修饰与免疫系统之间的联系,将有助于揭示机体免疫的调节机制,并为相关疾病的治疗提供新的潜在靶点和策略。