O-连接-N-乙酰葡糖胺糖基化蛋白质的富集方法
2024-04-23孟领航王佳佳
孟领航, 张 威, 王佳佳
(河南大学抗体药物开发技术国家地方联合工程实验室,河南, 开封 475000)
蛋白质翻译后修饰是维持生命活动的重要过程,包括磷酸化、乙酰化和甲基化等多种类型,其中糖基化也是重要的一种类型。糖基化是指糖类与蛋白质和脂质的共价连接,是结构最多样化的翻译后修饰,常见参与蛋白质糖基化的单糖有 9 种:葡萄糖(glucose, Glc)、半乳糖(galactose, Gal)、甘露糖(mannose,Man)、N-乙酰半乳糖胺(N-acetylgalactosamine,GalNAc)、N-乙酰葡糖胺(N-acetylglucosamine,GlcNAc)、 葡萄糖醛酸(glucuronic acid, GlcA)、木糖(xylose, Xyl)、岩藻糖(fucose,Fuc)和N-乙酰神经氨酸(N-acetylneuraminicacid,NeuAc)。根据糖与蛋白质的连接方式不同可将蛋白聚糖分为N-连接型聚糖(N-linked glycan)和O-连接性聚糖(O-linked glycan)。本文主要围绕一种简单的单糖修饰O-GlcNAc修饰进行综述。
1 O-连接-N-乙酰葡糖胺糖基化
O-GlcNAc 糖基化是一种在原核生物和真核生物中广泛存在的糖基化形式。己糖胺生物合成途径(hexosamine biosynthetic pathway, HBP,Fig.1)是O-GlcNAc 修饰蛋白质的主要生物来源,虽然进入细胞的大部分葡萄糖是通过糖酵解代谢为机体提供能量,但有 2%~5%的葡萄糖会被分流到 HBP,以细胞内的 L-谷氨酰胺(L-glutamine)、乙酰辅酶 A(acetyl-CoA)和三磷酸尿苷(uridinetriphosphate,UTP)为原料,在 6-磷酸果糖氨基转移酶(glutamine--fructose-6-phosphate aminotransferase,GFAT)等酶的作用下合成糖基供体 UDP-GlcNAc。与其他O-和N-糖修饰不同,O-GlcNAc 糖基化修饰特别之处在于:(1)O-GlcNAc 修饰是将 GlcNAc 单糖分子以β-O 的连接方式附着在细胞核、细胞质和线粒体蛋白质的丝氨酸或苏氨酸残基上[1-3],由于与蛋白质磷酸化的修饰位点相同,两种修饰形式之间存在互相拮抗或促进的阴阳关系[4];(2)O-GlcNAc 修饰是一个高度动态的过程,蛋白质中O-GlcNAc 的添加和去除是通过在真核生物中高度保守的 2 种紧密调控的酶的作用而维持,这种可逆的修饰确保细胞中O-GlcNAc 水平保持平衡。其中,O-GlcNAc 转移酶(O-GlcNActransferase,OGT)将 HBP 通路合成的 UDP-GlcNAc 作为供体连接到目的蛋白质[5,6],而水解酶O-GlcNAcase(OGA)主要负责去除底物中的O-GlcNAc[7, 8](Fig.1)。
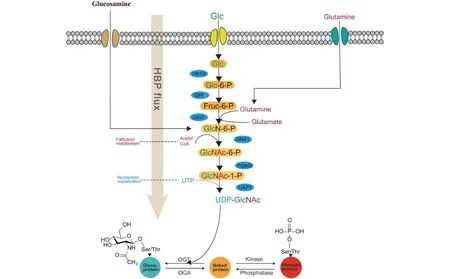
Fig.1 Hexosamine-biosynthesis pathway in vivo UDP-GlcNAc is de novo synthesized from HBP, which is linked with glucose metabolism, fatty acid metabolism, amino acid metabolism, and nucleotide metabolism. The generated products of UDP-GlcNAc is transferred by OGT onto Ser/Thr residues of target proteins and removed by OGA
O-GlcNAc 修饰广泛存在于哺乳动物细胞中,且在细胞的生命活动中起发挥至关重要的调节作用[9,10],目前已证明,该修饰与糖尿病、癌症[11]、信号传递[12,13]、应激反应[14]、抑郁和神经衰退性疾病等密切相关[15]。O-GlcNAc 糖基化修饰蛋白质是一个重要的营养传感器,广泛调控重要的生理过程,例如在Ⅱ型糖尿病中矿化皮质激素受体(mineralocorticoid receptor,MR)的O-GlcNAc 糖基化修饰会增加高糖条件下受体的转录活性[16]。其次,越来越多的证据表明,O-GlcNAc 修饰对癌症的进展发挥促进作用,并且肿瘤细胞内的 OGT 和O-GlcNAc 糖基化水平比正常细胞要高,例如,O-GlcNAc 修饰可通过调节谷氨酰胺途径的关键酶苹果酸脱氢酶 1(malate dehydrogenase 1,MDH1)的活性,或上调烟酰胺腺嘌呤二核苷酸(NAD+)依赖的去乙酰化酶 sirtuin 家族成员 SIRT7 的表达来促进胰腺导管腺癌的生长[17, 18],同时有研究表明,苏氨酸蛋白激酶(threonine-protein kinase,PLK1)的O-GlcNAc 修饰通过影响其有丝分裂功能进而促进肿瘤的发生发展[19]。另外,O-GlcNAc 修饰还可以在肿瘤的“Warburg 效应”中发挥直接作用,例如磷酸甘油酸激酶 1(phosphoglycerate kinase 1,PGK1)的 T255O-GlcNAc 修饰会促进糖酵解,降低三羧酸循环,进而促进肿瘤发生[20]。此外,OGT 作为一种营养感应酶在细胞间信息传递中发挥重要作用[21],有研究表明,酪氨酸激酶底物的O-GlcNAc 修饰会抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)在腔内的分选以及溶酶体内的降解,导致 EGFR 的积累,延长 EGFR 在细胞中的信号传导[22]。
2 O-连接-N-乙酰葡糖胺糖基化修饰蛋白质的富集方法
尽管O-GlcNAc 糖基化修饰在生物体内发挥着重要功能,然而因为其修饰位点鉴定比较困难,相关领域的研究仍存在瓶颈,其主要原因有:首先,O-GlcNAc 糖基化是一种动态的、低丰度和亚化学计量的修饰;其次,GlcNAc 糖苷键不稳定,无论是酶法还是化学方法,在标准质谱检测中很容易脱落,同时O-GlcNAc 修饰肽的离子信号会被大量未修饰的离子信号掩盖而被抑制;此外,由于 OGT 识别缺乏明确的一致序列,使得仅基于一级序列的体内修饰位点的特异性确定困难。为了更深入研究O-GlcNAc 修饰蛋白质,多年来已经开发了多种方法用于检测O-GlcNAc 的位点定位,已鉴定超过 5 000 个人类O- GlcNAc 糖基化蛋白质和 7 000 个糖基化位点[23]。下面本文将介绍多种策略在体外和体内富集和检测O- GlcNAc 糖蛋白质方面的应用、优势和局限性。
2.1 抗体和凝集素法
抗体是研究生物大分子相关修饰的重要工具,目前,已有几种能够检测胞质和核提取物中的商业化O-GlcNAc 抗体。利用 Western 印迹通过泛特异性O-GlcNAc 单克隆抗体 RL2(一种针对O-GlcNAc 修饰的糖基化核孔蛋白片段 IgG 型抗体)[24]和 CTD110.6(一种 IgM 类抗体,使用合成的 RNA 聚合酶 II C 端 O-GlcNAcylation 重复序列作为免疫原)[25],已经鉴定了许多O-GlcNAc 修饰蛋白质。然而,由于这些抗体特异性有限,存在交叉反应性以及结合亲和力相对较低等问题[26],单个修饰的、低丰度的O- GlcNAc 修饰蛋白质的检测仍存在困难。其次,一些抗O-GlcNAc 小鼠单克隆抗体可以特异性识别末端O-GlcNAc 结构,例如 HGAC39 和 85[27],10D8[28], 以及 3 种使用合成的O-GlcNAc 糖肽类抗原开发的IgG 单克隆抗体(18B10.C7(#3)、9D1.E4(#10)和 1F5.D6(#14))[29],IgM CTD110.6、IgG 单抗18B10.C7(#3)和 9D1.E4(#10)可以特异性地检测细胞表面糖蛋白质的 GlcNAc 修饰,这些抗体与 1F5.D6(#14)混合也能够结合N-糖的末端 β-GlcNAc[30, 31]。此外,还有一些位点特异性的O-GlcNAc 抗体,例如针对特定蛋白质中独特的O-GlcNAc 表位,包括 c-Myc(Thr58)[32],Tau 蛋白(Ser400)[33],组蛋白H2A(Ser40、Thr101)[34]和 TAB1(Ser395)[35]等,这些抗体让我们对O-GlcNAc 修饰蛋白质功能的研究更加精确。这些抗体能用于检测O-GlcNAc 修饰蛋白质,但仍需开发更多的O-GlcNAc 特异性 IgG 抗体,对O-GlcNAc 修饰蛋白质进行更深入地研究。
植物凝集素作为天然的糖物质结合蛋白质,已长期用于识别O-GlcNAc 修饰蛋白质的研究,特别是小麦胚芽凝集素(wheat germ agglutinin,WGA)。WGA 不仅可以结合细胞内的O-GlcNAc 修饰蛋白质,而且可以结合N-乙酰神经氨酸(N-Acetylneuraminic acid ,Neu5Ac)和糖聚合物以及低聚糖上的末端GlcNAc 残基[36]。琥珀酰化的 WGA(sWGA)对O-GlcNAc 的特异性更高,但它也降低了未修饰的 WGA 的亲和力,所以这种凝集素仅作为纯化和免疫印迹的富集工具[37]。最近,来源于真菌的其他凝集素已被鉴定出对O-GlcNAc 有更强的亲和力[38],这可能也为后续O-GlcNAc 修饰蛋白质的鉴定提供新的工具。但由于植物凝集素的局限性,其只能作为O-GlcNAc 修饰蛋白质的广谱性探针,无法特异性标记O- GlcNAc 修饰蛋白质。
2.2 化学酶法
化学酶法是对O-GlcNAc 修饰的体外间接标记,不会干扰体内代谢途径,可以标记细胞生理过程中自然发生的O-GlcNAc 修饰。检测细胞中O-GlcNAc 修饰的经典化学酶法策略依赖于 β-1,4-半乳糖基转移酶(β-1,4-galaetosyltransferase,GalT)。GalT 可以 UDP-[3H]-半乳糖为供体,将[3H]-半乳糖标记在糖蛋白末端O-GlcNAc 残基的 C4-羟基上。由于这种方法需要处理放射性物质,因此不适合常规应用。Hsieh-Wilson 课题组构建了 GalT 的突变体 GalTY289L[39],该突变体具有更大的活性位点,能够容纳 C2 修饰的半乳糖类似物,能将 2-酮-半乳糖残基从相应的非天然糖核苷酸转移到末端的O-GlcNAc 残基,且不影响酶的特异性和催化效率[40],研究者运用该策略发现,苹果酸脱氢酶和受体酪氨酸激酶底物的O-GlcNAc 修饰可以调控肿瘤生长[41, 42]。化学酶法还能够以非天然酮基为化学把手标记O-GlcNAc 修饰的蛋白质,随后,通过肟与氨基氧功能化的生物素探针与非天然酮基连接,再通过化学发光法检测目的蛋白质。这种生物素标记策略可以从细胞裂解液中富集O-GlcNAc 修饰蛋白质并进行蛋白质组学分析,最终,在哺乳动物大脑中鉴定到多种功能和多样的O-GlcNAc 修饰蛋白质,进一步揭示了这种修饰在调节神经元功能中发挥了关键作用[43]。此外,化学酶法还可以对不同预处理的细胞进行酮生物素标记,然后通过还原胺化将轻/重甲基掺入肽的胺中,通过相对定量质谱分析检测大脑中动态的O-GlcNAc 修饰位点[44]。Hsieh-Wilson 课题组进一步扩展了该工具的使用范围,使用了另一种含叠氮化物的半乳糖胺供体(UDP-GalNAz),该供体对 GalT(Y289L)耐受良好,可以将非天然的 UDP-GalNAz 转移到O-GlcNAc修饰蛋白质上,与相应的氨基氧基标记相比,这种改进的策略使炔基生物素和荧光探针能够更敏感、更快速和更特异性的进行点击化学反应标记,并直接用于细胞内的凝胶内荧光检测和O-GlcNAc 糖基化蛋白组学鉴定[45]。这种先进的化学酶学策略被用于检测和验证神经系统和代谢中许多重要调节蛋白质的O- GlcNAc 修饰,例如,在缺氧条件下磷酸化磷酸果糖激酶 1(6-phosphofructokinase1,PFK1)的 Ser529 位点动态糖基化,可以作为与体内癌细胞生长相关的葡萄糖代谢的关键代谢调节因子[46]。以上化学酶法标记策略通常为两步法,近期浙江大学易文教授团队研究发现,K279A 突变体可以识别 2 位生物素修饰的 UDP-GalNAc,并以此为底物开发了一种一步法标记O-GlcNAc 糖基化蛋白质的策略[47]。这些化学酶方法已广泛应用于细胞水平的O-GlcNAc 糖基化,该方法主要针对变性蛋白质样本,不太适用于体内天然的和完全折叠的蛋白质。然而,工程酶和非天然底物的使用,可能会导致酶的底物偏好和识别所固有的特异性以及反应性问题,同时也可以改变细胞代谢途径,可能提供不完整、不准确和/或非生理相关的信息。因此,对于更有效的O-GlcNAc 修饰蛋白质的鉴定和位点定位,化学酶学方法仍有需提高的空间来解读它们的功能作用和分子机制。
2.3 亲水作用液相色谱法(hydrophilic interaction chromatography,HILIC)
亲水作用液相色谱是一种出色的色谱技术,其利用O-GlcNAc 修饰蛋白质中的羟基与固定相(例如胺、酰胺或齐聚物键合硅胶)之间的亲水/极性/氢相互作用,有效地保留和分离糖与蛋白质分子。HILIC 已成为富集糖肽的有力工具[48]。近些年,有利用选择性酶解和亲水性微粒提高富集效果的方法,该方法包括两个步骤:(1)利用 PNGase F(peptide:N-glycosidase F)、唾液酸酶和O-糖苷酶移除N-聚糖和O- 聚糖;(2)用表面引发原子转移自由基聚合(SI-ATPR)合成的新型 HILIC 材料亲水性聚合物,修饰二氧化硅微颗粒(pPEGMA-SMs),可与O-GlcNAc 修饰蛋白质高度特异性结合。该材料主要使用聚乙二醇甲基丙烯酸酯(poly(ethylene glycol) methacrylate,PEGMA)合成亲水固定相,并在其表面沿羟基基团密集堆积,从而使其与O-GlcNAc 修饰蛋白质结合[49]。与传统的 HILIC 材料相比,这种材料主要使用聚乙二醇甲基丙烯酸酯合成亲水固定相,其表面沿 PEGMA 聚合物刷密集堆积的羟基,提供了更高的亲水性和更强的氢键相互作用。利用这种方法分析人体尿液中的O-GlcNAc 修饰蛋白质发现,从 457 个蛋白质中鉴定出了 474 个O-GlcNAc 修饰蛋白质。虽然这种方法很有效果,但它无法区分肿瘤组织中含量较高的O-GalNAc 修饰蛋白质。最近,氮氧化物接枝纳米球在O-GlcNAc 分析中显示氢键相互作用显著增强,对来自 PNAC-1 细胞的O-GlcNAc 修饰蛋白质进行了位点特异性分析,从 183 个糖蛋白中又发现了197 个O-GlcNAc 位点,这表明O-GlcNAc 修饰的高通量鉴定是成功的[50]。关于富集O-GlcNAc 修饰蛋白质的效果,仍需要进一步严格评估。
2.4 非天然糖代谢标记策略
为了克服上述在检测O-GlcNAc 修饰蛋白质时的特异性和效率方面的限制以及细胞毒性问题,人们开发了一种糖代谢标记策略用于标记聚糖。糖代谢标记(metabolic glycan labeling, MGL)是将叠氮或者炔基等基团修饰天然糖,该类修饰在不影响细胞正常代谢功能的前提下可以经由相应的代谢通路标记到聚糖结构中,随后与互补的生物正交反应基团进行反应,通过引入荧光基团或者生物素等基团,实现示踪定位和目标蛋白质富集等目的[51],常用的报告基团有叠氮[52]、酮[40, 43]、炔[53]和异腈[54]等。前文提到,HBP 是细胞内合成 UDP-GlcNAc 的主要来源,此外,该底物还可以通过 GlcNAc 和 GalNAc 补救途径生成。首先,细胞内不被降解的 GlcNAc(例如,来自溶酶体对糖共轭物的降解或营养成分的降解)和细胞外摄入的 GlcNAc 可以直接被 GlcNAc 激酶(N-acetyl-D-glucosamine kinase,NAGK)和磷酸乙酰葡糖胺变位酶(phosphoacetylglucosamine mutase,PGM3)先后发生 6 位磷酸化和 1 位磷酸化,最后经 UDP-N-乙酰己糖胺焦磷酸化酶(UDP-N-acetylhexosamine pyrophosphorylase,AGX1/2)有效地转化为 UDP- GlcNAc(Fig.2)。同时还存在另外一条 GalNAc 补救途径,即 GalNAc 进入细胞后可以经由N-乙酰半乳糖胺激酶(N-acetylgalactosamine kinase,GALK2)和 AGX1/2 生成 UDP-GalNAc,随后,经 UDP-半乳糖-4-异构酶(UDP-glucose 4-epimerase,GALE)将其转变为 UDP-GlcNAc 进而被 OGT 识别和利用。目前,人们发现 OGT 对底物具有较高的容忍度,可以识别多种结构修饰的 UDP-GlcNAc 衍生物[55]。由于 OGT 的这一特性,使得各种乙酰化修饰的 GlcNAc 衍生物有成为化学报告标签的可能,这些报告标签在进入细胞后被代谢加工成非自然的 UDP 糖供体,通过 OGT 转移标记目标蛋白质。Bertozzi 团队于 2003 年报道了第一个用于O-GlcNAc 糖基化标记的探针 2-叠氮乙酰氨基-2-脱氧吡喃葡萄糖(Ac4GlcNAz)[52],该课题组将生物惰性叠氮基团引入到 GlcNAc 乙酰氨基部分得到目标分子 Ac4GlcNAz,该分子可以通过GlcNAc 补救途径的生物合成酶生成 UDP-GlcNAz,进而被 OGT 识别并用该非天然的糖供体将 GlcNAz 代谢到丝氨酸/苏氨酸残基中,从而产生含有叠氮标签标记的蛋白质,再通过生物正交反应(staudinger 或者 CuAAC)进一步检测该非天然糖的细胞分布和位点功能鉴定[56-58]。
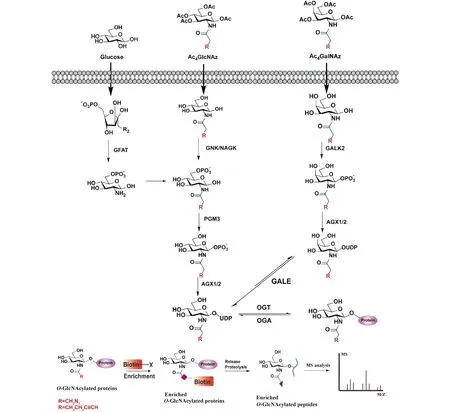
Fig.2 Different biosynthetic pathways of GlcNAc and workflow for labeled proteomic analysis Three pathways for synthesis of GlcNAc, including de novo hexosamine biosynthetic pathway (left), GlcNAc salvage pathway (center), GalNAc salvage pathway (right); The generated UDP-GlcNAc could be recognized by OGT for O-GlcNAc modification. General workflow for proteomic analysis after metabolic labeling and enrichment
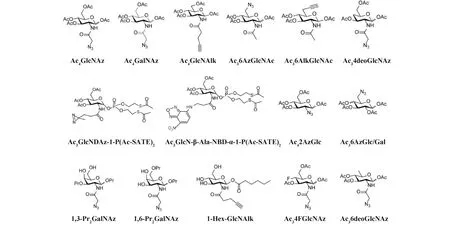
Fig.3 MCRs have been reported for labeling and identification of O-GlcNAc modified proteins MCRs equipped with a bioorthogonal chemical handle is incubated with cells. Once inside the cells, the MCRs are processed by the enzymes in biosynthetic pathway and the generated UDP-sugars bearing the chemical handle can be recognized and incorporated into glycan-modified proteins, which will be utilized for visualization or affinity purification through bioorthogonal reaction with fluorescent dyes or biotin
由于 GlcNAc 补救途径中限速酶 AGX1 的影响,Ac4GlcNAz 代谢标记效率较低,且存在非特异性糖基化标记。前期研究表明,GlcNAz 不仅被代谢入细胞内的O-GlcNAc 修饰蛋白质中,而且还直接掺入N-链聚糖的核心五糖中[59]。此外,由于 UDP-GlcNAc 可以通过 UDP-半乳糖-4-异构酶(GALE)相互转化为 UDP-GalNAc,相应的 GlcNAz 也可以交替地并入粘蛋白型O-聚糖[60],进一步降低了标记的特异性和效率。基于此,Bertozzi 团队设计合成了另外一种分子探针 Ac4GalNAz,该分子经与细胞共孵育后,可以通过 GalNAc 补救途径中的酶代谢合成 UDP-GalNAz,并由 GALE 异构合成 UDP-GlcNAz,且其比Ac4GlcNAz 对O-GlcNAc 修饰蛋白质标记效果更强烈[61]。尽管 Ac4GalNAz 也会被代谢标记到细胞表面的O-/N-糖链结构产生较高的背景信号,然而该探针仍是目前富集O-GlcNAc 修饰蛋白质和位点鉴定的主要手段[62]。
此外,Pratt 课题组在 2-乙酰基位置引入炔基制备得到 Ac4GlcNAlk,结果表明,GlcNAlk 能够以与GlcNAz 相似的速率从目标蛋白质中添加和去除,并且不容易通过 GALE 相互转化为 GalNAlk,导致标记的O-链粘蛋白糖蛋白水平较低。与 Ac4GlcNAz 和 Ac4GalNAz 相比,Ac4GlcNAlk 是一个更具特异性的O-GlcNAcylation 报告探针,使用此探针并结合生物正交标记,使用可切割的生物素亲和标签共鉴定到 374 个O-GlcNAc 修饰蛋白质,其中大多数以前未报道过(例如,泛素连接酶 NEDD4-1)[63]。然而,Ac4GlcNAlk 仍然会被整合到N-糖链中,导致其不能成为完全特异性的O-GlcNAcylation 报告探针。此后,该课题组在 GlcNAc 的 6 位引入叠氮基团制备获得 Ac36AzGlcNAc[64]。研究发现,该分子由于 C6 羟基被叠氮基取代不能发生 6 位磷酸化,因此,该化合物不能通过典型的 GlcNAc 补救途径生物合成相应的 UDP-糖供体,作者进一步研究表明,6AzGlcNAc 可以通过 C1-羟基直接磷酸化来绕过这个最初的生物合成步骤,然后回到挽救途径通过 AGX1 得到相应的 UDP-6AzGlcNAc,最终被 OGT 识别用于O- 6AzGlcNAcylation;随后使用全乙酰化的 6AzGlcNAc、GlcNAz 和 GalNAz 进行蛋白质组学研究,结果差异表明,与 GlcNAz 和 GalNAz 相比,6AzGlcNAc 对O-GlcNAc 修饰蛋白质具有高度特异性,几乎不标记其他类型的聚糖结构[64]。2017 年,该课题组将6 位的叠氮基团替换为炔基,命名为 Ac36AlkGlcNAc[65]。运用 Ac36AlkGlcNAc 进行化学蛋白质组学分析可以鉴定到更多潜在的O-GlcNAc 修饰蛋白质(包括caspases-3 和-8),表明其具有更高的效率和选择性。为了避免糖探针在其他糖链结构的非特异性标记,基于 GlcNAc 和 GalNAc 在其他糖链结构中多以β-1,4 糖苷键连接,我们课题组前期开发了 4 位脱氧的小分子探针 Ac34deoGlcNAz,以提高探针的特异性,结果表明,该探针可以减少在细胞膜上的标记且所标记蛋白质约 98%为胞内蛋白质,显示出较高的特异性[66]。随着人们对探针功能的期望越来越高,基于不同目的的各种修饰应运而生,例如在 GlcNAc 的 2 位引入双吖丙啶基团得到 Ac3GlcNDAz-1-P(Ac- SATE)2,通过生物合成可以得到O-GlcNDAz 修饰蛋白质,经紫外线照射产生碳自由基可以与修饰蛋白质相互作用蛋白质的近端结合发生光交联[67],实现O-GlcNAc 糖蛋白质相互作用蛋白质的捕获和鉴定目的。Vocadlo 团队在 GlcNAc 的 2 位引入一个荧光基团香豆素,并制备获得自带荧光的分子探针Glucosamine-nitrobenzoxadiazole(GlcN-NBD),该分子可以直接实现细胞内O-GlcNAc 糖基化修饰的可视化,并通过双荧光脉冲等实验验证了该探针对O-GlcNAc 标记的特异性。此外,其他非N-乙酰胺基葡萄糖单糖,例如 2-和 6-叠氮基团修饰的葡萄糖和半乳糖类似物(2AzGlc/GlcAz 和 6AzGlc/6AzGal)[68- 70],其相应的 UDP-糖结构也可以被 OGT 识别并进行标记。
2018 年北京大学陈兴教授团队发现,全乙酰化非天然糖容易与细胞内的半胱氨酸残基发生非酶介导的副反应,将会干扰其正常代谢且导致O-GlcNAc 糖基化蛋白组学鉴定的假阳性[71]。这种非酶介导的副反应,称为 S-连接的糖基化修饰,其发生机制为全乙酰化的非天然糖进入细胞后,当 1 位羟基优先裸露时碱性条件下容易发生 β-消除形成 α,β 不饱和醛,进而与含巯基的蛋白质发生迈克尔加成反应得到3 位取代的 S-糖基化副产物[72]。在此基础上,该课题组先后报道了 2 种改进的非天然糖 1,3-Pr2GalNAz[73]和 1,6-Pr2GalNAz[72]。利用这种新型的非天然糖,作者在小鼠胚胎干细胞中发现 ESRRB(estrogen related receptor beta)(Ser25)可发生O-GlcNAc 糖基化,且在干细胞的再生和多能性中发挥关键作用。此外,鉴于糖环结构中 3,4 位乙酰基的保护会促使 β-消除介导的 S-连接糖的副反应,Pratt 课题组仅在 GlcNAlk 结构的 1 位引入己烷链得到 1-Hex-GlcNAlk,其中较长的烷烃链结构可以平衡非天然糖的脂水分配系数,由此可以协助探针跨膜进而提高代谢标记效率[74]。此外,本课题组长期致力于新型O-GlcNAc 糖基化探针的开发,先后合成了 Ac34deoGlcNAz[75],Ac34FGlcNAz[76]和 Ac36deoGlcNAz[77]3 种探针,研究结果表明,糖环上不同位置的修饰均可以显著降低 S-糖修饰水平,此外,通过 Western 印迹和蛋白组学等多种方法证明,这 3 种探针对细胞内的O-GlcNAc 糖基化修饰具有较高的选择性,并且仍保留较高的标记效率。
目前所报道的探针主要集中在细胞层面,而肿瘤微环境中细胞之间的复杂相互作用会影响蛋白质的表达修饰和功能,因此,研究自然状态下活体肿瘤组织中糖基化蛋白质修饰的动态变化更具有临床价值。已有研究报道,O-GlcNAc 糖基化不仅直接参与调控肿瘤的增殖和凋亡等,而且会影响肿瘤微环境中 T细胞、巨噬细胞等免疫细胞的活化及其对肿瘤的调控[78, 79]。更重要的是,部分蛋白质的O-GlcNAc 糖基化只有在低氧[80]、IL-8 浸润[81]等特定肿瘤微环境中发生。因此,探究肿瘤组织中O-GlcNAc 糖基化修饰蛋白质动态变化才能如实反映肿瘤发生发展的调控机制。Bertozzi 团队首次将新鲜的人前列腺正常组织和肿瘤组织切片与 Ac4ManNAz 共孵育进行唾液酸代谢标记,经与生物素-炔基反应、蛋白质富集和质谱分析,发现肿瘤细胞中唾液酸修饰水平较高,其中 21 种蛋白质只在肿瘤细胞中表达(例如豆荚蛋白),并且部分蛋白质已被报道与前列腺癌的恶性发生有密切关系[82]。2022 年,陈兴教授等团队先后开发了一种可基因编码的代谢聚糖标记技术,该策略基于化学生物学“凹凸互补”原理,利用非天然糖 1,3- Pr2GlcNAl 及其匹配的焦磷酸酶突变体 AGX2 F383G 的正交组合,以小鼠心血管为模型实现对特定组织细胞的聚糖分析[83];同时 Schumann 团队利用相同的理论开发了一种糖蛋白生物正交细胞系特异性标记(BOCTAG)技术,该策略在多种细胞共培养以及小鼠模型中都可以成功标记特定位点蛋白质[84]。此外,易文教授团队利用光控激活策略,使 OGT 关键活性位点(K842)脱笼并恢复活性,在活细胞内实现对O-GlcNAc 糖基化蛋白质时空分辨的动态调控[85]。2023 年,Christina 等人构建了 4-羟基他莫昔芬(4-HT)响应的 OGA-内涵肽,活化后的 OGA 可以在细胞特定区域去糖基化,并对 MCF-7 细胞具有显著的抑制作用,该策略为时空调控生物体内的O-GlcNAc 修饰和生物学功能提供了可行性[86]。因此,基于肿瘤细胞自身特点开发高效、特异并可时空动态检测活体肿瘤内O-GlcNAc 糖基化修饰蛋白质标记技术,将为阐明糖代谢相关疾病的发病机制和靶向治疗提供突破口。
3 问题与展望
蛋白质糖基化作为一种真核生物中广泛存在的翻译后修饰,在许多生命活动中发挥重要作用。异常的糖基化修饰,包含N-/O-聚糖修饰,O-GlcNAc糖基化等,已被报道参与了多种癌症的发生发展,针对糖蛋白和聚糖的鉴定及分析对于理解糖基化修饰在肿瘤在内的多种疾病的发病机制中至关重要。由于O- GlcNAc修饰是动态、化学计量的单糖修饰,为了提高实验对象中O-GlcNAc修饰水平,过表达OGT或者添加OGA抑制剂是常用的研究策略。此外,随着糖代谢标记策略的涌现,虽然可以富集到更多特异的目的蛋白质,但是这些额外添加物是否影响细胞的正常合成代谢以及相应修饰蛋白质的生理学功能尚不清楚。因此寻求安全可靠、特异性好的富集方法是解决糖修饰蛋白质功能研究的重要途径。
近期,基于“凹凸理论”设计合成的突变转移酶和底物的特异性识别策略已成功用于O-GlcNAc[87]和O-GalNAc 修饰[88, 89],该策略通过在细胞内转入底物特异性强的转移酶载体,进而可以实现对特定细胞和组织内蛋白质的标记,具有干扰小、特异性强等特点。另外,多组学、多功能酶类等“一石多鸟”策略可以实现同时对N-连接、黏蛋白型O-连接和O-GlcNAc 修饰完整糖肽的富集及分析(Click- iG 策略)[90],或者利用特异性识别核心岩藻糖基化和O-GlcNAc 糖基化的酶、叠氮化探针分子和功能化温度敏感的富集材料,同时实现 2 种糖基化位点的精准解析[91]。这些新型策略提高了目的蛋白质的富集效率和特异性,有助于探究糖修饰在相关疾病进展中的机制研究。总之,本文综述的多种O- GlcNAc 糖基化修饰蛋白质富集方法,极大程度改善了质谱检测过程中的信噪比,进而便于精准检测分析。随着科学研究和仪器设备的不断进步,我们相信,复杂机体环境中包括O-GlcNAc 在内的糖蛋白质特异性修饰和精准鉴定一定会迎刃而解,这对阐明糖修饰在相关疾病发生发展过程中的作用至关重要,也是实现临床分子诊断并进行靶向干预的关键。