靶向编辑O-GlcNAc糖基化修饰的化学生物学技术
2024-04-23潘雅文王贞超沈大成
潘雅文, 王贞超*, 沈大成
(1)贵州大学药学院, 贵阳 550025;2)深圳湾实验室化学生物学研究所, 深圳 518132)
糖基化是最丰富和最复杂的蛋白质翻译后修饰(post-translational modification,PTM)之一,O-GlcNAc糖基化修饰作为最重要的细胞内蛋白质上的修饰之一,近年来逐渐被大家所熟识。O-GlcNAc糖基化修饰是一种单糖翻译后修饰,它是唯一发生在细胞内的参与信号转导的糖修饰,一般发生于真核细胞中数千种细胞核、细胞质和线粒体蛋白质的多个丝氨酸或苏氨酸残基上[1]。O-GlcNAc于1984年由Hart团队首次发现[2],至今人们已经在超过5 000种蛋白质上鉴定到了超过7 000个O-GlcNAc的糖基化位点[3]。在细胞中,葡萄糖代谢通过一系列的反应最终导致了己糖胺的产生,并且UDP-GlcNAc作为O-GlcNAc糖基化修饰的供体底物会通过己糖胺生物合成途径(hexosamine biosynthesis pathway, HBP)的胞外葡萄糖代谢生成,而O-GlcNAc糖基化修饰则是HBP中的最后一个环节,其过程涉及到将己糖胺连接到特定蛋白质上[4]。通过观察O-GlcNAc在细胞中的表达水平或变化,可以了解细胞的营养状态。此外,由于细胞中蛋白质的O-GlcNAc糖基化修饰及其供体底物UDP-GlcNAc的水平都会随葡萄糖、游离脂肪酸、尿苷和氨基酸谷氨酰胺的水平而波动,O-GlcNAc糖基化修饰被认为是一种营养传感器和代谢调节器[5-6]。这种动态和可逆的修饰乃是多种细胞过程的关键调节因子,如信号转导、转录、翻译和细胞骨架功能,而O-GlcNAc糖基化异常通常也与糖尿病、癌症、心血管疾病和神经退行性疾病等一系列病症有关[7]。
O-GlcNAc糖基化修饰主要由哺乳动物细胞中的2种高度保守的酶控制:O-GlcNAc转移酶(O-GlcNAc transferase, OGT)[8]用于将O-GlcNAc修饰到底物蛋白质上;O-GlcNAc水解酶(O-GlcNAcase, OGA)[9]用于将其去除。而在与O-GlcNAc功能相关的治疗应用研究中,这2种酶也成为了关键的治疗靶点[10]。此外,为了探究O-GlcNAc在靶蛋白上的功能,有时需要制备高度糖基化或去糖基化的靶蛋白质。通常,纯化的靶蛋白与OGT在体外孵育很容易提升其O-GlcNAc修饰水平,靶蛋白质也可在大肠杆菌或昆虫细胞中直接与OGT共表达[11]。然而,这些方法并不适用于一些动态的和复杂的细胞。因此,在活细胞中对靶蛋白质进行O-GlcNAc编辑对于深入研究O-GlcNAc的功能具有至关重要的意义。
目前,已经较为成熟的代谢标记和化学酶标记策略以及糖蛋白组学等可靠的检测方法为O-GlcNAc糖基化修饰的可视化和量化研究提供了便利[12]。现有的在总体范围内调节细胞中O-GlcNAc修饰水平的策略,主要集中在对糖基化底物UDP-N-乙酰基葡萄糖胺(UDP-N-acetyl-D-glucosamine, UDP-GlcNAc)[13]或对循环酶OGT和OGA的操控上。如果能在靶蛋白质甚至特定的修饰位点上对O-GlcNAc进行编辑,有望通过下游生物学影响研究该修饰的特定功能。然而,由于O-GlcNAc修饰本身的复杂性和动态性,在不干扰细胞整体O-GlcNAc水平的情况下对靶蛋白甚至特定糖基化位点进行选择性编辑仍然存在许多挑战。开发出能够有效调控O-GlcNAc修饰的技术,对于生理和病理过程中的功能分析和治疗干预至关重要。本文将重点介绍几种对于细胞中靶蛋白质上O-GlcNAc修饰进行调控的化学生物学技术方法。
1 纳米抗体导向技术
2021年,Woo课题组采用纳米抗体导向的方法,在活细胞中的靶蛋白上编辑O-GlcNAc。该技术基于工程化纳米抗体和O-GlcNAc循环酶OGT和OGA,通过引入这些工程化纳米抗体,在活细胞中募集所需靶蛋白,可以实现对细胞中靶蛋白的选择性糖基化或去糖基化的能力[14]。作者巧妙地利用纳米抗体尺寸小(<15 kD)、高度可溶和稳定,以及它们与典型IgG抗体具有相似的高亲和力和特异性等优点[15],将OGT融合到具有识别标签或内源性蛋白质靶标的纳米抗体中,实现了细胞中靶蛋白的选择性O-GlcNAc糖基化修饰。为了进一步提高蛋白质选择性并减少对非靶向底物的干扰,将全长OGT(具有13.5个识别内源性底物的螺旋-转-螺旋四肽重复序列tetratricopeptide repeat, TPR)截断为4.5个较短形式的TPRs [OGT(4)]。由于OGT(4)对内源性底物显示出较弱的转移酶活性,因此,可以通过减少O-GlcNAc糖基化修饰的脱靶效应来增强纳米抗体融合后的靶蛋白选择性。利用纳米抗体α-突触核蛋白(α-synuclein)衍生的EPEA表位[16],纳米抗体-OGT(4)选择性地增加了EPEA标记的靶蛋白上的O-GlcNAc,以及HEK-293T细胞中的内源性α-突触核蛋白。随着更多种类的靶向内源性蛋白质纳米抗体被开发,未来该系统靶向的内源性底物的范围可能会大幅度扩展[17-18]。
在此研究基础之上,该课题组还开发了一种纳米抗体融合的分裂OGA,作为活细胞中靶向蛋白质去糖基化的工具。作者利用OGA在细胞凋亡过程中可以被胱天蛋白酶3(caspase-3)切割成2个片段的特性[19],设计了于不同位点截断的N-和C-片段,该方法与OGA过表达相比可以显著降低造成非目标蛋白质去O-GlcNAc带来的潜在影响。经过一系列优化后所产生的纳米抗体融合的分裂OGA,可用于靶向去除几种O-GlcNAc糖基化蛋白质上的O-GlcNAc,而对细胞内其它蛋白质上O-GlcNAc水平的影响则被降至最低。
纳米抗体融合的OGT和分裂OGA可作为在细胞中的靶蛋白上编辑O-GlcNAc的互补工具集,用于直接观察目标蛋白质上O-GlcNAc修饰水平,还可以实现对靶蛋白的双向调控和功能评估(Fig.1A)。从长远来看,靶蛋白的糖基化和去糖基化也可能揭示了O-GlcNAc的原生功能以及其参与重连相关信号通路的新功能,类似于其他翻译后修饰,如泛素化[20]和磷酸化[21]。然而,纳米抗体融合的分裂OGA策略目前仍存在一些局限性,例如纳米抗体融合的分裂OGA系统募集必须要标记和表达靶蛋白。虽然可以通过生成靶向内源性蛋白质的纳米抗体或通过基因工程方法(例如clustered regularly interspaced short palindromic repeats, CRISPR)解决,但纳米抗体与靶蛋白的结合也可能会影响其功能。将来可以尝试进行方法改进,使其由纳米抗体融合的分裂OGA所介导的蛋白质选择性去糖基化,可以区分共翻译[22]及翻译后O-GlcNAc糖基化修饰相关功能。总而言之,通过纳米抗体导向技术可以精准地干预特定蛋白质的糖基化过程,从而影响相关的生物学功能。这种研究和应用可能对于疾病治疗和生物医学研究领域具有重要的潜在影响,尤其是对于那些与异常糖基化状态相关的疾病。通过调控蛋白质糖基化水平,这项技术有望为开发新的治疗策略提供一种创新的途径。

Fig.1 The concepts of some chemical biology techniques for targeted manipulation of O-GlcNAcylation (A) Editing of O-GlcNAc glycosylation modification on the target protein using nanobody-fused OGT and split OGA. (B) Basic principles of the genetic code expansion technique. (C) Reactivation of OGT activity by optogenetic catalysis of lysine residue degradation. (D) Site-directed mutagenesis allows engineering modification of O-GlcNAc at specific sites
2 遗传密码子扩展技术
遗传密码子扩展技术(genetic code expansion, GCE)是重新编程原生细胞翻译机制,将具有特殊物理性质或化学性质的非天然氨基酸(unnatural amino acid, UAA)整合到活细胞的蛋白质组中。GCE的基本构成包括正交氨酰-tRNA合成酶(aminoacyl tRNA synthetase, aaRS)/tRNA对和1个或多个空白密码子。由于其能够精确地控制和修饰蛋白质的结构和功能,该技术也被广泛用于在体外和体内使用正交tRNA及其合成酶将不同的UAA位点特异性地掺入靶蛋白中[23](Fig.1B)。因此,引入O-GlcNAc糖基化修饰的另一种间接策略是首先通过GCE引入反应性弹头,然后经由生物正交化学与GlcNAc部分缀合。
2022年,王磊课题组利用具有生物反应性的UAA ,即氟磺酸苯甲酰取代的赖氨酸(fluorosulfate-l-tyrosine, FSY),通过和周围的丝氨酸或苏氨酸之间进行硫-氟交换反应 [sulfur (VI)-fluoride exchange, SuFEx],在活细胞中特异性地产生反应性脱氢丙氨酸或脱氢丁氨酸。这些反应随后可与巯基糖反应,以制备糖基化蛋白质[24]。目前,已有超过200种具有独特化学、物理或生物功能基团的结构和功能多样化的UAAs被位点特异性地引入到许多细菌、酵母和哺乳动物细胞的蛋白质组中[25-27]。尽管原则上可以在细胞内使该糖链进一步糖基化,但是,目前这些策略仅采用纯化的蛋白质在体外进行,且只能生成具有人工化学键的O-GlcNAc类似物,无法确保O-GlcNAc糖基化靶蛋白的内源性。为了在细胞中共翻译产生天然O-GlcNAc修饰的丝氨酸或苏氨酸,人们试图通过GCE直接编码带O-GlcNAc修饰的氨基酸。据报道,第一个糖基化的UAA,三乙酰基-β-GlcNAc-丝氨酸,在大肠杆菌中通过一种正交的詹氏甲烷球菌酪氨酰tRNA合成酶(Methanococcusjannaschiityrosyl-tRNA synthetase, MjTyrRS)被遗传编码到肌红蛋白中[28]。虽然GCE技术已有很多应用实例[29],但迄今为止,尚未有O-GlcNAc糖基化修饰的氨基酸及其衍生物被直接整合到真核细胞的靶蛋白上的报道。UAAs的掺入在,较大程度上取决于翻译机制对相应的氨基化tRNA的耐受性[30]。此外,任何由UAA掺入引起的影响也可能是表达水平改变的结果。在非预期氨基酸的错误结合代替内源性终止密码子的情况下,也可能观察到其他脱靶效应,导致表型发生变化,GCE在未来的一个优化方向就是如何解决上述问题。
3 正交赖氨酸光笼策略
基于遗传密码子扩展技术及光激活策略的发展[31-32],易文课题组在2022年利用生物正交赖氨酸光笼策略创建了一种基因编码的光敏基团保护的赖氨酸,用于临时使O-GlcNAc转移酶(OGT)失活,再通过光照来去除保护基团,重新激活OGT的活性[33](见Fig.1C)。研究人员首先合成光敏化合物DOMONBK,将对应于OGT蛋白的K842位点的密码子突变为琥珀抑制密码子TAG,再在HEK 293T细胞中共表达吡咯赖氨酰-tRNA合成酶对(pyrrolysyl-tRNA synthetase/tRNA pairs, PylRS/tRNA)。通过质谱分析验证了非天然氨基酸成功地被内插到OGT蛋白中,携带光敏保护基的OGT蛋白仅在光照后显示出极高的活性。研究将该激活策略应用于控制成纤维细胞的形态收缩,并且主要在细胞质中实现了OGT活性的空间激活。
该研究方法为时空精确控制细胞内的O-GlcNAc糖基化修饰水平提供了有价值的工具,有助于更好地理解O-GlcNAc糖基化修饰的功能,显示了其在调控蛋白质功能以及在疾病中的潜在作用。通过利用光激活脱笼策略来操纵蛋白质功能,为研究O-GlcNAc及其在细胞过程中的功能做出了贡献。但是该策略也具有一定局限性,主要表现在光敏基团的稳定性以及光照条件的限制等方面。生物正交赖氨酸光笼策略需要使用光敏基团来临时解除融合蛋白质的活性,但光敏基团的稳定性可能受到光照环境、细胞内氧化还原状态等因素的影响。有时光敏基团不够稳定,会影响相关研究结果的可靠性。这可能限制了该策略在某些特定场景下的应用,例如在体内或组织深处进行研究时可能无法进行有效的紫外光照。
4 定点突变技术
基于质谱法提供糖位点图谱时,功能缺失突变是在培养细胞中探测位点特异性O-GlcNAc糖基化的最常用方法,例如将丝氨酸(serine, Ser)和苏氨酸(threonine, Thr)突变为丙氨酸(alanine, Ala),以永久性地抑制此处的O-GlcNAc糖基化[34-35]。该方法易于在过表达或内源性底物上进行,从而提供无修饰的蛋白质对照用于功能比较。尽管如此,Ser/Thr突变为Ala无法等价于天然未修饰的靶蛋白产生的表型[35]。对于磷酸和O-GlcNAc占据相同位点的蛋白质,该突变也破坏了潜在的磷酸化可能性[36]。
2020年,van Aalten小组报道了一种遗传基因重新编码的方法,将1个不可水解的GlcNAc硫苷化修饰(S-GlcNAc)位点特异性地安装在活细胞中的靶蛋白内[37](见Fig.1D)。半胱氨酸(cysteine, Cys)的GlcNAc硫苷化修饰是哺乳动物细胞中的一种稳定PTM,其可以通过OGT安装,但不能被OGA水解[38-39]。通过利用OGT修饰半胱氨酸的能力,只需将已知糖苷上的Ser/Thr突变为Cys,就可以在体外和体内实现稳定的S-GlcNAc修饰。利用CRISPR-Cas9技术,作者通过基因编码了一种具有S405C突变的内源性OGA,由于S-GlcNAc糖基化的不可水解性,导致GlcNAc糖基化水平升高70%。高S-GlcNAc糖基化的OGAS405C显示出显著降低的半衰期,也表明了GlcNAc糖基化对OGA稳定性的影响。这种方法既不需要过度表达GlcNAc糖基化加工酶,也不需要化学抑制剂的处理,并且极大地减少了对GlcNAc糖基化蛋白质组的整体影响。与Ser/Thr 突变为Ala一样,在复杂的体内环境下,可以通过对内源性蛋白质进行常见的重组蛋白分子生物学技术加工或CRISPR-Cas9基因编辑来完成Cys突变。这种直接在哺乳动物细胞中靶蛋白内引入GlcNAc糖基化修饰的位点特异性方法,也易于拓展到糖基化位点已知的其他靶蛋白质。
尽管定点诱变用于评估靶蛋白上特定糖位点的贡献具有优势,但仍存在一些问题。其一,Ser/Thr突变为Cys技术可能并不适用于具有多O-GlcNAc糖基化位点的蛋白质,或不能通过OGA抑制而升高其O-GlcNAc化学计量的糖位点。其二,该方法需要事先鉴定糖基化位点,这本身就是一个技术难点[40-42]。
5 O-GlcNAc水解酶结构域突变重组技术
OGA是唯一一种能够从多种蛋白质上去除O-GlcNAc糖基化修饰的酶,在癌症中会发生一些衍生突变[43]。2023年,蒋骄杨课题组在一种新的促癌机制中,首次发现了OGA的非催化柄结构域的癌症衍生突变S652F,该突变异常地调节了关键细胞过程中一小部分OGA蛋白相互作用和O-GlcNAc水解,增强了细胞恶性表型以及一些潜在的分子途径[44]。
人的OGA是一种多结构域酶,由具有水解O-GlcNAc活性的N端催化结构域、中心茎结构域和C端组蛋白乙酰转移酶(histone acetyltransferase, HAT)结构域组成,而该策略使用了截断的人类OGA结构即OGAcryst,包括了催化结构域和大部分茎结构域(见Fig.2A)。该OGA突变体能靶向水解PDLIM7(PDZ and LIM domain 7)的O-GlcNAc糖基化修饰,通过转录抑制和MDM2(mousedouble minute 2,为潜在的癌症标志物)介导的泛素化,在不同类型的细胞中下调肿瘤抑制因子p53,从而促进细胞促瘤表型[3,45]。并且作者发现,在茎结构域的溶剂暴露表面上的单个突变,会改变OGA与参与调节细胞癌化过程的一组底物和非底物蛋白质的相互作用。此外,在体外和细胞研究中,OGA茎结构域S652F突变体具有较高的内在酶活性,能比野生型OGA更有效地去除PDLIM7等底物的O-GlcNAc糖基化修饰。并且这种对PDLIM7的“增强”活性似乎是S652F突变体所特有的,而生化和细胞研究也有力地支持了OGA茎结构域与蛋白质底物/非底物之间的相互作用,其可能是调节OGA功能和O-GlcNAc动态以响应环境刺激的关键因素。
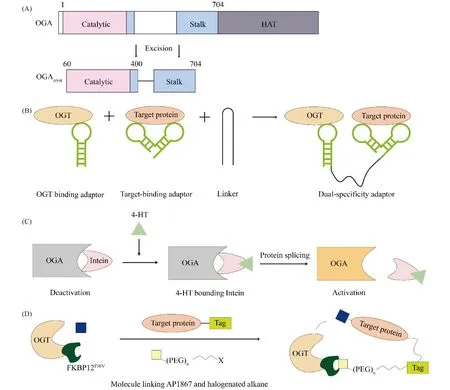
Fig.2 The concepts of some chemical biology techniques for targeted manipulation of O-GlcNAcylation (A) Schematic diagram of OGA and truncated OGAcryst structures. The catalytic domain and stem domain are represented in pink and blue, the histone acetyltransferase domain and disordered region are shown in gray and white. (B) Dual RNA aptamer technology capable of simultaneously targeting OGT and β-catenin. (C) Temporal and spatial modulation of O-GlcNAc levels in live cells induced by 4-hydroxytamoxifen (4-HT)-triggered OGA engineering activation. (D) Conceptual design of OGTAC. Target protein-specific O-GlcNAc glycosylation is induced by recruiting FKBP12F36V-OGT to the HaloTag fusion of the target protein
该研究首次提供了OGA在其催化位点之外识别底物的直接证据,并为在不干扰整体O-GlcNAc稳态的情况下OGA在生物医学应用中的精确作用指明了新的方向。但是,PTM调控的p53-MDM2整合了各种因素来精确控制应激或刺激下的细胞功能[46],简单地靶向p53或MDM2本身可能会破坏许多其他重要系统的内稳态,这也是该技术未来需要克服的主要障碍之一。
6 双RNA适配体技术
在研究O-GlcNAc的调控作用时,还有1个主要的问题就是不能只改变单个蛋白质上的O-GlcNAc糖基化。前文中提到的纳米抗体导向技术虽然在一定程度上可以实现靶向O-GlcNAc编辑,但是仍需要过表达工程化后的纳米抗体与OGT、OGA的融合蛋白质,Zhu等人开发了一种基于双RNA 适配体的方法,可以同时靶向内源O-GlcNAc转移酶(OGT)和内源无标记的β-联蛋白(β-catenin)(与胚胎发育和癌症密切相关的Wnt信号通路的关键转录因子),并且在不影响其他OGT底物的情况下选择性地增加后者的O-GlcNAc糖基化修饰[47]。
该课题组使用指数富集配体的系统进化技术(systematic evolution of ligands by exponential enrichment,SELEX)[48],可以得到靶向目标蛋白质或其它物种的DNA或RNA核酸适配体。利用SELEX,他们发现了一种与OGT结合紧密但不抑制其活性的RNA适配体。将其连接到一个已知的与绿色荧光蛋白(green fluorescent protein, GFP)结合的适配体上,经过一系列优化,经该适配体转染的细胞将内源性OGT重新定位到GFP标记的蛋白质上,可以使这些蛋白质的O-GlcNAc糖基化水平显著升高。该研究较好地证明了增加OGT与其底物之间的“粘性”可以选择性地增加该蛋白质的修饰,从而可以在分离后能够单独研究这些O-GlcNAc修饰的效果。然而,使用该适配体仍然需要对靶蛋白质进行工程修饰,将其进行GFP标记。为了克服这一限制,作者以O-GlcNAc糖基化修饰β-联蛋白作为模型进行了研究。已有报道,β-联蛋白可以通过O-GlcNAc糖基化修饰抑制磷酸化并增加自身的稳定性。因此,本文使用SELEX成功筛选到了另一种可以与内源性β-联蛋白结合的适体,再将其与OGT适配体连接,实现了通过招募内源OGT增加内源β-联蛋白的O-GlcNAc糖基化修饰水平。该技术的优势在于其不需要蛋白质工程,只需要用DNA或RNA转染细胞即可实现。通过使用这种适配体,作者发现,O-GlcNAc在诱导Wnt信号传导时增加了β-联蛋白与另一种转录调节因子EZH2(enhancer of zeste homolog 2)的相互作用,从而改变了转录组。此外,通过将生物核糖开关(riboswitch)或诱导型表达系统偶联到适配体上的方法,也实现了对蛋白质特异性O-GlcNAc糖基化修饰的诱导调节。然而,该技术尚缺乏进一步的优化和表征。并且目前的适配体只能在目标蛋白质上增加大约4~5倍的O-GlcNAc糖基化修饰水平,这可能还不足以揭示其生物学作用。此外,适配体诱导的O-GlcNAc糖基化修饰位点不一定与天然OGT底物相互作用所安装的位点相同。尽管仍存在着一些未知因素,但这种新技术仍具有较好的应用前景。
7 小分子控制的O-GlcNAc水解酶激活技术
细胞中的O-GlcNAc水平以时间和空间的方式动态响应环境信号,导致信号转导和功能影响的改变。而O-GlcNAc水平的时空调节将加速O-GlcNAc的功能和对细胞行为的操纵,以达到预期的结果。目前已有报道,通过外源光激活OGT的形式上调O-GlcNAc水平的方法,但是由于OGT和OGA对O-GlcNAc的调节可能并不直接等效,因此,通过OGA的时空控制来消除O-GlcNAc的方法将为操纵OGT的方法提供一种补充策略,以探索O-GlcNAc糖基化修饰的必要性。
葛韵等人通过将一个可由小分子4-羟基他莫昔芬(4-HT)触发脱离的结合肽(intein)融合到1个OGA蛋白中,报道了一种在活细胞中时空下调O-GlcNAc的策略[49]。经过优化,作者发现了一种OGA-intein融合体(C181),证明了4-HT激活的OGA-intein融合体可以通过减少O-GlcNAc糖基化修饰来增强对乳腺癌细胞的抑制作用。其中OGA的活性可以通过4-HT以时间和剂量依赖的方式,在所需的亚细胞区室中被触发,而通过小分子活化的OGA-intein融合体对O-GlcNAc糖基化修饰的时空控制,将有效调节活细胞中的O-GlcNAc糖基化水平。虽然无活性的OGA-intein融合通常在细胞中过表达,但通过添加4-HT可以精确地产生活性剪接产物,用少量小分子诱导大量的去糖基化。并且模块化的设计思路使得这种激活方法可以通过添加靶向模块,例如纳米抗体,以提高底物选择性。O-GlcNAc稳态的内部响应通常发生在几分钟之内,而这种方法在激活后需要近3 h才能实现O-GlcNAc的大量去除。并且该策略中激活是不可逆的,在添加4-HT后会将导致持续的OGA激活。这些局限性可能在未来有望通过生物正交剪切反应和配体控制的蛋白质构象开关等新的方法来解决。
8 双功能小分子嵌合体技术
为了能够精确研究位点特异性O-GlcNAc糖基化修饰,Ng等人开发了一种双功能小分子,命名为O-GlcNAc糖基化修饰靶向嵌合体(O-GlcNAcylation-targeting chimeras, OGTACs),它可以在细胞中实现靶向蛋白质的O-GlcNAc糖基化修饰。并且该策略具有时间和强度控制,是一种很有前景的诱导靶向蛋白质的O-GlcNAc糖基化修饰的方法,为O-GlcNAc糖基化靶向治疗开发提供了新的方向[50]。
基于化学诱导临近技术(chemical induced proximity,CIP)的发展[51-52],作者设计了一个双功能系统以将OGT招募到靶蛋白质上,从而实现靶蛋白质特异性的O-GlcNAc糖基化修饰。作者首先建立了一个通用的系统进行概念验证,利用FKBP12F36V融合的OGT(fOGT)作为O-GlcNAc转移酶,它可以被小分子配体AP1867有效募集,而卤代标签融合的目标蛋白(proteins of interest,POIs)作为O-GlcNAc糖基化靶标过表达,可被卤代烷共价捕获。通过不同长度的聚乙二醇(PEG)链连接AP1867和卤代烷烃的分子,产生了一系列OGTACs。OGTACs旨在诱导fOGT和融合有HaloTag的POIs相互接近,同时促进O-GlcNAc转移到目标蛋白质上。传统的OGA抑制剂直接阻断去糖基化,从而维持高水平的O-GlcNAc糖基化修饰,而双功能分子会同时结合OGT和POI,诱导它们的接近并触发靶向O-GlcNAc糖基化修饰。并且该嵌合体理论上可选择性地诱导任何POI的O-GlcNAc糖基化修饰,例如BRD4(bromodomain-containing protein 4)、CK2α(casein kinase 2)和EZH2等。此外,作者还优化了OGTACs的分子结构,并验证了其诱导O-GlcNAc糖基化修饰的作用是剂量和时间依赖的。通过蛋白质高效液相色谱串联质谱联用技术(liquid chromatography-tandem mass spectrometry, LC-MS/MS),也表征到了BRD4上以前未知的O-GlcNAc糖基化修饰位点,证明OGTACs技术作为一种基于小分子的方法,可以实现一般、快速、且剂量依赖的靶向O-GlcNAc糖基化修饰。
虽然该方法实现了靶向O-GlcNAc糖基化修饰,但目前仍然存在一些局限性。由于缺乏能够与OGT结合而不会抑制其活性的非抑制性配体,因此,需要对fOGT进行外源性表达,这一要求成为阻碍该技术向医疗领域转化的因素,因为外源性表达可能涉及到一些复杂性和挑战性的问题,例如在临床应用中的可行性和安全性。此外,定量蛋白质组学对于准确确定Ser/Thr位点水平的O-GlcNAc糖基化修饰状态是不可或缺的,检测和定量蛋白质特异性O-GlcNAc糖基化修饰的方法仍有待完善。但总的来说,OGTACs技术也展示了利用小分子诱导蛋白质特异性O-GlcNAc糖基化修饰的潜力。
9 问题与展望
O-GlcNAc糖基化修饰在细胞中数千种蛋白质,其存在的生物学意义正被越来越多的研究逐步阐明。但由于目前靶向蛋白O-GlcNAc糖基化编辑的工具数量有限,我们对其下游功能的了解仍只是冰山一角,并且从本文所述的研究进展也可以看出,目前,仍没有一种研究蛋白质和位点特异性O-GlcNAc糖基化修饰的技术具有较高普遍性,所有讨论的化学生物学技术都有其优点和缺点。
迄今为止,纳米抗体融合的OGT/OGA允许以增加蛋白质或区域特异性对O-GlcNAc进行编辑,并且不需要事先鉴定糖位点。然而,考虑到这些方法诱导的酶-底物复合物的形成,应仔细控制研究以排除对蛋白质扩散、稳定性和相互作用等潜在脱靶效应。通过GCE技术掺入糖基化氨基酸对于实现位点特异性糖基化是可行的,但目前仅适用于体外[36,53]。而生物正交赖氨酸光笼策略仍需要在光敏基团的稳定性以及光照条件的限制等方面进行优化。将糖苷位点定点诱变为Cys或Ala是在细胞中以位点选择性精确控制O-GlcNAc糖基化修饰的主要方法[37]。然而,由于该技术建立在糖位点定位的基础上,其仅适用于底物的一个亚群。在OGA的非催化柄结构域进行癌症衍生突变,可以重新连接OGA蛋白网络并重新编码相关的细胞机制,可能为剖析OGA在生物学和疾病中的多种作用提供新的方向,从而实现更精确的控制,但许多挑战限制了它们的临床应用[54]。双RNA适配体技术虽然可以在不影响其他OGT底物的情况下选择性地增加O-GlcNAc糖基化修饰,考虑到适配体本身功能的限制,该技术仍存在一定的局限性。小分子控制的OGA激活技术能通过OGA的时空控制来调节O-GlcNAc修饰水平,反应时间也很长,但其激活是不可逆的,未来仍需要进一步的优化。
开发用于在细胞中进行靶蛋白质的O-GlcNAc糖基化编辑的新方法,将有助于进一步增强在细胞中时空操纵O-GlcNAc的水平。随着生物正交化学的发展,改良的半胱氨酸转化化学有望将GlcNAc位点特异性引入细胞内[55-56]。优化了分子结构的OGTACs技术可以实现一般、快速、且剂量依赖的靶向O-GlcNAc糖基化修饰,虽然目前该技术仍未达到医疗领域应用的标准,但该策略也是一种很有前景的诱导靶向蛋白质的O-GlcNAc糖基化修饰的方法。
随着糖化学生物学的高速发展,短短几十年内靶向编辑O-GlcNAc糖基化修饰技术已得到了长足的进步。O-GlcNAc糖基化修饰与调节免疫细胞的发育、稳态和功能息息相关,现有技术的改进与相关新技术的开发使得我们能更精准地调控OGT和OGA,或直接操纵O-GlcNAc糖基化水平。随着更深入地了解相关生物学过程,靶向编辑O-GlcNAc糖基化修饰技术也有望对自身免疫病、癌症、病原体感染等疾病的诊断与治疗提供新的启示。而在O-GlcNAc糖基化修饰的编辑领域,尽管取得了显著的进展,但仍然面临着挑战,例如编辑技术对目标蛋白质的精准性和特异性,以及探索O-GlcNAc在不同疾病中的作用机制。未来的发展方向包括对于技术的精细化和优化,进一步优化和改进现有的编辑技术,以提高编辑的精准性和可控性。例如对于纳米抗体融合的分裂OGA等策略,应致力于减少潜在的脱靶效应,确保编辑的特异性。其次还可以探索并开发新的编辑技术,以实现对蛋白质O-GlcNAc糖基化更精细、更灵活的调控。此外,还可以重点关注临床应用的转化,加速将这些编辑技术从实验室转化到临床应用,为疾病治疗提供更多选择。深入了解O-GlcNAc在不同疾病中的作用机制,有望为开发定制化的治疗策略奠定基础。
在不断攻克这些挑战的过程中,O-GlcNAc糖基化修饰的编辑技术的发展将为更全面、深入地理解这一重要的细胞调控机制提供新的工具和视角。这也将为治疗相关疾病提供更具针对性的手段,推动该领域在未来的研究和应用中迈出更大的步伐。