免疫分子的糖基化修饰与重要感染性疾病
2024-04-23章晓联
方 丹, 章晓联
(1)武汉大学泰康医学院(基础医学院)免疫学系, 武汉 430071;2)湖北省过敏与免疫相关疾病重点实验室, 武汉 430071)
蛋白质糖基化修饰是一种广泛存在于真核生物中的蛋白质翻译后修饰,它以多种形式存在,主要包括O-糖基化和N-糖基化等修饰[1,2],其特征是在糖基转移酶的作用下,通过酶促反应并以糖苷键的形式与蛋白质特定的氨基酸残基共价结合[3],该过程涉及多种糖基转移酶和糖苷酶,且主要发生在内质网和高尔基体的特定位置[2]。此外,糖基化修饰能通过各种酶和重复共有支架的组合运用产生大量的聚糖结构,其在蛋白质折叠、转运、细胞定位、细胞间信号传递、细胞增殖、分化和迁移中具有重要的作用[4]。
1 蛋白质糖基化修饰类型
细胞表面膜型或分泌型糖蛋白主要包括N-糖基化和O-糖基化修饰的糖蛋白,是由共价连接的寡糖侧链或聚糖单元的多肽结构组成的大分子。根据糖苷键的类型主要分为:(1)N-聚糖(N-Glycan),其通过N-乙酰氨基葡萄糖和天冬酰胺的酰胺基团之间的连接,发生在氨基酸序列NXS/T(X≠P)[3]。该过程始于内质网、终于高尔基体,共同形成高甘露糖型、杂合型和复合型3种N-聚糖类型[5];(2)O-聚糖(O-Glycan),其通过N-乙酰半乳糖和丝氨酸/苏氨酸的羟基之间的连接,发生在氨基酸序列的S/T位点[3],该过程主要在高尔基体中,进行粘蛋白(mucin)的修饰。值得注意的是,O-糖基化包含了O-乙酰氨基葡萄糖、O-N-乙酰半乳糖胺、O-葡萄糖、O-甘露糖和O-岩藻糖等[6]。相较于N-糖基化,O-糖基化的生物合成过程更直接,不需要共有序列或多萜醇前体进行合成[7]。此外,细胞浆或核内蛋白质的糖基化一般都是O连接的N-乙酰葡萄糖胺(O-linkedN-acetylglucosamine,O-GlcNAc)修饰的单糖修饰,整个过程只通过N-乙酰氨基葡萄糖转移酶(O-β-N-acetylglucosaminyltransferase, OGT)和乙酰葡萄糖胺糖苷酶(O-β-N-acetylglucosaminidase, OGA)2种酶催化,OGT负责在蛋白质上添加O-GlcNAc修饰,OGA负责去除O-连接聚糖上的O-GlcNAc修饰,是一种动态、可诱导和可调控的方式。
2 宿主重要免疫分子的糖基化修饰
在病原体与宿主的相互作用中,存在病原体的致病性和宿主对病原体的免疫两方面。研究表明,宿主的免疫抗性与免疫细胞表面蛋白质的糖基化有密不可分的关系[8],而糖基化影响着所有免疫细胞的功能,且几乎所有的免疫分子都是糖基化的,包括关键的免疫蛋白,如B细胞受体、T细胞受体、主要组织相容性复合物、细胞因子、补体和免疫球蛋白[9]等。大多糖蛋白质都具有特征性的糖基化模式和异质性的糖链。下面概述几种重要宿主免疫分子的糖基化修饰及其功能。
2.1 B细胞受体的糖基化修饰
B细胞在免疫系统中是独一无二的,因为它表现出先天性和适应性免疫活性,当B细胞活化时,B细胞通过B细胞受体(B-cell receptor, BCR)识别可溶性和膜结合的抗原,并对其作出反应[10]。在识别抗原后,B细胞上的BCRs会触发并最终诱导B细胞产生抗体的信号[11]。BCR复合物包含1个具有胞质结构域的膜结合免疫球蛋白(membrane bound immunoglobulin, mIg)和1个二硫键连接的异二聚体Igα-Igβ(CD79a-CD79b),其中包含免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motifs, ITAMs)[12]。
BCR是一个高度核心岩藻糖糖基化的糖蛋白,核心岩藻糖基化可调节BCR的功能以区分抗原,核心岩藻糖转移酶-FUT8的敲除降低了BCRs与其配体的亲和力,但并不影响BCR的表达[13](如Fig.1所示)。由于BCR的核心岩藻糖基化可以调节膜受体的构象和配体亲和力[13],并且可能影响N-聚糖的柔性[14],因此推测,核心岩藻糖基化可以控制Fab臂的轴向旋转和BCR对抗原的识别。
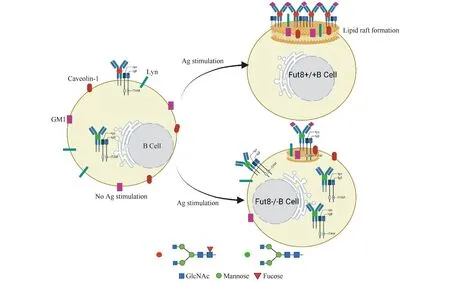
Fig.1 Regulation of BCR core fucosylation on B cell signal transduction Antigen stimulation-triggered signal transduction is required for B cell activation. The core fucosylation of BCR promotes the efficient formation of lipid raft domains in B cells. BCR forms and crosslinks with lipid rafts, thus mediating signal transduction. Deficiency of FUT8-induced core fucosylation suppresses the formation of lipid raft domains and BCR signal transduction
脂筏(lipid raft)是细胞膜脂双层内含有特殊脂质与蛋白质的微区,它的形成是异质、动态而且瞬时的。脂筏内含众多信号分子,包括BCR、TCR等在内的许多信号转导都在脂筏内传递信息。此外,荧光共振能量转移结果显示,BCR与脂筏的缔合在几秒钟内发生,并导致BCR的交联[15]。抗原刺激时,核心岩藻糖在30 s内影响脂筏的形成,并在5 min后进行BCR介导的信号转导[13],而岩藻糖基转移酶8(fucosyltransferase 8, FUT8)敲除可以抑制BCR、酪氨酸蛋白激酶Lyn、神经节苷脂GM1或窖蛋白1(Caveolin-1)在脂筏结构域的表达[16],还会减少BCR的聚集和内化,减弱激酶的激活,直接干扰近端BCR信号转导[10,17]。因此,核心岩藻糖基化对于B细胞的活化至关重要,包括抗原识别、BCR信号转导和脂筏簇的形成。
2.2 T细胞受体的糖基化修饰
T细胞受体(T-cell receptor, TCR)是T细胞区分多肽-主要组织相容性复合物(peptide-loaded major histocompatibility complex, pMHC)能力的核心,也是适应性免疫反应的一个重要特征,而TCR糖基化模式的改变可能会影响与多肽-主要组织相容性复合物的结合能力[18]。TCR翻译后的N-糖基化修饰会改变T细胞的激活阈值[19]。例如,用2-脱-D-葡萄糖(2DG)(一种N-糖基化调节剂,可以增强T细胞活化)处理T细胞,可以增强T细胞的抗肿瘤活性,这种N-糖基化修饰已被证明可以促进人类T细胞的抗肿瘤免疫反应[20],此外,TCR的糖基化在T细胞激活的调节中具有独特的作用,如高度核心岩藻糖基化的TCR,对于有效的TCR-pMHC-II接触和CD4+T细胞的激活是必需的,并且TCR超核心岩藻糖基化有可能作为系统性红斑狼疮(systemic lupus erythematosus, SLE)患者血清中潜在的新型生物标志物[21]。
2.3 细胞因子的糖基化修饰
许多天然存在的细胞因子都是糖蛋白。与任何其他糖蛋白一样,细胞因子或蛋白酶可以有1个或多个糖基化位点。研究表明,N-糖基化的位点锚定在连接序列Asn-X-Ser/Thr(X≠Pro)上,而O-糖基化的糖连接在丝氨酸或苏氨酸残基上。通常糖基化对蛋白质活性的影响并不显著,尤其是糖基化和去糖基化之间通常相差2~3倍,然而,当它们在级联中被放大时,这些小差异将变得显著[22]。例如细胞因子白细胞介素-6(Interleukin-6, IL-6)[23]、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)[24]、白细胞介素-4(Interleukin-4, IL-4)[25]和白细胞介素-1β(Interleukin-1 beta, IL-1β)[26]的特异性活性由于糖基化修饰的不同存在差异。在这些情况下,N-糖基化可以降低细胞因子的功能程度。例如本室此前发表的文章表明,IL-24上的N-糖基化位点的突变,可以增强细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)反应,N-糖基化对于IL-24抗伤寒沙门菌感染功能是必需的,IL-24的N-糖基化突变体刺激γ-干扰素(Interferon-gamma, IFN-γ)的能力下降,保护小鼠抵抗感染功能也有所下降[27]。
O-糖基化对于IL-5的生物学活性具有重要意义。虽然,最初认为IL-5糖基化对其生物活性并不重要[28],但后续的报道表明,O-和N-连接糖都会影响IL-5的活性。去除N-聚糖链导致IL-5生物活性提高2.8倍,去除O-糖基化使其活性提高了10倍,表明O-糖基化比N-糖基化更有效地抑制IL-5的生物活性[29]。因此,IL-5是O-糖基化降低细胞因子生物活性的例子。
2.4 补体的糖基化修饰
人类的补体(complement)途径是一种高效识别和清除感染性微生物和已经受损的宿主成分的系统,有超过30种血浆蛋白质或膜调节和结合受体分子参与其中,它们大多数都是经糖基化修饰的,这些蛋白质共同提供了高度受控的蛋白酶级联反应[30]。补体途径包括经典途径(classical pathway)、替代途径(alternative pathway)和凝集素途径(lectin pathway),不同补体成分糖基化修饰不同。补体C3上的N-糖基化位点仅包含低聚甘露糖型聚糖[31],C4同时具有低聚甘露糖和复合聚糖,而C5仅含有复合聚糖[32]。C1q释放的N-聚糖的高效液相色谱显示,其含有核心岩藻糖修饰[33]。人类补体C9蛋白在补体途径中与其他补体蛋白C5、C6、C7和C8一起在膜攻击复合体(membrane attack complex, MAC)中发挥着重要的作用,有研究表明,C9蛋白N-末端除了具有N-糖基化修饰和O-糖基化修饰之外,还有第3种罕见的糖基化修饰类型:C-甘露糖基化。补体蛋白C9如此丰富的糖基化修饰赋予了它生理功能的潜在性,例如具有岩藻糖基化N-聚糖的C9已被提议作为鳞状细胞肺癌的生物标志物,因为患者通常表现为这种形式的C9蛋白的过度表达[34]。补体受体的糖基化修饰也对宿主有一定的保护作用。可溶性补体受体1(soluble complement receptor 1, sCR1)的胞外结构域被唾液酸化的Lewis x糖基化(sCR1sLex),会抑制补体的激活和内皮-血小板-白细胞的相互作用,定位于表达C1q的神经元,抑制中性粒细胞和血小板积累,减少脑梗死的体积[35]。
2.5 免疫球蛋白糖基化
免疫球蛋白G(immunoglobulin G, IgG)是许多传染性疾病保护性免疫反应的重要组成部分,也是大多数已批准的疫苗的主要保护因素[36-38]。IgG由可变区(F ( ab′) 2)和恒定区(Fc)2个功能域组成。F ( ab′) 2负责识别抗原,从而有助于病原体的阻断或中和作用,而Fc区与多种不同的Fc受体(Fc receptors, FcRs)和补体蛋白质相互作用,将适应性免疫系统的高度特异性与先天免疫系统强大的效应功能联系起来。Fc区的生物活性在基因组水平上通过抗体同种型和亚类的选择进行调节,在翻译后水平上通过糖基化进行调节。各种疾病的累积数据表明,抗体糖基化是抗体稳定性、半衰期、分泌和功能调节器的重要因素。
在感染过程中,Fc区生物学活性首先通过抗体亚类的选择在基因组水平进行调节。在人类中,有5种不同的抗体同种型:IgM、IgD、IgE、IgA和IgG。此外,IgG和IgA还分别有亚型:IgG1-IgG4和IgA1、IgA2。除了同型选择,所有的IgG分子在每个重链的天冬酰胺297(Asn297)处都有一个N-糖基化位点。IgM、IgD、IgE、IgA1和IgA2在各自的重链上都有一定数量的N-糖基化位点。此外,IgD和IgA1还有多个O-糖基化位点[39]。虽然这些亚型上大量的Fc糖基化位点为其功能异质性提供了巨大潜力,但大多数与感染相关的免疫分析都集中于IgG Fc片段糖基化的变化。
N-聚糖首先在B细胞的内质网中被添加到IgG Fab和Fc片段上,该过程主要是在抗体多肽链上添加单一的高甘露糖。从内质网转运到高尔基体的IgG,糖链以有序的方式构建,涉及糖基转移酶和糖苷酶的不同底物特异性[40]。糖基转移酶合成糖链,而糖苷酶水解特定的糖链,包括修剪和延伸聚糖,进而形成经典的“核心聚糖”结构[41]。该过程由2个GlcNAc分子组成核心聚糖基部,在后面附加3个甘露糖,GlcNAc分子与每个分子相连。4种糖基转移酶按照一定顺序对核心聚糖进行进一步修饰。FUT8能够在内侧高尔基体内加入岩藻糖,β1,4-半乳糖基转移酶1(Beta 1,4-galactosyltransferase 1, B4GALT1)可以在触角的GlcNAc上进行半乳糖化,从而在反式高尔基体内添加1个或2个半乳糖,而α-2,6唾液酸转移酶1(Alpha-2,6-sialyltransferase 1, ST6GAL1)则能够对已有的半乳糖结构上添加唾液酸,从而实现唾液酸化[42]。这些变量的增加导致了巨大的IgG异质性,在健康个体的循环IgG中发现了超过30种不同的聚糖[43]。非还原性末端岩藻糖、半乳糖和唾液酸残基与这个决定糖基化异质性的核心相关联,并参与了IgG-Fc与FcRs之间的相互作用[44]。尽管它们与受体的物理接触很少,但对IgG Fc和FcR之间的相互作用有显著的影响,进而影响IgG的功能效应,如抗体依赖的细胞介导的吞噬作用(antibody dependent cell-mediated phagocytosis, ADCP)[45]和抗体依赖的细胞介导的细胞毒性作用(antibody dependent cell-mediated cytotoxicity, ADCC)[46]。Fab区的N-糖基化发生在IgG4和IgG1上,大多数Fab聚糖具有复杂型双触角结构,具有高水平(>90%)的末端唾液酸残基[48]。Fab糖基化的升高是自身免疫的常见特征,在系统性红斑狼疮、抗肾小球基底膜肾炎和血栓性血小板减少性紫癜等多种自身免疫性疾病中自身抗体的Fab糖基化水平增加[47]。许多生物制药现在都采用聚糖修饰,从而具有更佳的水溶性和热稳定性,并通过影响他们的生物活性、药代动力学等来控制其发挥效果[48]。了解糖蛋白结构的细节,包括其中的糖类成分,可以帮助研发糖蛋白类生物制品,以及用于疾病的诊断和治疗。
2.6 其他免疫相关分子的糖基化
抗体的保护和治疗功效主要是通过抗体的Fc片段与免疫细胞上的Fc受体(FcR)的相互作用来介导。这些相互作用可以触发一系列的免疫调节反应,涉及先天和适应性免疫反应。抗感染性疾病中产生的抗体主要与巨噬细胞表面的Fcγ受体(FcγR)结合。Fcγ受体(FcγR)在生物学以及健康和疾病中的作用十分复杂,虽然在改变IgG糖基化以增强生物活性方面已有深入研究,但对FcγR的糖基化的研究较少。每个FcγR至少含有2个N-糖基化位点,在高亲和力FcγRⅠ中观察到多达7个潜在位点。绝大多数聚糖数据发现于FcγRⅢa,凝集素结合实验验证来自NK细胞的FcγRⅢa主要为寡甘露糖型的N-聚糖[49],而单核细胞表达的相同受体表现为复合型寡糖[50]。此外,从FcγRⅢa中去除高甘露糖导致聚糖IgG结合的变化。对于重组FcγRⅢa的研究则更为深入,FcγRⅢa的2个N-糖基化位点直接调节与IgG的结合,Asn162处N-聚糖的诱变显著降低了与IgG1的结合,证明了IgG与FcγRIIIa的相互作用对FcγRⅢa特定位点糖基化的依赖性[51]。此外,Asn45位的N-聚糖被证明在IgG结合中具有抑制作用,去除该位点的N-糖基化显著提高了与IgG1的结合能力[52]。
3 免疫分子糖基化与感染性疾病
糖基化改变是不同疾病情况的共同特征。这些变化可能有遗传来源,例如先天性糖基化障碍,或由于炎症和感染引起的糖生物合成机制的失调。历史上,感染性疾病曾多次引起全球大规模的公共卫生关注,威胁人类的健康和生存。糖基化在宿主-病原体相互作用中的作用被广泛认可,在一系列病毒和细菌疾病中出现的数据表明,在感染期间,蛋白质糖基化是几种感染性疾病的关键参与者,并已被证明影响宿主免疫反应[53,54]。
3.1 免疫分子的糖基化修饰与结核病
结核病是一种严重危害人类和动物健康的慢性传染病,由感染结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)引起。全球目前有近三分之一的人感染结核分枝杆菌,这些感染者在免疫力下降或其他疾病侵袭时都有发展为结核病的可能。
在对活动性结核患者的全转录组分析中发现,多种糖基转移酶基因的转录水平发生改变。与其他感染条件一样,在结核分枝杆菌感染的病人和小鼠肺中检测到唾液酸化聚糖结构Sialyl-Lewis(SLeX)表达增强[55]。Fut4和Fut7的联合缺失导致结核分枝杆菌感染后小鼠加速死亡,说明了末端岩藻糖基化在结核病易感性中发挥作用[56]。
在结核病患者中观察到抗体糖基化的显著差异,活动性结核(active tuberculosis, ATB)患者表现出促炎性IgG糖链的增加,以高水平的去半乳糖基化IgG为标志[57](如Fig.2 所示)。而去半乳糖基化的IgG与宿主抗结核菌反应相关,降低了机体对结核分枝杆菌的吞噬和杀伤。相反,与ATB患者相比,潜伏性结核感染(latent tuberculosis, LTB)患者的IgG具有更少的核心岩藻糖基化,而IgG岩藻糖基化的缺失显示出对FcγRⅢa结合的增强和NK细胞激活[51]。这些独特的LTB衍生抗体与ATB个体的IgG相比,增强了对感染的人原代巨噬细胞内M.tb的杀伤。因此,结核患者中不同的Fc糖基化模式可能与M.tb控制的增强或减弱有关。本室通过定量评估377例肺结核患者和190例健康供者血清中IgG半乳糖基化的变化发现,结核患者(包括涂片阴性结核患者)中IgG的无半乳糖化(G0)聚糖明显高于健康供者,在结核分枝杆菌感染小鼠模型中也观察到类似结果,特异凝集素印迹法定性证实,结核患者IgG半乳糖基化降低,表明血清IgG-Gal比值G0/(G1+G2×2)定量分析可用于结核病的辅助诊断,且具有较高的有效性和可行性[58]。

Fig.2 Schematic diagram of galactose modification of IgG Fc fragment in different disease states of tuberculosis After infected with M.tb, the patient’s diseases states go through three stages: active tuberculosis (ATB) or latent tuberculosis (LTB), recovery period. In ATB patients, IgG presents severe deficiency of galactosylation (G0) in the serum; Some individuals do not show tuberculosis after infection with M.tb (LTB). The IgG of LTB and recovered patients (CP) shows a rise in the level of galactosylation (G1); In healthy donors (HD), serum IgG exhibits high levels of galactosylation (G2)
3.2 免疫分子的糖基化修饰与新型冠状病毒肺炎
人类冠状病毒(包括SARS-CoV、MERS-CoV和SARS-CoV-2)的高致病性与病毒颗粒附着和进入宿主细胞的侵袭机制密切相关。越来越多证据表明,细胞糖萼的唾液酸化化合物(sialic acid, SA)可以作为冠状病毒感染机制的重要因素[59]。SA是天然存在的9碳单糖,已被鉴定为附着在糖蛋白和糖脂的N-聚糖或O-聚糖末端的功能性受体[60]。SA存在于细胞和粘膜组织的外表面,是许多病原体与宿主接触的第一个位点之一。当严重急性呼吸综合征冠状病毒2(SARS-CoV-2)进入人体时,首先识别SA,同时寻找其受体,然后与血管紧张素转换酶2(angiotensin converting enzyme 2, ACE2)结合,打开进入细胞的通道[60]。SARS-CoV-2刺突(S)蛋白特异性IgG1的Fc区的岩藻糖基化水平降低,与抗-S IgG1低半乳糖基化和低唾液酸化一样,它也可以作为疾病严重程度的早期标志,而高半乳糖基化和唾液酸化则主要出现在严重程度低的患者中[61]。
此外,有研究者对轻度和需住院的COVID-19患者,以及接种疫苗个体之间IgG的糖基化水平做了深入研究[62]。作者通过检测来自接种疫苗个体的抗体结合能力和中和能力发现,此过程与其IgG的糖基化模式密切相关。同时发现需住院的COVID-19患者具有与低中和抗体应答的接种个体相似的糖基化模式。随着时间的推移,COVID-19患者和接种疫苗个体的IgG糖基化的关键转变,可以预测疾病严重程度和疫苗抗体反应,表明IgG的糖基化修饰在预后判断中的价值。
3.3 免疫分子的糖基化修饰与获得性免疫缺陷综合征
艾滋病是由人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染引起的疾病,是全球人类健康的最大威胁之一。尽管大多数HIV感染者在缺乏抗病毒治疗的情况下无法控制病毒复制,并最终进展为获得性免疫缺陷综合征,但仍有约1%的感染者被称为“自发控制者”,即能够在缺乏治疗的情况下自发控制感染[63]。HIV感染者的抗体Fc糖基化谱显示,与进展中的感染个体相比,控制者中存在显著高水平的去半乳糖基化抗体[64]。这些在HIV控制者中的去半乳糖基化水平很可能是生发中心内HIV遏制和持续存在的标志。事实上,在B细胞活化位点持续存在的病毒存储库可能导致永久性B细胞活化,因此,会导致持续升高的IgG去半乳糖基化的产生。然而,与进展期患者相比,自发控制者中虽然未观察到大量循环的抗体,但诱导了HIV特异性抗体,且其Fc区选择性地丢失了半乳糖基化,增强了NK细胞的活化[64]。这些数据既指向患者的炎症变化,也指向抗原特异性抗体糖基化的选择性变化,这些变化追踪到自发控制HIV的受试者NK细胞活性的增强。
3.4 免疫分子的糖基化修饰与流感
流感病毒包膜上的血凝素(hemagglutinin, HA)糖蛋白通过与含有唾液酸的膜受体分子相互作用,负责将病毒与细胞结合,这种相互作用对于不同流感病毒的特异性有所不同。优先结合特性可归因于与SA连接的倒数第2个半乳糖残基的变化。禽流感病毒主要结合α-2,3连接的SA残基,而人流感病毒则优先结合α-2,6连接的SA残基[65]。
与来自HIV个体的特异性抗体相比,流感特异性抗体表现出不同的IgG Fc糖基化谱,这表明不同抗原特异性的IgG Fc糖基化图谱存在差异[66]。具体来说,流感特异性抗体的半乳糖基化和唾液酸化增加,这可能归因于HA与唾液酸结合以促进病毒入侵宿主细胞,因此,病毒可能会选择富集唾液酸化聚糖[67]。但是,这种聚糖谱也可能代表了不同于流感特异性免疫的程序化Fc聚糖谱。此外,一项关于检测接种流感疫苗后IgG Fc糖基化的研究发现,虽然接种疫苗不影响患者总体IgG糖基化谱,但接种疫苗后流感IgG的半乳糖基化和唾液酸化水平进一步增加[68]。由于接种疫苗不一定能获得足够水平的HA,这一结果仅证明了选择性疫苗诱导的抗原特异性Fc糖基化的转变。
3.5 免疫分子的糖基化与登革热
登革热(dengue fever)是最常见的虫媒病毒疾病,估计每年影响3.9亿人。登革热病毒(dengue viruses, DENVs)是黄病毒科的一种RNA病毒,有4种不同的血清型,可引起从轻度登革热(dengue fever, DF)到严重登革出血热(dengue hemorrhagic fever, DHF)和登革休克综合征(dengue shock syndrome, DSS)的疾病[69]。DENVs病毒复制的假设机制是内在的抗体依赖性增强(antibody-dependent enhancement, ADE),即现有的抗病毒IgG通过Fcγ受体介导的病毒扩增,从而导致疾病加剧的一种现象[70]。有研究表明,个体中抗登革热的非岩藻糖基化的IgG1的水平可能会导致人患上更严重的登革热病[71]。所有IgG分子均携带N-聚糖,Fc区CH2结构域中Asn297残基的岩藻糖基化会影响其与免疫细胞上Fc受体的相互作用,Fc区岩藻糖的存在降低了IgG与自然杀伤细胞、巨噬细胞和单核细胞上FcγRIIIa受体的结合亲和力,而它的缺失会增加结合亲和力。IgG结合Fc受体的能力取决于IgG的亚类(IgG1-IgG4),IgG1和IgG2构成人类抗体的主要群体,研究表明,其中IgG1与FcγRIIIa 的结合亲和力最强[72],该研究还发现,在无病毒的情况下从血清中纯化得到的IgG1可能会导致血小板耗竭,这是DHF/DSS的症状,这说明IgG1本身就可以引起疾病的增强,因此,进一步确定登革热感染早期体内非岩藻糖基化IgG1是否可以作为预测严重疾病发展的标志,以便对高危人群进行针对性治疗将具有重要意义。
3.6 宿主其他蛋白质的糖基化修饰与丙型肝炎
除了免疫分子的糖基化修饰之外,宿主内其他蛋白质的糖基化修饰也与传染性疾病相关。例如异常的N-糖基化与病毒性疾病有关,FUT8是糖蛋白生物合成过程中唯一负责合成N-核心岩藻糖的酶。本室最新研究发现,包括丙型肝炎病毒(HCV)-E2、水疱性口炎病毒(VSV)-G、严重急性呼吸综合征冠状病毒2(SARS-CoV-2)-Spike和人类免疫缺陷病毒(HIV)-gp120在内的多种病毒包膜蛋白,可以增强宿主FUT8的表达。这些异常表达的FUT8会通过EGFR-JAK1-STAT3-RIG-I信号通路抑制抗病毒干扰素(type I interferon, IFN-I)的应答。这项研究解释了一种RNA病毒的免疫逃逸机制,其中FUT8通过增强表皮生长因子受体(epidermal growth factor receptor, EGFR)的核心岩藻糖基化来抑制抗病毒防御[73]。宿主免疫分子的糖基化修饰对一些传染性疾病的抑制是有效的,而一些其他蛋白质的糖基化修饰则对宿主对抗病原微生物是不利的。这为病毒导致的传染性疾病的治疗提供了新的思路。
4 问题与展望
免疫分子的糖基化与许多疾病相关,IgG Fc片段的糖基化模式的改变与传染性疾病密切相关。就结核病而言,人体感染结核分枝杆菌后,不同的个体会出现不同的抗体糖基化模式,从而表现为不同的疾病状态和病症:IgG去半乳糖修饰表现为活动性结核,IgG保留半乳糖修饰的表现为潜伏性结核感染。但是随着疾病状态“健康→活动性结核→恢复期”的进展,患者抗体糖基化模式主要呈现2个半乳糖修饰(G2)→去半乳糖修饰(G0)→恢复半乳糖修饰(G1)的变化,所以病原微生物的感染也会导致抗体糖基化模式的改变[56,57]。同时不同抗体分子糖基化修饰会导致抗体介导的调理吞噬作用、补体活化、ADCC或抗体依赖的增强作用(antibody-dependent enhancement, ADE)等发生变化,又会造成不同的感染性疾病病症,例如ADE依赖FcγR的机制介导登革热病毒、SARS-CoV2等病毒进入宿主细胞,从而加重疾病的严重程度[74,75]。因此,我们认为感染性疾病中抗体等分子的糖基化修饰改变是宿主和病原体相互作用的结果。
越来越多的证据表明,宿主免疫细胞中的糖基化修饰和糖识别模式的改变可以在一定程度上反映感染的进展,有望成为感染诊断和治疗的新靶点。随着糖生物学和生物医学联系的愈发紧密,糖生物学领域产生的关于蛋白质糖基化途径和功能的知识,将会大大推动对多种疾病的分子发病机制和进展的理解。近几十年来聚糖与感染性疾病的研究进展,将为疫苗和诊疗药物的开发提供新的见解,并有助于开发新的靶点来抵御这些病原体。