生长阻滞特异性转录因子5剪接变异体GAS5_O1增强慢性髓系白血病细胞对伊马替尼的敏感性
2024-04-23张斯玮GwynWilliams
张斯玮, Gwyn T. Williams
(1)西安医学院 基础医学部生物化学与分子生物学教研室, 西安 710021;2)西安医学院 西安市病原微生物与肿瘤免疫重点实验室, 西安 710021;3)School of Life Sciences, Keele University,Staffordshire, UK)
慢性髓系白血病(chronic myeloid leukemia,CML)由原始造血干细胞(primitive hematopoietic stem cells)的恶性转化(neoplastic transformation)引起,并影响所有造血细胞谱系(hematopoietic cell lineages)[1]。CML的染色体缺陷源于多能干细胞中断裂点簇集区BCR(breakpoint cluster region)和 艾贝尔逊鼠白血病病毒癌基因ABL(Abelson murine leukemia viral oncogene)基因的融合,产生的费城染色体(Ph)和BCR-ABL1融合基因是CML的特征。表达的促癌蛋白质BCR-ABL1具有高酪氨酸激酶活性,可激活不同的信号通路,抑制CML细胞凋亡和促进其增殖[2]。伊马替尼(imatinib,IM)仍是有效的CML一线治疗药物[3]。
生长阻滞特异性转录因子5(growth-arrest specific transcript 5,GAS5)属于长非编码RNA。GAS5最早被发现在生长停滞的细胞中有累积[4]。在多数报道中,GAS5是肿瘤抑制因子,在肿瘤中低表达,可以通过促进凋亡、抑制细胞增殖而发挥抑瘤的作用[5-6])。体外研究表明,GAS5过表达抑制癌细胞增殖[7-8]和集落形成能力[9],促进癌细胞凋亡[7-10],抑制癌细胞侵袭能力[11-12]和抑制上皮-间质转化过程[13-14],并且可能经由抑癌基因PTEN实现抑癌作用[7,9,11-12,15],或通过抑制AKT/mTOR通路抑癌[8]。此外,GAS5表达水平能影响细胞对凋亡诱导剂(例如阿霉素、5-氟尿嘧啶、多烯紫杉醇和顺铂)的反应[16-18],从而对癌症的耐药性具有调节作用,例如GAS5介导乳腺癌的阿霉素耐药性[6]。GAS5的表达水平也会受到抗癌药物的调控[19]。此外,GAS5能增加电离辐射引起的细胞凋亡,并可能使肿瘤对放射治疗敏感[20-21]。并且GAS5对于凋亡的作用不限于肿瘤细胞中[22-23]。
GAS5有多种剪接变异体(splicing variant),然而,目前对于GAS5剪接变异体的种类仍有待研究。GAS5共有11个内含子[24],其中包含进化中保守的snoRNAs(小核仁RNA)[25]。基于表达系列标签(expressed sequence tag,EST)数据推测以及通过使用基因预测方法自动计算(BestRefSeq)分析,列出2种只含有外显子的成熟形式GAS5a和GAS5b(GAS5b较长),以及部分带有内含子序列的剪接变异体包括:(1)GAS5_1B:IMAGE clone 6194071,1 249 bp;(2)GAS5_2B:IMAGE clone 2598129,1 270 bp;(3)GAS5_O1:IMAGE clone 3585621,1 396 bp;(4)GAS5_3A:IMAGE clone 5739605,1 802 bp;(5)GAS5_4A:IMAGE clone 2761825,1 802 bp[4,26-27]。GAS5a和GAS5b是最早发现的转录物(区别在外显子7的选择性剪接),在大多数细胞中主要表达GAS5b(含有较长的外显子7,记为GAS5_AE,即variant 1)[25-26]。
GAS5不同剪接变异体可能在癌症中发挥独特的作用,但GAS5的确切机制以及其剪接变异体的分子功能仍缺乏研究报道。特别是缺乏反映髓系白血病中GAS5各剪接变异体作用的相关数据。因此,本研究选取一系列髓系白血病细胞系:早幼粒细胞白血病(promyeloblast leukaemia)细胞系NB4 和HL-60;以及骨髓母细胞白血病(myeloblastic leukaemia)Kasumi 1;成红细胞白血病(erythromyeloblastoid leukaemia)细胞系K562。通过反转录PCR,检测生长停滞期和指数增长期中部分GAS5剪接变异体的表达模式,从而(1)明确GAS5在各髓系白血病细胞系中是否表达,以及表达水平,从而判断代表不同亚型疾病的细胞系之间,GAS5可变剪接的模式是否不同。(2)检测在细胞密度诱导的生长停滞时GAS5的可变剪接水平是否发生变化。(3)通过过表达GAS5不同剪接变异体,检测各剪接变异体是否影响各髓系白血病细胞系的生长停滞、细胞活性和凋亡水平。(4)由于CML细胞系K562具有p210Bcr-Abl酪氨酸激酶[28],因而用酪氨酸激酶抑制剂IM处理细胞,明确GAS5的可变剪接水平是否可以在IM诱导K562细胞凋亡、抑制增殖[1]的基础上,进一步增强K562细胞对IM的敏感性。
1 材料与方法
1.1 材料
培养基、添加剂、分子生物学试剂购自Invitrogen(Invitrogen/Life Technologies,Paisley,UK)和Sigma-Aldrich(Gillingham,UK)公司。胎牛血清(FCS)购自Biosera公司。用于核转染的Nucleofector solution V 和Nucleofector® I Device 购自龙沙(Lonza,Verviers,Belgium)集团公司。用于PCR的试剂中,除了随机六聚体引物购自Invitrogen,其余购自Bioline(London,UK)试剂公司。
1.2 细胞培养
本研究用到的细胞系包括:急性髓系白血病细胞系Kasumi-1,急性早幼粒细胞白血病细胞系NB4和HL-60,CML细胞系K562。
完全培养基包含:RPMI-1640(pH7.4,含2 mmol/L的L-谷氨酰胺)、FBS(10%,V/V)、丙酮酸钠(1 mmol/L)、HEPES缓冲剂(10 mmol/L)和庆大霉素溶液(250 μg/mL)。细胞培养箱设置的培养条件为37 ℃、5% CO2。每2~3 d将细胞用新鲜培养基以每毫升(2~3)×105个细胞稀释重悬。在各种处理之前,细胞处于指数生长期。
1.3 质粒提取分离
按照QIAGEN® Maxi Preps(QIAGEN,Germantown,MD,USA)说明书,进行无内毒素质粒提取。使用NEBcutter V2.0在线软件分析限制位点的序列。
1.4 白血病细胞的核转染
将空载质粒pcDNA3.1或载有不同GAS5剪接变异体序列的过表达质粒转染到由单个集落扩增而来的K562克隆细胞中。依据Lonza说明书对核转染过程进行优化。核转染前24 h,种6×105cells/mL的HL-60和4×105cells/mL的K562。核转染时,以1 500 r/min,6 min,室温收集细胞,用核转染液V(nucleofector solution V) 将细胞重悬至2×107cells/mL。取100 μL的细胞悬浮液与过表达质粒混匀,转移到核转染专用的小池(cuvette)中。用Nucleofector® I Device将过表达质粒引入细胞中(K562 程序T-016)。核转染后,每个小池加入500 μL的预热的完全培养基(Iscove’s 培养基加2 mmol/L的谷氨酰胺和 20%的胎牛血清),悬浮细胞,转移到6孔板(每孔加2.5 mL预热的Iscove’s培养基)。在37℃/5% CO2培养箱培养,每24 h,取少量细胞用显微镜直接计数,评估其细胞活性。pcDNA3.1-GFP质粒作为阳性对照,并通过荧光显微镜评估转染效率(即有荧光染色的成功转染细胞数与总细胞数之比,每个样品至少评估200个细胞)。通常,转染的细胞需培养24 h,再做其他处理。
1.5 软琼脂细胞克隆形成实验
将细胞置于软琼脂中,在90 mm组织培养皿中形成单独的菌落。底层的培养基包括80%的Iscove完全培养基(含有20%的胎牛血清,250 μg/mL庆大霉素和2 mmol/L L-谷氨酰胺)和20%的高质量琼脂(5%W/V)。细胞层包含80%的完全培养基、10%的相应细胞的条件培养基(收集培养活跃生长的细胞的培养基)、10%的高质量琼脂和每皿2.4×104个细胞。经24 h孵育,加入覆盖上层(具有10%细胞条件培养基的Iscove完全培养基),7 d 后再加5 mL培养基,避免细胞层干燥和暴露。在37 ℃、5% CO2培养2~3周,待集落形成。
(1)对于单个集落进行扩增:挑取单个集落,重悬到100 μL的Iscove完全培养基中,96孔板中培养。随细胞扩增,将细胞渐次移入24孔板、12孔板、6孔板,之后常规培养。通过紫外线和IM处理后,选取对凋亡诱导敏感的集落。
(2)稳定转染细胞的筛选:对单个集落扩增出的细胞进行转染,将转染后的细胞置于软琼脂中,细胞层种的细胞数从12 000~48 000/每盘,以便获得分离良好的集落。上层加入G418(0.8 μg/mL)以便对转染的细胞进行筛选。在培养3~4周,挑取单集落、扩增。
扩增过程中,均使用加有G418的Iscove培养基中(浓度如上)。扩增到6孔板时,使用加有G418的1640完全培养基(浓度如上)。
1.6 诱导凋亡
1.6.1 IM处理 使用0.3 μmol/L 甲磺酸伊马替尼(Cayman Chemical, Ann Arbor, MI,USA)诱导凋亡。IM储备液浓度20 mmol/L(DMSO配制),使用0.03 ‰ (V/V) DMSO处理溶剂对照组细胞。实验起始,重悬细胞3×105个/mL后3~5 h再加相应浓度的IM或DMSO。
1.6.2 紫外线处理 HL-60细胞以6×105/mL重悬,转移到直径35 mm的塑料培养皿中,移去盖子将细胞暴露在254 nm、10.45 J/m2的UV下(剂量约诱导50%的细胞凋亡)。对照组无照射UV的步骤,其余给予相同的处理。UV照射后立即将细胞离心(6 000 r/min,6 min)并用新鲜培养基重悬至3×105/mL。然后在测定前培养72 h。
1.7 细胞生长和活力测定
台盼蓝染色排除法:台盼蓝染料液(0.8 mmol/L溶于PBS)与细胞悬浮液1∶1混匀,将混合液滴入细胞计数板,非活性细胞呈淡蓝色或深蓝色,活细胞未着色。
初始种3×105/mL细胞,每24 h进行1次细胞计数,48 h后补加新鲜培养基。之后不再补充培养基,待其进入生长停滞期。
1.8 细胞凋亡的测定
作为细胞凋亡的特征,通过吖啶橙染色法进行常规评估,使用吖啶橙(25 μg/mL)对样品进行染色,通过荧光显微镜对样品的凋亡特征变化(主要是染色质固缩/片段化)进行评估。每个样品至少评估200个细胞。
1.9 RT-PCR检测
按照Trizol 试剂(Invitrogen/ThermoFisher Scientific,Rockford,IL,USA)说明书提取细胞总RNA。使用RQ1 RNase-Free DNase Kit (Promega)对样品中的DNA进行消化,去除残留的基因组DNA。取2 μg DNase处理过的样本,加入随机六聚体引物(0.05 μg/μL,Invitrogen)和RNase-free dNTPs(0.5 mmol/L),65℃温浴10 min,使得引物与模板相结合,之后加入反转录缓冲液、Ribosafe核糖核酸酶抑制剂 (Bioline Ltd.)、Tetro 逆转录酶(Bioline Ltd.)室温放置10 min,42℃孵育30 min,合成cDNAs。之后在95℃ 下加热5 min,终止反应。反应终体积是30 μL。假设反转录效率为100%,以2 μg每30 μL起始,最终cDNA的浓度是67 ng/μL。
按照ImmoMix (Bioline)说明书进行RT-PCR,加入一定量的cDNA和特异性引物,扩增相应片段。扩增18S rRNA时,每个反应体系cDNA样本稀释10倍(约取5 ng);扩增GAS5各剪接变异体时,cDNA样本不稀释(每个反应体系约取67 ng样本)。三步法,30或34个循环:95℃(30 s)、62℃(30 s)和72℃(60 s),最终5 min终延伸。PCR引物见Table1。
配制琼脂糖凝胶:琼脂糖溶解到1×TAE(Tris-acetate-EDTA)使其终浓度达到1.25%W/V,再加入溴化乙锭(0.5 μg/mL)。每个PCR产物取5 μL与2 μL上样缓冲液混合,上样后进行电泳。分子量标准选用Hyperladder I和IV(Bioline)。用imageJ进行密度分析。根据结果,对PCR的样本量进行调整,使样本之间的18S rRNA水平相当,减少样本间的差异。以调整后的样本量进行PCR,跑胶并记录。
1.10 实时定量PCR
按照2×Sensimix和TaqManTM基因表达Assay(Bioline) 说明书,使用ABI PRISMTM7000 序列检测系统检测GAS5各剪接变异体的RNA水平。GAS5正向引物:CCTGGACCAGCTTAATGGTT;反向引物:GTCTGCCTGCATTTCTTCAA。以18S rRNA作为内参。18S rRNA的正向引物:GATGGTAGTCGCCG TGCC,反向引物:GCCTGCTGCCTTCCTTGG。结果按照 2-ΔΔCt公式计算。
1.11 统计学分析
所有实验都重复3次。所有结果均以平均值±SEM(平均值的标准误)表示。数据比较分析时,如果方差齐,使用单因素方差分析(One-way ANOVA)检查多组之间的统计学显著性;如果方差不齐,则进行Games Howell测试。
2 结果
2.1 髓系白血病细胞系之间生长阻滞特异性转录因子5剪接模式无明显差异
不同方法推测出众多GAS5剪接变异体(Fig.1)。本文主要参考Mourtada-Maarabouni等(2008)EST分析所得的GAS5剪接变异体[26](Fig.1A)和NCBI列出50种只包含外显子的剪接变异体(Fig.1B示意其中通过BestRefSeq方法推测的15种)。Ensembl数据库推测有31种非冗余剪接变异体(http://nov2020.archive.ensembl.org/,Fig. 1C),其中也包括保留有内含子的转录本。其中剪接变异体GAS5_3A(Fig.2C,Fig.3C)、GAS5_1B(Fig.2D,Fig.3B)和GAS5_O1(Fig.2E)可以通过RT-PCR识别,并且三者在4种髓系白血病细胞系中均有出现,在生长停滞期和指数增长期都有表达,GAS5剪接模式未见明显差异(Fig.2)。18S rRNA作为内参(Fig.2A)。条带①的大小与外显子2到外显子12完全由GAS5外显子组合的GAS5_AE和_O1预期扩增子的大小较为相符。可见4种髓系白血病细胞系,特别是在K562细胞中存在GAS5_AE和/或_O1累积(Fig.2B,3D)。但GAS5_O1的水平在K562和HL-60细胞进入生长停滞期后有下降的趋势(Fig.2E,Fig.3A),所以条带①所反映的是K562细胞中存在GAS5_AE的累积(Fig.2B,Fig.3D)。NB4和KASUMI1细胞系中GAS5_O1的水平在生长停滞期略有增加(Fig.2E,Fig.3A)。

Fig.1 The structure of the human GAS5 gene and its transcript variants
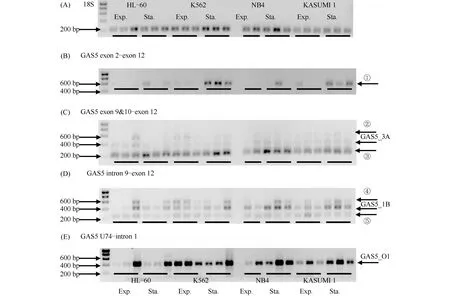
Fig.2 GAS5 expression patterns in myeloid leukaemia cell lines by RT-PCR
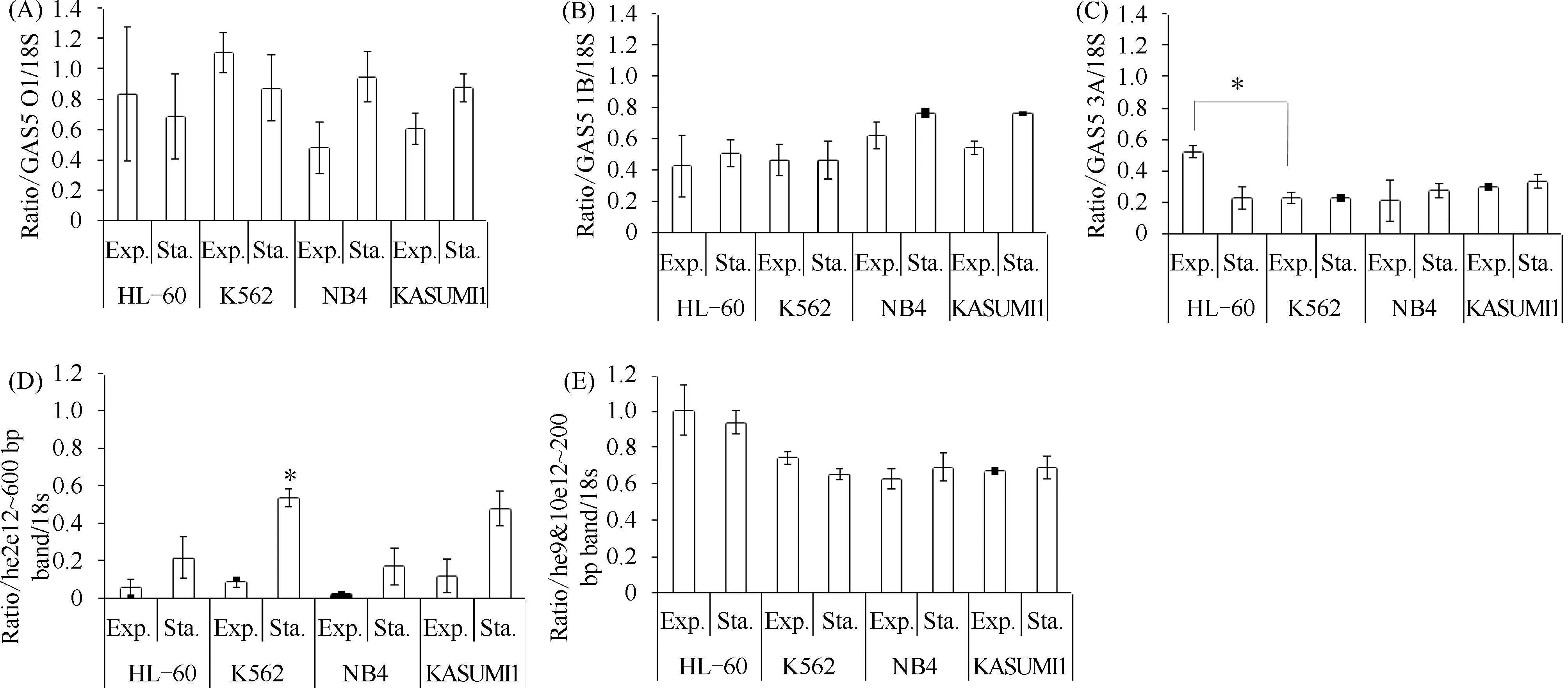
Fig.3 Quantitative analysis of the levels of GAS5 splice variants
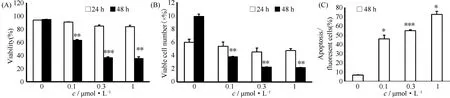
Fig.4 Imatinib-induced effects on apoptosis and cell survival on cloned apoptotic sensitive K562 cells
有较多剪接变异体扩增子大小与条带③相符,从中无法检测出生长停滞期GAS5的累积(Fig.2C,Fig.3E)。GAS5_2B和GAS5_4A有相似的序列,因此条带④的出现意味着二者至少其中之一出现在4种细胞系的两个时期(Fig.2D)。
观察扩增子的大小,条带②(Fig.2C)和条带⑤(Fig.2D)与本研究参考的剪接变异体无对应关系,可知GAS5存在其他剪接变异体。GAS5_3A水平随HL-60细胞密度增加呈下降趋势。在其他细胞系中,GAS5_3A水平与细胞密度无关(Fig.2C)。当培养密度达到饱和时,GAS5_1B的表达水平在3个细胞系中有增加趋势,但在K562细胞系中保持不变(Fig.2D)。
2.2 生长阻滞特异性转录因子5剪接变异体在K562单克隆株中的功能评估
使用不同浓度的IM,即0.1 μmol/L、0.3 μmol/L或1.0 μmol/L处理K562细胞。在48 h时0.3 μmol/L的IM可以使细胞活性下降50%以上,且可以诱导55%左右的细胞凋亡(Fig. 4),因此,选取此浓度的IM抑制细胞增殖和诱导凋亡。
(1)短期高表达GAS5各剪接变异体未影响细胞对IM的敏感性
核转染K562细胞的效率是42.2%。核转染各GAS5剪接变异体对K562细胞的基础凋亡水平(Fig.5A)和细胞活性(Fig.5E)无明显影响。上调GAS5_1B、GAS5_2B、GAS5_3A或GAS5_4A表达水平不能影响K562的基础增殖水平,而上调GAS5_O1或GAS5_AE表达水平有促进K562基础增殖水平的趋势(Fig.5C)。高表达GAS5各剪接变异体对克隆形成能力有一定促进作用,例如GAS5_4A和GAS5_O1(Fig.5G)。

Fig.5 Imatinib-induced effects on apoptosis and cell survival in cloned K562 cells transfected with different GAS5 constructs
细胞被转染24 h,以0.3 μmol/L的IM处理细胞(对照组加DMSO),IM促进细胞凋亡(Fig.5B)、抑制细胞增殖(Fig.5D)、降低细胞活性(Fig.5F)、抑制细胞克隆形成(Fig.5H),但GAS5各个转录变异体对IM的作用无进一步的促进或抑制(Fig.5)。
(2)K562稳转株中GAS5_O1表达水平和倍增时间成正比
构建GAS5_O1稳定转染株(即O1-C1至O1-C6、O1-C8),通过实时PCR检测7个稳转株中GAS5的表达水平(Fig.6A)。与对照相比,GAS5_O1稳定转染株在基础细胞活性(Fig.6B-C)和倍增时间(Fig.5E-F)方面无统计学意义上的显著差异。但倍增时间和GAS5的表达水平之间存在一定相关性(R2= 0.5692),即GAS5_O1表达水平高,细胞所需的倍增时间长(Fig.6D)。
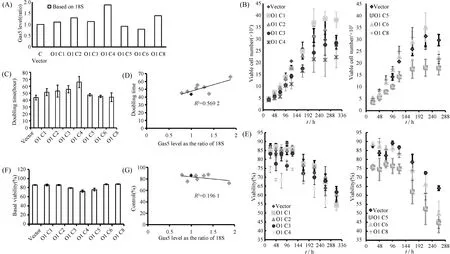
Fig.6 Growth characteristics of K562 clones stably expressing GAS5_O1
(3)K562稳转株中GAS5_O1使细胞对IM敏感
从7个稳转株中挑选O1-C4、O1-C5和O1-C8等3株,以进一步评估GAS5-O1对IM靶向CML细胞作用的影响。O1-C8细胞显示出GAS5-O1促进IM对K562细胞增殖的抑制(56.94% ± 2.84%vs.36.07% ± 2.32%,P<0.05,Fig.7A,B),促进凋亡(29.33% ± 1.30%vs.52.00% ± 2.52%,P<0.05,Fig.7C),以及对细胞活性的抑制(79.06% ± 0.84%vs.65.02% ± 2.20%,Fig.7D)。虽然O1-C4中GAS5表达水平最高,但并未观察到类似现象。
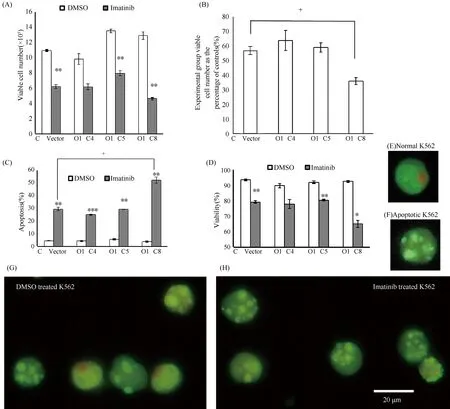
Fig.7 Imatinib-induced effects on K562 stable clones
3 讨论
GAS5被认为是一种肿瘤抑制基因,在骨肉瘤[29]、肝癌[30]、胃腺癌[7]、食管鳞癌[9]、乳腺癌[13-14]、卵巢癌[11,31]、子宫内膜癌[12]的癌组织内GAS5表达水平低于正常组织/癌旁。治疗后GAS5水平下降不利于恶性胸膜间皮瘤患者生存[32]。GAS5的表达水平和肿瘤患者的生存期相关:其高表达和AML[33]、膀胱癌[34]、喉癌[35]患者的良好DFS(无病生存期)相关,与乳腺癌[36]、子宫内膜癌[37]和卵巢癌[38,12,31]患者良好OS以及DFS相关,在肺癌[39]、低级别胶质瘤[40]、结直肠癌[41-44]、前列腺癌[45]、食道癌[46]、宫颈癌[47]、肝癌[48-49]、尿路上皮癌[50-51]中的高表达也可能利于生存。但GAS5并非总是发挥抑癌作用,在B型儿童急性淋巴细胞白血病[52]、肾透明细胞癌[53]和肝癌[54]中,高GAS5表达水平是生存的不利因素。也有研究提出,大肠癌和癌前病变组中GAS5的表达水平显著高于癌旁病变、良性腺瘤和非肿瘤性病变(P<0.05)[55]。因此,GAS5对肿瘤的作用不能一概而论。
GAS5不同剪接变异体可能在癌症中发挥独特的作用,但GAS5的确切机制以及其剪接变异体的分子功能仍缺乏研究报道。已有研究表明,GAS5的2种剪接变异体GAS5_O1和GAS5_AE促进前列腺癌细胞凋亡[8]。在T细胞系中,不同GAS5剪接变异体在不同程度上诱导生长停滞,特别是其中的GAS5_O1在促进细胞凋亡中最为有效[26]。关于B淋巴细胞白血病的报道也指出了相较于正常对照组,GAS5在患者样本中高表达,以及GAS5在细胞系内过表达抑制增殖,引起生长停滞在G1期,并促进凋亡[56]。在人白血病T细胞系CEM-C7和外周血淋巴细胞中,高表达GAS5-1B、-2B、-3A、-4A和-O1均可显著抑制细胞生长,降低克隆形成能力,提高凋亡水平,减缓细胞周期。GAS5的过表达本身就足以诱导白血病细胞和正常外周血淋巴细胞的生长停滞[26]。GAS5_O1过表达在急性T细胞白血病细胞系Jurkat、乳腺癌细胞系MCF-7 和人胚胎肾细胞系HEK 293 T细胞中也有抑制细胞生长和促凋亡的作用。乳腺癌上皮细胞系MCF-10A中过表达GAS5-O1、GAS5-2B和GAS5-3A,会促进细胞在诱导条件(如UV、顺铂等)下的凋亡,而GAS5-1B和GAS5-4A无此作用[4,9]。本研究中,虽然提高GAS5_AE和GAS5_O1的表达在短期有增加细胞增殖的趋势,但延长培养时间,在稳定转染株中观察到,GAS5_O1表达水平的提高和K562细胞倍增时间的增加呈正相关,体现出一定的抑制肿瘤细胞增长的作用。多数文章认为,GAS5引起的生长停滞和细胞周期有关,且增高GAS5表达水平可以使得G1期细胞增多,S/G2/M期的细胞减少,反之亦然[57-61]。据此推测,GAS5_O1引起的生长停滞和细胞周期有关,GAS5高表达可使G1期细胞增多。此外,本研究观察到,GAS5_3A水平随HL-60细胞密度增加呈下降趋势,淋巴细胞白血病细胞系也有类似的表现[26]。GAS5_4A对K562细胞的集落形成能力有一定促进作用,但GAS5剪接变异体GAS5_1B、GAS5_2B、GAS5_3A、GAS5_4A和GAS5_AE对细胞的增殖、凋亡、克隆形成等方面无统计学意义上的作用。
Zhang等人[62]关于GAS5 剪接变异体的研究则是专注于GAS5-007(即Ensembl中的GAS5-227),雄激素受体抑制GAS5-007的表达。GAS5-007在肿瘤样本(n=14)中的表达高于正常组织(n=11)。不同于一般认为的GAS5是肿瘤抑制因子,GAS5-007显现出促瘤的作用。下调GAS5-007,下调LNCaP细胞活性、细胞增殖被抑制(细胞周期G1期增长、S和G2期下降)、凋亡水平增加。而GAS5-001(即GAS5_AE、GAS5_V1(NCBI)或GAS5-221(Ensembl 20220))被广泛报道为一种抑瘤的剪接变异体。本文结果显示,K562细胞在生长停滞期也有一定程度的GAS5_AE累积。但其他内源性GAS5剪接变异体在4种髓系白血病细胞系的生长停滞期和指数生长期中的表达水平无明显差异。
观察扩增子的大小,可知GAS5剪接变异体不只有GAS5_1B、GAS5_2B、GAS5_O1、GAS5_3A、GAS5_4A、GAS5_AE这6种。本文主要参考Mourtada-Maarabouni等人(2008)EST分析所得的GAS5剪接变异体(见Fig.1A[26])和NCBI列出的50种只包含外显子的剪接变异体(Fig.1B示意其中的15种)。而除此之外,Ensembl数据库推测有29种(目前更新到31种http://nov2020.archive.ensembl.org/,Fig. 1C)非冗余剪接变异体,其中包括保留有内含子的转录本[63-64]。Xu等人[65]通过UCSC数据库(The UCSC Genome Browser database,GENCODE V43)92条序列(http://genome.ucsc.edu/)分析出至少25种GAS5剪接变异体,其中GAS5 003长度最长(2 554 bp)。参考以上数据库,条带①除了从外显子2到外显子12完全由GAS5外显子组合的可能性之外,未见外显子和内含子共存的组合与之相符。根据UCSC数据库推测,条带②(Fig.1C)可能对应到剪接变异体ENST00000688557.1,即外显子9和10相连,之后链接内含子10、外显子11、内含子11和外显子12。条带⑤可能包括:内含子9、外显子10、11和12(与GAS5-213、ENST00000686918.1、ENST00000685008.1相符),或内含子9、外显子11和12。尽管GAS5基因不编码蛋白质产物,但变体剪接的模式比已有推测更为复杂。造成这种复杂剪接模式的原因尚不清楚。需要对这些无对应关系的条带开展进一步分析,以确定它们的序列。条带①大小约600 bp,更接近于外显子7b所能带来的长度。在大多数细胞中主要表达的是含有较长的外显子7的GAS5_AE[25-26]。外显子7b多出于7a的GTAAGGACATG AAGACAGTTCCTGTCATACCTTTTA AAG序列也出现在人MDN1(midasin AAA ATPase 1)基因的内含子中,而具体功能还有待进一步研究。
此外,本文参考的GAS5剪接变异体都保有外显子12,多数推测的GAS5剪接变异体中也含有外显子12,其中的茎环结构可以作为诱饵(称为GRE-mimic),与糖皮质激素响应元件(glucocorticoid response element,GRE)竞争糖皮质激素受体(glucocorticoid receptor,GR)的DNA结合位点[4]。GAS5参与调节GR的转录活性,而GR诱导某些响应糖皮质激素的抗凋亡基因的转录活性(如细胞凋亡抑制因子cIAP2、血清和糖皮质激素调节蛋白激酶SGK1)[4,66]。GAS5竞争性的与GR结合可以阻碍由GR诱导的 DNA 转录[67],从而有促进凋亡的作用。但多数GAS5剪切变异体包含外显子12,然而作用各异,且GAS5总水平和增殖凋亡相关性低,因而以上研究提出的外显子12的作用在很多GAS5剪切变异体中并未体现出来。并且有研究表明,糖皮质激素可诱导凋亡[67-68],相关机制无法解释GAS5的促凋亡作用。
综上所述,髓系白血病细胞系在指数生长期和生长停止期存在GAS5_2B和/或GAS5_4A、GAS5_1B、GAS5_3A、GAS5_O1和GAS5_AE的表达。此外,还可能存在ENST00000688557.1和GAS5-213、ENST00000686918.1和/或ENST00000685008.1的表达。进入细胞密度生长停滞期,其中的GAS5_AE表达存在一定程度的累积。GAS5_O1的表达水平和K562细胞倍增时间成正比。GAS5_O1对K562细胞受IM作用敏感性有一定影响,但与GAS5表达水平不相关。
