铁死亡相关的环状RNA在疾病中的作用及机制
2024-04-23何梦婕龙方懿
王 芹, 何梦婕, 龙方懿
(四川省妇幼保健院/成都医学院附属妇女儿童医院实验医学中心, 成都 610032)
环状RNA(circular RNA, circRNA)于1971年在马铃薯纺锤茎块类病毒中被首次发现[1]。它们种类丰富且具备多种生物学功能,例如,转录调节、miRNA海绵、结合及降解蛋白质等[2]。近年来circRNA在各种疾病中的作用不断被报道,揭示了它们作为临床诊断生物标志物和治疗靶点的潜力[3]。铁死亡是一种调节性细胞死亡,它的发生已被证实与细胞内的铁稳态被破坏、脂质代谢紊乱和氧化应激密切相关[4]。一些信号通路在铁死亡的调控机制中发挥了重要作用,其中最广为人知的2条途径就是胱氨酸/谷氨酸逆向转运体(system xc-)和谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)[5],可调节细胞内谷胱甘肽(Glutathione, GSH)水平,催化GSH还原过量的脂质过氧化物。越来越多研究揭示了非编码RNA对铁死亡的调控作用[6, 7],证实了表观遗传调控机制在疾病发展中的重要性。随着研究的不断深入,circRNA调控铁死亡的机制也在不断地拓展。本文将总结铁死亡相关circRNA的作用机制和药物开发策略,探索以circRNA为铁死亡靶点开发药物的可能性,为未来铁死亡相关治疗药物的开发提供新的见解。
1 环状RNA的形成和功能
CircRNA的形成和功能在生理病理过程中具有重要作用。其形成涉及多种复杂的机制,如反转录、选择性剪切和内含子转录后剪切等,导致了多种类型的circRNA生成。这些过程在细胞水平上调控着circRNA的丰度和多样性。功能上,circRNA参与基因表达的调控,包括对转录和翻译的调节,同时在细胞信号传导中发挥着关键作用,影响细胞的生命周期、增殖和凋亡。此外,它们还在维持细胞稳态和对外部环境刺激的应对中扮演着关键角色。
1.1 环状RNA的形成
CircRNA主要有3种类型[8],分别为外显子circRNA(exonic circRNA, ecircRNA)、外显子-内含子circRNA(exon-intron circRNA, EIcircRNA)和内含子circRNA(intronic circRNA, ciRNA)。EcircRNA在细胞质中存在,而EIcircRNA和ciRNA则位于细胞核中[9]。这3种circRNA的形成可以通过2种模型解释:外显子跳跃(套索中间体)模型和直接反剪接模型。在“外显子跳跃”模型或“套索中间体”模型中,跳跃外显子规范剪接后,相邻外显子反向剪接形成内含子套索中间体,最终生成ciRNA[2]。“直接反剪接”模型从下游的5′剪接位点通过外显子反向连接到上游的3′剪接位点,生成EcircRNA和EIcircRNA,并形成外显子-内含子-外显子中间体,进一步生成线性RNA[10]。2种模型的提出有效解释了circRNA的形成机制,且可通过分析剪接过程的中间产物,对circRNA的产生机制进行区分。
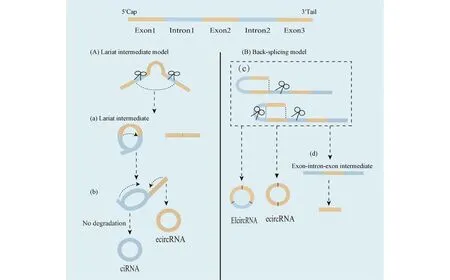
Fig.1 The biogenesis of circRNA
1.2 环状RNA的功能
CircRNA的功能对于解释其在疾病中的作用至关重要。通过了解circRNA的功能可揭示其在调控铁死亡过程中的分子机制,有助于全面理解不同疾病中铁死亡的发展过程,为疾病治疗提供更准确的依据,推动精准医学的发展。
1.2.1 转录调节 环状RNA不仅通过形成R环结构与DNA亲本基因位点相互作用,也与U1小核核糖核蛋白(small nuclear ribonucleic proteins, snRNPs)或RNA聚合酶Ⅱ(RNA polymeraseⅡ, PolⅡ)相互作用,影响转录延伸[3, 11]。例如,在拟南芥中[12],circSEP3能与同源DNA形成R环,导致转录暂停。此外,环状RNA可以通过共激活转录因子(transcription factor, TF)或海绵化微RNA(microRNA, miRNA)来调节转录。例如,在间叶性肿瘤细胞中,circPOK可以增强白细胞介素增强结合因子2(interleukin enhancer-binding factor 2, ILF2)/ ILF3复合体与白细胞介素-6(interleukin-6, IL-6)近端启动子区域的亲和力,提高ILF2/3在调节IL-6 mRNA转录和稳定性方面的能力[13]。
1.2.2 翻译功能 CircRNA利用帽不依赖性翻译起始替代机制进行翻译,内部核糖体位点(internal ribosome entry site, IRES)是最早发现的帽不依赖性翻译起始机制之一,IRES上富含AU序列及18S rRNA互补序列,并有助于其被特异性识别[14, 15]。另一种circRNA翻译起始机制由N6-甲基腺苷(N6-methyladenosine, m6A)介导,该过程受到多种因素的调控,包括甲基转移酶样蛋白3(methyltransferase-like 3, METTL3)、METTL14、脂肪含量和肥胖相关蛋白(fat mass and obesity-associated protein, FTO)以及应激状态等[16, 17]。滚环翻译是circRNA进行多肽扩展时的主要机制,通常需要特定类型核糖体结合位点或IRES来启动,常发生在无终止子的circRNA中[18]。该过程不需要核糖体解离和重新装配,显著提高了circRNA的翻译效率[8]。
1.2.3 与RBP相互作用 CircRNA可与RNA结合蛋白(RNA-binding protein,RBP)相互作用,RBPs参与circRNA的多种调控过程,包括转录、翻译、转运和降解:RBPs可以通过内含子序列驱动circRNA的循环化[19];RBPs通过IRES和m6A参与circRNA的翻译[20];通过结合位点影响circRNA的核输出[21];通过引导核酸内切酶降解circRNA[22]。circRNA对RBPs的功能有重要影响:circRNA可以作为RBPs的支架和海绵,促进蛋白质间相互作用[23];增强RBPs与mRNA的结合,稳定mRNA并提高翻译效率[24];调节RBPs在细胞内的转运[25];将RBPs募集到特定位点,改变细胞内的生物调控[26]。
1.2.4 miRNA海绵功能 CircRNA可以通过与miRNA结合影响靶基因的表达,参与细胞生命活动的调控。一个circRNA可以结合多种miRNA。例如小脑变性相关蛋白1反义转录本CDR1as,也被称为ciRS-7,最初被发现拥有超过70个miR-7保守结合位点[27]。它已确认可以与多种miRNA(例如miR-671、miR-92等)相互作用,参与了数十种癌基因的调控,被认为是一个潜在的癌症治疗靶点[28]。circRNA作为miRNA海绵对不同疾病的调控作用可能不同。例如,circ-ITCH可以通过海绵化miR-17和miR-224,抑制膀胱癌细胞的增殖和侵袭[29];而在骨肉瘤(osteosarcoma, OS)中,circ-ITCH通过作为miR-7的海绵,促进癌细胞的增殖和转移[30]。
2 铁死亡的调节及在疾病中的作用
铁死亡是一种与细胞铁代谢紧密相关的特殊细胞死亡机制。它的核心特征包括细胞内铁离子的代谢失衡,通常由铁的积累或分布异常引起,以及脂质代谢的紊乱,这种异常铁代谢状态诱发氧化应激反应,导致线粒体结构和功能的受损,同时还伴随着其他细胞内病理学过程[4]。最终,这一连锁反应导致细胞不可逆地走向死亡。
2.1 铁代谢
铁的代谢调节涉及铁的摄取、储存与转运等。食物中的铁由二价金属转运体1(divalent metal transporter 1, DMT1)或血红素载体蛋白1(heme carrier protein 1, HCP1)转运至肠细胞,并经由铁转运蛋白1(ferroportin 1, FPN1)外排进入循环[31, 32]。血清中,Fe2+被氧化为Fe3+,并通过转铁蛋白受体1(transferrin receptor 1, TFR1)进入细胞中,在前列腺家族成员3(six-transmembrane epithelial antigen of prostate 3, STEAP3)作用下还原为Fe2+[33]。细胞内的铁有2种存在形式,由游离铁组成的不稳定的铁池(labile iron pool, LIP)和由血红蛋白(hemoglobin, Hb)、硫原子及铁蛋白形成的血红素、铁硫簇及铁蛋白等复合物[34]。一些蛋白质负责铁的转运和储存,例如核受体共激活因子4(nuclear receptor coactivator 4, NCOA4)介导铁蛋白的选择性自噬,释放细胞内不稳定的Fe2+,引发Fenton反应产生大量的活性氧自由基(reactive oxygen species, ROS)诱导铁死亡[35]。其他蛋白质例如突起蛋白2(prominin 2, PROM2)则协助将铁从细胞中运出[36]。在线粒体内,铁通过一系列酶的作用,例如氮固定S样蛋白1(nitrogen fixation S (NIFS)-like 1), NFS1)和铁硫团簇组装酶(iron-sulfur cluster assembly enzyme, ISCU),生成铁硫簇(Fe-S)[37]。并通过CDGSH铁结构域蛋白1(CDGSH iron sulfur domain protein 1,CISD1)和CISD2减少线粒体的铁摄取[38, 39]。这些机制共同调控细胞内铁的平衡。
2.2 脂代谢
脂代谢在铁死亡的过程中扮演着维护细胞膜完整性、调控细胞信号传导和提供能量等关键角色。脂质代谢通路的紊乱可能导致脂质过氧化和破坏细胞膜结构,触发细胞死亡。同时,脂质代谢的调控也可能影响铁死亡相关的信号传导途径。因此,深入了解脂代谢在铁死亡中的作用对于揭示相关疾病机制、开发治疗策略具有重要意义。
2.2.1 脂质合成 多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)掺入细胞膜磷脂(phospholipid, PL)对于铁死亡信号的产生是必要的[40]。花生四烯酸(arachidonic acid, AA)和肾上腺酸(adrenic acid, AdA)产生的PUFA-PLs对过氧化尤其敏感[41]。该过程需要酯酰辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain familymember4, ACSL4)和溶血磷脂酰胆碱酰基转移酶3(lysophosphatidylcholine Acyltransferase 3, LPCAT3)的参与[42]。单不饱和脂肪酸(monounsaturated fatty acids, MUFAs)是铁死亡的有效抑制剂,其抑制机制主要是与PUFAs竞争PL的合成[43]。饱和脂肪酸(saturated fatty acid, SFA)生成的具有sn1脂肪酸酰基链的醚连接PL,也会影响铁死亡的敏感性[44]。而硬脂酰辅酶A去饱和酶-1(stearoyl-CoA desaturase 1, SCD1)催化SFA底物产生MUFAs[45]。
2.2.2 脂质过氧化 脂质过氧化(lipid peroxidation, LPO)涉及两种反应类型:非酶促和酶促[4]。非酶促LPO是由芬顿(Fenton)反应引发的,涉及细胞内铁和氧的连锁反应,导致磷脂氢过氧化物(phospholipid hydroperoxide, PLOOH)生成,从而损害细胞膜磷脂[46]。酶促的LPO则由铁依赖性酶催化,例如脂氧合酶(lipoxygenases, LOX)和细胞色素P450氧化还原酶(cytochrome P450 oxidoreductase, POR),它们促使PLOOH生成[41, 47]。GSH在减少氧化的细胞内成分中发挥关键作用[85]。在机体内,有2种GSH依赖性的抗氧化途径:System xc-和GPX4[6]。System xc-由溶质载体3家族膜2(solute carrier family 3 member 2, SLC3A2)和溶质载体7家族膜11(solute carrier family 7 member 11, SLC7A11)(又名xCT)组成,它们负责向细胞内运输胱氨酸,用于GSH的生物合成[48]。GPX4作为铁死亡的核心调控蛋白质,通过催化GSH和其他硫醇提供电子,将细胞膜上的PLOOH还原为相应的醇,从而防止氧化损伤[46]。此外,辅酶Q10(CoQ10)是一种GSH非依赖性的抗氧化途径。氧化形式的CoQ10由铁死亡抑制蛋白1(ferroptosis-suppressor-protein 1, FSP1)(又名AIFM2或AMID)介导还原为泛醇,并清除LPO中间体,阻止LPO产物的增殖[49]。
2.2.3 脂质的储存和降解 细胞内脂质主要以三酰基甘油(triacylglyceol, TAG)的形式,储存于脂滴(lipid droplet, LD)中,并通过TAG降解释放游离脂肪酸(free fatty acid, FFA)[50]。LDs的形成作为一种细胞抗氧化保护机制,通过将PUFA从细胞膜转移到脂滴的核心,减弱过氧化的影响[51]。脂质储存和降解的信号调节分子,参与调节铁死亡。例如,脂肪酸结合蛋白(fatty acid binding protein, FABP)通过增强FA摄取和储存来抑制铁死亡[52];增强肿瘤蛋白D52(tumor protein D52, TPD52)依赖性脂质储存或阻断自噬相关基因5(autophagy-related gene 5, ATG5)依赖性脂质降解,能抑制铁死亡诱导剂RSL3诱导的LPO及随后的铁死亡[53]。
2.2.4 脂质的转运和β氧化 细胞内的FA既可以从头合成,也可以从细胞外经被动转运或由脂肪酸转运蛋白质,例如脂肪酸转位酶(fatty acid translocase, FAT/CD36)、脂肪酸转运蛋白(fatty acid transport protein, FATP)、FABP主动转运至细胞中[54, 55]。细胞内较高的FA转运通过诱导LPO和铁死亡,导致脂毒性[56]。线粒体脂肪酸β氧化(fatty acid β-oxidation, FAO)是FA降解的主要途径,其通过降低未酯化的PUFAs可用性负调控铁死亡,维持人体能量稳态[57]。在FAO之前,FA需在ACSL的催化下转化为脂酰辅酶A(acyl CoA)[58]。并经由肉碱棕榈酰转移酶-1(carni-tine palmitoyltransferase fattyacids1, CPT1)转运进入线粒体,这一步是FAO的关键调控位点,受到多种信号分子调控[59]。例如,FAT与CPT1相互作用,促进FA进入线粒体进行氧化[60];在缺氧条件下,缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)与CPT1启动子结合以增加CPT1的转录[61]。
2.3 铁死亡在疾病中的重要作用
铁死亡与铁代谢失衡、氧化应激和炎症等关键因素密切相关,参与多种疾病的发生和发展。了解铁死亡在疾病中的分子机制和其作用,有助于为未来疾病治疗策略提供新靶点和方向。
2.3.1 肿瘤 铁死亡在肿瘤发展中发挥着双重作用。一方面铁死亡不利于肿瘤进展。首先,铁死亡抑制肿瘤生长。例如在肺癌和胶质母细胞瘤(glioblastoma, GBM)中,细胞内LIP增加,会使细胞触发铁死亡,减缓体内肿瘤生长[62, 63]。其次,铁死亡与癌症耐药密切相关。例如,结直肠癌(colorectal cancer, CRC)细胞通过降低铁水平以及上调GPX4和xCT等组分的表达,抑制铁死亡,导致CRC细胞对5-氟尿嘧啶的耐药性[64];类似的,在肺腺癌(lung adenocarcinoma, LUAD)中抑制铁死亡的GPX4上调诱导表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKI)耐药[65]。最后,抑制铁死亡有助于癌症的侵袭和转移。例如,淋巴系统中增加的MUFAs水平以ACSL3依赖的方式来保护黑色瘤细胞免受铁死亡,并增加其形成转移性肿瘤的能力[66];骨肉瘤中,SLC7A11的表达增加,通过抑制骨肉瘤铁死亡,促进肺转移[67]。另一方面,铁死亡通过引发肿瘤微环境(tumor microenvironment, TME)中的免疫抑制促进肿瘤生长。Dai等人对胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)的研究表明,铁死亡不仅支持PDAC中炎性TME的形成,还通过自噬依赖的机制促使PDAC细胞释放和摄取Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten ratsarcoma viral oncogene homolog, KRAS)蛋白,并驱动肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)极化,限制抗肿瘤免疫[68, 69]。Liu等人也在GBM细胞中发现,铁死亡可以促进TAMs募集和极化为M2样表型诱导免疫抑制和免疫治疗耐药[70]。
2.3.2 神经系统疾病 神经系统疾病与铁稳态失衡和LPO相关。帕金森病(Parkinson’s disease, PD)的主要病理特征是黑质中多巴胺能(dopamine, DA)神经元的退化[71]。其发病原因与黑质中DMT1、铁蛋白重链1(ferritin heavy chain 1, FTH1)、脂质运载蛋白-2(lipocalin 2, LCN2)介导的铁积累相关[72-74]。DA神经元中的GPX4和GSH可对抗氧化应激,减轻神经退行性[75]。阿尔兹海默症(Alzheimer’s disease, AD)中,脑铁含量升高显示出了对AD的不利影响[76]。海马体中FPN1的下调可能导致AD的进行性脑萎缩[77]。而在GPX4过表达的条件下,认知障碍和神经变性均得到改善[78]。肌萎缩侧索硬化症(amyotrophic lateral sclerosis, ALS)是由运动神经元选择性变性引起的。ALS中,GPX4缺乏可导致LPO,从而导致运动缺陷。GPX4过表达可恢复铁死亡的防御作用,抑制LPO和运动神经元死亡,改善运动功能和预后[79]。出血性卒中(intracerebral hemorrhage, ICH),作为中风的类型之一,是常见的致残性神经损伤原因。其发展为脑损伤(SBI)的主要原因包括氧化应激和血红素铁引起的神经元不可逆损伤相关[80]。N-乙酰半胱氨酸通过消除AA依赖性花生四烯酸5-脂氧酶(arachidonate 5-lipoxygenase, ALOX5)产生的毒性,改善ICH早期的神经功能恢复[81]。而SBI可在恢复GPX4水平后得到明显缓解[82]。
2.3.3 其他疾病 除了肿瘤和神经系统外,铁死亡在其他疾病中也发挥着重要作用。急性肾损伤(acute kidney injury, AKI)常见于多种疾病,例如肾缺血、败血症和肾小球肾炎,也可能是由造影剂和化疗药物等引起[83]。AKI与铁死亡调节因子的异常表达相关,恢复SLC7A11、GPX4水平或敲除ACSL4会显著提高肾小管上皮细胞的活性[84]。此外,顺铂引发的急性肾损伤可通过线粒体自噬和减弱LPO逆转由GPX4下调引起的肾小管上皮细胞铁死亡[85]。铁死亡还参与多种妇科疾病的发展,例如,先兆子痫(preeclampsia, PE)人体胎盘组织中发现GPX4和FPN1的表达降低,补充铁死亡抑制剂能减轻大鼠PE模型的症状[86];在多囊卵巢综合征(polycystic ovary syndrome, PCOS)模型中,LPO水平升高,促进颗粒细胞的铁死亡[87];子宫内膜异位症(endometriosis, EMs)中发现子宫内膜基质细胞中GPX4表达的增强,加速了其增殖和迁移[88]。
3 环状RNA对疾病铁死亡的调控作用
近年来,越来越多研究发现circRNA参与了铁死亡对多种疾病的调控过程之中。目前circRNA在铁死亡中的作用形式较为多样化,以miRNA海绵作用居多;其次,circRNA还能作为蛋白质支架以及RNA结合蛋白调控因子,甚至还可以直接与疾病靶点相互作用而发挥铁死亡调控作用。深入了解circRNA与铁死亡的调控关系有望为疾病的诊断和治疗提供新途径。
3.1 肿瘤
CircRNA可以通过多种途径参与肿瘤细胞铁死亡的调控过程,对肿瘤细胞的生存、增殖和耐药性等方面产生影响,进而影响肿瘤的发生与发展。
3.1.1 肝癌 CircRNA在肝细胞癌(hepatocellular carcinoma, HCC)中通过多种机制参与铁死亡的调控,影响HCC的发展。首先,circRNA能充当miRNA的海绵,通过直接或间接调节铁死亡的关键靶点。例如,circIDE作为miR-19b-3p的海绵,上调RNA 结合蛋白1(RNA binding motif single stranded interacting protein 1, RBMS1)的表达,减低HCC细胞内GPX4的稳定性,促进细胞铁死亡,从而抑制HCC的进展[89]。相反,circIL4R作为miR-541-3p的海绵,增加GPX4的表达,减轻miR-541-3p引起的铁死亡,促进HCC的发展[90]。而circ0097009通过海绵化miR-1261,上调SLC7A11的表达,抑制HCC细胞的铁死亡,促进HCC的发展[91]。其次,circRNA可以通过募集RBPs参与HCC细胞的铁死亡调控。Wilms瘤1相关蛋白(Wilms tumor 1-associated protein, WTAP)介导的m6A甲基化在HCC发生中扮演重要角色[92]。研究发现,WTAP通过介导circCMTM3的m6A修饰,募集胰岛素样生长因子2 mRNA结合蛋白1(insulin-like growth factor 2 mRNA-binding protein 1, IGF2BP1)以增加PARK7(Parkinson’s disease protein 7)稳定性,抑制HCC细胞铁死亡[93]。最后,circRNA通过与RBPs相互作用,参与HCC铁死亡的调控。例如,cIARS通过与脱甲基化酶ALKBH5(AlkB homolog 5)相互作用,逆转由ALKBH5介导的自噬抑制,正向调控索拉非尼(Sorafenib,SF)诱导的HCC细胞铁死亡[94]。
3.1.2 肺癌 CircRNA在肺癌中扮演着重要角色,尤其在调控铁死亡方面。CircRNA通过参与脂质代谢相关靶点的调控来影响肺癌细胞的铁死亡。例如,在LUAD中,cir93可以与FABP3相互作用,增加了FABP3对AA的转运,降低了细胞对铁死亡的敏感性[95]。类似的,circSCN8A通过作为竞争性内源RNA海绵化miR-1290,增强了ACSL4的表达,从而促进非小细胞肺癌(non-small cell lung cancer, NSCLC)细胞的铁死亡,抑制了NSCLC的增殖、迁移和上皮-间充质转化(epithelial-mesenchymal transition, EMT)[96]。此外,circRNA还能通过调控抗氧化系统,参与肺癌铁死亡。例如,circP4HB和circ_0070440在LUAD中的表达水平升高,它们分别作为miR-1184和miR-485-5p的海绵,上调SLC7A11表达,保护LUAD细胞免受铁死亡损伤,从而促进LUAD恶性进展[97, 98]。而在NSCLC中,circDTL能作为miR-1287-5p的海绵,上调GPX4的表达,抑制细胞铁死亡和凋亡以发挥致癌作用,而沉默circDTL可促进NSCLC细胞对化疗药物的敏感性[99]。
3.1.3 乳腺癌 乳腺癌(breast cancer, BC)是全球女性最常见的癌症之一。近期发现,circRNA在抑制乳腺癌细胞铁死亡,促进乳腺癌进展中发挥重要作用。首先,circRNA参与了抗铁死亡途径中的关键靶点的调控。例如,circGFRA1在HER-2阳性的乳腺癌细胞中显着上调,它作为miR-1228海绵上调AIFM2和GPX4的表达,抑制肿瘤细胞的铁死亡,这表明靶向上述2种途径可能会成为改善HER-2阳性乳腺癌治疗效果的潜在策略[100]。其次,CircRNA可以充当铁死亡相关蛋白质相互作用的桥梁。例如,circ-BGN的存在可以增加曲妥珠单抗耐药的乳腺癌细胞去泛素化酶1(OTU domain-containing ubiquitin aldehyde-binding protein 1, OTUB1)和SLC7A11的结合,从而稳定SLC7A11蛋白,提高GSH含量和GPX4活性,进而抑制乳腺癌细胞的铁死亡[101]。最后,circRNA作为miRNA海绵调控癌症相关信号靶点,影响乳腺癌细胞的铁死亡。例如,circRHOT1通过海绵化miR-106a-5p,靶向信号转导及转录激活蛋白3(signal transducer and activator of transcription 3, STAT3),抑制了铁死亡,从而推动了乳腺癌的恶性进展[102]。
3.1.4 食管癌 缺氧已被证明可通过抑制铁死亡来促进肿瘤的发展[103, 104]。通常情况下,铁死亡常与肿瘤生长抑制相关,但Xin等人的研究表明[105],在食管癌(esophageal cancer, EC)中,缺氧诱导的circBCAR3不仅促进了铁死亡,还导致了食管癌的进展,这其中与circBCAR3通过海绵miR-27a-3p促进运输蛋白1(transportin-1, TNPO1)的表达有关。此外,circRNA还能通过调控铁死亡,在食管癌治疗中发挥化学增敏剂的作用。Yao等人的研究发现[106],在具有化学抵抗性的食管鳞状细胞癌(ESCC)细胞中,circPVT1通过上调ESCC细胞中的GPX4和SLC7A11水平,减弱了食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)细胞的铁死亡,从而抑制了5-氟尿嘧啶化学敏感性。
3.1.5 胶质瘤 胶质瘤是一种常见的脑瘤,circRNA在其发病机制中具有重要作用。CircCDK14、circ-TTBK2和circLRFN5均可抑制胶质瘤细胞铁死亡,但它们的调控机制及在胶质瘤细胞中的表达存在差异。CircCDK14和circ-TTBK2在GBM细胞中过表达,circCDK14通过海绵化miR-3938上调血小板源生长因子受体α(platelet-derived growth factor receptor α, PDGFRA)的表达,降低胶质瘤细胞对铁死亡的敏感性[107]。而Circ-TTBK2作为miR-761的海绵,上调整合素β8(integrin beta8, ITGB8)的表达,抑制GBM细胞的铁死亡[108]。相反,circLRFN5在胶质瘤中下调,它可以与成对相关的同源基因盒2(paired related homeobox 2, PRRX2)蛋白结合,并通过泛素介导的蛋白酶体途径促进其降解,抑制PRRX2介导的GCH1(GTP Cyclohydrolase 1)表达上调,通过减少四氢蝶呤(tetrahydropterin, BH4)的产生来促进铁死亡[109]。
3.1.6 结直肠癌 CircRNA在CRC中作为miRNA海绵发挥铁死亡调控作用。一方面,circRNA通过调控癌症因子,参与CRC细胞铁死亡。例如circABCB10在CRC中充当了miR-326海绵,通过上调RC细胞中CC基序趋化因子配体5(C-C motif chemokine ligand 5, CCL5)的表达,促进了CRC细胞铁死亡和细胞凋亡[110, 111]。类似的,circ_0007142作为miR-874-3p的海绵,上调CRC细胞中甘油磷酸二脂酶磷酸结构域5(phosphodiesterase domain containing 5, GDPD5),抑制CRC细胞铁死亡[112]。另一方面,circRNA还通过调控CRC抗氧化相关靶点,调控铁死亡。例如,circSTIL在CRC中显着上调,它通过miR-431/SLC7A11信号传导,促进CRC细胞增殖,抑制铁死亡[113]。
3.1.7 胃癌 越来越多研究证实,胃癌(gastric cancer, GC)中circRNA通过作为miRNA海绵参与其细胞铁死亡的调控。例如,Jiang等人的研究表明[114],circ_0000190通过海绵化miR-382-5p正向调节锌指环指蛋白3(zinc and ring finger3, ZNRF3)的表达,诱导GC细胞铁死亡,并抑制胃癌的增殖、迁移和侵袭。与其类似,Gao等人的研究发现[115],hsa_circ_0008035通过miR-302a靶向E2F转录因子7(E2F transcription factor 7, E2F7)抑制胃癌细胞铁死亡,促进胃癌进展。此外,Liu等人的研究表明[116],circRPPH通过miR-375/SLC7A11轴,抑制细胞铁死亡,促进胃癌细胞的干细胞性,揭示了circRNA在调控胃癌铁死亡方面的潜力。
3.2 神经系统疾病
CircRNA调控铁死亡方面的作用除了在癌症研究中被广泛报道以外,在神经疾病中也发挥了相似的调控作用。Yin等人的研究发现,circAFF1在ICH细胞模型中高表达,敲低circAFF1能通过调节miR-140-5p,靶向糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β),抑制ICH损伤并减弱Hb诱导的神经元铁死亡[117]。多项研究证实,ACSL4是miR-3098-3p的下游靶基因,其通过促进铁死亡,加重ACI模型细胞的功能障碍[118, 119]。Circ-Carm1在小鼠海马神经元细胞系(HT22)细胞的急性脑梗死损伤(ACI)模型中高表达,circ-Carm1的缺乏通过调节miR-3098-3p/ACSL4,恢复HT22细胞活力,从而抑制铁死亡以防止ACI[119]。此外,circRNA调控铁死亡的相关机制可能参与神经性疾病的治疗机制。例如,褪黑素作为松果体的主要激素,已被证明是一种出色的铁死亡抑制剂,可以有效的改善创伤性脑损伤(traumatic brain injury, TBI)导致的功能缺陷[120]。在褪黑素治疗后的TBI体内模型和血红素诱导的体外内皮细胞损伤模型中,circPtpn14作为miR-351-5p的海绵上调5-LOX(5-lipoxygenase)的表达,减少了血红素暴露的小鼠脑微血管内皮细胞中的铁死亡和内质网应激[121]。
3.3 其他
CircRNA在多种疾病的铁死亡过程中展现出调控功能,这为深入探讨铁死亡在不同疾病中的发病机制提供了重要线索,也有助于为疾病早期诊断和治疗方案提供潜在的生物标志物和治疗靶点。
3.3.1 糖尿病并发症 糖尿病肾病(diabetic nephropathy, DN)主要与足细胞的病理和形态改变有关。研究表明,DN中mmu_circRNA_0000309通过竞争性海绵化miR-188-3p,促进GPX4表达,从而使铁死亡依赖性线粒体损伤和足细胞凋亡失活[122]。Qin等人的研究表明,circASAP2通过诱导SLC7A11在DN模型中表达,保护肾小球内皮细胞免受铁死亡的影响,相反,circASAP2的表达水平下调,促进了DN模型中的铁死亡,加剧了糖尿病肾病小鼠模型中的肾损伤[123]。糖尿病足溃疡(diabetic foot ulcer, DFU)是一种慢性致残性糖尿病并发症。Circ-ITCH在DFU的体内外模型中被下调,过表达的circ-ITCH通过激活核因子-红细胞分化诱导因子2(nuclear factor erythroid 2-related factor 2, Nrf2)信号通路,缓解高糖诱导的铁死亡,提高人脐静脉内皮细胞的血管生成能力。此外,骨髓基质细胞的外泌体circ-ITCH也以时间依赖性方式抑制DFU小鼠的铁死亡来加速伤口愈合[124]。
3.3.2 视网膜病 糖尿病视网膜病变(diabetic retinopathy, DR)会引起眼底的特定病理变化,是获得性失明的主要原因之一[125]。Zhu等人的研究表明[126],circ-PSEN1和肌动蛋白脱聚蛋白-2(cofilin-2, CFL2)在DR中上调,下调circ-PSEN1通过miR-200b-3p/CFL2轴改善成人视网膜色素上皮细胞中高糖诱导的铁死亡。因此,circ-PSEN1可能是DR的新型治疗靶点。年龄相关性黄斑变性(age-related macular degeneration, AMD)是老年人口严重视力障碍的主要原因。多项研究表示,铁死亡相关的circRNA-miRNA-mRNA网络参与了AMD的发展[127, 128]。Chen等人的研究表明[129],在AMD患者的视网膜色素上皮中,由m6A修饰的circSPECC1能海绵miR-145-5p以阻断其与细胞周期依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A, CDKN1A)的相互作用,减弱RPE细胞氧化应激损伤,维持RPE中的脂质代谢,抑制RPE细胞铁死亡。
3.3.3 多囊卵巢综合症 多囊卵巢综合征(polycystic ovary syndrome, PCOS)是育龄妇女中常见的内分泌疾病,与代谢紊乱相关。近年来有关circRNA及铁死亡在PCOS进展中的作用被不断报道,例如circ_FURIN的耗竭可以通过抑制颗粒细胞的增殖并诱导细胞凋亡,缓解PCOS的发展[130, 131],而circ_0043532通过调节miR-182靶向血清/糖皮质酮激酶 3(serum/glucocorticoid regulated kinase family member 3, SGK3),促进PCOS的颗粒细胞增殖[132];最近,Zhang等人的研究发现,在PCOS患者颗粒细胞中,circRHBG可以通过miR-515-5p/SLC7A11轴抑制PCOS细胞铁死亡[133],进一步揭示了circRNA在PCOS发展中作为铁死亡调控靶点的潜力。
3.3.4 缺血性疾病 缺血性疾病是一类由供应特定组织或器官的血流受到限制,或中断而引发的组织或器官缺血和缺氧的疾病,例如心肌梗死(myocardial infarction, MI)和缺血性卒中。近期研究发现,铁死亡相关的circRNA在缺血性疾病的发展中发挥了重要作用。对于心肌缺血再灌注(myocardial ischemia/reperfusion, MI/R)损伤来说,过表达的circ FEACR通过上调FTH1的表达,抑制心肌细胞铁死亡,保护心血管功能免受MI/R损伤[134]。相反,circHMGA在受损的心肌细胞中上调,并进一步促进了细胞中GPX4和SLC7A11的下调,加剧了心肌细胞的缺血性损伤[135]。心力衰竭(heart failure, HF)是MI的常见并发症,受损心肌细胞中circ_0091761作为miR-335-3p的海绵,上调ACSL4的表达,进一步促进了心肌细胞的铁死亡[136]。另外,对于缺血性卒中,circBBS2的表达降低;但脐带间充质干细胞外泌体中的circBBS2,可增加SLC7A11的表达,抑制铁死亡,从而缓解缺血性卒中。因此,脐带间充质干细胞来源的外泌体被认为是治疗缺血性卒中的有效方法之一[137]。这些发现突显了circRNA在缺血性疾病方面的潜在作用。
4 靶向铁死亡相关circRNAs的药物开发策略
基因治疗和药物递送策略在铁死亡相关的circRNA药物开发中扮演着关键角色。基因治疗可调控与铁死亡相关的circRNA的表达水平,从而影响细胞内的铁代谢和死亡途径。然而,实现这一治疗效果还需要解决药物递送的困难,确保circRNA药物能够稳定、特异性地输送到目标细胞或组织。因此,综合运用基因治疗和先进的药物递送策略,有望推动铁死亡相关circRNA药物的研发,为未来治疗相关疾病提供新的方向。
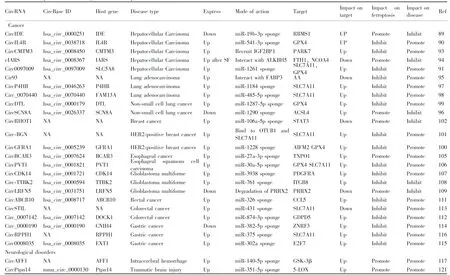
Table 1 Examples of circRNA regulation of ferroptosis in disease
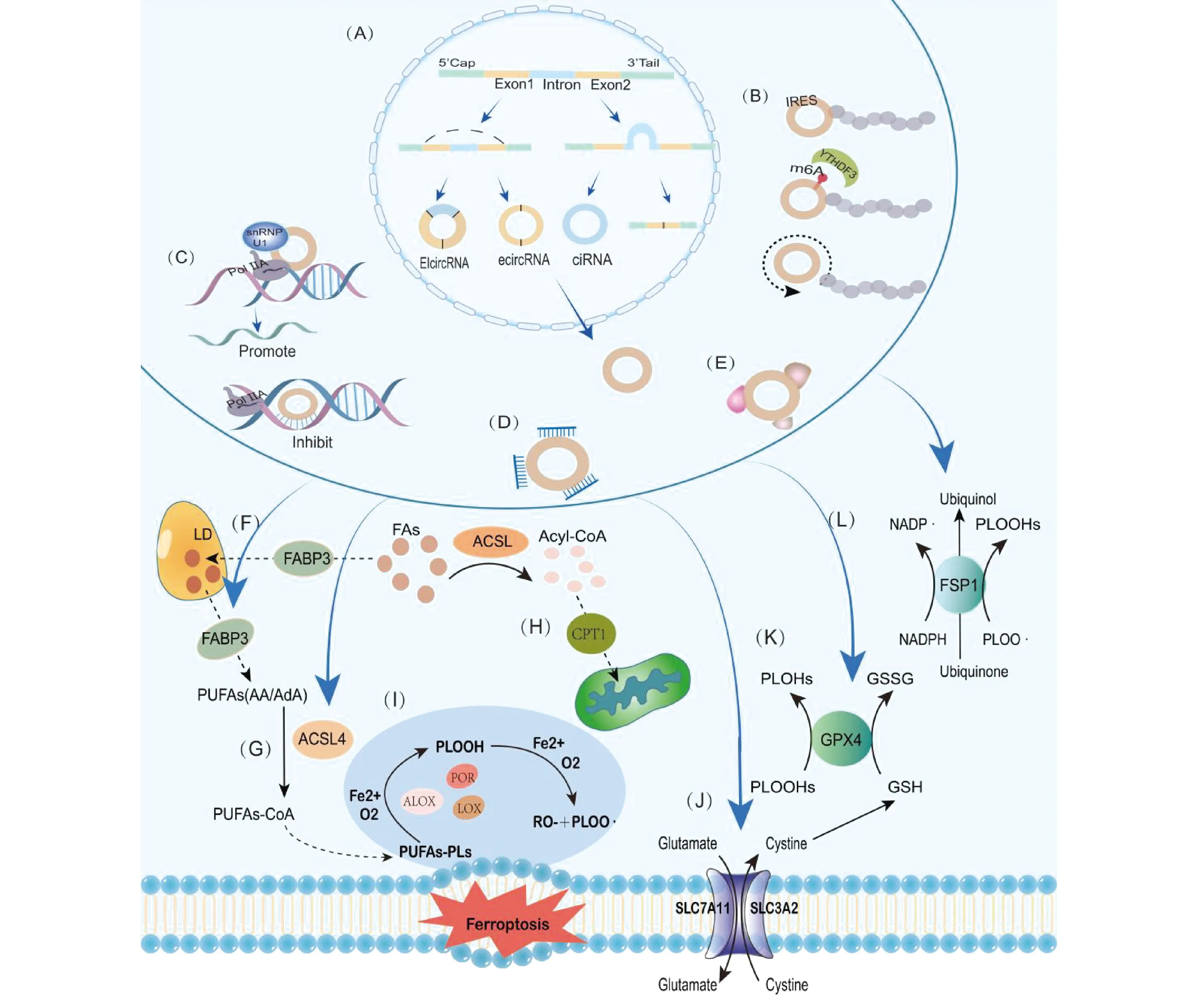
Fig.2 The function and regulatory mechanism of circRNA in ferroptosis
4.1 基因治疗
4.1.1 小干扰RNA技术 目前小干扰RNA(small interfering RNA, siRNA)技术已被广泛用于circRNA靶向铁死亡的机制研究,例如,si-cIARS通过下调HCC细胞中与铁死亡相关的cIARS的表达,显著抑制了细胞对SF或Erastin的敏感性[94]。si-circ-Carm1能下调ACI细胞模型中circ-Carm1的表达,抑制细胞铁死亡并恢复细胞活力[119]。CircFNDC3B shRNA对circFNDC3B的沉默会抑制口腔细胞中GPX4和SLC7A11的表达,并增强ROS、铁和Fe2+的水平[138]。由此,靶向铁死亡相关circRNA的siRNA技术将成为未来药物研发的策略,但由于siRNA技术具有广泛的脱靶效应,其稳健性及特异性较差[139]。因此,在药物开发方面仍然面临挑战。
4.1.2 反义寡核苷酸技术 反义寡核苷酸(antisense oligonucleotide, ASO)技术已被证明可用于改变由circRNA介导而并非线性RNA介导编码的基因位点功能[140]。目前,ASO对circRNA的抑制作用已在体内外肿瘤模型中得到验证。Han等人发现,circLONP2在体外可以增强CRC细胞的侵袭性,通过ASO靶向circLONP2显著降低了体内异物转移的外显率[141]。Jia等人通过靶向circPVT1的ASO抑制了雌激素受体α(estrogen receptor-α, ERα)阳性乳腺癌细胞和肿瘤生长,使他莫昔芬耐药的ERα阳性乳腺癌细胞对他莫昔芬治疗重新敏感[142]。ASO是近几年临床应用开发最多的一类基因靶向治疗药物,目前,以miRNA为靶向治疗各种疾病的ASOs已进入临床试验[143]。因此,circRNA的ASO技术在靶向铁死亡的药物开发中十分具有潜力。
4.1.3 CRISPR/Cas9和CRISPR/Cas13 CRISPR/Cas9和CRISPR/Cas13是近年来靶向circRNA的新策略。Monika等人使用CRISPR-Cas9敲除circRNA Cdr1as基因,导致小鼠神经元中的miRNA失衡,进而损害了脑功能[144]。通过CRISPR/Cas9介导的circRNA cZfp292敲除,成功使血管内皮细胞形态和血流分布出现异常[145]。Ishola等人成功应用了CRISPR/Cas13系统,敲低了NSCLC细胞中hsa_circ_0000190的表达,抑制其在体内外的致瘤特性[146]。这些技术在circRNA抑制方面表现出高度特异性和稳定性,因此,其有望成为未来circRNA抑制剂的良好选择。
4.1.4 人工合成circRNA 人工合成circRNA代表了基因治疗的新方向。这些人工circRNAs不仅具有高蛋白质合成效率和出色的稳定性,还能用于针对性地失活miRNA功能[147]。例如,Wang等人构建了人工circRNA,它同时充当多个miRNA的海绵,抑制了EC细胞中miR-21和miR-93,减少了细胞增殖和迁移,促进了细胞凋亡[148]。Liu等人合成的circRNA不仅对核酸酶具有抵抗性,还能作为miR-21的海绵,抑制GC细胞中miR-21的活性,从而抑制了细胞增殖[149]。由于circRNA在铁死亡中的作用逐渐揭示,人工合成铁死亡相关的circRNA有望成为未来药物研发的趋势。然而,外源性circRNA是否会引发细胞免疫反应仍存在争议,这是未来人工合成环状RNA药物开发中需要解决的主要问题。
4.2 递送策略
目前一些药物递送策略,例如脂质体、纳米材料及病毒载体等技术已被用于解决circRNA在体内输送的稳定性、选择性和效率等问题,确保药物能够有效输送到目标细胞或组织,发挥治疗效果。
4.2.1 脂质体 脂质体(lipid nanoparticle, LNP)作为一种药物或基因的载体,可降低circRNA的免疫原性,为各种难治性疾病开发circRNA疫苗提供了新的前景。Qu等人成功设计了脂质体封装的circRNA,针对新型冠状病毒及其变异株,减少了免疫反应,同时提高了抗原的生成,并在小鼠和恒河猴的动物模型中表现出卓越的免疫效果和保护力[150]。Li等人通过将合成的编码抗原的circRNA包封在脂质体中,建立了一种能够触发强大的先天性和适应性免疫激活的circRNA癌症疫苗,成功地提高了RNA疫苗的稳定性,在多种小鼠肿瘤模型中显示出优越的抗肿瘤功效[151]。因此,脂质体作为circRNA的有效载体,有望为疫苗和治疗策略的发展提供新的可能性。
4.2.2 纳米材料 基于纳米材料和si-circRNA构建的纳米复合物在一些研究中取得了良好进展。Mao等人用聚β-氨基酯(poly(β-amino ester), PBAE)材料制备的PBAE/si-ciRS-7纳米复合物,可显著抑制体内肾细胞癌细胞的增殖、侵袭和转移[152]。Du等人用PBAE建立的siRNA递送系统,提高了siRNA靶向circMDK的稳定性和效率,能够有效抑制体内HCC增殖和转移[153]。Hao等人通过使用壳聚糖(chitosan, Cs)材料构建的CS/si-circPAK1纳米络合物,其对HCC的生长和转移的抑制作用优于单纯的si-circPAK1[154]。因此,基于纳米材料构建的递送系统将成为提高基因靶向治疗效果的策略之一。
4.2.3 病毒载体 腺病毒相关载体(adeno-associated viral, AAV)是以AAV基因组为骨架改造而来的基因递送工具,被广泛用于构建circRNA过表达模型。例如,以腺病毒基因组为基础进行改造,被广泛应用于构建circRNA的过表达模型[155]。Zhang等人设计了AAV-sh-circ0044226,并通过经气管内注射至肺纤维化小鼠模型,成功地抑制了肺成纤维细胞向肌成纤维细胞的转化[156]。而Zhou等人则使用AAV构建了circEPS15的过表达模型,该模型在体内和体外成功保护了DA神经元免受神经毒素诱导的神经退行性的损害[157]。目前,AAV具有体内表达时间长、免疫原性低和安全性高等优点,是解决circRNA递送问题的有效策略。
5 问题与展望
疾病的发展常涉及多种相互作用的因素,包括遗传、免疫、代谢和环境等。在这种多因素影响的背景下,铁死亡作为一种新型的细胞调节性死亡机制引起了广泛关注。它与铁代谢调节及脂质过氧化等多种生物学过程密切相关。近年来越来越多研究揭示了表观遗传机制对疾病铁死亡的调控作用,体现了铁死亡在疾病治疗方面的充分潜力。同时,有部分研究报道了铁死亡通过引发的免疫细胞死亡和免疫激活,在疾病调控方面发挥着双重的作用[158, 159]。然而,铁死亡作为潜在的疾病治疗策略,也面临着诸多问题:例如,如何明确定义铁死亡调控的主要上游靶点和信号传导通路、如何识别各调控机制之间的相互作用、如何明确其在疾病进展中扮演的角色、以及免疫反应如何与铁死亡相互影响,特别在产生与治疗目的相反的结果方面。
近年来,circRNA作为基因研究领域的热点之一,具有多种功能和调控机制,包括作为miRNA海绵、蛋白质结合桥梁、促进蛋白质转运及降解等。最近,铁死亡相关的circRNA在多种疾病中的作用逐渐显现,包括恶性肿瘤、内分泌疾病及神经系统疾病等。目前有相关研究阐述了circRNA在免疫抑制中的作用[178, 179]。然而,circRNA是否参与了铁死亡相关的免疫抑制机制,是未来需要进一步深入研究的方向之一。同时,虽然多种基因技术已初步用于靶向铁死亡相关的circRNA,但如何提高靶向特异性,降低机体免疫原性,是未来我们需要面临的问题。
介于铁死亡相关的circRNA对疾病靶点的复杂作用,我们期望深入探究这一机制,将有助于揭示铁死亡在疾病发展中的双重作用,并为疾病治疗提供新的思路,推动铁死亡相关治疗手段的发展。同时,理解circRNA与其他铁死亡调控机制之间的关系将有助于铁死亡相关药物的开发。目前,随着基因靶向技术和药物递送系统的不断发展和成熟,为未来铁死亡相关circRNA药物的开发和临床应用提供了更多可能性。
