运动:一种双向调控疾病中自噬异常的手段
2024-04-23甄志平薛亚奇
甄志平, 薛亚奇, 刘 纽
(北京师范大学体育与运动学院, 北京 100875)
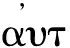
自噬有多种类型,主要可将其概括为3类:分别是巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)[4],本文主要针对巨自噬进行讨论。自噬是一种涉及蛋白质和细胞器降解的细胞途径,是细胞在不利环境中的防御机制,同时也被证实参与各种疾病病理过程[5, 6]。自噬可以保护细胞免受环境刺激,以维持生物体的代谢和平衡。自噬的异常水平可能导致各种疾病的发生[7]。尤其是近些年,其被发现与神经疾病发生之间也存在密切关联[8]。自噬的发生由许多因素均可引起,例如:能量缺乏、氧化应激、细胞器损伤和运动刺激等。运动作为一种与能量代谢及内环境变化密切相关的方式可以调节自噬水平,维持细胞稳态[9]。然而,值得关注的是运动对自噬的调节可能是一个双向的过程。运动可以使疾病诱发的自噬发生水平过低得到提升,或者使由疾病诱发的自噬发生过多得到降低,进而改善相关疾病及症状。本文综述了运动对不同疾病模型中自噬水平的影响,并分析运动发挥的潜在效应,为解释运动促进健康的生物学机制研究方面提供参考。
1 运动与细胞自噬
关于运动与自噬之间的关系,1984年Saliminen团队报道运动与自噬之间的联系,揭示了单次耐力运动可以诱导小鼠骨骼肌自噬活动[10]。随后近40年里,运动与自噬的关系成为研究热点。运动引起自噬的应答是一个受多种因素影响的复杂生理过程,运动时间、强度、周期以及机体的健康状况等条件产生的自噬应答是不一致的。单次30 min 50%最大摄氧量(VO2-max)的运动可以降低大鼠心肌LC3-Ⅱ蛋白质水平[11],单次60 min 50% VO2-max的运动降低了人体骨骼肌内LC3-Ⅱ蛋白质水平[12]。而单次的超耐力运动却提升人体骨骼肌LC3-Ⅱ蛋白质水平[13]。这反映了不同运动强度对机体自噬水平的影响是有差异的。运动周期的设置也会引起自噬应答出现变化。在动物与人体进行长期中等强度训练后发现,长期运动可以提升大鼠及人体肌肉自噬相关的蛋白质水平[14, 15]。长期运动与单次中等强度训练后的结果恰恰相反,而这些差异可以作为长期规律运动带来健康效益的潜在机制。
运动引起的自噬应答与蛋白质磷酸化位点有关[16]。目前的观点认为,自噬与运动的关系主要是因为运动过程中伴随的能量代谢变化。在运动过程中当能量需求大于供给时,AMP/ATP的比例发生变化,进而影响磷酸腺苷活化蛋白激酶 (adenosine 5′-monophosphate-activated protein kinase, AMPK) 信号通路被激活,使哺乳动物雷帕霉素靶蛋白 (mammalian rapamycin target protein, mTOR)复合物1的活性被抑制,导致自噬增强,同时也促进线粒体ATP合成[17]。运动过程中活性氧 (reactive oxygen species, ROS) 和NAD+的增加也会导致运动过程中AMPK的激活,AMPK的激活也会影响自噬启动阶段的关键蛋白Ⅲ型磷脂酰肌醇3-激酶 (vacuolar protein sorting 34, VPS34),影响自噬[18]。不仅如此,运动还可能通过影响叉头框蛋白 (forkhead box O, FOXO)、转录因子EB (transcription factor EB, TFEB)、肿瘤蛋白53 (tumor protein 53, p53) 和过氧化物酶体增殖激活受体辅助活化因子-1α (peroxisome proliferator-activated receptor-gamma coactivator-1alpha, PCG-1α) 对自噬能力产生影响[9]。反之,在自噬相关蛋白质突变的小鼠模型(BCL2-AAA)中发现,运动不能诱导的B-细胞淋巴瘤因子2 (B cell lymphoma 2, BCL2) 与Beclin-1解离,并无法激活自噬,最终使其最大运动能力低于正常小鼠。
因此,运动在机体内的自噬应答和运动强度,运动时长,运动周期之间有着密切的联系[19]。但不同运动的剂量与自噬发生之间的关系尚不明确,有待后续探究。
2 运动对自噬的双向调节效应
2.1 异常自噬与疾病发生
许多疾病的发病机制已经与其细胞内部的异常自噬水平联系起来。自噬相关的疾病大致可分为3类:(1)自噬、溶酶体本身功能异常;(2)自噬、溶酶体调节异常;(3)自噬基质装运异常。衰老过程中,细胞自噬水平异常易引发的阿尔茨海默、帕金森等各种神经退行性疾病[20, 21];早期发育过程中,细胞自噬异常被证实与孤独症发生有关[22]。不仅在中枢系统,肝的疾病、心肌肥大也通常伴随着自噬水平异常,甚至自噬的异常也与癌症之间存在密不可分的关系[23, 24]。
自噬异常与疾病的关系不仅是由疾病本身发现的异常自噬现象,通过对自噬相关基因敲除发现自噬异常会导致疾病发生。例如:在自噬相关基因5 (autophagy 5,Atg5)敲除模型中发现,自噬缺陷导致心血管收缩扩张功能障碍[25],小胶质细胞Atg7敲除基因的自噬缺陷小鼠模型,出现刻板行为和社交障碍两大孤独症核心症状[26]。帕金森样行为也在小胶质细胞Atg5敲除的自噬缺陷小鼠模型中出现[27]。运动干预作为一种影响自噬的有效手段,可以有效改善异常自噬水平,从而达到缓解病症的效果。
2.2 运动改善自噬发生水平过低
多种病理模型中均证实,运动可以改善自噬发生水平过低的情况。在大脑相关疾病中,帕金森模型小鼠与正常组相比脑部LC3-Ⅱ蛋白水平表达显著下降,8周跑台干预后LC3-Ⅱ蛋白水平表达增加,并显著提升其运动与平衡能力。行为学或病理形态的改变凸显出由运动干预所带来的效应,其可能是通过恢复自噬水平带来的效应。阿尔茨海默的大鼠脑部自噬水平下降,8周跑台干预改善了这个现象,并改善了阿尔茨海默症的症状[28]。脑卒中大鼠模型运动后同样得到了类似的改善[29]。不仅在于中枢。衰老动物模型证实,衰老会导致自噬减弱,40 min/5 d/ 8 w的跑台训练使老年大鼠的指长伸肌和腓肠肌LC3-Ⅱ、Beclin-1、Atg7蛋白质水平显著上升[30]。非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)模型、糖尿病导致的不同并发症模型中均发现,运动可以改善其异常的自噬水平,并减轻了病症[26]。这些研究均证实,运动可以提高病理水平下的低自噬水平并改善疾病病理状态(Table 1)。研究所采用的运动干预方式大部分都选用跑台和游泳,大部分强度定义为有氧运动,周期为4~10周。因此,这证实了周期性运动可以提升疾病导致的自噬发生水平过低,并改善病症。
2.3 运动降低自噬发生水平过高
过度自噬发生与多种疾病之间存在关联,例如:以自噬空泡积累为特征的自噬相关蛋白质表达过高与X连锁肌病之间存在密切关系[39]。运动干预可以产生较好的改善效果。糖尿病肌萎缩模型中,骨骼肌LC3Ⅱ/LC3Ⅰ蛋白质比例显著高于正常组,1 h/5 d/4 w的游泳运动,使糖尿病肌萎缩大鼠模型的自噬相关蛋白质表达恢复,并有效提高了大鼠骨骼肌质量[40],跑台干预后也有同样的效果[41]。4周运动可以改善心梗兔子模型的心肌过高的LC3-Ⅱ/LC3-Ⅰ蛋白质表达比例[42],游泳干预也有同样的功效[43]。运动能有效降低病理模型中自噬发生水平过高的情况,并对疾病(肌萎缩侧索硬化症、高脂血症等)产生缓解效应。这些研究均证实,运动可以降低病理水平下的高自噬水平并改善疾病病理状态(Table 2)。运动干预对自噬相关蛋白质表达的影响证实了运动对于自噬发生的改善作用,即运动能提升病理模型中低自噬水平,降低病理模型中的高自噬水平,并对疾病发挥改善作用。运动对不同疾病模型中异常自噬水平的纠正,改善疾病病理状态(Fig.1)。这些发现将从自噬的视角阐释运动促进健康的机制。

Fig.1 The bidirectional regulatory effect of exercise on abnormal autophagy
3 运动双向调控自噬的机制
运动带来的效应是一种来自全身的效应,体现在不同的病理模型及不同的器官中出现不同的变化。例如:在鼠类糖尿病模型的肌肉、骨、肝、肾、脑中表现出不同的自噬水平,而通过运动干预所获得的效果也不同。游泳运动可以通过抑制p38MAPK-Atf2通路来提升模型大鼠肝的低水平自噬,从而改善胰岛素敏感性,提升肝功能水平并促进肝细胞存活[34]。这可能是由于运动影响自噬水平进而导致大鼠脑内神经可塑性变化所致。在糖尿病模型的骨骼中,运动可能是通过改变Meg3-miR16-PI3K-AKT-mTOR-p62-NFκB-Runx2通路介导的自噬变化[37],另一项研究发现,运动可以通过p2x7-AMPK/mTOR通路影响关节内的自噬水平[36]。研究证实,在阿尔茨海默病模型中,运动可以通过AMPK-mTOR-ULK1信号通路影响其异常的自噬,进而改善阿尔茨海默病症的表型[32]。AMPK是一种能量调节的重要激酶,是真核生物代谢的中心调节剂,监管细胞的能量输入与输出[48]。运动作为一种细胞应激信号与AMPK息息相关,mTOR作为其下游信号,可以通过调节UNC-51样激酶1 (UNC-51-likekinase1, ULK1) 磷酸化进而调节自噬的发生。高血脂症小鼠模型中,MICT及HIIT干预均纠正了高血脂症小鼠模型中的自噬蛋白质LC3-Ⅱ/LC3-Ⅰ、Atg7、Beclin1的高水平表达,以及p62蛋白的过低水平表达[46]。这可能是通过PI3K-AKT-FOXO1通路进而调控Beclin1及LC3蛋白实现的[49]。此外,运动还可以通过改善mTORC1-ULK1蛋白质的表达来影响自噬水平[45]。mTORC1可以通过与ULK1作用,以及影响ATG13与200 kD家族相互作用蛋白质 (family interacting protein of 200 kD, FIP200) 的磷酸化水平调控自噬[50, 51]。

Table 1 Exercise improve low levels of autophagy in pathological models
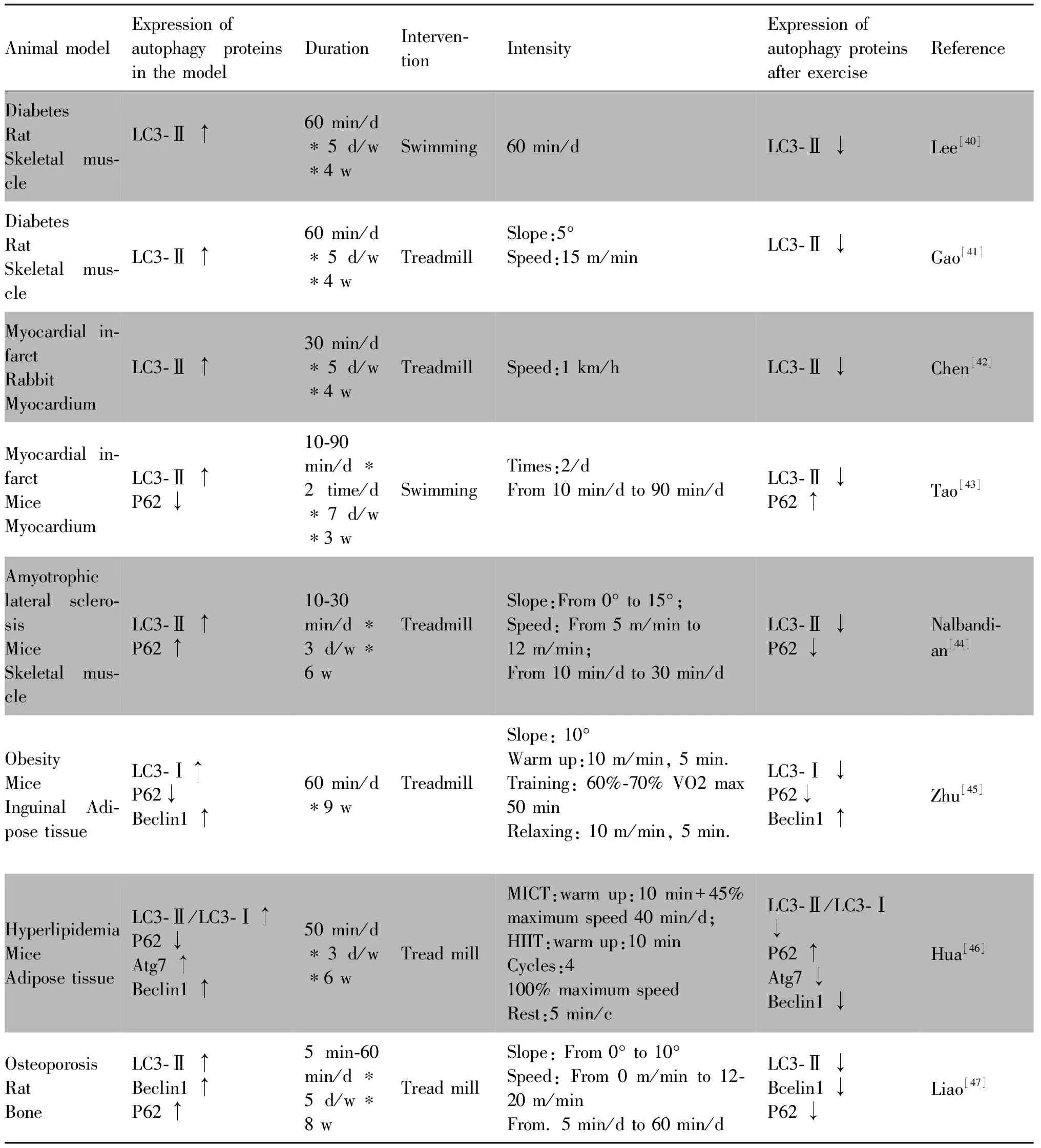
Table 2 Exercise reduces high levels of autophagy in pathological models
运动对自噬的调控不仅在自噬小体发生过程中体现,同样在自噬小体与溶酶体结合的过程中也有作用。例如运动干预NAFLD的动物研究显示,运动通过抑制血清脂肪酸结合蛋白1 (serum fatty acid binding protein 1, FABP1) 途径调节自噬溶酶体机制,通过暴露刺激溶酶体中FABP1的增加,FABP1触发溶酶体功能障碍,随后导致自噬通量损伤和肝脂肪变性[24]。先前的研究证实,FABP1抑制降低了脂肪酸摄取,降低了关键速率脂肪酸生物合成中的限速酶[52]。FABP1抑制介导的自噬溶酶体机制的补充代表了一种新的内源性机制,通过长期运动能改善脂质稳态并改善肝的脂肪变性。
目前,探索运动调控自噬的相关通路非常多,包括在自噬小体形成的发生过程的相关通路及自噬小体和溶酶体结合为自噬溶酶的相关通路。但总体而言,多数探讨运动影响调控异常自噬水平的研究均基于PI3K-AKT-mTOR及其上下游靶点进行探讨(Fig.2)。而运动本身带来的是一种综合效应,影响是广泛的,因此,探究通过某单一靶点产生整体效益或许是不准确的,在未来或许可以通过组学的方法或通路抑制剂/促进剂等对其具体的潜在机制进行探索。理清上述问题将为进一步解释运动与自噬调控的相互作用提供支持。

Fig.2 Possible mechanisms of motor regulation of autophagy in different pathological models
4 问题与展望
自噬对细胞内稳态的维持发挥重要作用。自噬水平异常与各类疾病产生之间有着密切联系,例如:非酒精性脂肪肝、心梗、糖尿病伴病,肾损伤和缺血性脑中风等。运动作为一种改变机体内环境与能量代谢的重要手段,与自噬水平调控之间存在密不可分的关系。但在不同病理状态下,运动对自噬的调控是不同的。运动改善自噬发生水平过低,运动也降低自噬发生水平过高,运动对自噬的调节是一个双向的过程。
运动调节自噬变化与运动强度与运动方式等剂量效应之间的关系是复杂的,不同剂量的运动效应是否会带来不同的结果呢?多数研究均使用长期运动,而急性运动对异常自噬调控的影响鲜有提及,同时在干预中多数研究均使用有氧运动,通过不同方式的有氧运动干预后对病理状态的自噬状态进行检测。对于运动强度与自噬调控的探索内容也较少,一项研究通过MICT或HIIT的方式对自噬标志蛋白质的表达进行了验证,发现不同的运动方式带来的效益是不同的。这提示了,后续研究可以通过改变运动强度探索运动强度对于异常自噬调节的影响。
通过对这种双向作用的深入研究,我们不仅能够更好地理解运动如何通过调节自噬来防治代谢疾病、神经退行性疾病和肌肉萎缩等健康问题,还可以开发出更加个性化和精准的运动干预方案。运动干预不再仅仅被看作是一种简单的身体活动,而是一个多层面的健康调控工具。因此,探讨最佳的运动剂量对于动物实验转化到人体应用有极为重要的意义,解析运动促进健康的机制也对运动干预转化到实际应用中提供强有力的证据。但目前关于运动剂量与健康机制解析并不明晰,仍需探索。
