滋肾清热利湿化瘀方治疗多囊卵巢综合征的网络药理学作用机制及实验研究
2024-04-23李佩双丁志玲彭佳华刘淑娟梁瑞宁
金 晶,李佩双,丁志玲,彭佳华,刘淑娟,梁瑞宁,5
(1. 江西中医药大学研究生院,江西 南昌 330004;2. 江西中医药大学附属医院,江西 南昌 330006;3. 江西中医药大学中医妇产科学研究所,江西 南昌 330006;4. 江西中医药大学附属生殖医院,江西 南昌 330001;5. 江西中医药大学第二附属医院,江西 南昌 330006)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一类高度异质性疾病,以雄激素过高、排卵障碍和卵巢多囊样改变为主要临床特征,是导致育龄期女性月经失调和不孕的重要原因。目前,治疗PCOS大多采用激素、手术或生活方式干预,但存在治疗周期长、并发症多、疗效欠佳等问题。中医药在治疗PCOS中有独特的优势,主要通过中药口服,结合针灸治疗、针药结合、中医综合疗法以及中西医结合治疗等多种方法,整体而观,辨证论治,因人制宜,从“因”调节内分泌,补充西医治疗的不足,其疗效确切且副作用小,更有助于缓解PCOS症状[1]。
PCOS属中医“闭经”、“不孕”、“癥瘕”等范畴,本课题组结合多年的临床治疗,认为PCOS病机多为肾虚兼湿热、痰浊、瘀血,也即肾虚为本,痰瘀湿浊等为标,致冲脉血气“逆盛”[2]。前期研究发现,滋肾清热利湿化瘀方(Zishen Qingre Lishi Huayu Prescription,ZQLHP)(简称滋肾方)能有效提高PCOS患者自主排卵率及有排卵月经的发生率,并能改善痤疮及降低血清睾酮水平[3]。尽管滋肾方体现了中药复方多靶点的优势,但其主要发挥作用的化学成分或其作用机制尚不明确。网络药理学作为一种能够有效预测中药以及中医复方靶点的研究方法,为中医复方研究提供了新的视角。基于此,本研究拟采用网络药理学、分子对接技术及实验验证探索滋肾方干预PCOS的机制,为滋肾方的临床应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1动物 雌性C57BL/6J小鼠40只,SPF级,3周龄,体质量(10±2)g,购自湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2019-0004。
1.1.2药物 滋肾方(知母10 g,山茱萸10 g,丹参10 g,桃仁10 g,薏苡仁15 g,白芥子10 g,黄柏10 g,玄参10 g,甘草6 g),购自于江西中医药大学第二附属医院。枸橼酸氯米芬片,购自高特制药有限公司,批号:Q1102。
1.1.3试剂与仪器 来曲唑(江苏恒瑞医药股份有限公司,批号:211130KL)。白介素-6(interleukin-6,IL-6)(批号2209M31)、白介素-10(interleukin-10,IL-10)(批号2209M18)和肿瘤坏死因子-α(tumor necrosis factor,TNF-α)(批号2209M29)购于江苏酶免实业有限公司。磷酸化蛋白激酶(phosphorylation AKT serine/threonine kinase,p-AKT)抗体(批号P2215051),AKT抗体(批号:A3321120),磷酸化p38丝裂原活化蛋白激酶(phosphorylation mitogen-activated protein kinase p38,p-p38MAPK)抗体(批号8690S),p38MAPK抗体(批号9216s),磷酸化信号转导和转录激活因子3(phosphorylation signal transducer and activator of transcription 3,p-STAT3)抗体批号ab76315),STAT3抗体(批号ab68153),分别购于翌圣和Abcam公司。伯乐电泳仪(Biorad公司);凝胶成像系统(Biorad公司)。
1.2 方法
1.2.1网络药理学分析
1.2.1.1 滋肾方活性成分及靶点筛选 通过中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)和BATMAN数据库(http://www.swisstargetprediction.ch/)检索滋肾方有效成分。在TCMSP中检索与成分相关的靶基因,预测药物有效成分的作用靶点。
1.2.1.2 PCOS靶点的预测 分别在GeneCards数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)、DisGENET(https://www.disgenet.org/)、PharmGKB数据库(http://www.pharmgkb.org)、DRUGBANK(https://go.drugbank.com/)搜索“Polycystic ovary syndrome”检索疾病靶点。
1.2.1.3 筛选共同靶点 将药物与疾病获得的相关靶点输入微生信在线平台(https://www.bioinformatics.com.cn/),得到共同靶点,绘制Venn图。
1.2.1.4 药物-活性成分-潜在作用靶点网络图构建 将滋肾方中药有效成分及方药疾病交集靶点导入Cytoscape 3.9.0软件,构建“药物-活性成分-潜在作用靶点”可视化网络图,Network Analyzer插件行网络拓扑分析,筛查滋肾方治疗PCOS的核心活性成分。
1.2.1.5 构建潜在作用靶点的蛋白互作网络 将滋肾方与PCOS的交集靶点导入STRING数据库,建立蛋白互作网络(protein-protein interaction, PPI)网络。将结果导入Cytoscape 3.9.0并应用CytoNCA 插件对网络进行拓扑分析,按照节点的Degree值调节网络中节点的属性。
1.2.1.6 GO富集与KEGG通路分析 将滋肾方治疗PCOS潜在作用靶点导DAVID数据库(http://david.ncifcrf.gov/tools.jsp),制作GO功能和KEGG富集分析。筛选出前20名KEGG通路和前10名GO生物学功能进行可视化。
1.2.1.7 分子对接验证 根据“药物-活性成分-潜在作用靶点”网络,将重要活性成分与PPI中前3位核心靶点进行分子对接验证。应用PubChem数据库中下载活性成分2D结构,PDB蛋白数据库中下载靶点蛋白的3D结构。在ChemBio3D软件优化活性成分并存为“mol2”格式。AutoDockVina与PyMOL软件进行分子对接验证与可视化制图。
1.2.2动物实验
1.2.2.1 动物分组及造模给药 将40只小鼠按体质量随机分为正常组、模型组、滋肾方(ZQLHP)组和枸橼酸氯米芬(clomiphene citrate,CC)组,每组10只。除正常组外,其余各组小鼠均予以1 mg·kg-1·d-1LET溶液灌胃诱导PCOS小鼠模型[4-5],连续21 d,正常组给予等容积生理盐水。造模第11天开始连续10 d观察小鼠阴道脱落细胞的变化,根据小鼠动情周期的变化以及LET造模后,随机挑选2只小鼠处死后,HE染色观察卵巢组织卵泡是否呈囊状样改变,以确认模型是否构建成功。造模成功后,第22天开始给予相应剂量药物灌胃,根据人和动物间按体表面积折算的等效剂量,滋肾方11.8 g·kg-1·d-1灌胃。枸橼酸氯米芬组1 mg·kg-1·d-1,正常组和模型组给予等容积生理盐水灌胃,每日1次,连续给药14 d。
1.2.2.2 苏木精-伊红染色观察卵巢组织病理 对小鼠卵巢组织进行固定、脱水、包埋、切片和染色等处理后,使用光学显微镜观察其病理变化。
1.2.2.3 ELISA检测IL-6、IL-10和TNF-α水平 按照ELISA试剂盒说明书步骤操作,采用酶标仪于450 nm波长下测定吸光度A,检测小鼠外周血中IL-6、IL-10和TNF-α水平。
1.2.2.4 Western blot检测卵巢组织p-AKT、AKT、p-p38MAPK、p38MAPK、 p-STAT3和STAT3蛋白表达 取各组小鼠卵巢组织研磨后,RIPA裂解缓冲液中裂解1 h后,超速冷冻离心机4 ℃,13 000 r·min-1离心30 min取上清。BCA法测定蛋白浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,5%脱脂牛奶封闭2 h,根据β-actin(1 ∶1 000)、p-AKT(1 ∶1 000)、AKT(1 ∶1 000)、p-p38MAPK(1 ∶1 000)、p38MAPK(1 ∶1 000)、STAT3(1 ∶1 000)、p-STAT3(1 ∶1 000)抗体说明书进行抗体稀释,4 ℃孵育过夜后,加入相应的二抗,室温反应2 h,ECL超敏溶液显影,采用ImageJ图像处理软件计算对应凝胶条带的灰度值,与内参的吸光度比值用于统计分析。
1.2.2.5 免疫组织化学观察卵巢组织中p-AKT、p-p38MAPK和p-STAT3蛋白表达 取各组小鼠卵巢组织,采用4%多聚甲醛固定,石蜡包埋并切片为4 μm。在柠檬酸缓冲液中进行孵育,冷却至室温后,使用5% BSA阻断非特异性结合。p-AKT(1 ∶500)、p-p38MAPK(1 ∶500)和p-STAT3(1 ∶500)抗体稀释后,4 ℃孵育过夜。二抗室温孵育30 min,PBS清洗后,使用DAB显色。最后使用光学显微镜获取图像,并使用ImageJ Pro Plus软件对图像进行光密度分析。
2 结果
2.1 网络药理学研究结果
2.1.1滋肾方有效成分与相关靶点 基于TCMSP数据库检索与OB、DL参数筛选,最终得到滋肾方456个化合物及其361个作用靶点。其中知母15个化合物,山茱萸20个化合物,丹参59个化合物,桃仁23个化合物,薏苡仁9个化合物,白芥子4个化合物,黄柏37个化合物,玄参9个化合物,甘草280个化合物。筛出排名前10的化合物信息如Tab1。基于滋肾方有效成分从TCMSP与SWISS平台搜集预测靶点,筛除重复项后共有361个药物靶点。
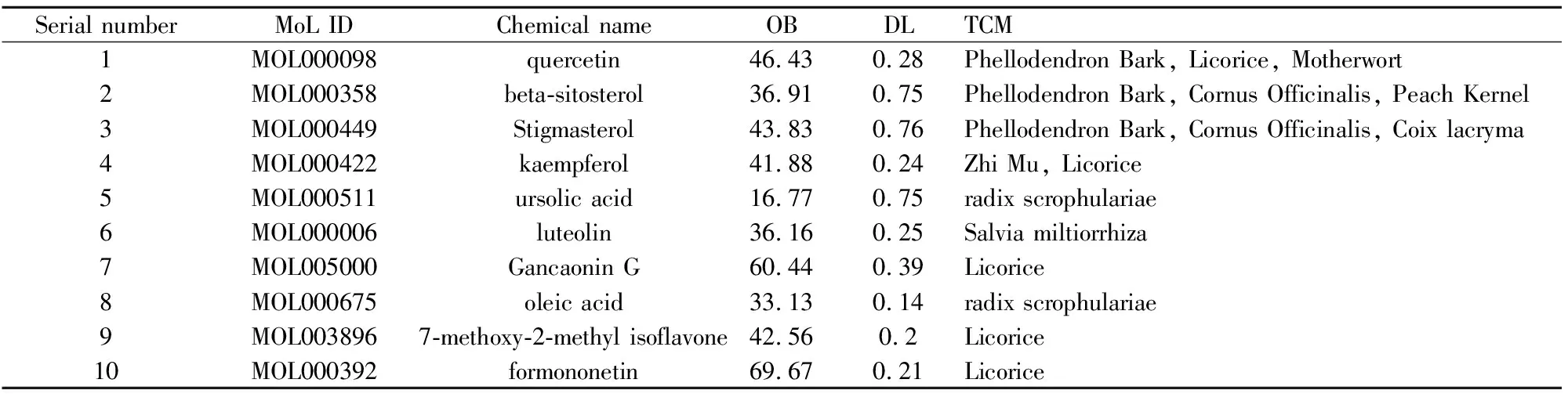
Tab1 The top 10 compounds with degree values and OB and DL values in formula for ZQLHP
2.1.2PCOS相关靶点与滋肾方治疗的潜在作用靶点 通过GeneCards、OMIM、DisGENET、PharmGKB和DRUGBANK 5个数据库共收集到PCOS疾病相关靶点1 397个,将滋肾方药物靶点与疾病靶点取交集制作韦恩图,得到125个交集靶点见Fig1,即滋肾方治疗PCOS的潜在作用靶点。
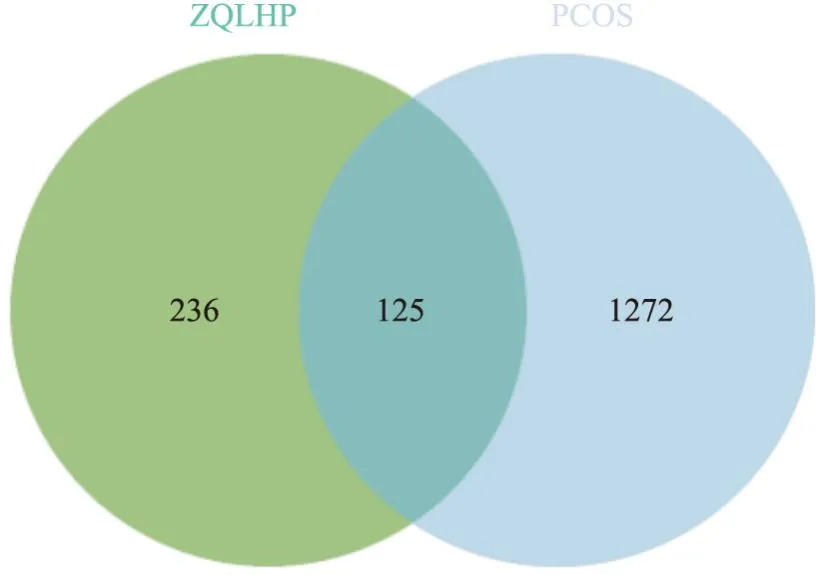
Fig1 Venn diagram of potential targets of action of ZQLHP for treatment of PCOS
2.1.3“药物-活性成分-潜在作用靶点”网络 将滋肾方中活性成分与疾病的125个交集靶点导入 Cytoscape 3.9.0 软件,与中药成分关联进行可视化。根据degree值大小调节节点的大小并排序,degree与节点大小成正比,共包括580个节点和3 598条边(Fig2)。网络拓扑分析计算化合物的度值,列出度值排名前10 位的化合物见Tab2。可以得知槲皮素(quercetin)、山柰酚(kaempferol)、β-谷甾醇(beta-sitosterol)和豆甾醇(stigmasterol)是几味中药的共有成分,且OB 值及 DL 值远高于筛选标准值,推测槲皮素、β-谷甾醇、豆甾醇等是滋肾方治疗PCOS的核心活性成分。
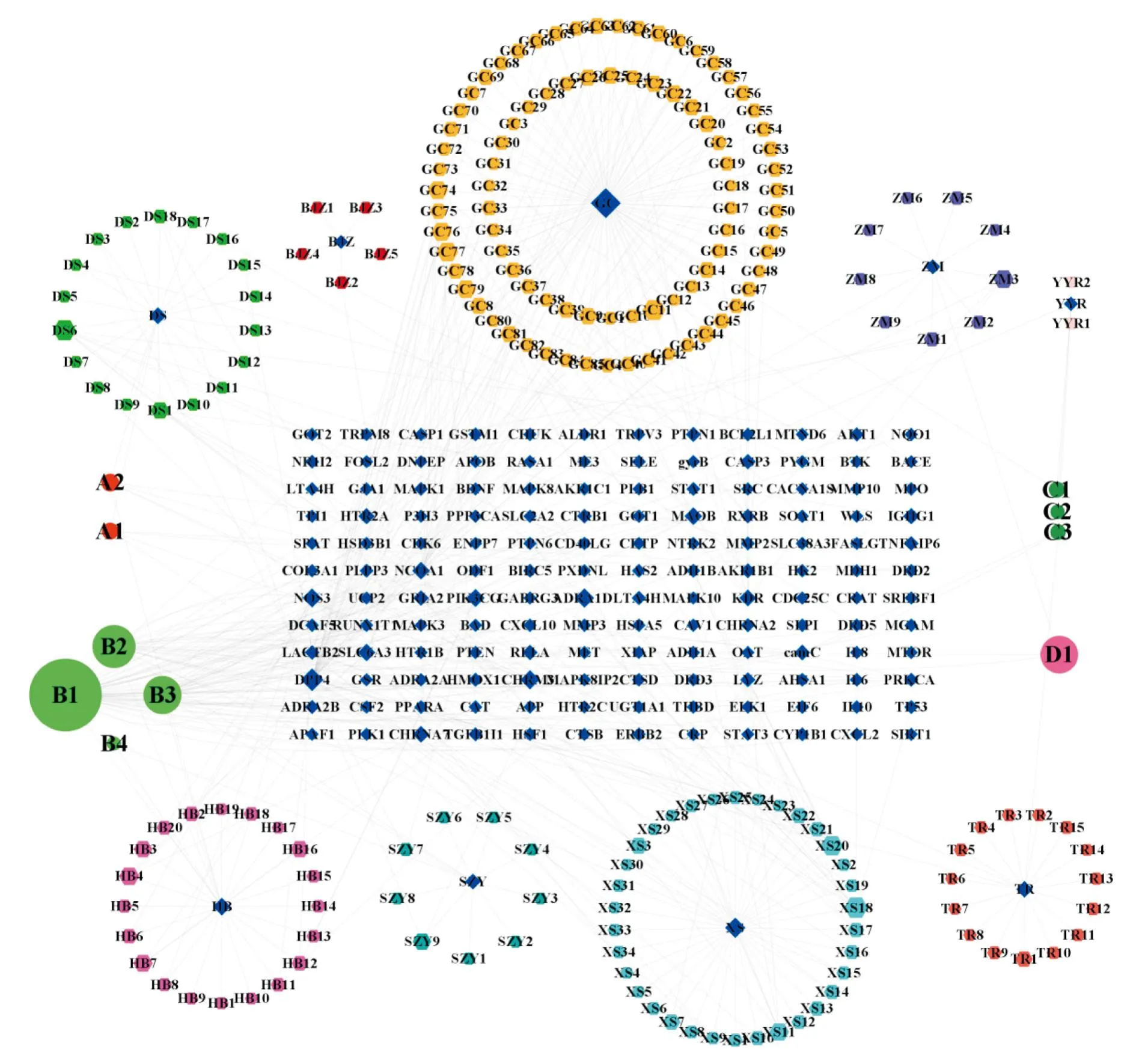
Fig2 Drug-component-target visualization network for treatment of PCOS with ZQLHP

Tab2 Information table of top 10 compounds in formula for ZQLHP
2.1.4滋肾方治疗PCOS的PPI网络构建 将滋肾方与PCOS相重合的125个关键靶点导入String数据库构建PPI网络(Fig3),该网络共有108个节点,371条边;将其结果导入 Cytoscape3.9.0软件进行网络可视化分析,根据Degree值大小对125个关键靶点进行排序,靶点颜色越深代表靶点相关度越高(Fig4)。同时利用 CytoNCA 插件工具分析网络拓扑参数,结合度值(degree)、介度(betweenness)、紧密度(closenesss)筛选核心靶点,结果显示3项参数均较高的核心靶点有MAPK3、AKT1、STAT3、IL-6、TP53、INS、CASP3等,表明这些蛋白在网络图中贡献度高,在滋肾方治疗PCOS疾病中起到重要作用。
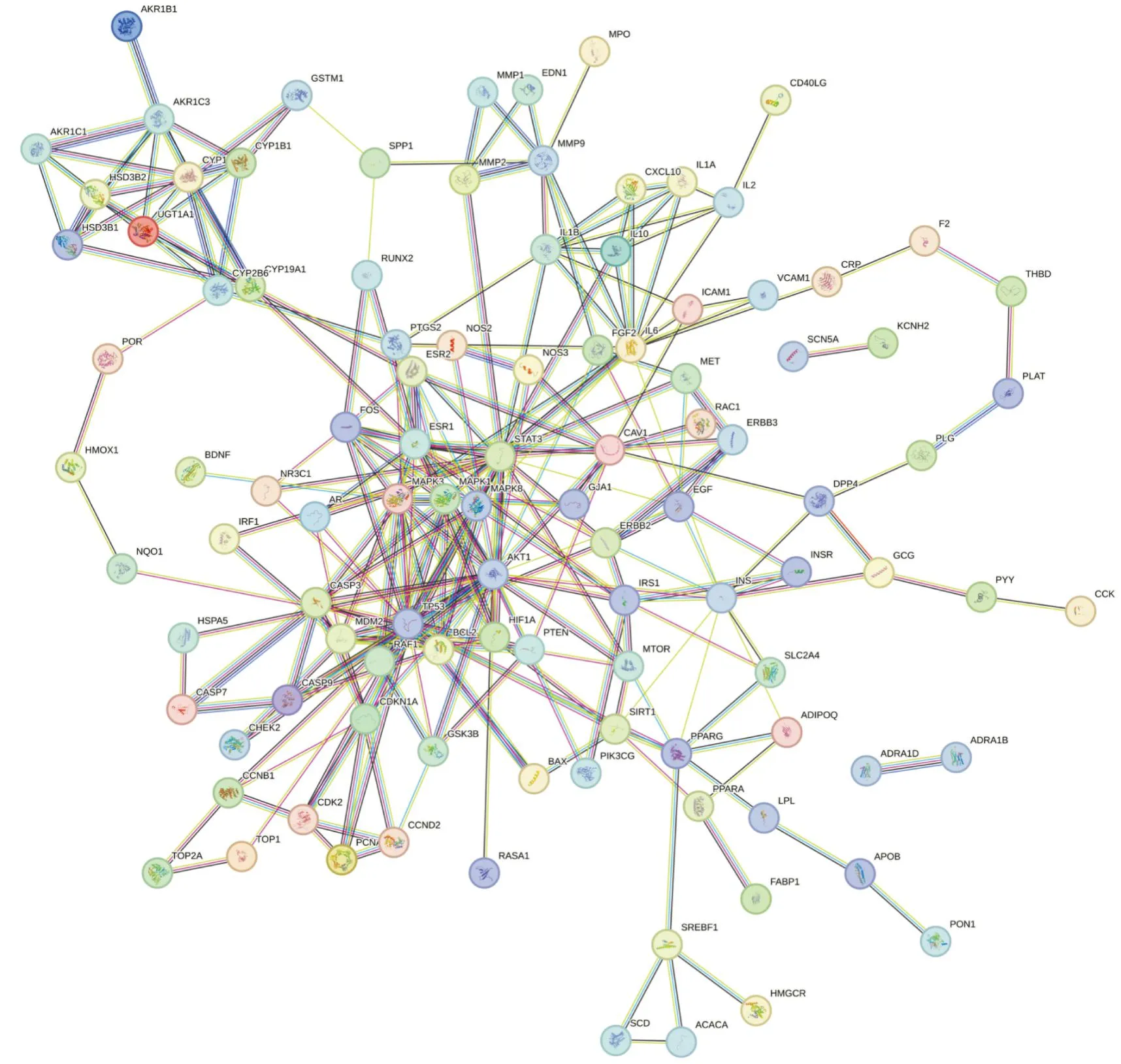
Fig3 PPI protein interaction network for intersecting therapeutic targets
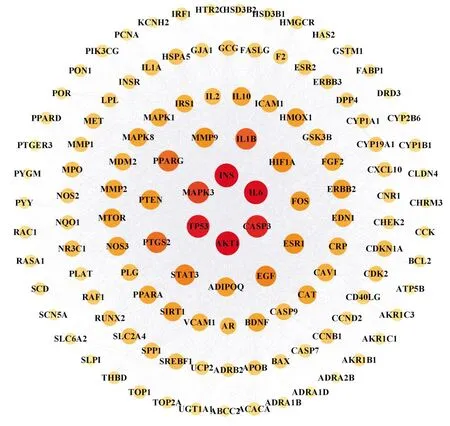
Fig4 Visualization of PPI protein interaction network for intersecting therapeutic targets
2.1.5关键靶点的GO功能富集和KEGG通路富集分析 对滋肾方治疗PCOS的125个潜在靶点进行GO基因本体论分析,GO 功能富集分析包括生物过程 (BP)、分子功能(MF)和细胞组分(CC)3 个方面。结果显示共富集到663条BP条目,64条CC条目,119条MF条目。其中富集基因数量最多的条目为negative regulation of apoptotic process,plasma membrane,protein binding,分别分布了31、56、115个基因。设置P<0.05,根据P值排序后,选取排名前10的条目绘制条形图(Fig5)。

Fig5 GO analysis of intersectional therapeutic targets of ZQLHP for PCOS
利用DAVID数据库做125个交集靶点的KEGG通路富集分析,共富集出156条KEGG通路。结合显著性程度与Count值,滋肾方治疗PCOS的潜在作用靶点主要在PI3K-Akt signaling pathway,TNF signaling pathway,pathways in cancer等信号通路,设置P<0.01,根据P值与Count值排序后选取排名前 20 位的条目绘制气泡图(Fig6)。
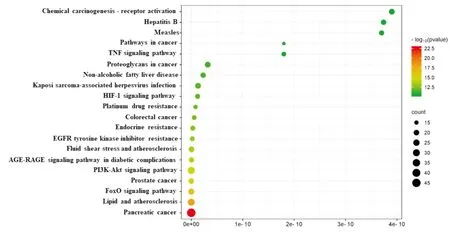
Fig6 Visualization of PPI protein interaction networks for intersecting therapeutic targets
2.1.6分子对接验证 根据前期结果,取排名前3化合物与关键交集靶点行分子对接,即槲皮素、豆甾醇、β-谷甾醇与STAT3、AKT1、MAPK3。结果显示滋肾方核心成分与关键靶点结合能均小于-5.0 kcal·mol-1,表明配体与受体蛋白结合稳定,药物关键成分与核心靶点具有良好亲和力,在疾病治疗中发挥关键作用。见结合能(Tab3)与分子对接图(Fig7)。

Fig7 Diagram of molecular docking between core ingredients and key targets of ZQLHP

Tab3 The binding ability of key components of ZQLHP to target gene molecules
2.2 动物水平实验结果
2.2.1滋肾方对PCOS小鼠体重、卵巢组织病理学影响 如Fig8所示。与正常组比较,模型组小鼠体质量增加(P<0.05),与模型组比较,ZQLHP组小鼠体质量降低(P<0.01)。病理学观察发现,正常组可见卵泡的颗粒细胞层较多且排列紧密,内可见卵母细胞。模型组卵巢切片可见颗粒细胞层数减少,小卵泡和闭锁卵泡数量增多,黄体数量减少。与模型组相比,各治疗组给药14 d后内见黄体,颗粒细胞排列正常及不同等级发育的优势卵泡。各组卵巢组织黄体及囊性卵泡数量统计可见,与正常组相比,模型组黄体数量下降(P<0.01),囊性卵泡数量明显升高(P<0.05),与模型组相比,给药组黄体数量增加(P<0.01),囊性卵泡数量明显减少(P<0.05),ZQLHP组与CC组无差异,结果提示ZQLHP可明显缓解PCOS小鼠卵巢病理损伤。

Fig8 Evaluation of efficacy of ZQLHP in PCOS model
2.2.2滋肾方对PCOS小鼠IL-6、IL-10和TNF-α水平的影响 如Fig9所示,与正常组比较,模型组小鼠IL-6、TNF-α水平升高(P<0.01),IL-10水平下降(P<0.01);给药治疗后与模型组比较,IL-6、TNF-α水平降低(P<0.05,P<0.01),IL-10水平上升(P<0.01),ZQLHP组与CC组无差异。
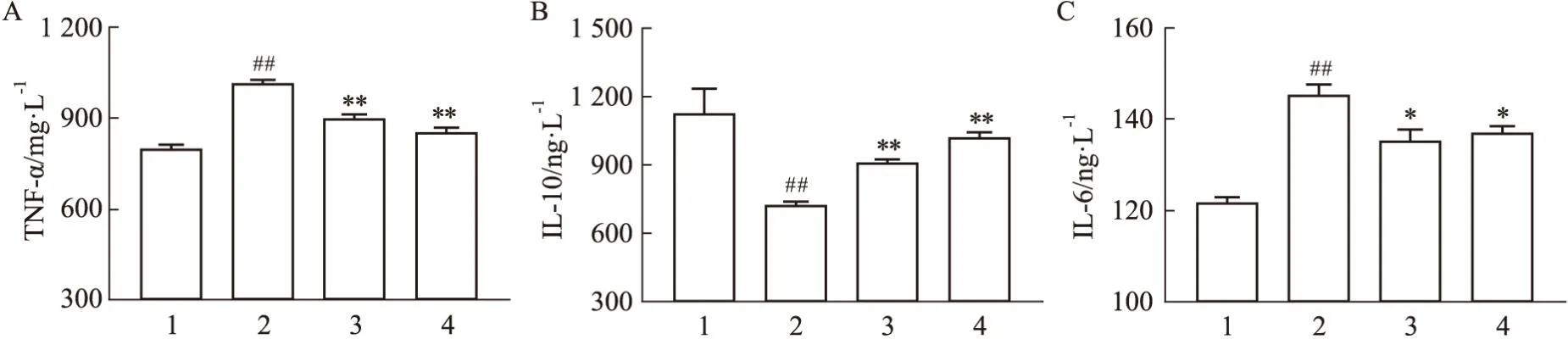
Fig9 Effect of ZQLHP on levels of IL-6, IL-10 and TNF-α in PCOS model
2.2.3滋肾方对PCOS小鼠AKT/p38MAPK/STAT3蛋白的影响 如Fig10和Fig11所示,与正常组比较,模型组小鼠卵巢组织中p-AKT蛋白表达量下降(P<0.05或P<0.01),p-p38MAPK和p-STAT3蛋白表达上升(P<0.05或P<0.01);与模型组比较,给药组小鼠卵巢组织p-AKT蛋白表达上升(P<0.05或P<0.01)、p-p38MAPK和p-STAT3蛋白表达量下降(P<0.05或P<0.01),ZQLHP组与CC组无差异。
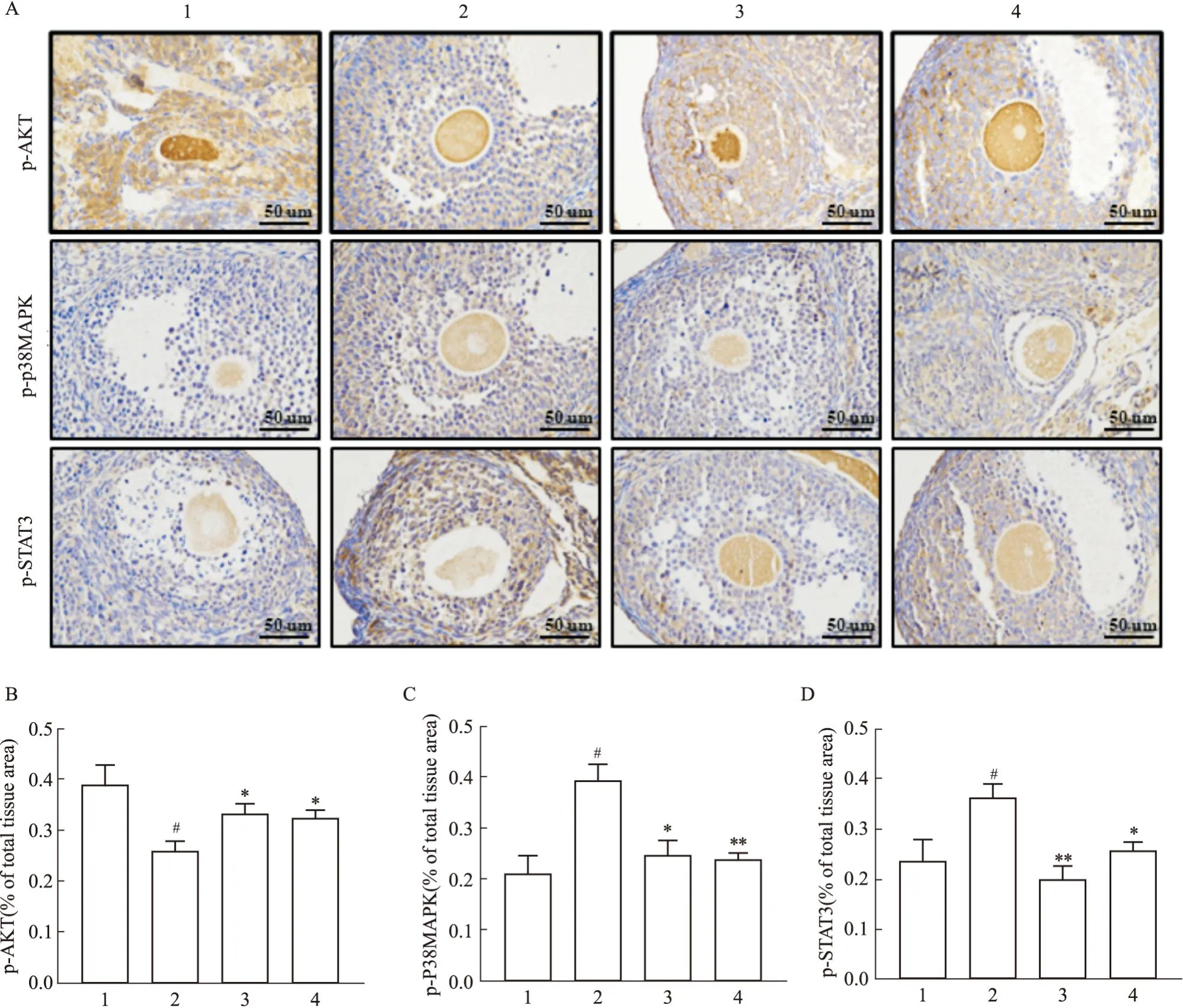
Fig11 Effect of ZQLHP on expression levels of p-AKT, p-p38MAPK and p-STAT3 proteins in PCOS model mice (immunohistochemistry, ×400)
3 讨论
PCOS是青春期与育龄期妇女最为常见的代谢内分泌疾病,流行病学调查显示,我国育龄期女性患病率为5.6%,PCOS患者约占不孕人群的1/3[6]。追溯古籍,尚无PCOS病名相关的记载,然根据其症状可将其划分为中医“闭经”、“不孕”、“癥瘕”等范畴。《校注妇人良方》有载:“妇人病有三十六种,皆由冲任劳损而致”,由此可知,冲任损伤是妇科疾病之总因。我们根据多年的临床经验认为,PCOS病位主要在肾与冲任,本病病机以肾阴亏虚为主,肾阴亏损则肾脏气化不及,血脉失养,燥热内生,水津不化酿生痰浊、湿热、瘀血之邪,痰热湿瘀内阻于冲任为本病之标[7-8]。因此,本方以滋肾清热利湿化瘀为治法,方中山茱萸酸温补益肝肾,知母、黄柏、玄参滋阴清热,佐以白芥子、薏苡仁健脾利湿,桃仁、丹参活血通经,甘草调和药性。诸药共同使用,共奏滋阴清热,活血通经之功,使肾阴得养、虚热得清,血脉通畅,从而使治疗效果得到进一步的提高。本实验研究发现经滋肾方灌胃干预后,PCOS小鼠体质量下降,卵巢病理损伤改善,黄体个数增多,囊性卵泡数量减少,颗粒细胞层数明显改善。以上结果提示滋肾方能够改善PCOS小鼠症状及体征,这与长期临床实践一致。
PCOS确切发病机制尚不清楚,但炎症因子、内分泌、代谢紊乱和颗粒细胞增殖凋亡等在其进展中起着关键作用。基于网络药理学分析结果显示,滋肾方中共筛出456个活性成分,作用于361个靶点对PCOS发挥作用,包括槲皮素、β-谷甾醇和豆甾醇等。研究表明槲皮素、β-谷甾醇和豆甾醇具有抗炎、抗氧化、调节免疫、改善代谢功能、降低血清胆固醇等作用[9]。研究发现槲皮素能降低肥胖患者巨噬细胞和脂肪细胞中炎性细胞因子TNF-α、IL-6、IL-1β的基因表达水平,降低胰岛素抵抗作用,缓解PCOS症状[10]。同时,槲皮素通过下调TNF-α和IL-6提高卵母细胞的质量,促进卵母细胞成熟和早期胚胎发育[11]。β-谷甾醇可通过抑制IL-6、TNF-α和IL-1β的水平发挥抗炎作用。β-谷甾醇一项粪菌移植实验研究表明,β-谷甾醇可以调节PCOS子宫内膜容受性,协调性激素平衡,从而影响PCOS的病理过程[12]。此外,赵帅等[13]发现β-谷甾醇可促进颗粒细胞增殖、抑制凋亡,其机制与AKT信号有关。豆甾醇也可通过抑制IL-6和IL-1等炎症因子的表达发挥抗炎作用。慢性低度炎症已被证实与PCOS的发生有关,促炎与抗炎因子的失调可延迟卵泡成熟并诱导类固醇生成异常[14]。本实验研究同样发现,与正常组相比,PCOS模型组小鼠血清TNF-α和IL-6上调,IL-10表达下调,滋肾方干预逆转了TNF-α、IL-6、IL-10表达趋势,进一步证实,活化的TNF-α和IL-6细胞因子是诱导慢性炎性PCOS的关键因素,由此可见,平衡促炎与抗炎因子对于PCOS转归与预后密切相关。提示平衡促炎与抗炎因子对于PCOS转归与预后至关重要。因此,推测滋肾方的关键活性成分可能是通过抗炎机制发挥作用。
根据PPI网络及KEGG富集分析得到滋肾方治疗PCOS的核心靶点主要包括MAPK3、AKT1、STAT3、IL-6、TP53、INS、CASP3等,潜在作用靶点主要富集在PI3K/AKT、TNF和癌症相关通路。研究发现PCOS患者卵巢中存在异常停滞生长的不成熟卵泡,AKT信号的激活有助于在卵泡发育过程中卵母细胞的成熟。此外,AKT信号通路中相关因子的改变会直接影响到卵巢组织的胰岛素传导以及糖代谢[15]。Hafizi等[16]研究表明PCOS与非PCOS患者减数分裂II期卵母细胞中,AKT1、AKT2无明显差异,然给药干预后AKT表达水平出现差异,AKT1、AKT2表现出与药物的高度亲和力。MAPK家族成员有4种,p38MAPK作为重要一员,磷酸化后被激活,发挥调控炎症反应及细胞免疫的作用,是信号转导过程中的关键蛋白。STAT3是STATs家族成员之一,研究发现在小鼠颗粒细胞分化过程中,STAT3是调节黄体生成素受体的关键信号。TNF-α和IL-6促炎细胞因子过度释放可导致p38MAPK、STAT3激活,进而促进炎症反应的发生[17],徐琴等[18]的研究发现通过抑制p38MAPK可以改善PCOS模型大鼠炎症反应。p38MAPK、STAT3被多种因子激活,调节细胞生长过程以及与免疫反应相关的炎性细胞因子分泌,从而影响宿主后发生炎症反应。此外,研究发现,STAT3是AKT通路介导下游信号所必需的关键因子,抑制STAT3活性会反馈性激活AKT活性。分子对接验证表明槲皮素、β-谷甾醇、豆甾醇与AKT、MAPK、STAT3结合活性较佳。实验研究进一步证实,与正常组相比,PCOS模型组小鼠卵巢组织p-AKT表达水平下调,p-p38MAPK和p-STAT3表达水平升高,经滋肾方灌胃治疗后,p-AKT表达水平上调,p-p38MAPK和p-STAT3表达水平下降。
综上,本文基于网络药理学方法构建“滋肾方成分—靶点—PCOS”网络,以期获得滋肾方对PCOS的具体作用靶点及机制,通过动物实验对所获得的重要靶点进行验证,结果表明滋肾方能够有效改善PCOS小鼠症状及体征,平衡促炎、 抗炎因子的水平,可能是通过提高p-AKT表达水平和降低p-p38MAPK和p-STAT3表达水平,干预其下游的效应细胞来参与PCOS病理进展,进而改善PCOS。本研究通过动物实验验证了网络药理学预测结果,为滋肾方治疗PCOS提供了科学依据,并为滋肾方药理机制研究提供了参考价值。然而,鉴于对PCOS病理生理机制的认识还不完善,且网络药理学存在局限性,本研究预测结果仍需进一步实验验证和探索。
(致谢:本文作者非常感谢以下老师提供的帮助,梁瑞宁教授构思并设计了实验,生殖医学科刘淑娟主任提供了宝贵建议,刘端勇教授对于本文手稿进行了的指导。)
