二十碳五烯酸和二十二碳六烯酸及其组合对斑马鱼阿尔茨海默病模型认知障碍的改善作用和机制
2024-04-23黄城益邓淑怡
黄城益,邓淑怡,宋 采,2
(1.广东海洋大学食品科技学院,广东 湛江 524088;2.广东海洋大学深圳研究院,广东 深圳 518117)
β淀粉样蛋白(β-amyloid,Aβ)沉积、胆碱能递质缺失、神经炎症和神经元凋亡等在阿尔茨海默病(Alzheimer′s disease,AD)的发生与发展中起着至关重要的作用。有关AD发病的起因与机制众说纷纭。其中Aβ假说认为,氧化应激促进β-分泌酶(beta-site amyloid precursor protein cleaving enzyme 1,Bace1)和γ-分泌酶先后切割淀粉样前体蛋白(amyloid precursor protein,APP),产生了Aβ并沉积于脑内,损伤神经元,最终引发AD[1]。而炎症假说对其进一步解释,可溶性Aβ寡聚体(Aβ oligomers,O-Aβ)能够过度激活小胶质细胞释放促炎因子,小胶质细胞上的Tyro3-Axl-MerTK(TAM)受体酪氨酸激酶之一Axl酶的水平降低,从而降低了小胶质细胞的吞噬作用,进一步加剧了Aβ的积聚[2]。细胞凋亡假说认为,可溶性O-Aβ使电压依赖性阴离子通道-1(voltage dependent anion channel-1,VDAC1)水平上升,诱导促凋亡蛋白从线粒体内膜释放到细胞质中,如B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X,Bax)[3]以及半胱天冬酶(Caspase)家族的Caspase-3和Caspase-9[4],这些促凋亡蛋白使神经元凋亡。已有研究报道,炎症反应能够使乙酰胆碱酯酶(acetylcholinesterase,AChE)水平上升,而AChE除了能够导致乙酰胆碱(acetylcholine,ACh)降解,阻碍神经信号传递外,还能使细胞对凋亡诱导更敏感,进一步促进细胞凋亡[5],最终导致AD的发生。
已有研究证明Al3+能够成功诱导斑马鱼AD模型,并应用于阿尔茨海默病的病因和治疗研究中,但Al3+诱导AD的中枢神经炎症机制仍有待研究[6]。我们假设,Al3+一方面使脑内产生Aβ的前体APP,导致Aβ的积累,另一方面使外周炎症发生,释放促炎细胞因子进入大脑,激活小胶质炎症亚型并抑制其吞噬作用,从而加剧Aβ的积累,诱导了促凋亡机制的发生,使神经元细胞死亡,AChE水平上升,导致认知障碍,引发了AD。
当前针对AD的治疗药物疗效差,尚无准确靶向中枢神经炎症的药物,且副作用大。而omega(n)-3多不饱和脂肪酸(polyunsaturated fatty acids, PUFAs)作为海洋生物活性物质,是细胞膜的重要组成成分,也是维持人体正常生理活动的必需脂肪酸,具有明显的抗炎效果且无毒副作用。二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)是主要的n-3 PUFAs,增加饮食中EPA的摄入,能够明显改善中枢神经炎症[7]。增加DHA的摄入,能够明显改善免疫疾病中氧化损伤、外周炎症水平等[8]。我们和他人的大量研究证明EPA和DHA能够改善M1型小胶质细胞的过度激活,减少促炎细胞因子的释放,增加神经营养因子合成,且均能够抑制细胞凋亡[9]。但是,我们曾报道EPA具有强大的抗炎、抗氧化作用,而DHA促进神经发育和再生,似对记忆的改善作用更强[10]。由于两者在食物、衰老和疾病中的比值多变,其单一和最佳组合的功效不明。本团队曾在Aβ诱导的SH-SY5Y 细胞AD模型上发现,EPA+DHA(1 ∶2)对抗氧化、抗炎和神经保护的作用最佳[11]。本实验拟解决的关键问题是利用Al3+诱导斑马鱼AD 模型比较研究EPA、DHA及EPA+DHA (1:2)对认知障碍及神经炎症的改善作用及其机制。
本研究通过新物体识别及奖赏记忆实验评估了斑马鱼的认知和记忆能力;通过ELISA法检测Aβ、q-PCR检测APP、Bace1和Axl用于评估斑马鱼脑内Aβ沉积情况及小胶质细胞的吞噬能力;q-PCR测定脑内IL-6和TNF-α,评估斑马鱼炎症水平;q-PCR检测脑内VDAC1、Bax、Caspase-3和Caspase-9,评估斑马鱼细胞凋亡情况;q-PCR检测脑内AChE,进一步评价斑马鱼的认知障碍;利用GC-MS检测并评估斑马鱼躯干多不饱和脂肪酸的组成和浓度。
1 材料与方法
1.1 材料与试剂6~8月龄野生型斑马鱼(上海佳誉水族馆);棕榈油(益海嘉里金龙鱼粮油有限公司,批号:20200406);EPA(纯度:85%,批号:TZSW210310-1)、DHA(纯度:85%,批号:TZSW210315-1)均购自西安通泽生物科技有限公司;六水合氯化铝(西陇科学股份有限公司,批号:7784-13-6);Trizol RNA 提取试剂(广州齐云生物科技有限公司);HiScript ® Ⅱ Q Select RT SuperMix反转录试剂盒(批号:7E472J0)和SYBR qPCR Master Mix荧光染料试剂盒(批号:7E551A1)均购自南京诺维赞生物科技有限公司;RNA引物由上海生物工程股份有限公司合成。
1.2 实验方法
1.2.1分组及处理方式 野生型斑马鱼随机分成5组:对照组、模型组、DHA、EPA和DHA+EPA (2 ∶1)治疗组。其中DHA+EPA的比例,根据团队中已发表的研究选择2 ∶1。对照组在pH值为6.0±0.2 的清水中并饲喂含棕榈油质量分数为1%的饲料;将模型组以及治疗组的斑马鱼暴露在含Al3+质量浓度为100 μg·L-1,pH值亦为6.0±0.2的清水中,模型组饲喂含棕榈油质量分数为1%的饲料,治疗组分别喂食含DHA、EPA和DHA+EPA(2 ∶1)质量分数均为1%的饲料;每天测量并使用盐酸溶液调节水的pH值。实验周期为30 d。
1.2.2行为学实验 新物体识别实验于T形迷宫中评价成年斑马鱼的认知能力。T形迷宫由透明有机玻璃制成,外部各臂粘有黑色塑料自黏膜,利用不透光的黑色塑料自黏膜镂空裁出三角形、正方形和圆形,并将自黏膜分别粘于起始臂、训练臂和新臂。将斑马鱼放入起始臂,关闭新臂,使其在起始臂和训练臂中自由活动30 min,24 h后打开新臂,将斑马鱼仍从起始臂放入,使其自由探索迷宫5 min,记录到达新臂的潜伏期、进入新臂的次数以及在新臂中活动的时长。奖赏记忆实验亦于T形迷宫中,利用斑马鱼对食物的偏好性,评价斑马鱼的记忆水平。将斑马鱼放入起始臂,自由活动30 min,在训练臂和奖励臂各放置一个投食环,仅在奖励臂的投食环中每10 min投放少量饲料,24 h后,撤去两端的投食环,将斑马鱼仍从起始臂放入,使其自由探索迷宫5 min,记录第一次到达奖励臂的潜伏期。当天结束试验后,使斑马鱼在迷宫中自由活动20 min,在奖励臂的投食环中每10 min投放少量饲料,进行强化记忆训练。第2、3和4天重复第1天的实验步骤,第4天测试结束后不再进行强化训练。
1.2.3GC-MS检测脂肪酸 脂肪酸提取及甲酯化:称取斑马鱼躯体200 mg,加入适量氯仿-甲醇溶液(2 ∶1)研磨均匀,室温离心(3 600 r·min-1, 2 min)取上清加入圆底玻璃试管中,与7 mL氯仿-甲醇溶液混合,充满氮气后充分涡旋。加入2.5 mL 生理盐水,充满氮气后充分涡旋,室温离心(500 r·min-1, 20 min)。吸取下层溶液过滤于无水硫酸钠,3 mL 氯仿缓慢滴洗后收集滤液并用氮气吹干。于样品中加入2 mL 0.5 mol·L-1NaOH的甲醇溶液, 90 ℃水浴15 min。冷却后加入2 mL 14% 三氟化硼-甲醇溶液, 90 ℃水浴30 min。冷却后加入2 mL 饱和氯化钠溶液和3 mL 正己烷,萃取2次,仅收集上层溶液。合并2次上层溶液,氮气吹干,得到脂肪酸甲酯,加入正己烷稀释至所需浓度,用0.45 μm滤膜过滤,可于-20 ℃保存待测。GC-MS仪器参数:色谱柱InterCap Pure-WAX(30 m×0.25 mm×0.25 μm),载气为氦气,流速1 mL·min-1,分流比1 ∶50,进样器温度250 ℃,检测器温度250 ℃,进样量1 μL。采用程序升温:80 ℃保留2 min,以10 ℃·min-1升至120 ℃,保留5 min,以10 ℃·min-1升至180 ℃,保留5 min,以10 ℃·min-1升至240 ℃,保留8 min。MS条件及参数:离子源温度:230 ℃,接口温度:250 ℃,采集方式:Q3 Scan。
1.2.4qPCR检测 取适量斑马鱼脑组织,利用Trizol提取RNA,测定RNA浓度,利用ddH2O稀释统一RNA质量,根据反转录试剂盒说明书操作,得到cDNA,利用荧光染料试剂盒于PCR仪检测IL-6、TNF-α、CD206、APP、Bace1、Axl、AChE、VDAC1、caspase-3、caspase-9、和Bax的mRNA水平,并计算得到相对mRNA水平。各引物序列如Tab1。

Tab1 Primer sequence of qPCR
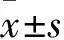
2 结果与分析
2.1 EPA、DHA及其组合对Al3+诱导斑马鱼记忆障碍的改善作用由Fig1所示,与对照组相比,Al3+暴露后明显增加了d 1~4天斑马鱼进入奖励臂的潜伏期(P<0.01,P<0.01);与模型组相比,给予DHA(P<0.01,P<0.01)和DHA+EPA(2 ∶1)(P<0.01)均明显改善了d 1~4斑马鱼进入奖励臂的潜伏期,且DHA+EPA的改善效果更好,而EPA仅明显改善了d 2~4的潜伏期(P<0.01)。

Fig1 DHA, EPA and their combination significantly inhibited memory deficit of zebrafish induced by Al3+ exposure(n=11-12)
2.2 DHA及其与EPA的组合抑制甚至逆转了Al3+诱导的斑马鱼认知障碍由Fig2所示,与对照组相比,Al3+暴露后明显增加了斑马鱼到达新臂的潜伏期(P<0.01),明显降低了进入新臂的持续时间(P<0.05)和次数(P<0.05);与模型组相比,DHA+EPA(2 ∶1)均明显逆转了Al3+暴露后到达新臂的潜伏期(P<0.01)、进入新臂的持续时间(P<0.01)和次数(P<0.01),而DHA 仅明显改善了到达新臂的潜伏期(P<0.01),EPA则均无明显的改善作用。上述结果表明组合的抑制效果最佳。

Fig2 DHA and DHA+EPA significantly reduced or even reversed increased latency of zebrafish to reach new arm (A), the duration in new arm (B) and the number of entries into new arm (C) in Al3+
2.3 EPA与DHA改善Al3+对斑马鱼躯体omega-3多不饱和脂肪酸的降低由Fig3所示,与对照组相比,Al3+暴露后明显降低了斑马鱼躯体EPA(P<0.01)、DPA(P<0.01)和DHA(P<0.05)的浓度,明显增加了AA(P<0.05)的浓度;与模型组相比,单独EPA明显增加了斑马鱼躯体EPA(P<0.05)和DPA(P<0.05)的浓度,明显降低了AA的浓度(P<0.05);DHA明显增加了躯体DHA的浓度(P<0.05),明显抑制了AA浓度的增加(P<0.01);DHA+EPA(2 ∶1)明显逆转了AA的浓度增加(P<0.01),对AA浓度的降低效果最佳。
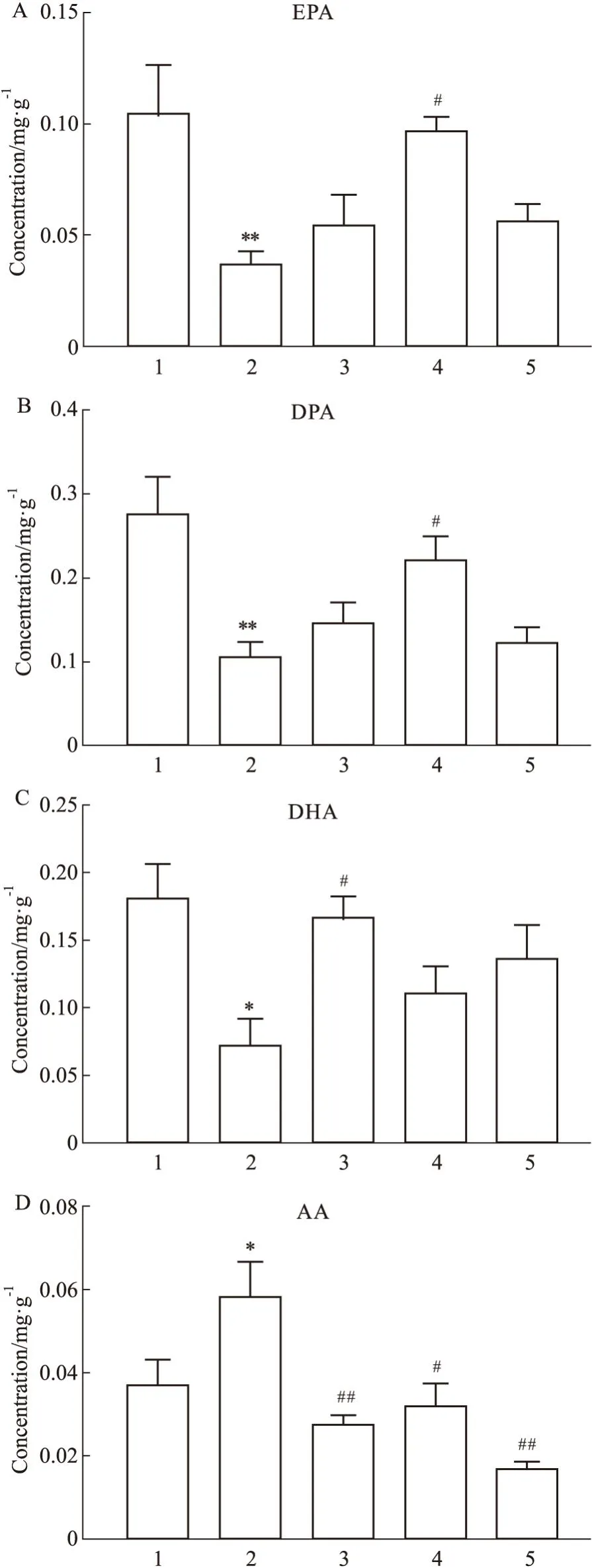
Fig3 DHA, EPA and their combination significantly ameliorated decrease in EPA (A), DHA (B) and DPA concentration (C),while inhibited AA (D) in zebrafish
2.4 EPA、DHA及其组合对Al3+暴露后斑马鱼脑内神经病理变化的改善作用
2.4.1EPA、DHA及其组合对Aβ蛋白浓度以及APP和Bace1 mRNA表达的干预作用 由Fig4.1所示,与对照组相比,Al3+暴露后明显增加了斑马鱼脑内Aβ蛋白浓度以及APP和Bace1的mRNA水平,DHA和EPA则明显逆转了APP(P<0.01,P<0.01)和Bace1(P<0.01,P<0.01)的mRNA水平变化,DHA和DHA+EPA(2 ∶1)均明显抑制了Aβ蛋白浓度的上升(P<0.05,P<0.05)。其中单独EPA对APP mRNA表达具有最佳的抑制作用。

Fig4.1 DHA, EPA and their combination significantly reduced level of Aβ related parameters in zebrafish brain of Al3+ model group: Aβ protein concentration (A) and relative mRNA level of APP (B) and Bace1
2.4.2EPA、DHA及其组合对神经炎症、小胶质亚型及其吞噬清除能力的作用 Fig4.2显示,与对照组相比,Al3+明显增加了斑马鱼脑内TNF-α(P<0.01)和IL-6 (P<0.01)的mRNA水平,明显降低了小胶质细胞M2型标志物CD206(P<0.01)和吞噬清除Aβ相关基因Axl(P<0.01)的mRNA水平;与模型组相比,3种药物治疗明显降低IL-6的mRNA表达水平(均为P<0.01)明显增加CD206的mRNA水平(均为P<0.01);而DHA及DHA+EPA明显上调甚至逆转了Axl mRNA水平的降低(分别为P<0.001,P<0.05),DHA和EPA则明显逆转了TNF-α mRNA的增加(均为P<0.01)。从P值可以看出,单独DHA对IL-6和Axl水平的变化具有最佳的逆转作用。

Fig4.2 DHA, EPA and their combination significantly inhibited and even reversed increase of TNF (A) and IL-6 (B) and decrease of CD206 (C) and Axl (D) in zebrafish brain after
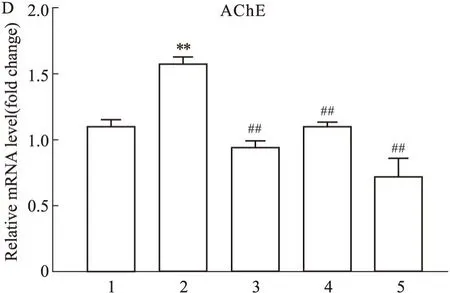
Fig4.3 DHA, EPA and their combination reversed increase of AChE in zebrafish brain after Al3+exposure(n=6-8)
2.4.3EPA、DHA及其组合对AChE mRNA表达的抑制作用 Fig4.4显示,与对照组相比,Al3+明显增加了斑马鱼脑内AChE(P<0.01)的mRNA水平;与模型组相比,DHA(P<0.01)、EPA(P<0.01)、DHA+EPA(2 ∶1)(P<0.01)均明显改善甚至逆转了Al3+暴露后AChE的mRNA水平,其中单独DHA和DHA+EPA(2 ∶1)的改善效果优于单独EPA,且作用相似。
Fig4.4 DHA, EPA and their combination significantly alleviated and even reversed increased apoptosis related factors mRNA level in zebrafish brain after Al3+exposure: VDAC1 (A), caspase-3 (B), caspase-9 (C) and Bax (D)(n=7-9)
2.4.4EPA、DHA及其组合对脑内神经元凋亡的抑制作用 由Fig4.3所示,与对照组相比,Al3+明显增加了斑马鱼脑内VDAC1(P<0.01)、Caspase-3(P<0.01)、Caspase-9(P<0.05)和Bax(P<0.05)的mRNA水平;EPA、DHA及组合治疗均降低了Al3+增加Caspase-3(均为P<0.01)、Caspase-9(分别为P<0.05,P<0.01,P<0.01)和Bax(分别为P<0.05,P<0.01,P<0.01)的mRNA水平。而单独给予DHA(P<0.01)和DHA+EPA(2 ∶1)(P<0.01)明显改善甚至逆转了VDAC1的mRNA水平。P值进一步显示,DHA+EPA (2 ∶1)对Caspase-3和Bax水平的升高有更好的改善作用。
3 讨论
众多动物实验和临床研究证明,n-3 PUFA作为重要的膜成分之一,通过增加膜流动性、减少氧化应激、抑制神经炎症反应和凋亡途径[12],从而改善或预防神经退行性疾病。本研究首次比较了EPA和DHA及其组合对Al3+诱导的斑马鱼AD模型中认知障碍和神经病理性变化的不同作用,然后探讨EPA和DHA在该模型中的潜在协同作用。根据这些结果,我们发现DHA和EPA及其组合具有改善甚至逆转认知障碍和神经病理性变化的作用。其机制涉及不同程度地抑制神经炎症反应,恢复小胶质细胞的吞噬作用,降低AChE水平上升,减少神经元凋亡。本研究将从以下几个发现进行讨论。
3.1 EPA和DHA的组合对认知障碍具有最佳的逆转作用本研究结果显示,与AD患者的行为相似,暴露于Al3+的斑马鱼出现认知与记忆障碍,说明Al3+诱导的斑马鱼AD模型成立。临床实验表明,长期摄入n-3 PUFAs能改善衰老和早期AD引起的认知和记忆衰退[13],本研究的行为结果进一步支持该临床研究发现。在奖赏记忆实验中,DHA和EPA及其组合均明显降低了斑马鱼进入奖励臂中的潜伏期,其中两者的组合具有最佳的改善记忆的作用。在新物体识别实验中,单独EPA无明显改善作用,单独DHA则明显降低了斑马鱼到达新臂的潜伏期,而DHA+EPA的组合不仅明显降低了到达新臂的潜伏期,还明显增加了在新臂中的持续时间以及进入新臂的次数,说明在Al3+暴露下,此组合比单独DHA或EPA对记忆和认知障碍具有更好的抑制作用,其组合的作用机制可能与以下讨论结果相关。
3.2 EPA和DHA的组合对AA浓度上升具有最佳的抑制作用我们在机制方面首先探讨了三种治疗方式对斑马鱼躯干中EPA、DHA、DPA和AA浓度的干预效果。结果表明,Al3+明显降低了斑马鱼躯体中EPA、DPA和DHA的浓度,明显增加了AA的浓度,这些结果证明Al3+抑制抗炎omega-3,增加促炎omega-6 PUFAs合成, 前人在其他动物AD模型上也有类似的结果。并且我们发现,给予单独EPA明显增加了Al3+暴露后斑马鱼躯干中EPA和DPA的浓度,明显降低了AA的浓度;单独DHA明显改善DHA浓度的降低和AA浓度的升高;而DHA+EPA的组合虽然对EPA、DPA以及DHA没有明显的干预效果,但对AA浓度上升的抑制作用最佳。已有动物实验表明,AA浓度反映了动物体内的炎症水平,且与记忆和认知能力呈负相关[14]。因为我们认为,在本研究中,DHA和EPA在这个比例的组合具有协同作用,可能是通过降低斑马鱼躯干AA的浓度来抑制斑马鱼体内的炎症水平,从而改善Al3+诱导的斑马鱼记忆和认知障碍。
3.3 EPA、DHA及其组合对Aβ蛋白浓度及其相关蛋白水平表达的抑制作用有研究发现,给予的饲料中降低n-3/n-6比例能够使APP/PS1转基因小鼠大脑中Aβ浓度增加[15],且我们团队曾发现EPA的抗炎活性能够抑制IL-1β诱导的Aβ前体APP的表达[16]。本研究的结果证明,给予单独DHA或EPA均明显逆转了Al3+诱导斑马鱼脑内Bace1和APP的mRNA水平的增加。虽然单独DHA与组合均明显降低了Aβ的蛋白浓度,但两者之间无明显差异。因此我们认为DHA+EPA的组合可能主要不是通过干预Aβ的生成而达到改善斑马鱼记忆和认知障碍的最佳效果。这一结果间接地提示多年来作用于Aβ的药物研发屡屡失败的潜在原因。
3.4 单独DHA对神经炎症、小胶质细胞激活及其吞噬清除能力有最佳的逆转效果本研究也同样发现,与对照组相比,Al3+成年斑马鱼脑内M1标志物CD11表达增加,抗炎M2型小胶质细胞标志物表达明显降低,与之对应,促炎细胞因子的表达明显上升,说明Al3+的刺激能够诱导斑马鱼脑内炎症的发生,使小胶质细胞功能紊乱。由于小胶质细胞具有吞噬Aβ的功能,对AD的发生与发展起到了重要的作用[17]。本研究发现Al3+的刺激不仅引发了中枢神经炎症,还降低了小胶质细胞的吞噬能力,由此加剧了Aβ在脑内的积累,诱导了斑马鱼AD的发生。3种PUFAs干预后,DHA对降低炎症指标TNF-α和IL-6、抑制小胶质细胞过度激活并恢复其吞噬功能具有最佳的效果,说明单独DHA可能是通过恢复小胶质细胞的对Aβ的吞噬作用而干预Al3+诱导的斑马鱼认知和记忆障碍。但未知组合PUFAs干预斑马鱼认知和记忆障碍最佳疗效的作用机制。
3.5 DHA+EPA的组合对AChE水平的增加和脑内神经元凋亡的抑制作用最佳AChE在胆碱能突触间能够降解ACh,阻碍神经信号传递,AChE过度活跃是引起记忆和认知障碍的原因之一[5]。本研究发现,单独DHA和EPA以及两者组合均明显降低了AChE的mRNA水平,其中组合的干预作用最佳,说明DHA和EPA在这个比例下对AChE水平的降低具有协同作用。
3.6 PUFAs组合对细胞凋亡的抑制作用最佳AD的细胞凋亡假说认为,可溶性O-Aβ使神经元细胞的阴离子通道VDAC1水平上升,诱导促凋亡蛋白从线粒体内膜释放到细胞质中,如Bcl-2相关X蛋白(Bcl-2 associated X,Bax)[3]以及Caspase家族的Caspase-3和Caspase-9[4]这些蛋白使神经元凋亡。本研究发现,Al3+明显增加脑内VDAC1、Bcl-2、Bax、Caspase-3和Caspase-9的mRNA表达水平,说明Al3+模型符合AD的细胞凋亡假说。EPA和DHA及其组合干预均逆转了VDAC1、Bcl-2、Bax、Caspase-3和Caspase-9的mRNA水平的上升,而DHA+EPA的组合具有最佳的干预效果。综上所述,DHA和EPA的比例为2 ∶1时,在抑制细胞凋亡相关蛋白的表达方面具有协同作用,并且对AChE表达的最佳抑制作用可进一步降低了神经元与细胞凋亡相关蛋白的结合,从而实现对Al3+诱导的斑马鱼记忆和认知障碍的最佳干预效果。
