黄连素下调NRAV和PI3K/AKT通路减轻RSV感染致HEp-2细胞的损伤
2024-04-23崔玉娟苏东霞胡丹东
崔玉娟,赵 辉,苏东霞,张 莹,胡丹东
(1. 西北师范大学生命科学学院,甘肃 兰州 730070;2. 北京市延庆区疾病预防控制中心,北京 102100;3. 北京市延庆区市场监管检验检测监控中心,北京 102100)
呼吸道合胞病毒(respiratory syncytial virus,RSV)属于副粘病毒科、肺病毒属,是一种含有包膜的反义单链RNA病毒,在全球范围内具有高度的流行性,发病率呈现逐年上升的趋势,存在较大的威胁。RSV主要感染者为儿童和老人,感染后的症状以支气管炎或者其他下呼吸道疾病、发烧为主,随着感染加剧可引起不同的组织病变,特别是引发肺炎等严重的呼吸系统疾病[1]。黄连素(berberine,BE)为从小檗属植物中分离得到的生物碱,具有抗菌、抗病毒、抗炎、抗癌等多种作用,在抗病毒领域已经发现可适用于治疗多种病毒感染性疾病,其机制与BE调节MAPK途径、PI3K/AKT、AMPK/mTOR、NF-κB信号通路以及自噬密切相关[2]。不仅如此,BE还被发现可以支持宿主的免疫反应,提高机体内代谢能力,进一步强化对病毒的清除能力。由于BE毒性低、人体耐受性好,因此在抗病毒治疗领域具有一定的潜力。
NRAV是近年来发现的长链非编码RNA(long non-coding RNA,LncRNAs)家族成员之一,可通过抑制干扰素刺激基因(ISGs)转录调节抗病毒的活性,病毒的感染可以诱导宿主细胞NRAV的差异性转录,在免疫信号通路中发挥抗病毒作用,并介导病毒的复制,减少对宿主细胞病毒感染后的抗病毒先天免疫反应[3]。有研究表明,NRAV的过表达可促进体外RSV的复制,宿主细胞可能通过降低NRAV水平抑制RSV病毒感染[4]。PI3K/AKT信号通路与细胞的生长、分裂、存活有关,研究发现,病毒为了入侵细胞,并在细胞内进行有效的复制,通过激活该通路的方式对宿主细胞采取了抑制凋亡的策略,促使感染细胞逃避先天免疫反应而短期生存,从而使病毒在细胞凋亡前进行有效的复制,在不同类型的病毒感染过程中,均发挥关键作用[5]。本研究旨在探究LncRNA NRAV与PI3K/AKT信号通路在BE减轻RSV病毒感染致HEp-2细胞损伤中的作用及相关机制,为RSV感染性疾病的治疗和药物开发提供参考。
1 材料与方法
1.1 细胞、主要试剂和仪器人喉表皮样癌细胞(HEp-2)、RSV病毒株购自美国ATCC公司。BE购自北京索莱宝科技有限公司(CAS号:2086-83-1,分子量:336.36,纯度:≥98%)。NRAV过表达质粒(pc-DNA3.1-NRAV)、NRAV低表达质粒(sh-lncRNA NRAV)、NRAV阴性对照质粒(NC-lncRNA NRAV)、空白质粒(pc-DNA3.1),购自湖南普拉特泽生物科技有限公司;PI3K激活剂740Y-P(M00988)购自北京百奧菜博科技有限公司;RPMI 1640培养基、DMEM培养基、二甲基亚砜(DMSO)(200-664-3)、MitoSOX工作液(1821370-28-8),购买自西格玛奥德里奇(上海)贸易有限公司;CCK-8试剂(HY-K0301)购自德国默克公司;一抗抗体PI3K、AKT、NLRP3、ASC、caspase-1、PINK1、Parkin、P62、Beclin1、LC3 I、LC3 II、BNIP3购自美国Cell Signaling Technology公司;IL-1β(SEKH-0002)、IL-6(SEKH-0013)、IL-8(SEKH-0016)、TNF-α(SEKH-0047)ELISA检测试剂盒购自北京索莱宝科技有限公司;PBA缓冲液、JC-1试剂盒(C2005)、ATP试剂盒(S0026)购自上海碧云天生物技术有限公司。流式细胞分析仪(CytoFLEX型)购自美国美国贝克曼库尔特公司;酶标仪购自赛默飞世尔科技(中国)有限公司;全自动蛋白印迹系统(Qblot型)购自上海曼博生物医药科技有限公司;激光共聚焦显微镜(OLS5100型)购自日本奥林巴斯公司。
1.2 方法
1.2.1细胞培养、分组及处理 HEp-2细胞用含有10%胎牛血清的DMEM培养基在37 ℃、5% CO2培养箱中培养,取对数生长期HEp-2细胞按照1×105/孔接种于6孔板中,细胞生长度达80%~90%时备用。取适量BE在DMSO溶液中充分溶解,配置浓度分别为5、10、15 μmol·L-1的BE溶液,RSV处理剂量为200 pfu/孔。将HEp-2细胞随机分为:pcDNA3.1-NRAV组(细胞转染pcDNA3.1-NRAV,RSV处理)、sh-lncRNA NRAV组(细胞转染sh-lncRNA NRAV,RSV处理)、NC-lncRNA NRAV组(细胞转染NC-lncRNA NRAV,RSV处理)、Control组(不用RSV和BE处理)、RSV组(RSV处理)、RSV+5 μmol·L-1-BE组(RSV和5 μmol·L-1的BE处理)、RSV+10 μmol·L-1-BE组(RSV和10 μmol·L-1的BE处理)、RSV+15 μmol·L-1-BE组/RSV+BE组(RSV和15 μmol·L-1的BE处理),RSV+BE+740Y-P组(RSV、15 μmol·L-1的BE和50 μg·L-1的740Y-P处理)、RSV+BE+pcDNA3.1组(细胞转染pcDNA3.1,且RSV、15 μmol·L-1的BE处理)、RSV+BE+pcDNA3.1-NRAV组(细胞转染pcDNA3.1-NRAV,且RSV、15 μmol·L-1的BE处理)对照组和感染组则加入DMSO 20 μL,BE处理组加入相应浓度的BE溶液20 μL。各组细胞在37 ℃、5% CO2的细胞培养箱中培养24 h后,收集细胞检测相应指标。
1.2.2细胞转染 细胞在60 mm培养皿中以3.0×105个/皿的密度培养24 h。然后,使用Lipofectamine 2000转染试剂将pcDNA3.1-NRAV、sh-lncRNA NRAV、NC-lncRNA NRAV、pcDNA3.1质粒3 μg转染至HEp-2细胞中,在37 ℃、5%CO2的培养箱中培养48 h。
1.2.3qRT-PCR检测mRNA表达水平 收集培养24 h后的各组HEp-2细胞,用TRIzol法提取总RNA,反转录后进行PCR,以GAPDH为内参,采用2-ΔΔCT法定量NRAV、RSV-F、NS2的相对表达水平。
1.2.4Western blot检测HEp-2细胞相关蛋白表达 收集培养24 h后的各组HEp-2细胞,用RIPA裂解液提取总蛋白,用BCA法测浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),并转膜,用5%脱脂奶粉封闭,加入相应一抗(1 ∶1 000),4 ℃过夜。加入辣根过氧化物酶标记的二抗(1 ∶5 000),37 ℃孵育1 h。ECL显色、暗室曝光。以GAPDH为内参,利用Quantity One软件分析各条带灰度值。目的蛋白表达水平=目的蛋白灰度值/GAPDH灰度值×100%。
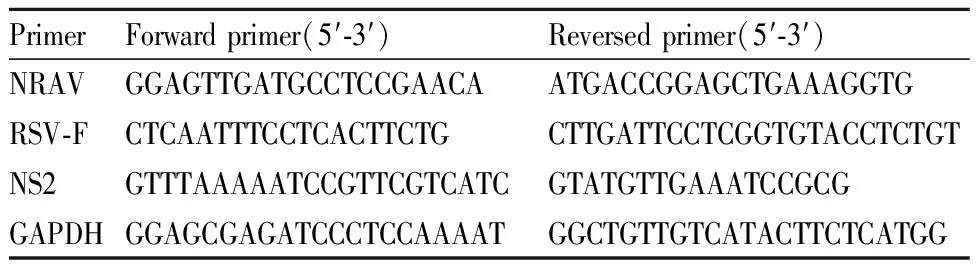
Tab1 Primer sequences
1.2.5CCK-8实验检测HEp-2细胞存活率 收集培养24 h后的各组HEp-2细胞,加入100 μL CCK-8试剂,37 ℃孵育1 h,检测450 nm处的吸光度值,计算细胞存活率。细胞存活率=实验组吸光度值/对照组吸光度值×100%。
1.2.6流式细胞术检测HEp-2细胞凋亡率和线粒体膜电位 HEp-2细胞培养48 h后,收集细胞,用冰冷的PBS洗涤两次,并在70%冰冷的乙醇中在4 ℃下固定过夜。在PBS中再水化15 min后,将细胞在黑暗中用PI溶液染色30 min,通过流式细胞术分析细胞凋亡率。HEp-2细胞培养24 h后,2 000 r·min-1离心5 min,弃上清,加入500 μL的JC-1工作液,37 ℃下孵育20 min。2 000 r·min-1离心5 min,弃上清,缓冲液洗涤细胞,并重悬,用流式细胞仪分析各组HEp-2细胞线粒体膜电位。线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合物,呈红色荧光。线粒体膜电位较低时,JC-1为单体,不能聚集在线粒体基质中,呈绿色荧光。线粒体膜电位用红色荧光细胞的比例表示。
1.2.7检测HEp-2细胞中ATP水平 收集培养24 h后的各组HEp-2细胞的培养液上清,加入ATP检测溶液,用多功能酶标仪测量发光强度。随后根据标准曲线计算ATP含量(nmol·mg-1蛋白)。
1.2.8MitoSOX染色检测线粒体活性氧(mtROS)水平 HEp-2细胞培养24 h后,加入终浓度5 μmol·L-1的MitoSOX工作液,37 ℃避光孵育20 min,PBS洗涤,加入DAPI工作液,室温避光孵育15 min,PBS洗涤,激光共聚焦显微镜下观察。红色为mtROS,蓝色为细胞核。
1.2.9ELISA检测HEp-2细胞炎性因子分泌水平 收集培养24 h后的各组HEp-2细胞的培养液上清,按照ELISA试剂盒说明书检测IL-1β、IL-6、IL-8、TNF-α水平。
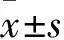
2 结果
2.1 LncRNA NRAV对RSV感染HEp-2细胞的影响qRT-PCR检测LncRNA NRAV的转染效率,pcDNA3.1-NRAV组中NRAV表达水平明显高于sh-lncRNA NRAV组与NC-lncRNA NRAV组(P<0.05),而sh-lncRNA NRAV组最低(P<0.05)(Fig1A)。过表达NRAV使RSV活性基因RSV-F、NS2明显升高(P<0.05),敲低NRAV后活性降低(Fig1B)。pcDNA3.1-NRAV组细胞活性最低,凋亡率最高(P<0.05),sh-lncRNA NRAV组结果相反(Fig1C-E)。过表达NRAV可以抑制感染RSV的HEp-2细胞的活性,促进病毒复制,并促进感染细胞凋亡。

Fig1 Effect of LncRNA NRAV on RSV infection in HEp-2 cells
2.2 BE对RSV感染HEp-2细胞中NRAV和PI3K/AKT信号通路的影响RSV感染后明显降低了HEp-2细胞中的NRAV表达水平,BE处理后进一步降低了NRAV的表达水平,且呈剂量依赖性(P<0.05)(Fig2A)。信号通路检测结果显示,RSV感染HEp-2细胞后,细胞中PI3K、AKT蛋白的表达水平成功上调,PI3K/AKT信号通路被激活,Control组HEp-2细胞中PI3K、AKT的表达水平最低(P<0.05)。与RSV组相比,BE组干预的3组细胞中PI3K、AKT蛋白表达水平均下降,且随浓度的增加其表达量呈剂量依耐性降低(P<0.05)(Fig2B、C)。

Fig2 Effect of BE on NRAV and PI3K/AKT signaling pathways in RSV infected HEp-2 cells
2.3 过表达NRAV、激活PI3K/AKT通路逆转BE引起的通路抑制RSV感染HEp-2细胞后,BE抑制了由病毒感染引起的PI3K/AKT信号通路激活(P<0.05)。PI3K激活剂740Y-P处理后,逆转了BE对RSV感染HEp-2细胞中PI3K/AKT信号通路的抑制作用,PI3K、AKT的表达水平明显升高(P<0.05)。过表达NRAV同样可以逆转BE对RSV感染HEp-2细胞中PI3K/AKT信号通路的抑制作用,差异具有统计学意义(P<0.05),与740Y-P处理组相比无统计学意义(P>0.05)(Fig3)。
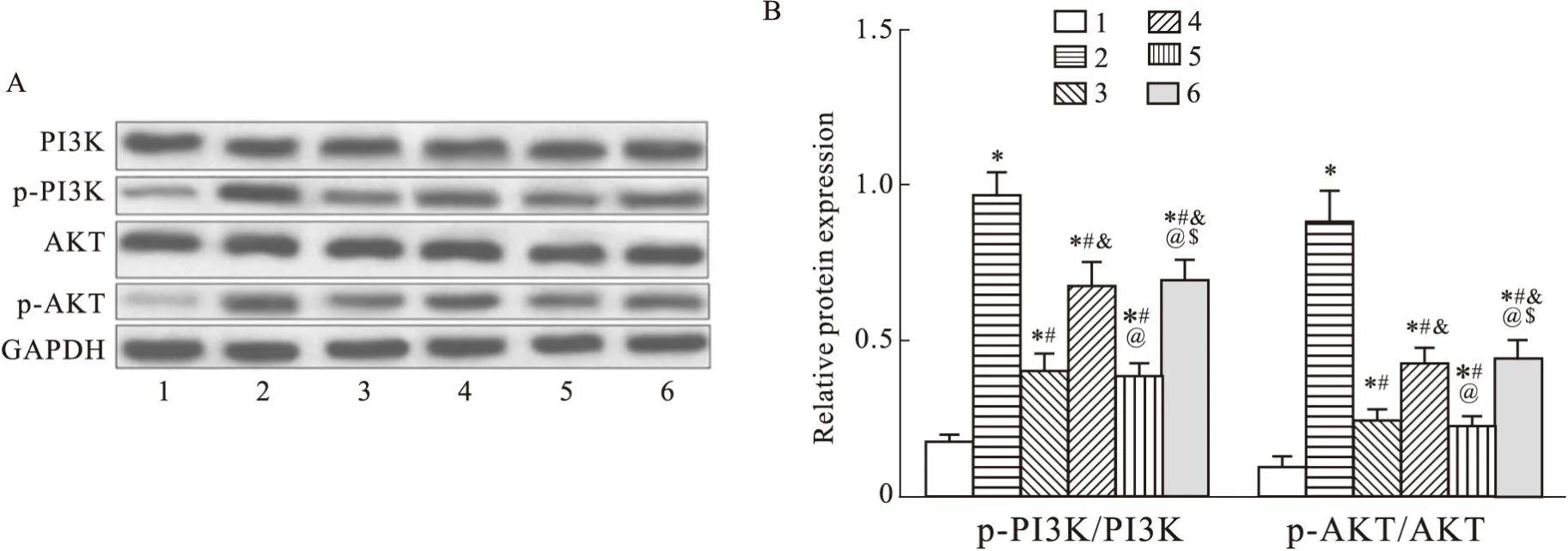
Fig3 Overexpression of NRAV and activation of PI3K/AKT pathway reverse pathway inhibition caused by BE
2.4 过表达NRAV、激活PI3K/AKT通路加重线粒体损伤RSV感染降低了HEp-2细胞的ATP、线粒体膜电位(P<0.05),并明显增加了HEp-2细胞的mtROS水平(P<0.05)。BE处理则增加了RSV感染HEp-2细胞的ATP、线粒体膜电位(P<0.05),并降低了HEp-2细胞的mtROS水平(P<0.05)。PI3K激活剂740Y-P处理、过表达NRAV均可逆转BE对RSV感染HEp-2细胞ATP、线粒体膜电位、mtROS水平的影响(P<0.05),加重了线粒体损伤(Fig4)。
Fig4 Overexpression of NRAV and activation of PI3K/AKT pathway exacerbate mitochondrial damage
2.5 过表达NRAV、激活PI3K/AKT通路降低线粒体自噬水平BE干预明显增加了RSV感染HEp-2细胞线粒体自噬标志蛋白PINK1、Parkin、Beclin1、LC3Ⅱ/LC3Ⅰ、BNIP3的表达水平(P<0.05),降低了p62的表达水平(P<0.05),诱导PINK1/Parkin、BNIP3途径共同介导了线粒体自噬,减轻细胞损伤。PI3K激活剂740Y-P处理、过表达NRAV则逆转了BE对自噬标志蛋白的影响(Fig5)。

Fig5 Overexpression of NRAV and activation of PI3K/AKT pathway reduce mitochondrial autophagy levels
2.6 过表达NRAV、激活PI3K/AKT通路增加凋亡率、加重炎症反应RSV组凋亡率为27.22%,与Control组相比细胞损伤严重(P<0.05)。BE干预后,细胞活性升高,细胞凋亡率降低至9.75%(P<0.05)。通路激活剂740Y-P和过表达pcDNA3.1-NRAV质粒干预后,细胞活性降低,而细胞凋亡率又分别上升至18.58%和22.98%,细胞损伤严重(P<0.05)(Fig6A-C)。BE干预后明显抑制了炎性小体的活性(P<0.05),而通路激活剂740Y-P和过表达pcDNA3.1-NRAV质粒的干预,逆转了BE的作用效果,炎性小体被再次活化,加重了细胞的炎症反应(Fig6D-F)。
3 讨论
RSV是在人类中广泛流行的病原体,目前尚缺乏特效的药物,严重威胁人类健康,对RSV抗病毒分子机制的研究将为未来抗病毒药物的研发提供新靶点和新方向。BE作为一种传统的中药提取物,在多种病毒感染性疾病中表现出显著的抗病毒功效。研究表明,BE可以有效地靶向抑制宿主AP1和阻断病毒蛋白,发挥对HPV的抗病毒能力[6],并通过抑制逆转录酶的活性抑制HIV的复制[7],通过诱导线粒体自噬,降低线粒体ROS的产生,进而抑制IAV引发的炎症反应[8]。众所周知,病毒感染过程及许多抗病毒药物的药理机制还涉及LncRNAs的调控,NRAV在RSV、IAV感染期间明显下调,过表达NRAV可促进RSV在A549和BEAS-2B细胞中的复制,促进IAV的复制和毒力,NRAV的下调可能是宿主抗病毒先天免疫反应的一部分[4,9]。而我们过往的研究还发现,BE可以通过NRAV、RAB5C靶向竞争结合miR-299-3p,抑制JNK/p38 MAPK信号通路和PI3K/AKT信号通路提高HSV-1感染HEp-2细胞的存活率,并降低凋亡率[10]。基于上述结果,本研究从过表达NRAV和激活PI3K/AKT信号通路入手,探究BE对RSV感染HEp-2细胞的影响。
在本研究中,过表达NRAV后,感染RSV的HEp-2细胞活性降低,凋亡率增加,促进了病毒复制,而敲低NRAV则出现了完全相反的结果。NRAV的过表达,能够使RSV大量增殖,破坏宿主的正常细胞结构,促使细胞的加速凋亡,从而造成一系列的炎症反应与病理损伤产生。RSV感染细胞后,宿主激活先天免疫反应使NRAV的表达水平明显降低,BE干预处理可进一步降低RSV感染的HEp-2细胞NRAV表达水平,结果表明NRAV可能参与BE的抗病毒过程。
研究发现,在许多病毒感染期间PI3K/AKT信号通路会被病毒激活,并进一步促进病毒入侵和复制[11]。在病毒感染早期,进入宿主细胞后病毒为了在宿主细胞内有效的增殖,采取了激活PI3K/AKT信号通路促进感染细胞生存的策略,使病毒在细胞死亡之前能够大量增殖。细胞的抗病毒先天免疫反应通过抑制PI3K/AKT信号通路促进感染细胞凋亡[5],抑制病毒的复制。研究发现NRAV的表达水平随BE浓度的增加而降低,PI3K/AKT信号通路相关蛋白的表达水平随BE浓度的增加而降低,推测BE通过上述分子机制发挥对RSV的抗病毒作用。进一步用PI3K激活剂740Y-P处理后,在BE的作用下通路蛋白的表达水平仍然明显升高,逆转了BE对病毒感染HEp-2细胞中PI3K/AKT信号通路的抑制作用,而过表达NRAV也得到了同样的抑制结果。通过上述实验可知,在过表达NRAV以及激活PI3K/AKT信号通路后,BE对PI3K/AKT信号通路的抑制作用被逆转,BE则可能通过下调NRAV并抑制PI3K/AKT信号通路抑制RSV的感染能力。
病毒感染致细胞损伤与线粒体受损有关。受损线粒体的膜电位降低进一步导致ATP合成受阻,且释放ROS,导致ROS大量积累,进而诱导细胞与组织损伤[12]。线粒体损伤受线粒体自噬的调控,线粒体自噬是一种专一降解损伤或老化线粒体的选择性自噬,其对维持线粒体数量及正常功能、保持线粒体ROS平衡非常重要[13],并且在抵御病原体感染中发挥重要作用。PINK1/Parkin通路和BNIP3通路的激活均可介导自噬小体对损伤线粒体的识别和包裹,进而诱导线粒体自噬[14-15]。在本研究中,RSV感染HEp-2细胞后,线粒体内膜两侧外正、内负的线粒体膜电位下降,线粒体膜电位的异常影响氧化磷酸化和线粒体ATP合成,同时释放了大量的ROS,导致HEp-2细胞的线粒体严重受损。PINK1在线粒体外膜积累,进一步招募Parkin并泛素化受体蛋白和适配器蛋白,PINK1/Parkin和介导的线粒体自噬被激活。在BE干预后,线粒体功能得到了恢复,线粒体膜电位升高、ATP水平升高、ROS水平降低,PINK1/Parkin和BNIP3介导的线粒体自噬均被激活,BE改善了线粒体功能,维持了线粒体的稳定。而740Y-P处理和过表达NRAV后,在BE的作用下线粒体膜电位降低、ATP合成减少、细胞中ROS水平升高,线粒体功能仍然受损,线粒体自噬蛋白水平降低,自噬通路被抑制,逆转了BE对RSV感染HEp-2细胞线粒体功能的改善作用。过表达NRAV对线粒体功能损伤的程度要大于740Y-P激活PI3K/AKT信号通路后对线粒体的损伤程度。有文献显示[16],抑制PI3K/AKT信号通路可通过促进线粒体自噬,促进线粒体功能恢复,进而减轻细胞损伤。因此,结合本次研究的结果可知,BE可能通过下调NRAV并抑制PI3K/AKT信号通路提高线粒体膜电位、提高ATP水平、降低mtROS水平,激活线粒体自噬,改善RSV导致的线粒体功能障碍和细胞损伤。
为进一步研究NRAV与PI3K/AKT信号通路在BE抗RSV病毒过程中的作用,本研究进行了细胞增殖、凋亡水平、炎症反应检测。结果发现,BE处理可增加RSV感染HEp-2细胞的存活率并降低凋亡率。740Y-P处理或过表达NRAV可逆转BE对RSV感染的HEp-2细胞增殖、凋亡的影响。表明NRAV与PI3K/AKT信号通路可促进RSV感染导致的HEp-2细胞损伤。BE减轻RSV致HEp-2细胞损伤的机制可能与BE下调NRAV和PI3K/AKT信号通路通路有关。NLRP3炎性小体能被多种类型的病原体或危险信号激活,在机体免疫反应和疾病发生过程中具有重要作用,是机体介导免疫炎症的关键调控因子。病毒感染后,线粒体损伤会释放大量ROS,进而使NLRP3炎性小体过度活化,促进IL-1β、IL-6、IL-8、TNF-α等炎症因子成熟释放,诱导细胞高炎症状态,导致细胞损伤,进而发生细胞凋亡[17]。大量的研究证明,NLRP3炎性小体的过度活化是病毒感染导致细胞损伤的重要原因之一[18]。研究显示,RSV感染可明显提高HEp-2细胞内 NLRP3、ASC、caspase-l蛋白表达及IL-1β、L-6、IL-8、TNF-α分泌水平,导致 NLRP3 炎性小体过度活化,使感染细胞的存活率降低,这与既往病毒感染的结果相似。BE干预可降低RSV感染HEp-2细胞内NLRP3、ASC、caspase-l蛋白表达及炎性因子分泌水平,抑制NLRP3 炎性小体活化。740Y-P处理或过表达NRAV可再次激活炎性小体、促进炎性因子分泌,逆转了BE抑制RSV感染的HEp-2细胞炎症反应的作用。结果提示BE可能通过下调NRAV并抑制PI3K/AKT信号通路抑制NLRP3炎性小体活化对RSV感染HEp-2细胞起保护作用。
综上所述,过表达NRAV和激活PI3K/AKT信号通路可以逆转BE改善线粒体功能、激活线粒体自噬、增加细胞活性、降低细胞凋亡率、减轻炎症反应等作用。BE减轻RSV感染所致HEp-2细胞损伤,其机制可能与BE下调NRAV和PI3K/AKT信号通路,进而激活线粒体自噬、降低线粒体损伤与炎症反应有关。然而,BE的抗病毒作用可能不仅仅是通过上述机制进行的,可能是由其他细胞机制共同作用的结果,针对这一点将在后续的研究中进行更多的验证,以全面了解BE对RSV的抗病毒分子机制。
