海马G蛋白偶联雌激素受体1参与癫痫调控的转录组学研究
2024-04-23郝世杰任晓璠马文倩王盼盼王诗雨戎伟芳刘昆梅
左 娣,郝世杰,杨 盼,李 苗,任晓璠,丁 娜,马文倩,王盼盼,王诗雨,戎伟芳,刘昆梅
(宁夏医科大学1. 颅脑疾病重点实验室、2. 临床医学院、3. 口腔医学院,宁夏 银川 750004;4. 上海交通大学基础医学院,上海 200025)
癫痫是一类脑部神经元异常放电引起自发、反复性发作的疾病。抗癫痫药物是癫痫治疗的主要方式[1],但约30%的患者对药物治疗反应差,这类癫痫被称为“难治性癫痫”,颞叶癫痫即临床常见的难治性癫痫之一。因此,深入开展颞叶癫痫发病机制研究,对其治疗方式的拓展及抗癫痫药物的开发具有重要意义。随着转录测序技术的进步,转录组测序变得越来越便捷和准确,可以结合蛋白互作等研究手段,筛选出更加特异、作用显著的靶蛋白。转录测序可为完善癫痫发病机制研究提供有力的生物信息学支持,为抗癫痫药物筛选提供潜在靶点。
近年来研究发现,雌激素与癫痫有紧密联系[2],高浓度雌激素会加剧癫痫发作,而低浓度雌激素具有抗癫痫效应,雌激素还有降低癫痫持续状态死亡率效应。G蛋白偶联雌激素受体1(G-protein coupled estrogen receptor 1,GPER1)与17β-雌二醇特异性结合后,引起cAMP合成,促进钙动员、激活酪氨酸激酶Src,促进肝素结合表皮生长因子(heparin binds to epidermal growth factor,HB-EGF)分泌,促进EGFR反式激活,进而激活下游PI3K/Akt和ERK/MAPK信号通路。GPER1发挥调控记忆认知[3-4]、神经保护[5]等作用,参与阿尔茨海默病、帕金森病、脑外伤、缺血性脑损伤、脑部肿瘤等病理过程。课题组之前研究表明,GPER1表达水平降低或功能被抑制时,能够明显提高颞叶癫痫易感性和癫痫持续状态发作严重程度[6-7],然而GPER1调控癫痫发作的分子机制并不清楚。本研究分别以野生型(wild type,WT)、Gper1敲低(Gper1-knockdown,Gper1-KD)大鼠海马组织为样本,使用二代真核转录组测序方法,对GPER1敲低对转录组影响进行分析,以期获得关键的基因及调控通路,丰富GPER1在癫痫中作用的基础研究。
1 材料
1.1 实验动物SD大鼠,体质量(230~280) g,♂,6~8周龄,购自宁夏医科大学实验动物中心,动物生产许可证号:SCXK(宁)2020-0001。所有大鼠饲养于恒温恒湿、12 h ∶12 h光暗循环SPF级环境中,均自由饮水饮食。实验中使用的Gper1-KD基因鼠由上海交通大学戎伟芳教授惠赠,该鼠为Gper1基因全身性敲低动物模型。用于转录组测序的鼠分为WT、Gper1-KD组,每组为含6只鼠海马组织的混合样品。用于qPCR验证的鼠分为WT、Gper1-KD、野生型癫痫后8h癫痫持续状态(status epilepticus,SE)组(WT SE)、Gper1敲低癫痫后8h癫痫持续状态组(Gper1-KD SE),每组包括4~6个独立海马组织样品。所有动物实验经过宁夏医科大学伦理委员会批准(宁医大伦理第2021-N0122号)。
1.2 试剂TRIzol RNA提取试剂,购自Thermo Fisher科技公司;反转录试剂盒(货号:KR118-02),购自北京天根生物公司;荧光定量PCR试剂盒(货号:RR820A),购自TaKaRa生物技术公司。
2 方法
2.1 二代真核转录组测序方法取新鲜大鼠脑组织,冰上分离出海马脑区。提取海马组织RNA,并进行RNA质量鉴定、浓度检测,分装后保存在-80 ℃。加入Fragmentation Buffer将Oligo(dT)磁珠富集之后mRNA打断,然后以此打断的mRNA作为模板,进行cDNA两条链的合成。将合成的cDNA进行纯化,添加多聚腺苷酸尾,之后与测序接头连接,PCR反应进行文库构建,通过IlluminaHiSeq平台开展测序工作。将Gper1-KD组与WT组相比,根据差异表达基因条件倍数变化(fold change,FC)>2,且错误发现率(false discovery rate,FDR)<0.01进行筛选,此二代真核转录组测序由北京百迈客生物科技公司协助完成。
2.2 蛋白互作网络将所得FPKM(Fragments Per Kilobase per Million reads)数值,作为评价基因表达水平的一项重要指标。使用软件DESeqR分析两组样品间差异基因表达,运用Benjamini和Hochberg计算方法来控制P值,以降低错误率,只有FC≥2,FDR<0.05的基因才被认定为表达水平差异基因。使用STRING数据库将所有差异基因表达蛋白构建蛋白质互作网络,并对核心和关键蛋白进行进一步互作分析,应用Cytoscape软件将蛋白互作网络进行可视化。
2.3 荧光定量PCR(RT-qPCR)验证分离新鲜大鼠海马组织,提取RNA,按照反转录试剂盒方法步骤进行cDNA合成。每个反应体系包括1 μL cDNA,上、下游引物各1 μL,使用SYBR GREEN荧光定量PCR试剂盒进行PCR扩增。PCR仪设置程序为:95 ℃预反应5 min,95 ℃变性10 s,58 ℃退火45 s,72 ℃延伸45 s,从第2个步骤开始进行40个循环。以GAPDH转录表达水平为内参,基因表达相对值根据2-ΔΔCt计算。引物序列见Tab1。

Tab1 Primers used in real-time PCR
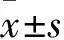
3 结果
3.1Gper1-KD组与WT组差异基因及癫痫相关基因将Gper1-KD组与WT组相比,根据差异表达基因筛选条件(FC>2且FDR<0.01)进行筛选,共检测到DEGs 2 253个,其中上调基因1 380个,下调基因873个,从DEGs中对癫痫相关基因进行筛选分析,见Tab2。

Tab2 Analysis of epilepsy-related gene expression
3.2Gper1-KD组多个生物过程及信号通路发生变化GO富集结果显示,DEGs富集的主要生物过程有淋巴细胞趋化性、细胞分泌、巨噬细胞趋化性、中性粒细胞趋化性、血管生成正向调控等(Fig1A);DEGs主要涉及的细胞组分有蛋白性细胞外基质、细胞表面、郎飞氏结、轴突起始段等(Fig1B);DEGs主要涉及转录因子结合、趋化因子活动、清道夫受体活性、整合蛋白结合等分子功能(Fig1C)。KEGG富集结果显示,DEGs所涉及的分子信号通路主要有肿瘤信号通路、PI3K-Akt、肿瘤蛋白聚糖相关通路、黏着斑相关通路、MAPK信号通路等(Fig1D)。
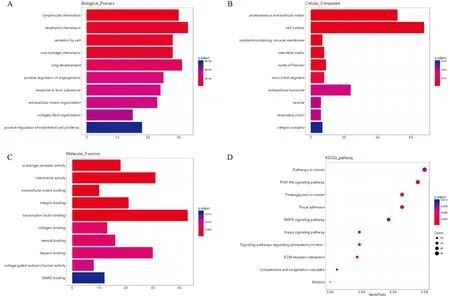
Fig1 GO and KEGG enrichment of DEGs between WT and Gper1-KD samples
3.3Gper1-KD组与WT组样品差异基因蛋白互作网络对Gper1-KD组与WT组样品DEGs表达蛋白进行互作分析,形成1个929个节点,10 592个互作关系的复杂网络结构(Fig2A)。对其中关键RNA和富集的信号通路绘制网络图,网络通路以大圆点显示。结果表明,关键差异蛋白主要在TNF信号通路、TGF-β信号通路、FoxO信号通路等,位于蛋白网络核心的蛋白主要有Mlkl、FoxO3、Mapk12、Pdpk1、Pik3cg、Cdh1等(Fig2B),其中位于网络结构中心的Mlkl、Pdpk1和Cdh1蛋白与癫痫发生密切相关。
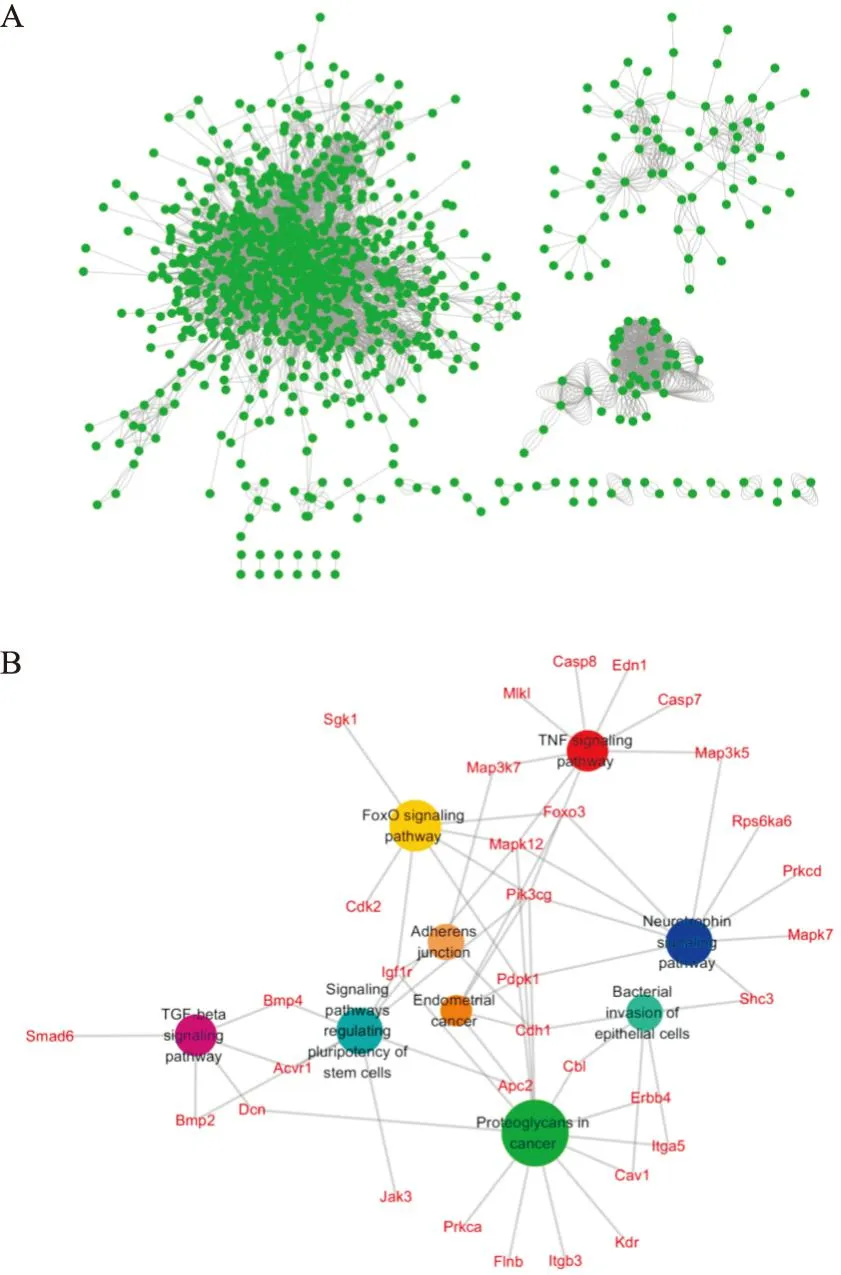
Fig2 Proteininteraction analysis between WT and Gper1-KD group
3.4Gper1-KD组与WT组关键差异基因RT-qPCR验证根据蛋白互作网络结果,选取筛选出的关键基因进行验证。实验结果表明(Fig3、4),与WT组相比,Gper1-KD组Mapk12、Pdpk1、Foxo3、Camk2d、Pik3cg、Gper1基因表达水平差异具有显著性,Pik3cb、Cdh1、Rac2基因表达水平差异无显著性。此外,Gper1-KD组与WT组相比,Camk2d和Pik3cg表达水平差异有显著性,然而,Gper1-KD SE组与WT SE组相比,Camk2d和Pik3cg表达差异无显著性,可能与癫痫持续状态时,Camk2d和Pik3cg基因表达水平迅速升高有关。雌激素处理后,Rac2基因表达水平下调[8],本实验结果表明,Gper1-KD SE组与WT SE组相比,Rac2表达水平明显升高,表明雌激素对Rac2基因表达的调控可能是通过GPER1。Rac2参与轴突的生长和引导[9],因此,GPER1可能通过调节Rac2基因表达改变,影响癫痫后神经元形态和功能。
Fig3 Detection of relative mRNA expression of key genes using n=4-6)

Fig4 Detection of relative mRNA expression of key genes using n=4-6)
4 讨论
本研究对WT、Gper1-KD组大鼠海马组织进行转录组学测序分析,KEGG富集结果显示,PI3K-Akt、MAPK信号通路调控效果明显。之前研究证实,mTOR能维持GABA能和谷氨酸能神经元的平衡,而GABA能和谷氨酸能神经递质的失衡是癫痫形成的关键原因。PI3K/Akt下游mTORC1复合物活性提高时,会提高神经元兴奋性,mTOR和炎症信号通路被抑制时,能起到降低发作,延迟或者抑制癫痫发展的作用[10]。另外,抑制PI3K和Akt可以阻止mTOR激活,与直接抑制mTOR起到一样的效应,即可以降低发作活动和细胞死亡数目。对创伤后癫痫海马类器官进行培养,可以发现一系列抗癫痫发生生物过程和神经保护活动,发现这个过程中mTOR被PI3K-Akt信号通路激活,并且短暂地抑制mTOR可以对癫痫产生持续的效应[11]。目前,关于mTOR信号通路在癫痫中作用的临床前研究越来越多,未来有望对难治性癫痫的治疗提供一定的帮助[12-13]。
长期反复性癫痫发作可能导致慢性癫痫、认知和行为障碍,在这个过程中,突触可塑性改变起到重要作用。长时程增强,即突触强度持续提高,对学习和记忆过程至关重要。针对癫痫小鼠认知障碍和突触可塑性改变的研究发现,此过程与促炎因子和PI3K/Akt通路密切相关[14-15]。研究发现,癫痫损伤学习和记忆能力,长时程增强减少,海马区炎症因子IL-1β、IL-6和TNF-α水平提高,而使用IL-1β受体拮抗剂后,长时程增强得以提高,通过PI3K/Akt信号通路改善小鼠癫痫后学习记忆障碍[16]。说明癫痫后分泌的IL-1β可以通过PI3K/Akt信号通路,影响海马区突触可塑性和学习记忆过程。因此,PI3K/Akt信号通路在癫痫发作、突触可塑性、学习记忆等过程中均有重要作用,本研究通过转录组比较也发现,多个PI3K-Akt信号通路基因存在明显的表达差异。
研究发现,激活小胶质细胞GPER1可通过NF-κB/MAPK信号通路,保护神经元免于兴奋性毒性[17]。MAPK家族包含3条信号通路,ERK、p38、JNK信号通路。ERK通过调节NMDA受体活性导致癫痫发生。MAPK在多种化学药物诱发癫痫动物模型中均发挥作用,提示MAPK通路参与癫痫发生过程。课题组之前研究也证实,p38 MAPK信号通路在癫痫后被激活,而且在GPER1调控下影响癫痫后炎症反应[6]。提示GPER1可能通过MAPK和PI3K-Akt-mTOR信号通路调控癫痫发病过程。
蛋白质互作结果提示,在WT、Gper1-KD海马组织中,差异蛋白富集的TGF-β通路是影响癫痫的关键信号通路。FoxO信号通路位于PI3K-Akt信号通路下游,可能通过PI3K-Akt信号通路在GPER1介导癫痫发作的过程中起作用。网络结构中心的PDPK1蛋白激酶,靶蛋白包括PKB、SGK1、PAK1等,之前研究证实PDPK1与癫痫发生密切相关[18],PDPK1可能在GPER1调控癫痫易感性中起关键作用。
WT与Gper1-KD组蛋白互作结果提示TNF信号通路有明显差异,这也与GPER1在神经炎症中有重要作用相符合,与我们之前GPER1敲减影响癫痫后炎症反应的研究结果相一致[6]。Pik3cg表达有明显差异,Pik3cg是属于PI3/PI4-kinase家族的一类激酶,PI3K/Akt/mTOR信号通路对癫痫发作有重要调控作用,因此Pik3cg蛋白在GPER1调控癫痫发作易感性过程中的作用也值得深入研究。
