基于TLR2/MyD88/NF-κB信号通路探讨加味少腹逐瘀汤对寒湿瘀结证子宫内膜异位症痛经小鼠腹腔炎症微环境干预作用
2024-04-23黄灿灿毛海燕吉秀家连小龙张作良陈元欢岳斌张小花申剑武权生
黄灿灿,毛海燕,吉秀家,连小龙,张作良,陈元欢,岳斌,张小花,申剑,武权生
(1.甘肃中医药大学中医临床学院,2.甘肃省人民医院,甘肃 兰州 730000;3.青海大学医学部,青海 西宁 810016)
子宫内膜异位症(endometriosis,EMT)是指具有生长功能的子宫内膜组织(腺体和间质)出现在子宫体腔以外部位的一种疾病。EMT的核心病理机制是随着卵巢功能周期性的变化,异位内膜发生周期性剥脱及出血,规律且进行性加重的痛经及慢性盆腔疼痛是EMT最主要的临床表现[1]。目前造成EMT痛经的机制尚不清楚且临床缺乏理想的根治手段[2],因此,探究EMT的致痛机制,寻求合理高效的治疗方案一直是临床防治EMT痛经的重点。EMT被认为是一种慢性炎症性疾病,研究表明慢性炎症反应可能造成EMT痛经最为直接的关键因素,异位内膜的侵袭和种植、性激素异常(雌激素优势、孕激素抵抗等)、免疫功能紊乱等因素均可以加重局部的炎症反应并刺激大量致痛因子的释放,进而加重EMT的疼痛状态,同时内异症患者血清炎症因子与盆腔粘连程度和痛经程度呈正相关[3]。故探寻相关炎症通路和靶向干预效应蛋白一直是EMT防治的热点。Toll样受体2 (Toll-like receptor 2,TLR2) /髓样分化因子88(myeloid differentiation primary response gene 88,MyD88)/核因子κB(nuclear factor κB,NF-κB)作为一条重要的炎症通路,其可介导心绞痛、骨关节痛、三叉神经痛、盆腔炎性疼痛等多种疼痛的发生[4-5],因此,靶向TLR2/MyD88/NF-κB信号通路或可成为EMT痛经防治的新方向。中医学认为,EMT痛经属于“经行腹痛”“癥瘕”范畴,其基本病机可概括为两个方面:一为气血不通,胞脉瘀滞而作痛;二为阳虚不足,温煦失司而为痛。针对这两大病机,课题组前期提出“温肾暖宫以除冷积、化瘀通滞以消癥瘕”的治疗原则,运用加味少腹逐瘀汤治疗,收效显著[6]。然而加味少腹逐瘀汤是否通过调控TLR2/MyD88/NF-κB信号通路发挥拮抗EMT痛经的作用,目前尚未见相关报道。故本研究以加味少腹逐瘀汤对EMT小鼠模型进行干预,旨在探讨该方是否通过对TLR2/MyD88/NF-κB信号通路相关蛋白及腹腔微环境的调控发挥拮抗EMT痛经的干预效应,为加味少腹逐瘀汤防治EMT痛经的推广运用提供分子生物学依据。
1 材料
1.1 动物选用6~8周龄BALB/c雌性小鼠共74只,体质量(18~20) g,购自斯贝福(北京)生物技术有限公司(SCXK(京)2019-0010),饲养于甘肃中医药大学SPF级动物房(许可证号:SYXK(甘)2021-0004)。所有小鼠适应性饲养1周。实验操作均严格遵照动物伦理相关规定执行并通过甘肃中医药大学动物中心伦理委员会批准(2022-056)。
1.2 药物与试剂加味少腹逐瘀汤(川芎6 g,五灵脂6 g,赤芍6 g,小茴香1.5 g,官桂3 g,干姜3 g,延胡索3 g,没药6 g,当归9 g,生蒲黄9 g,三棱3 g,莪术9 g、土鳖虫3 g、紫石英9 g)购自甘肃中医药大学附属医院,以1 ∶10药水比将药物浸泡于蒸馏水中2 h,按常法煎煮2次,每次30 min,滤出药液加热浓缩至每1 mL药液含生药1 g,高温灭菌冷却后置4 ℃冰箱备用,使用时稀释至所需浓度;孕三烯酮(上海麦克林生化科技有限公司,批号:C10681333);预染Marker(YESEN,20351ES72);RIPA裂解液(R0010)、BCA蛋白定量试剂盒(PC0020),购自北京索莱宝公司;抗TLR2(Bioss公司,bs-1019R),山羊抗兔IgG(RS0002)、抗MyD88(YT2928)、抗NF-κB(YT3108)、抗p-NF-κB(YP0191)、抗GAPDH均购自Immunoway公司。白介素6(Interleukin 6,IL-6)试剂盒(JC00632)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)试剂盒(JC00325)、前列腺素E2(Prostaglandin E2,PGE2)试剂盒(JC00745)、雌二醇(Estradiol,E2)试剂盒(YJ001962)、孕激素(Progesterone,P)试剂盒(YJ057778)均购自上海酶联生物科技有限公司。
1.3 仪器Western blot电泳仪(北京君意东方电泳设备有限公司,型号:JY-SCZ2+),实时定量PCR仪(西安天隆科技有限公司,型号:Gentier 96R),酶标仪(美国Thermo公司,型号:Multiskan Mk3)。
2 方法
2.1 模型构建适应性喂养后随机选取8只作假手术组(Sham)。其余66只小鼠按照1 ∶2的比例随机分为受体组44只,供体组22只,每只供体小鼠,构建2只模型小鼠。采用异体种植腹腔注射法构建EMT痛经模型[7]:造模前,所有小鼠颈背部皮下注射苯甲酸雌二醇(150 μg·kg-1),每4 d 1次以统一动情周期,共用两次,颈椎脱臼处死供体小鼠,迅速取出小鼠子宫于4 ℃生理盐水中清洗后沿中线等分为二,分别置于盛有0.5 mL 1×PBS培养皿中,将培养皿置于冰上将子宫纵向剖开并剪碎为体积约1 mm3的碎片,采用1 mL注射器配20 mL针头将0.5 mL子宫碎片于尿道口正上方约0.5 cm处注入受体小鼠下腹部,注射后轻按针孔后涂抹红霉素预防感染。假手术组亦于造模当日腹腔注射等体积PBS;同时模型各组采用冷水浴法构建寒湿瘀结证模型[8]:于造模第1天下午3点将小鼠置于冷水中水浴,水温保持(5±1)℃,持续10 min,连续干预21 d。造模第21天,随机选取4只小鼠,颈椎脱臼处死,开腹观察异位病灶,确定造模成功与否。
2.2 分组及药物干预建模成功后将模型小鼠分为5组,B组:模型组(Model)、C组:中药低剂量组(JWSFZYT-L)、D组:中药中剂量组(JWSFZYFT-M)、E组:中药高剂量组(JWSFZYT-H)、F组:阳性药物组(Gestrinone),每组8只。持续灌胃干预15 d。假手术组及模型组每日蒸馏水灌胃,给药浓度按照人与小鼠体表面积等效计量换算得出,以等效剂量作为中剂量给药浓度,两倍计量为高剂量给药浓度,二分之一剂量为低剂量给药浓度,得出中药高、中、低剂量组每天分别给予19.8、9.9、5.0 g·kg-1剂量的加味少腹逐瘀汤灌胃1次,共干预15 d。阳性对照组给予孕三烯酮组(0.325 mg·kg-1)灌胃,每3 d 1次,共15 d。第15日给药后,给予缩宫素注射,观察各组小鼠扭体反应次数。
2.3 标本制备与采集给药结束,禁食24 h后取材。经0.3%戊巴比妥钠10 mL·kg-1剂量行腹腔注射麻醉后,立刻打开腹腔,仔细检查腹腔粘连程度及病灶。空白组取子宫,其余各组剥离全部内异灶组织用生理盐水冲洗干净并称重(干重)。取一部分组织固定于10%多聚甲醛溶液中,一部分置于冻存管中,放入-80℃冰箱中冻存,用于指标检测。
2.4 观察指标
2.4.1自主活动检测 药物干预第15天上午灌胃结束后30 min,检测各组小鼠自主活动能力,于自主活动仪中适应3 min后检测5 min内站立次数。
2.4.2粪便含水率检测 于药物干预第15天下午,将小鼠禁食水2 h后,收集4 h粪便,称取湿重后置于(60 ℃)干燥恒温箱内干燥24 h,称取干重。称重后将粪便再次烘干1 h后二次称重,两次重量之差控制于3 mg之内,即可计算粪便含水量。粪便含水率=(粪便湿重-粪便干重)/粪便湿重×100%。
2.4.3热板试验 药物干预第15天上午自主活动能力检测后30 min,将各组小鼠置于热板仪(温度55 ℃)上记录两次舔足时间的平均值为热痛潜伏期。
2.4.4组织病理学评价 于药物干预后的第16天上午取材,当天进行腹腔粘连程度评价;异位病灶取出后测量异位灶的体积和总重量;子宫及异位病灶用4%多聚甲醛溶液固定,石蜡包埋。切片后行苏木精-伊红(hematoxylin-eosin,HE)染色。HE染色观察异位病灶的细胞形态,免疫组化染色检测NF-κB表达情况,图像分析使用ImageJ软件。
2.4.5实时荧光定量PCR检测 取新鲜的内异灶组织(假手术组取子宫组织)于离心管中,使用TRIzol法进行组织总RNA的提取,超微光分光光度计检测样品浓度。按步骤进行逆转录和扩增,扩增后将得到的Ct值采用2-ΔΔCT法计算目的基因的mRNA相对表达量。具体引物见Tab1。
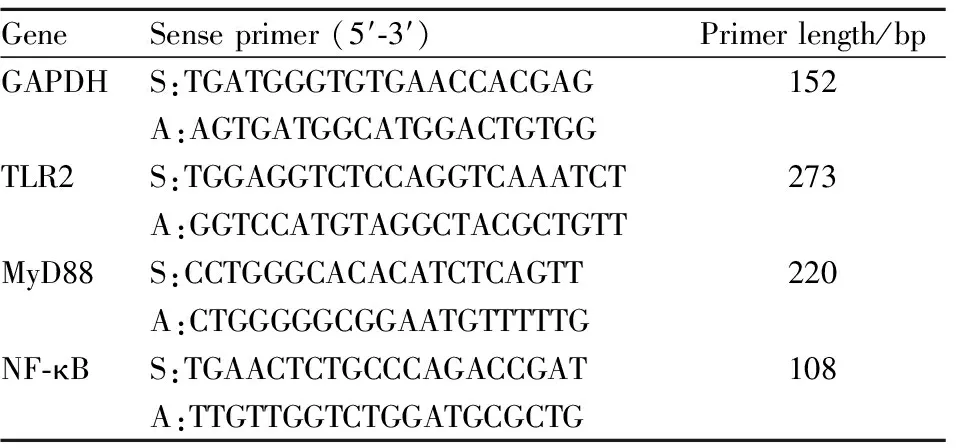
Tab1 Information of primer sequences
2.4.6Western blot检测 取异位病灶组织,剪碎后裂解,冰上研磨30 min,离心后取上清液,加缓冲液,加热变性后采取BCA法测定蛋白浓度;配胶、上样、电泳、转膜后封闭。一抗孵育过夜(4 ℃):TLR2、MyD88、NF-κB、p-NF-κB(均以1 ∶1 000稀释)、GAPDH(1 ∶2 000);TBST洗膜后加山羊抗兔IgG二抗(1 ∶3 000);ECL法显影,ImageJ测量灰度值及目标蛋白表达量。
2.4.7ELISA检测 戊巴比妥钠麻醉后,采用眼球取血法取小鼠外周血1 mL,离心取上清,按照试剂盒说明书步骤操作,检测小鼠外周血IL-6、TNF-α、PGE2、E2、P含量。
3 结果
3.1 加味少腹逐瘀汤可以改善模型小鼠证候表现
3.1.1自主活动检测 与假手术组相比,模型组小鼠自主活动次数明显减少(P<0.01);与模型组相比,加味少腹逐瘀汤高剂量组可以明显增加模型小鼠自主活动次数(P<0.01);其余各组与模型组之间无统计学差异(P>0.05)。见Tab2。

Tab2 Comparison of autonomous activity,fecal water content,
3.1.2粪便含水率检测 与假手术组相比,模型组小鼠粪便含水量明显增加(P<0.01);与模型组相比,加味少腹逐瘀汤高剂量组可以显著降低模型小鼠粪便含水量(P<0.01);其余各组与模型组之间无统计学差异(P>0.05)。见Tab2。
3.1.3热痛潜伏期比较 与假手术组相比,模型组小鼠热痛潜伏期明显缩短(P<0.01),与模型组相比,除中药低剂量组外,干预各组小鼠热痛潜伏期均较模型组有所延长(P<0.05,P<0.01),且以中药高剂量组和阳性药物组明显(P<0.01)。见Tab2。
3.2 加味少腹逐瘀汤可以减小异位病灶及异位子宫的大小取材时模型小鼠腹腔内可见形态不规则大小不等的异位灶,病灶多呈半透明的囊性包块,包块常与周围组织粘连且囊壁充满新生小血管;异位灶多位于大网膜,还可能侵犯腹壁、子宫、肠壁、卵巢等部位(Fig1)。病灶直径范围1~9 mm不等,其中模型组病灶直径较大,中药高剂量组及阳性对照组病灶直径较小(Fig2)。测量各组小鼠子宫体积并对各组异位病灶进行称重比较异位病灶总重量,结果显示:与模型组相比,药物干预后各组小鼠子宫体积及异位灶均较模型组有所减小,且以阳性对照组和中药高剂量组减小明显(P<0.01)。见Fig2、Fig3。
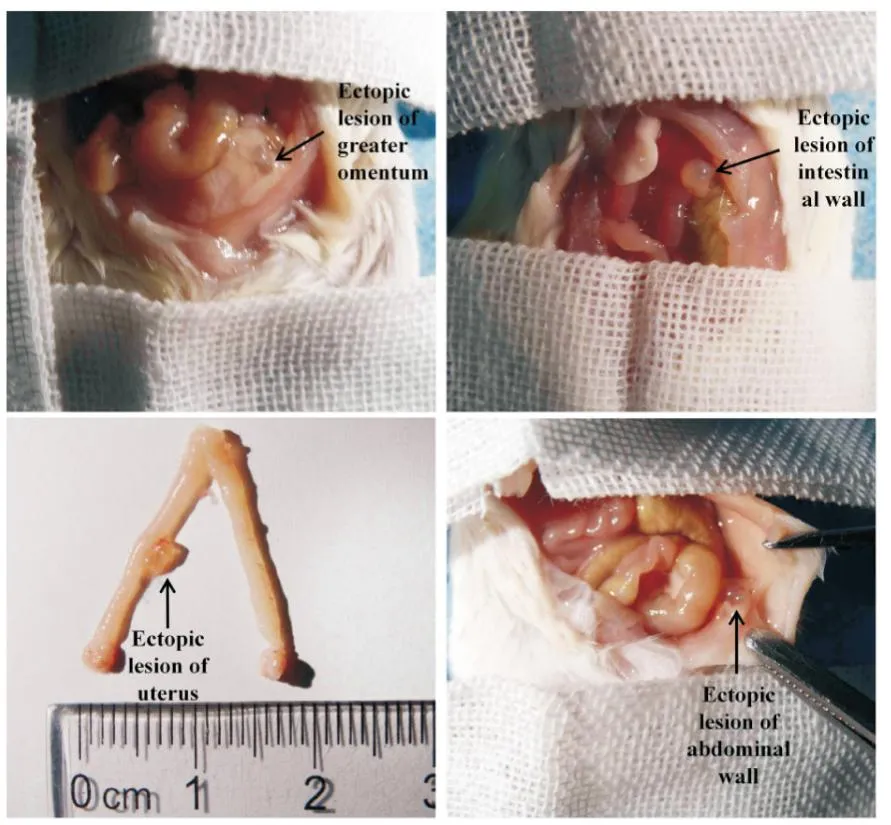
Fig1 Location and morphology of ectopic lesions in mice
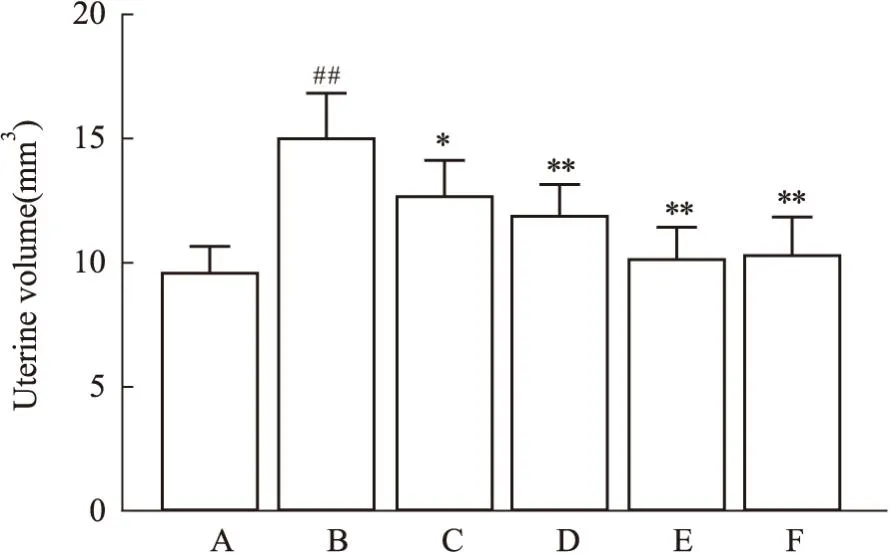
Fig2 Comparison of uterine volume of mice in each
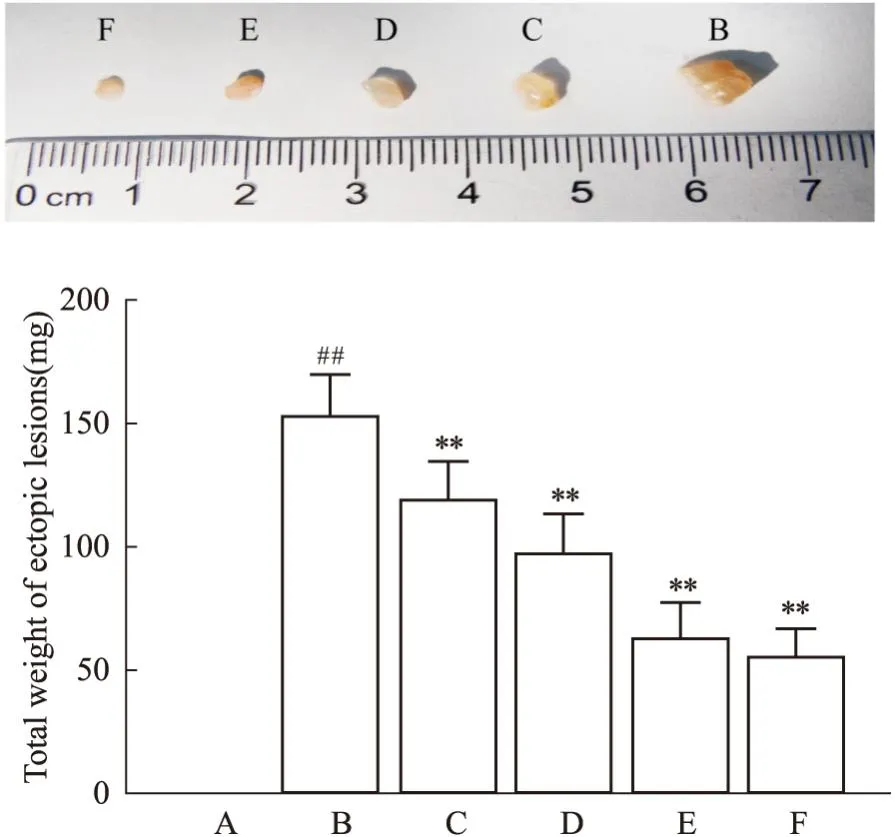
Fig3 Comparison of volume and total weight of ectopic lesions in each
3.3 加味少腹逐瘀汤可以缓解模型小鼠病理损伤假手术组取子宫组织,其结构层次正常,病理可见单层柱状上皮,偶见点状坏死,固有层子宫腺数量丰富,可见少量淋巴细胞散在浸润;模型组小鼠异位组织可见与假手术组相似的单层柱状上皮及间质,且结构明显异常,内膜腺体周边可见明显炎症细胞浸润;腺体下可见核下空泡;治疗后,除低剂量组外,其余各治疗组异位灶病理显示损伤有显著好转,其中以中药高剂量组和阳性药物组改善最为明显。见Fig4。

Fig4 Comparison of pathological features of ectopic lesions in each group of mice(×200)A:Sham;B:Model;C:JWSFZYT-L;D:JWSFZYT-M; E:JWSFZYT-H; F:Gestrinone.
3.4 加味少腹逐瘀汤可以降低模型小鼠异位病灶NF-κB的表达与假手术组相比,模型组小鼠异位灶组织、胞质、胞核中NF-κB的表达明显增高,与模型组相比,各给药组异位灶组织、胞质、胞核中NF-κB的表达有所降低,以阳性药物组和中药高剂量组表达降低最为明显。见Fig5。

Fig5 Comparison of expression of NF-κB in heterotopic lesions of mice in each group A:Sham;B:Model;C:JWSFZYT-L;D:JWSFZYT-M; E:JWSFZYT-H; F:Gestrinone.
3.5 加味少腹逐瘀汤对TLR2/MyD88/NF-κB信号通路mRNA的影响与假手术组相比,模型组小鼠异位组织TLR2、MyD88、NF-κB mRNA表达量明显增加(P<0.01),与模型组相比,除中药低剂量组外,各给药组TLR2、MyD88、NF-κB mRNA的表达量降低,以阳性药物组和中药高剂量组下降最为明显(P<0.01)。见Fig6。

Fig6 Comparison of mRNA relative expression levels of TLR2,MyD88 and NF-κB in heterotopic lesions of mice in each
3.6 加味少腹逐瘀汤对TLR2/MyD88/NF-κB信号通路蛋白的影响与假手术组相比,模型组小鼠异位组织TLR2、MyD88、p-NF-κB 表达量明显增加(P<0.01),与模型组相比,各给药组TLR2、MyD88、p-NF-κB的表达量降低(P<0.05,P<0.01),以阳性药物组和中药组高剂量组下降最为明显(P<0.01)。各组小鼠异位灶中NF-κB蛋白表达无明显差异。见Fig7。
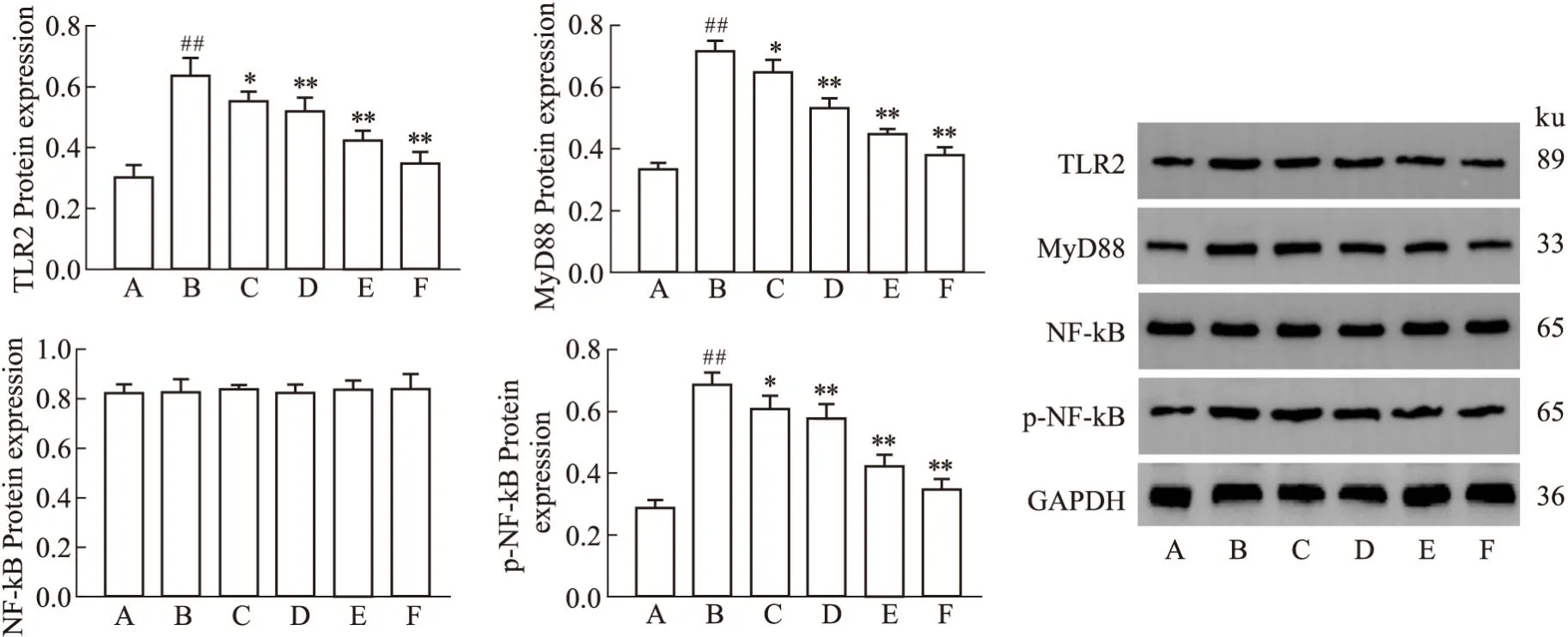
Fig7 Comparison of heterotopic lesions TLR2,MyD88,NF-κB,P-NF-κB in each
3.7 加味少腹逐瘀汤对血清炎症因子的影响与假手术组相比,模型组小鼠血清IL-6、TNF-α、PGE2水平明显增高(P<0.05),与模型组相比,各给药组血清IL-6、TNF-α、PGE2水平均有所降低(P<0.05,P<0.01),以阳性药物组和中药高剂量组下降最为明显(P<0.05)。见Fig8。

Fig8 Comparison of serum levels of IL-6,TNF-α and PGE2 in each
3.8 加味少腹逐瘀汤对血清E2、P的影响与假手术组相比,模型组小鼠血清E2水平升高(P<0.05)、P水平下降(P<0.05),与模型组相比,给药后各组血清E2水平有所降低、P水平有所升高,但仅阳性药物组和中药高剂量组变化有统计学差异(P<0.05)。见Fig9。

Fig9 Comparison of serum E2 and P levels in each group of
4 讨论
EMT作为一种妇科常见病,常伴随着严重的慢性疼痛,该病疼痛以渐进性加重的痛经和慢性盆腔痛最为典型,目前EMT痛经发病机制尚不完全清楚,研究证实,炎症反应在EMT病程进展中发挥着重要作用,慢性炎症刺激亦是引起EMT局部免疫细胞聚集、致痛因子分泌、新血管生成、组织纤维化粘连的重要因素,而这些病理过程均可促进慢性疼痛的发生[9]。现代医学对于EMT痛经的治疗主要以口服药物为主,常选择非甾体类抗炎镇痛药、性激素制剂,疼痛严重者可选择手术治疗;然而口服西药仅能短暂缓解疼痛,手术治疗存在复发率高的缺点[10],因此,寻求理想控制EMT痛经的方案已成为临床亟待解决的问题。研究表明中医药在防治EMT痛经方面表现出独特的优势。大量临床证据显示温肾化瘀法可以有效缓解EMT患者的慢性疼痛[11],并改善中医证候。课题组前期致力于中医药防治妇科血瘀证的研究,临床运用加味少腹逐瘀汤治疗EMT痛经疗效显著[12],本次实验结果亦证实,加味少腹逐瘀汤在改善自主活动次数、大便含水量及热痛潜伏期等证候表现方面有较好的作用,但该方作用机制有待进一步探索。
IL-6是由多种细胞分泌的具有免疫调节功能的细胞因子,其具有调节免疫细胞功能、刺激局部炎症反应,促进组织粘连和纤维化等作用[13],其还参与慢性炎症的形成。研究表明TNF-α是一种多能性的细胞因子,其与神经性疼痛、炎性疼痛 、癌痛等多种疼痛有直接关系;在炎性疼痛形成过程中TNF-α可引起血管内皮损伤和局部微血栓形成,而刺激局部组织的出血、坏死,同时,TNF-α还可以促进中性粒细胞黏附和吞噬功能,加重局部炎症状态,促进炎性致痛因子分泌,进而加剧炎性疼痛[14]。PGE2是一种常见的致痛炎症因子,研究表明,PGE2与痛经严重程度呈正相关,这可能与PGE2诱发超敏反应增加末梢神经元的兴奋性有关,PGE2还可以通过激活TRPV1、CaV1.4及Nav1.8 等离子通道,增加神经元的敏感性,介导慢性疼痛的发生[15]。本研究结果显示,加味少腹逐瘀汤可以降低血清中致痛炎症因子IL-6、TNF-α、PGE2水平,这可能是改善EMT痛经的直接原因。
NF-κB信号通路是炎症反应的主要调节通路之一,研究表明该信号通路在EMT病变中过度活跃,并参与介导了EMT的发作、进展和复发,EMT病灶的形成,会激活NF-κB相关通路诱导产生免疫细胞监视,长时间的作用下进而形成慢性炎症反应,促进IL-6、TNF-α、PGE2等致痛因子的高表达[16]。此外,EMT作为一种雌激素依赖性疾病,疾病发生过程中还会出现雌激素受体-β和孕激素受体的畸变,这些受体改变亦会加重NF-κB介导的局部炎症反应,进而促进炎性疼痛的加剧,本研究结果显示,模型组小鼠外周血存在雌激素水平增高及孕激素水平下降的现象,加味少腹逐瘀汤可以降低血清中E2水平并恢复P水平;而NF-κB表达降低与外周血E2及P水平的恢复呈正相关,因此,靶向NF-κB信号通路防治EMT痛经已逐渐成为研究的热点。Toll样受体 (Toll-like receptors,TLRs)是最早被发现的天然免疫模式识别受体,其中TLR2可以在局部炎症浸润、超敏反应、病原体侵袭等条件下被激活,从而发挥免疫监视及清除病原体的作用[17]。衔接蛋白MyD88与TLR2相结合后可激活下游NF-κB信号通路从而促进炎症反应的发生[18],因此,TLR2/MyD88/NF-κB信号通路或可称为防治EMT痛经的关键靶点,本研究结果显示加味少腹逐瘀汤可显著TLR2/MyD88/NF-κB相关基因和蛋白的表达,从而发挥拮抗慢性炎症反应的作用。
本研究发现阳性对照药物孕三烯酮作为临床指南推荐的治疗EMT的非甾体类孕激素药物,亦可以调控TLR2/MyD88/NF-κB信号通路,改善模型小鼠的炎症反应。其作用机制可能是通过结合异位灶孕激素受体,进而降低外周血E2水平,同时抑制下丘脑-垂体-靶腺轴降低雌激素水平,抑制异位病灶的生长,从而降低局部炎症反应而实现的。
综上所述,加味少腹逐瘀汤可以通过抑制TLR2/MyD88/NF-κB信号通路,改善局部炎症微环境,降低炎症因子IL-6、TNF-α、PGE2的表达,调节性激素水平,从而达到改善证候表现及痛经状态。
