载阿霉素纳米粒温敏凝胶复合体系的体内缓释性能和抗肿瘤作用及瘤内滞留性能评价*
2024-04-22杜华康陆苑金阳陈玉颖王永林李勇军刘文
杜华康, 陆苑, 金阳, 陈玉颖, 王永林,3, 李勇军,3, 刘文***
(1.贵州医科大学 贵州省药物制剂重点实验室 & 省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳 550004; 2.贵州医科大学 药学院, 贵州 贵阳 550004; 3.贵州医科大学 民族药与中药开发应用教育部工程研究中心, 贵州 贵阳 550004)
原发性肝癌是一种致命的消化道恶性肿瘤,其特点是起病隐匿、进展快、生活质量差及生存时间短[1],包括肝细胞癌(75%~85%)、肝内胆管癌(10%~15%)及混合细胞癌(<15%)[2-4]。由于大多数肝癌患者在早期无明显症状,确诊时已处于中晚期[5-6]。对于这类中晚期患者,通常采用经肝动脉化疗栓塞术(transarterial chemoembolization,TACE),即在数字减影血管造影机引导下,经导管将混有化疗药物的碘油注射至肿瘤组织供血的二级或三级动脉血管中,局部栓塞肿瘤组织的供血,“饿”死肿瘤的同时释放化疗药物“毒”死肿瘤[7-8]。现已证实,传统TACE治疗后(化疗药物与碘油简单的混合乳化后注射),与系统给药方式相比,肿瘤局部药物浓度虽能在短时间提高100倍以上,但化疗药物会在1~2 d内迅速扩散殆尽,肿瘤局部药物有效治疗浓度维持时间短,难以达到临床期望效果[9]。为解决传统TACE中化疗药物维持局部有效浓度时间短的问题,临床上已广泛推广载药微球(将化疗药物装载在聚合物材料内,可达到缓慢释放药物的目的)[10]。但这类载药微球价格昂贵,给肝癌患者带来巨大经济压力,且为不可降解材料不利于后续治疗。本课题组前期研究制备的通过微导管注射的载阿霉素纳米粒温敏凝胶(doxorubicin-loaded nanoparticles thermosensitive gel,DOX-NPs-Gel)复合体系可较好地解决传统TACE中阿霉素(doxorubicin,DOX)-碘油乳剂释药过快的问题且材料安全、可生物降解,但其在体内的缓释性能、抗肿瘤作用及瘤内滞留性能尚不明了,因此本研究考察了DOX-NPs-Gel在大鼠体内的缓释性能和对H22荷瘤模型小鼠的抑瘤效果及瘤内滞留性能。
1 材料与方法
1.1 实验材料
1.1.1动物和细胞来源 雄性Sprague-Dawley(SD)大鼠18只,体质量(250±20)g,购于辽宁长生生物技术股份有限公司[生产许可号SCXK(辽)2020-0001];美国癌症研究所(Institute of Cancer Research,ICR)雄性小鼠90只,体质量(20±2)g,购于斯贝福(北京)生物技术有限公司[生产许可号SCXK(京)2019-0010];小鼠肝癌细胞株H22细胞购自武汉普诺赛生命科技有限公司。本研究实验方案获得学校实验动物伦理委员会审查批准(2201022)。
1.1.2主要试剂 DOX(含量>98.0%,大连美伦生物),壳聚糖(脱乙酰度≥95%,上海罗恩试剂),β-甘油磷酸钠(含量≥98.0%,美国西格玛奥德里奇),罂粟乙碘油注射液(碘浓度为480 g/L,江苏恒瑞),PLGA(相对分子量10 kD,西安瑞禧生物),卵磷脂(供口服用药用辅料,江苏曼氏生物),吐温-80(北京索莱宝),阿奇霉素(含量>98.0%,大连美伦生物),其余试剂为分析纯。
1.1.3主要仪器 ACQUITY UPLC型超高效液相色谱-三重四级杆质谱串联仪(美国Waters),Forma 905-ULTS1490医用低温冰箱(美国Thermo Fisher),FDU-1100真空冷冻干燥机(日本东京理化器械),JY88-IIN细胞破碎机(宁波新芝生物),90Plus激光粒度仪(美国布鲁克),R100旋蒸仪(瑞士步琦),Optima XPN-100超速离心机和Allegra X-30R低温高速离心机(美国贝克曼库尔特公司),MSC5R磁力搅拌器(群安实验),UV-2700紫外可见分光光度仪(岛津仪器),IMS-20制冰机(常熟雪科),XYN-15LP氮气发生器(上海析友),EL204电子天平(上海梅特勒-托利多)。
1.2 研究方法
1.2.1DOX-碘油的配制 用两注射器分别吸取4 g/L DOX溶液1 mL 与碘油1 mL,通过三通管连通并混匀,临用前现配。
1.2.2大鼠体内缓释性能考察 18只雄性SD大鼠随机均分为DOX组、DOX-碘油组及DOX-NPs-Gel组,分别腹腔注射给予DOX、DOX-碘油及DOX-NPs-Gel(DOX为5 mg/kg,DOX浓度为2 g/L),分别在给药后不同时间点(5、10、15、30、45、90、150 min及4、12、24、36、48、60、72、96、120、144、168 h)经眼底静脉丛穿刺取血100 μL,置于肝素化的1.5 mL离心管中,4 000 r/min离心10 min,分离血浆50 μL。参考根据课题组前期确定的样品处理方法和超高效液相色谱-串联质谱(ultra performance liquid chromatograph mass spectrometer,UPLC-MS/MS)定量测定血浆中DOX浓度[11-12],经WinNonLin 8.1软件拟合得到主要药动学参数,包括半衰期(half life,t1/2)、峰浓度(peak concentration,Cmax)、药时曲线下面积(area under curve,AUC)、清除率(clearance,CL)及平均驻留时间(mean residence time,MRT)。
1.2.3H22细胞的培养、收集及H22荷瘤模型小鼠的建立 参考文献方法[13-14]培养、收集H22细胞并建立H22荷瘤小鼠模型。H22细胞悬液经2次小鼠腹水传代后,PBS稀释,制成2×1010个/L的肿瘤细胞悬液;取上述肿瘤细胞悬液0.2 mL分别于90只小鼠右腋皮下单次接种,以接种后小鼠右腋出现肉眼可见瘤体为造模成功。
1.2.4小鼠体内抗肿瘤作用 取“1.2.3”项下H22荷瘤模型小鼠36只,隔天测量肿瘤体积,待肿瘤生长至400 mm3时开始给药。将荷瘤小鼠均分为生理盐水组、空白NPs-Gel组、碘油组、DOX组、DOX-碘油组及DOX-NPs-Gel组,DOX、DOX-碘油及DOX-NPs-Gel的给药量为10 mg/kg(以DOX计),DOX浓度为2 g/L。碘油组给药为碘油与水的乳剂,其制备除将DOX溶液换为生理盐水外,其它与DOX-碘油制备一致。生理盐水组、碘油和空白凝胶组给药体积为5 mL/kg。各组给药方式均采用瘤内注射,给药1次,给药当天记为第0 天,治疗周期10 d。
1.2.5小鼠体质量变化及生长情况 取“1.2.4”项下各组小鼠给药期间每2天称定体质量1次,绘制体质量变化曲线,计算各组小鼠的体质量变化百分比[体质量变化百分比(%)=当日体质量(mi)/最初体质量(m0)×100%]。
1.2.6小鼠肿瘤生长情况及抑瘤率的计算 取“1.2.5”项下各组小鼠称重后同时测量瘤体宽度、长度并计算肿瘤体积(volume,V),同时绘制肿瘤生长曲线;给药10 d后,脱颈处死各组小鼠,完整剥离肿瘤组织,称取瘤体质量并计算抑瘤率[抑瘤率(%)=(生理盐水组小鼠平均瘤体质量-各治疗组小鼠平均瘤体质量)/生理盐水组小鼠平均瘤体质量×100%]。
1.2.7小鼠肿瘤组织苏木精-伊红(hematoxylin-eosin,HE)染色 取“1.2.6”项下各组小鼠肿瘤组织称重、拍照记录后,放置于4%多聚甲醛固定液中保存,常规脱水,石蜡包埋、切片,HE染色,置于显微镜下观察并拍照。
1.2.8瘤内滞留性能评价 取“1.2.3”项下H22荷瘤小鼠54只,待H22荷瘤小鼠生长至400 mm3左右时开始给药。将荷瘤小鼠均分为DOX组、DOX-碘油组及DOX-NPs-Gel组,给药剂量和途径同“1.2.4”项下操作。各组分别于12、24、48、72、96及120 h时选择3只小鼠脱颈处死,剥离肿瘤组织,参考课题组前期确定的样品处理方法和UPLC-MS/MS分析方法测定肿瘤组织中DOX浓度[13-14],计算各时间点下DOX瘤内滞留率(DOX瘤内滞留率=DOX测得量/DOX给药量×100%)。
1.3 统计学分析
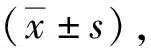
2 结果
2.1 大鼠体内缓释性能
药动学结果显示(图1和表1),48 h时DOX组和DOX-碘油组大鼠血浆中DOX含量低于检测限,168 h时DOX-NPs-Gel组大鼠血浆中DOX浓度仍为90.5 μg/L,与DOX组和DOX-碘油组相比,DOX-NPs-Gel组的AUC0-t分别提高7.9倍和12.2倍,CL分别降低96.8%和97.4%,MRT0-∞分别延长4.1倍和3.4倍,Cmax分别提高1.0倍和1.1倍,t1/2分别延长52.1倍和19.7倍。
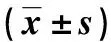
表1 各组大鼠的主要药动学参数Tab.1 The main pharmacokinetic parameters of each

图1 各组大鼠血浆DOX平均血药质量浓度-时间曲线Fig.1 Average DOX concentration-time curve in plasma of rats in each group
2.2 小鼠生长情况
给药后荷瘤小鼠体质量的变化趋势结果显示(图2),DOX组、碘油组和DOX-碘油组小鼠体质量于治疗后第2天出现下降,下降幅度大小依次为DOX-碘油组>碘油组>DOX组;DOX组和碘油组小鼠体质量第6天恢复到治疗前,DOX-碘油组治疗结束时体质量仍未恢复至治疗前;DOX-NPs-Gel组小鼠体质量与生理盐水组和空白NPs-Gel组变化趋势一致,未出现下降,提示DOX-NPs-Gel对机体几乎无毒副作用。
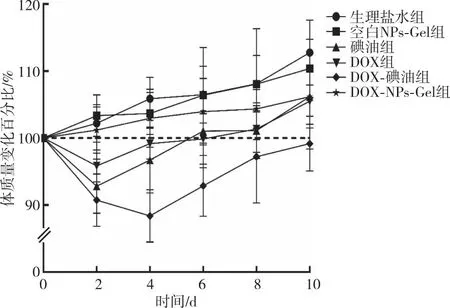
图2 各组荷瘤小鼠给药后的体质量变化Fig.2 Weight change in load tumor mice after administration
2.3 小鼠体内抗肿瘤作用
各组小鼠瘤体质量比较结果见表2所示,生理盐水组小鼠瘤重与空白NPs-Gel组比较、差异无统计学意义(P>0.05),各治疗组小鼠瘤体质量均较生理盐水组和空白NPs-Gel组下降(P<0.05),DOX-碘油组小鼠瘤体质量较DOX组下降(P<0.05),碘油组小鼠瘤体质量与DOX-碘油组瘤体质量比较、差异无统计学意义(P>0.05),DOX-NPs-Gel组瘤体质量小于其余各治疗组(P<0.05),提示其具有较好的抑瘤效果;各组小鼠抑瘤率比较结果见表2所示,碘油组、DOX组、DOX-碘油组和DOX-NPs-Gel组小鼠抑瘤率分别为54.8%、54.1%、68.3%和76.6%。各组小鼠肿瘤生长情况显示(图3),治疗期间生理盐水组和空白NPs-Gel组小鼠瘤体生长迅速,其余各治疗组瘤体生长速度均降低,其中DOX-NPs-Gel组生长速度最慢;各组小鼠肿瘤组织HE染色结果如图4所示,生理盐水组和空白NPs-Gel组小鼠肿瘤组织切片中可见细胞排列紧密、细胞核大、无明显坏死细胞,表明组织内细胞处于快速增殖状态,但其它各治疗组肿瘤组织切片出现细胞分布不规则、核固缩、破裂、溶解,提示肿瘤细胞坏死,其中DOX-NPs-Gel组肿瘤组织切片中出现大面积的细胞核固缩和溶解。
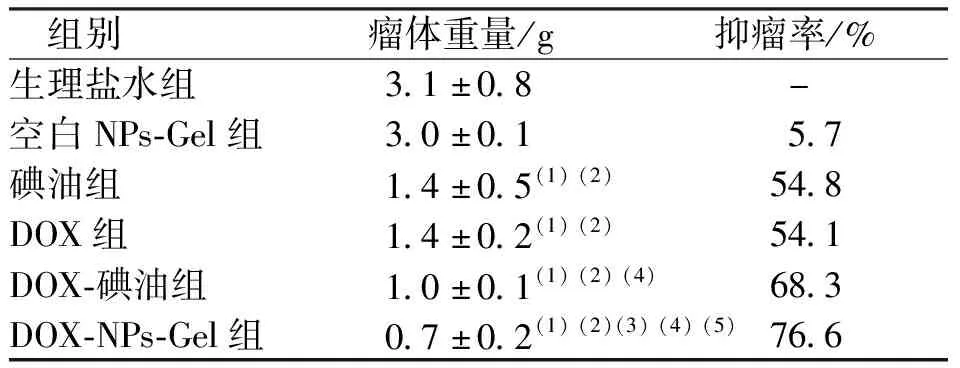
表2 各组小鼠的瘤体质量和抑瘤率Tab.2 Tumor weight and tumor inhibition rate of rats in each group
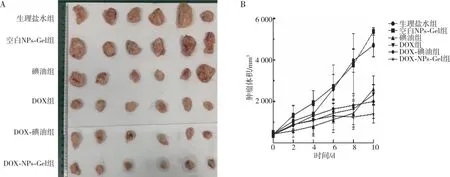
注:A为各组肿瘤实体的剖截图,B为各组肿瘤治疗期间肿瘤体积变化情况。
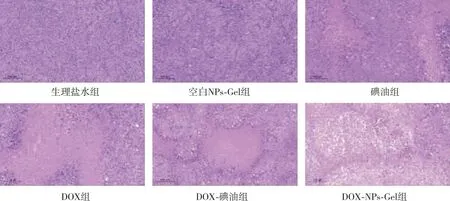
图4 各组小鼠瘤体的组织学特征(HE,×10)Fig.4 Histological characteristics of the tumor in each group (HE,×10)
2.4 瘤内滞留性能
各组小鼠DOX瘤内滞留率如图5所示。DOX组与DOX-碘油组小鼠DOX瘤内滞留率变化趋势基本一致,各时间点下DOX瘤内滞留率比较,差异无统计学意义(P>0.05);第12 h时,2组小鼠DOX瘤内滞留率分别为(57.4±7.6)%和(49.6±4.1)%,96 h时已降至0%;前96 h内所检测的时间点下DOX-NPs-Gel组小鼠DOX瘤内滞留率均高于其他组(P<0.05),而DOX-NPs-Gel组第120 h时DOX瘤内滞留率仍为(44.1±3.9)%。

注:(1)与DOX组相比,P<0.05;(2)与DOX-碘油组相比,P<0.05。
3 讨论
传统TACE作为中晚期肝细胞癌的一线治疗方法,在临床中得到了广泛应用。通常化疗药物和碘油是临用前乳化,但乳化后的乳液稳定性较差[15]。本研究中模拟临床制备方法制备DOX-碘油,结果显示DOX-碘油混匀后静置1 min会出现明显分层现象,与相关报道一致。
温敏凝胶的药动学考察,通常是采用皮下注射的方式给药[16]。本课题前期预实验中曾采用皮下注射的给药方式考察DOX、DOX-碘油和DOX-NPs-Gel在大鼠体内药代动力学过程,结果显示各组释放均较为缓慢且无差异,可能是因为皮下血管较少,吸收过程为限速过程,无法准确模拟肝脏中丰富血管的吸收过程;此外,皮下注射一段时间后,在注射部位会出现结痂,可能是因为局部药物浓度过高导致的皮肤坏死。因此,本研究采用腹腔注射的方式给药。为了模拟TACE术后药物的体内过程,腹膜表面积很大且具有丰富血管,吸收能力强,可较好模拟肝动脉血管环境[17]。本研究药动学结果表明,DOX-NPs-Gel组与DOX-碘油组相比达峰时间略晚,CL降低,Cmax、t1/2、AUC0-t和MRT0-t均增加;DOX-NPs-Gel组在48~168 h内血药浓度近乎无波动,这表明此时消除相与吸收相几乎达到平衡;这种恒速释放对维持肿瘤内化疗药物高浓度,提高肿瘤的治疗效果具有重要意义[18]。
体内抗肿瘤研究结果显示,DOX-NPs-Gel组小鼠瘤体质量最小、抑瘤率最大,结合其给药后体质量变化和瘤内滞留性能考察结果,分析原因可能是DOX-NPs粒径小于<200 nm,根据肿瘤组织的高渗透性和滞留效应,DOX-NPs倾向于滞留在肿瘤组织中,加上凝胶和纳米粒本身均具有缓释作用,因而能有效减少DOX在肿瘤部位的逃逸,降低DOX的毒副作用,延长治疗时间,提高治疗效果[19]。碘油在肝癌的TACE治疗中通常充当显影剂和栓塞剂的角色[20]。本研究结果提示,碘油具有一定的抑瘤作用,分析其原因可能是碘油将肿瘤细胞完全包裹,阻碍了肿瘤细胞与组织液之间的物质交换,促进了细胞死亡[21]。此外,结合碘油给药后,荷瘤小鼠体质量变化的结果可推断碘油存在毒性作用。DOX组与碘油组小鼠瘤重和抑瘤率结果相当,结合其在瘤内滞留性能考察结果和给药后荷瘤小鼠体质量变化,考虑推测DOX注射到肿瘤后可发挥抑瘤作用,但无法长时间维持治疗浓度,DOX暴露在体环境中,引起荷瘤小鼠体质量下降。DOX-碘油组小鼠抑瘤率高于DOX组和碘油组,瘤重小于DOX组和碘油组,表现出较强的抗肿瘤作用,但瘤内滞留性能考察结果表明DOX与DOX-碘油滞留基本一致,推测其抗肿瘤作用是碘油和DOX共同作用的结果。同时受到碘油和DOX的双重影响,DOX-碘油组荷瘤小鼠在治疗期间体质量下降最多。通过分析各组给药后荷瘤小鼠体质量的变化趋势可用于评估药物的毒副作用[22-23]。因此可推测DOX-NPs-Gel具有良好的安全性。
为更加贴合实际,后续研究可考虑采用兔肝癌VX2模型以TACE方式给药进行药动学与药效学考察。肿瘤治疗的困难之一是药物瘤内滞留量不足或维持时间不足,因此理想的药物递送系统应可将药物滞留在靶部位较长时间。瘤内滞留性能考察结果显示, DOX-NPs-Gel组小鼠DOX瘤内滞留率高于DOX组和DOX-碘油组,具有良好的瘤内滞留性能。
综上所述,DOX-NPs-Gel在体内可缓慢释药,瘤内注射后DOX可长时间滞留于肿瘤组织,从而可有效地抑制肿瘤发展,具有一定的TACE应用前景。
