缓释地塞米松改性丝胶蛋白水凝胶支架促进大鼠下颌骨缺损修复:基于调节巨噬细胞M2极化
2024-04-13范毅平罗梦琳黄东宗王潇宇关淼升李鸿波
范毅平,罗梦琳,黄东宗,刘 琳,傅 博,王潇宇,关淼升,李鸿波
1解放军医学院,北京 100853;中国人民解放军总医院第一医学中心2口腔科,3肾脏病科,北京 100853;4中国人民解放军战略支援部队特色医学中心,北京 100101;5中国人民解放军火箭军特色医学中心,北京100088
肿瘤、创伤及炎症性疾病容易导致难以自愈的大面积骨组织缺损[1,2]。近年来,研究发现在缺损区域植入负载生长因子或干细胞的组织工程支架能有效促进骨缺损修复[3-5]。蚕丝具有良好的机械和生物性能,研究者尝试将蚕丝及其主要组成(丝素蛋白与丝胶蛋白)应用于组织工程研究,显示丝胶蛋白可能存在免疫原性,而丝素-丝胶复合物也表现出不同程度的炎症效应[6-8]。有研究表明,丝胶蛋白的免疫原性与脂多糖的协同作用相关,而丝素-丝胶复合物的炎症效应则与丝胶蛋白的结构变化密切相关[9,10]。研究发现将丝胶蛋白与丝素蛋白按不同比例混合可以有效降低丝胶蛋白水凝胶的促炎效应[11]。Qi等[12,13]将丝胶与甲基丙烯酸酐交联,制备了光固化丝胶蛋白水凝胶(SMH),显示SMH具有良好的生物相容性。但以往研究并未深入分析研究丝胶蛋白在免疫-成骨过程中的调控机制。
巨噬细胞是免疫系统中的重要细胞类型,在机体愈合过程中也扮演着重要的角色[14-16]。研究发现M2极化巨噬细胞有助于减轻炎症反应,促进干细胞成骨分化,加速组织愈合[17-20]。因此利用具有巨噬细胞极化调节功能的药物或材料可以进一步促进骨缺损修复,考虑到丝胶蛋白本身的免疫原性,仍需要对其进行修饰改性进而调节巨噬细胞的免疫反应[21,22]。地塞米松(DEX)作为一种激素类药物,具有良好的免疫调节作用,也具有促进干细胞成骨分化的功能[23]。有研究利用β-环糊精(β-CD)的主客体相互作用对DEX进行控制性缓释有效促进间充质干细胞成骨分化[24],但其对巨噬细胞极化的影响并不明确。本研究旨在通过主客体相互作用将地塞米松包裹于丝胶蛋白水凝胶实现地塞米松缓释,首次构建并研究改性丝胶蛋白水凝胶(SMH-CD/DEX)调节巨噬细胞极化,从而为骨缺损修复提供新的治疗方案。
1 材料和方法
1.1 材料
胎牛血清、α-MEM培养液、1640培养液(Gibco),PMA、茜素红染液(Sigma),Triton X-100、CCK-8试剂盒、HE染色试剂盒、Masson染色试剂盒(Solarbio),地塞米松、蛋白酶抑制剂、RIPA细胞裂解液、BSA、辣根过氧化物酶标记山羊抗兔IgG(H+L)、BCIP/NBT碱性磷酸酶显色试剂盒(Beyotime);4%多聚甲醛、PBS(Biosharp);TRIzol、BCA 试剂盒、PowerUp SYBR Green(Thermo),LunaScript RT SuperMix Kit(New England Biolabs);iNOS 抗 体、Arginase-1 抗 体、COL1A1 抗体、RUNX2 抗体、β-Tubulin 抗体(CST);APC 标记CD68 抗体、FITC 标记CD86 抗体、PE 标记CD206抗体(Biolegend)。
1.2 方法
1.2.1 材料的合成 光固化丝胶蛋白水凝胶的合成方法同以往研究所述[11,12]。沸水中溶解2 g蚕茧,0.02 mol/L Na2CO3中超声处理2 h,4000 r/min离心5 min后取上清并透析3 d(MWCO:3500),取过滤产物冻干分离丝胶蛋白。在室温下将1 g丝胶蛋白和1 g甲基丙烯酸酐溶于PBS 中透析后获得SMH 前体(SerMA)。将75 mg SerMA 与1 mL 光引发剂LAP(0.1%)混合,制备15%SMH。通过7.6 μLDEX(1 μg/mL)与SMH物理混合制备了SMH/DEX水凝胶。此外,将DEX和1.15 mg氨化β-环糊精(NH2-β-CD)50°搅拌12 h。将产物与3.9 mg丙烯酰化聚乙二醇NHS酯(AC-PEG-NHS,EFL)混合到SMH中,合成SerMA-CD/DEX。将水凝胶在365 nm紫外光下照射30 s进行固化。
1.2.2 材料的表征 在3000 V加速真空下通过扫描电子显微镜(SEM)观察水凝胶形貌特征。通过傅里叶红外光谱扫描(FTIR)以4 cm-1分辨率进行测量分析水凝胶化学结构。将200 μL冻干水凝胶浸入PBS中,通过紫外-可见光谱在240 nm波长测量并分析DEX的释放曲线。
1.2.3 细胞的获取与培养 人牙周膜干细胞(hPDLSCs)的提取培养同以往研究所述[25],从18~25岁的健康者前磨牙中分离培养hPDLSCs。刮取牙周膜组织进行酶解消化后重悬于α-MEM完全培养液中。取第3代~第5代的细胞进行后续实验。该研究方案已获得中国人民解放军总医院伦理委员会批准(批准号:S2022-688-01)。THP-1人巨噬细胞培养于1640完全培养液中并通过20 ng/mL PMA促进细胞贴壁。
1.2.4 细胞活性鉴定 按5×104/孔密度THP-1 细胞铺板于96孔培养板孵育48 h。按照CCK-8试剂盒说明书,在不同水凝胶材料诱导的THP-1 细胞中加入10 μL CCK-8 试剂混合并培养4 h,随后使用多功能酶标仪(TECAN)在570 nm处记录分析吸光度A570nm。
1.2.5 Western blot 收集不同分组细胞,以RIPA裂解液裂解细胞,12 000 r/min离心30 min,BCA法测定上清液总蛋白浓度。每泳道40 μg蛋白加载于十二烷基硫酸钠-聚丙烯酰胺凝胶,电泳分离蛋白,半干转法转移蛋白于NC膜,5%脱脂牛奶封闭2 h。一抗孵育过夜(1∶1000 iNOS Rabbit mAb;1∶1000 Arginase-1 Rabbit mAb;1∶1000 COL1A1 Rabbit mAb;1∶1000 RUNX2 Rabbit mAb;1∶1000 β-Tubulin Rabbit mAb;CST)。TBST缓冲液洗膜后二抗室温孵育2 h(辣根过氧化物酶标记山羊抗兔IgG(H+L),Beyotime)。增强化学ECL发光试剂盒显影,ImageJ软件分析。
1.2.6 实时定量逆转录聚合酶链式反应(RT-qPCR)TRIzol法提取总RNA。使用逆转录试剂盒将mRNA逆转录为cDNA。PCR仪中95 ℃30 s 预变性,95 ℃变性5 s,退火30 s,共39个循环,使用PowerUp SYBR Green进行IL-6、IL-10、Arg-1、iNOS、ALP、Runx2、BMP2、OCN和GAPDH基因扩增,以GAPDH作为内参。通过2-ΔΔCt法计算基因的相对表达量。引物的序列见表1。

表1 RT-qPCR实验的引物序列Tab.1 Sequences of the primers for RT-qPCR
1.2.7 流式细胞分析 THP-1细胞在不同水凝胶条件下孵育12 h,收集细胞并调整细胞密度,4%多聚甲醛固定10 min,0.2%Triton X-100 通透10 min,5%BSA 封闭30 min。加入适量的流式抗体(CD68、CD86、CD206),4 ℃孵育30 min。流式分析仪上样分析。
1.2.8 Transwell共培养 材料/THP-1细胞/hPDLSCs细胞Transwell共培养模型中,THP-1细胞与hPDLSCs细胞均为1.0×105/孔,上层为THP-1细胞,下层为hPDLSCs细胞。
1.2.9 茜素红染色 在共培养体系中培养7 d,PBS洗涤下层hPDLSCs,4%多聚甲醛固定15 min,2%茜素红工作液室温下染色20 min,显微镜下观察。
1.2.10 碱性磷酸酶染色 共培养体系培养7 d,PBS洗涤下层hPDLSCs细胞,4%多聚甲醛固定15 min,使用BCIP/NBT碱性磷酸酶显色试剂盒进行碱性磷酸酶染色,按说明书配置并加入染液,室温下孵育30 min,显微镜下观察。
1.2.11 动物下颌骨缺损模型 采用8周龄SD大鼠制备下颌骨4 mm直径圆形极限骨缺损模型。根据缺损区不同处理方式分4组:NC 组(缺损区不植入材料)、SMH组、SMH/DEX组、SMH-CD/DEX组。分别在治疗后的第4周、第8周过量麻醉处死,取下颌骨行mirco-CT扫描。计算骨体积/总体积(BV/TV)。所有动物实验均经解放军总医院第一医学中心动物伦理委员会批准(批准号2023-X19-35)。
1.2.12 组织病理分析 取骨缺损模型下颌骨,4%多聚甲醛固定24 h,EDTA 脱钙,包埋切片后使用HE、Masson染色试剂盒进行组织染色,观察骨缺损区域修复情况。
1.3 统计学方法
通过SPSS16.0软件进行统计学分析。计量资料以均数±标准差表示,采用单因素方差分析比较组间差异,P<0.05为差异具有统计学意义。
2 结果
2.1 SMH-CD/DEX水凝胶的合成
SMH、SMH/DEX和SMH-CD/DEX水凝胶的合成过程如图1A。在365 nm紫外光照射下,SMH、SMH/DEX和SMH-CD/DEX水凝胶30~60 s内实现固化,表现出良好的光固化性能(图1B)。
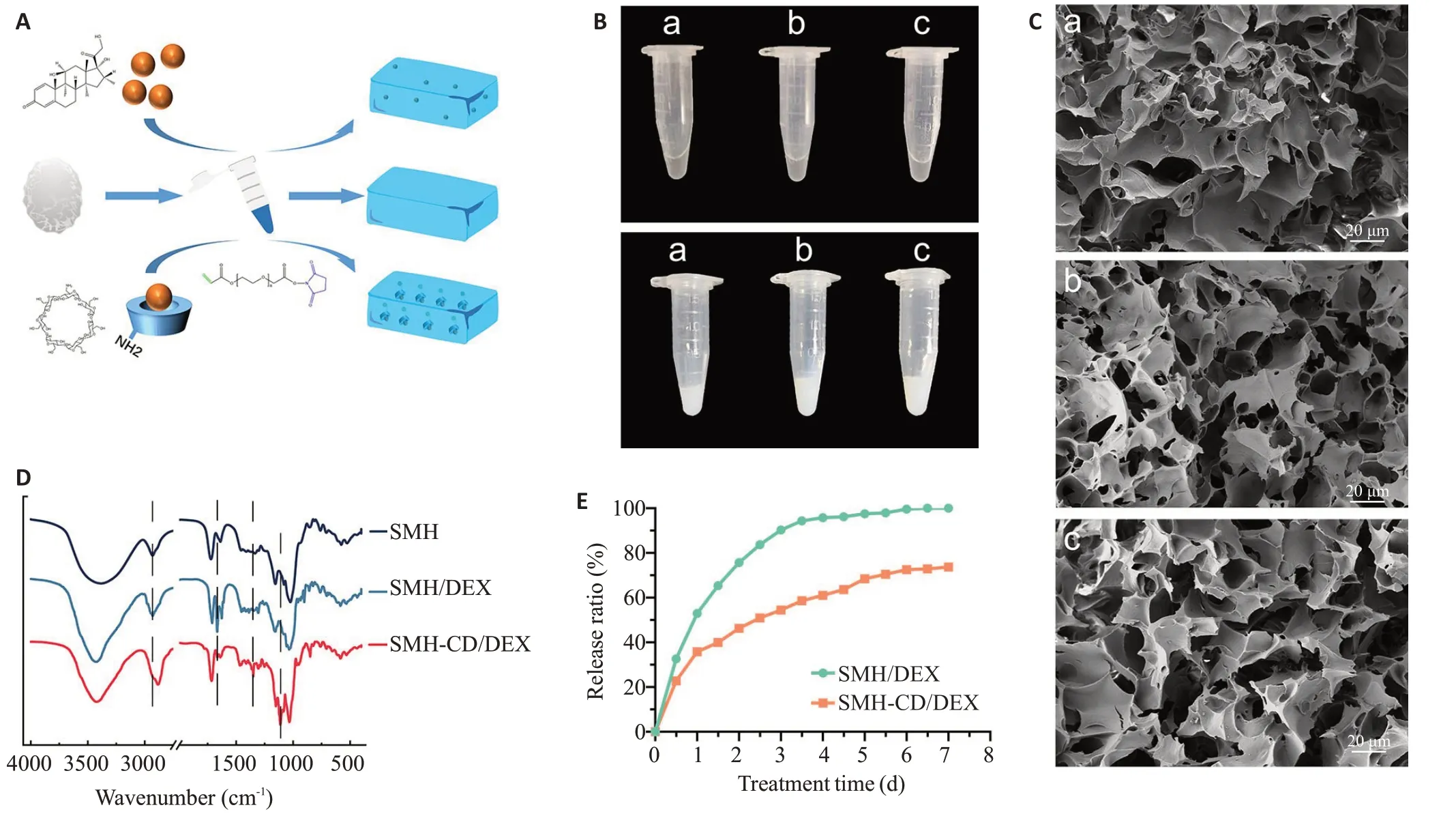
图1 水凝胶材料的合成与表征Fig.1 Fabrication and characterization of the modifies hydrogel.A:Schematic illustration of hydrogel preparation.B:UV-curing of the hydrogel at 365 nm.C:SEM morphology of the scaffold(scale bar=20 μm;a:SMH;b:SMH/DEX;c:SMH-CD/DEX).D:FTIR spectra.E:Release profile of dexamethasone.
2.2 SMH-CD/DEX水凝胶的性能表征
SEM结果显示,水凝胶形成了高度互联的海绵多孔结构,内部微孔结构完整,各组间无显著差异(图1C)。FTIR结果显示,SMH-CD/DEX组3293 cm-1处存在特征吸收峰,AC-PEG-NHS在CD-NH2和SMH之间形成酰胺键;相较于SMH/DEX 组,SMH-CD/DEX 组在1664、1621 和1299 cm-1处并未出现DEX 的典型吸收峰,β-CD和DEX已形成主客体相互作用(图1D)。释放曲线显示(图1E),相较于SMH-CD/DEX,SMH/DEX组在初始3 d释放DEX的速度显著较快,SMH/DEX水凝胶在3 d 后可释放近98%的载药DEX,而SMH-CD/DEX水凝胶仅能释放约55%的载药DEX。SMH-CD/DEX组与SMH/DEX水凝胶相比,DEX释放速率在前3 d内较缓慢,释放比例也较小。
2.3 SMH-CD/DEX水凝胶促进巨噬细胞M2极化作用
CCK-8结果显示,早期THP-1细胞活性呈上升趋势,18 h后呈下降趋势。与SMH组相比,SMH/DEX组细胞活性在18 h时降低(P<0.05,图2A)。提取THP-1细胞蛋白进行Western blot 分析,结果显示,SMH 组iNOS表达高于NC组、SMH/DEX组与SMH-CD/DEX组(P<0.05,图2B、C);而Arg-1蛋白在SMH-CD/DEX组表达量高于其他3组(P<0.05,图2D)。RT-qPCR检测结果显示,SMH组相较于SMH-CD/DEX组,IL-6、iNOS表达水平明显升高,炎症反应增强(P<0.001,图2E、H);SMH-CD/DEX组IL-10和Arg-1的基因表达水平高于SMH组(P<0.001,图2F、G)。流式细胞分析结果显示(图2H),SMH组中CD86的表达量达约12.5%,高于其余3组(P<0.05);而CD206在SMH/DEX组(约16.9%)和SMH-CD/DEX组(约18.7%)中高于NC组与SMH组(P<0.05),SMH/DEX组和SMH-CD/DEX组差异无统计学意义(P>0.05)。
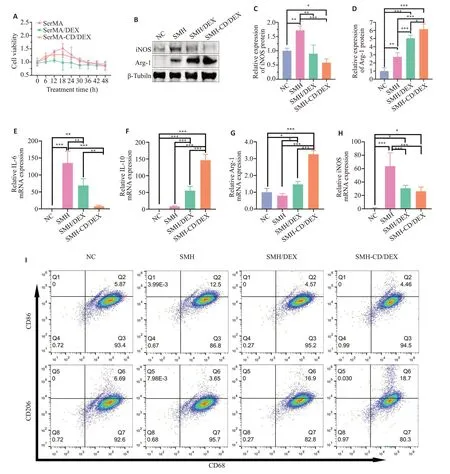
图2 水凝胶支架的细胞活性与巨噬细胞免疫反应分析Fig.2 Effect of hydrogel scaffold on THP-1 cell viability and immune responses.A:Proliferation of macrophages analyzed by CCK-8 assay.B-D:iNOS and Arg-1 protein expressions in THP-1 cells detected by Western blotting.E-H:mRNA expressions of IL-6,IL-10,Arg-1,and iNOS detected by RT-qPCR.I:Expression of CD68,CD86 and CD206 on macrophages after different treatments analyzed by flow cytometry.*P<0.05,**P<0.01;***P<0.001.
2.4 共培养体系下SMH-CD/DEX水凝胶促进人牙周膜干细胞成骨分化
RT-qPCR检测结果显示,SMH-CD/DEX 组 的ALP、Runx2和BMP2的表达水平较其他3组增强(P<0.05,图3A~C);OCN基因表达水平在NC组和3个治疗组之间的差异有统计学意义(P<0.05,图3D)。提取hPDLSCs 细胞蛋白进行成骨相关蛋白标志物分析(图3E),结果显示,COL1A1 蛋白在SMH-CD/DEX组中表达水平高于NC 组、SMH 组与SMH/DEX 组(P<0.001,图3F);SMH-CD/DEX组Runx2蛋白表达量高于其他3组(P<0.01,图3G)。茜素红染色结果显示(图3H),较NC组、SMH组和SMH/DEX组,SMH-CD/DEX组的钙结节数量增加(P<0.05);各组均可见ALP阳性细胞,且NC组、SMH组和SMH/DEX组的ALP阳性细胞数量少于SMH-CD/DEX组(P<0.05,图3I)。

图3 共培养体系中水凝胶支架的成骨诱导效应Fig.3 Effects of the scaffold on osteogenic differentiation of hPDLSCs in the co-culture system.A-D:mRNA levels of ALP,Runx2,OCN,and BMP2 detected by RT-qPCR. E-G: COL1A1 and Runx2 protein expressions in hPDLSCs detected by Western blotting.H:Alizarin red-S staining of hPDLSCs after 7 days of co-culture.I:Alkaline phosphatase staining of the hPDLSCs after 7 days of co-culture.*P<0.05,**P<0.01;***P<0.001.
2.5 SMH-CD/DEX水凝胶促进骨缺损修复
在大鼠下颌骨缺损模型中植入上述3种水凝胶材料,并在植入后4周、8周进行Micro-CT检查(图4A)。BV/TV分析显示,术后第4、8周,SMH-CD/DEX组缺损修复高于SMH 组(P<0.05,图4D)。HE 染色分析第8 周的最大骨缺损直径,结果显示NC组与SMH组、SMH-CD/DEX组差异有统计学意义(P<0.01),SMH/DEX组与SMH-CD/DEX组间差异有统计学意义(P<0.05,图4B、E)。Masson染色显示,胶原新生量与新生成骨量结果一致(图4C):SMH-CD/DEX组的胶原含量高于其他3组(P<0.001)。
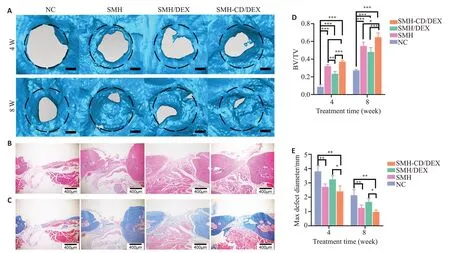
图4 水凝胶支架的体内第4、8周缺损修复能力分析Fig.4 SMH-CD/DEX scaffold promotes mandibular bone defect repair in rats. A: Mirco-CT for examining healing of rat mandibular defects. B: HE staining of the defect region at 8 weeks. C: Masson staining of the defect region at 8 weeks. D:Quantitative analysis of bone volume/total volume(BV/TV).E:Quantitative analysis of the maximum diameter of the defect.*P<0.05,**P<0.01;***P<0.001.
3 讨论
免疫系统是机体抵抗外界病原体的重要机能,研究者发现其在机体缺损组织修复的过程中也发挥重要作用[26]。机体在早期愈合过程中需要一定程度的炎症反应以清除异物,但持续的慢性炎症反应则不利于组织愈合[27]。因此必要时需要通过应用具有抗炎效应的材料促进组织愈合[28,29]。巨噬细胞可以通过极化为促炎的M1型清除伤口碎片和病原体、促进血运再生;也可以通过极化为M2型降低炎症反应、调节干细胞分化,在骨缺损愈合过程中发挥重要作用[30]。因此本研究将地塞米松加入水凝胶体系设计了一种能够缓慢释放地塞米松,调节机体炎症反应的SMH-CD/DEX水凝胶。本研究结果表明,SMH-CD/DEX水凝胶支架能有效促进巨噬细胞M2 极化,进而促进新骨形成修复缺损骨组织SMH-CD/DEX在共培养体系中相较于其他组表现出更好的成骨诱导作用。然而,SMH/DEX的成骨效果与SMH-CD/DEX相比并不理想,这可能归因于DEX的早期快速释放。有研究表明水凝胶材料可以通过其自生的支架作用,促进干细胞成骨分化、骨组织再生[31,32],在本研究结果中未改性的丝胶蛋白水凝胶也具有促成骨效应。以往的研究显示β-CD、DEX均具有促进成骨分化的作用,但SMH-CD/DEX水凝胶通过主客体相互作用控制DEX缓慢释放,从而维持DEX的较低水平浓度,调节巨噬细胞M2极化并发挥其促干细胞成骨分化的功能,加速组织愈合[23,24,33]。
不同研究关于丝胶蛋白的免疫原性问题存在差异[10,11,34,35]。研究表明丝胶蛋白的免疫原性与其二级结构变化及其物理性质密切相关,即在一定条件下丝胶蛋白与组织接触位置会出现大量的β折叠结构,使得丝胶蛋白更容易诱发免疫细胞反应;此外丝胶蛋白的亲水性降低也与β折叠结构的产生相关,物理性质的改变进而影响丝胶蛋白的生物相容性[34,35]。巨噬细胞的极化与干细胞的成骨分化密切相关,在本研究中丝胶蛋白在与巨噬细胞作用的早期,表现出对巨噬细胞M1极化的作用,但在促进干细胞成骨分化的实验中表现出促进成骨效应。相较于此,改性后的丝胶蛋白水凝胶SMH-CD/DEX则通过缓慢释放地塞米松,促进巨噬细胞Arg-1等标志物表达量提升并向M2极化,进而在共培养体系中表现出提高hPDLSCs细胞的COL1A1及Runx2等重要成骨分化相关蛋白及基因的表达,结果显示其促进成骨的能力显著高于未改性的丝胶蛋白水凝胶;SMH-CD/DEX水凝胶促成骨功能在骨缺损动物模型中也得到了验证,提高胶原的表达促进新骨的形成,加速骨缺损的愈合。
综上所述,本研究设计了一种通过主客体复合物将DEX负载于丝胶蛋白的光固化水凝胶(SMH-CD/DEX)。SMH-CD/DEX水凝胶能够调节巨噬细胞M2极化,加速干细胞成骨分化,促进骨缺损修复,这为进一步在组织工程领域运用丝胶蛋白作为骨缺损修复材料开拓了思路。
