高表达UBE2S通过增加癌细胞干性促进肝癌的进程机制
2024-04-13李振汉王明婷卢林明唐乾利罗良平
陈 浩,李振汉,王明婷,卢林明,唐乾利,罗良平
1暨南大学临床医学博士后流动站,广东 广州 510632;2右江民族医学院研究生学院,广西 百色 533000;皖南医学院3病理解剖学教研室,4临床医学院,安徽 芜湖 241002;5南京市第一医院产科,江苏 南京210006
原发性肝癌在各类恶性肿瘤中发病率排第六位,已经上升为全球肿瘤第二大死因[1];亦是我国最常见的恶性肿瘤之一,其发病率和死亡率逐年增加,肝细胞性肝癌(HCC)是主要病理类型[2,3]。由于HCC早期症状不明显,发现时绝大部分都会出现远处转移,经治疗整体预后仍然较差[4]。因此,探究HCC的发病机制,寻找有效的治疗靶点是亟待解决的问题[5]。泛素结合酶E2S(UBE2S)是E2泛素结合酶的一种,参与各种病理生理过程[6-8],与多种癌症联系紧密[9-12]。免疫逃逸是癌症发展的重要标志,肝癌具有多种免疫逃逸机制,因此深入研究肝癌微环境中不同免疫细胞状态以提出针对性的治疗策略对肝癌的防治具有重要意义[13-16]。UBE2S能否通过维持肝癌细胞的干细胞特性从而促进肝癌的进程尚未见报道。因此,本研究拟通过生信分析,挖掘单细胞测序结果,探究UBE2S在肝癌中的表达与预后的关系,并进一步分析其在各种细胞亚群的表达情况,及肝癌微环境中细胞通讯以及细胞群内部的关键转录因子等情况;利用临床样本对生物信息学分析结果进行验证,并通过细胞实验探究UBE2S对肝癌细胞干性的调控作用,该研究有望为肝癌的精准治疗提供新的候选靶点。
1 材料和方法
1.1 HCC标本
本研究使用的人类肝癌组织样本于2022年3月1日~2023年9月31日从弋矶山医院(中国芜湖)获得,并经弋矶山医院医学伦理委员会批准(2022伦审研7号),共10例配对的肝癌组织与正常肝脏样本。
1.2 数据库分析
从UCSC XENA(https://xenabrowser.net/datapages/)下载经Toil流程统一处理的TCGA和GTEx的TPM格式的RNAseq数据。提取TCGA的LIHC(肝细胞性肝癌)和GTEx中对应的正常组织数据,该数据用于进行非配对样本之间转录水平差异分析。将TPM 格式的RNAseq数据进行log2转化后在进行样本间的表达比较。通过R(3.6.3 版本)和ggplot2 [3.3.3 版本]进行Mann-WhitneyU检验。从TCGA (https://portal.gdc.cancer.gov/) 下载LIHC 肝细胞肝癌项目中level 3 HTSeq-FPKM格式的RNAseq数据,将FPKM格式的RNAseq数据转换为TPM格式并进行log2转化的同时保留配对样本。UNLCAN(http://ualcan.path.uab.edu/index.html)是一个可视化包含TCGA数据库中32个肿瘤和CPTAC数据的在线网站,本研究从UALCAN数据库中获取不同分组条件下的转录水平、甲基化差异情况,并基于蛋白组水平分析肝癌组织与正常对照组织的差异。
通过下载肿瘤免疫单细胞中心(TISCH)网站中的单细胞数据GSE166635,该数据集使用原发肝癌患者的临床样本进行了单细胞RNA 测序(scRNA-seq)分析。首先利用10x基因组学从患者中生成了新鲜分离的PLC的scRNA-seq图谱。在初始质量控制后,共从两例患者的肿瘤中获得25 189个单细胞转录组。使用标准化分析管道MAESTRO进行质量控制、聚类和细胞类型注释。基于标准过滤细胞每个细胞的UMI计数(>1000)和每个细胞的基因数(>500)。为探索组织内不同细胞之间的交流强度,集成CellChat来推断集群之间的细胞-细胞通信。在“CCI”选项卡中,使用预先计算的交互计数热图来提供这些集群之间通信模式的概述。此外,本研究使用LISA来预测影响不同单细胞RNA-seq簇中基因表达模式的转录调控因子。热图显示各簇中最高转录因子(TF)的富集情况,并标记了前10个TF。
1.3 细胞和试剂
肝癌细胞株HCC-LM3、HepG2[赛百慷(上海)生物技术股份有限公司]。转染试剂LipofectamineTM3000(Invitrogen),pGCSIL-GFP载体(上海吉凯公司),敲低UBE2S 的目的序列为shCtrl,5'-TTCTCCGAACGTG TCACGT-3';shUBE2S-1,5'-CATATGCTGGAGGTCT GTT-3';shUBE2S-2,5'-GGGCTCTCTTCCTCCTTCC AC-3',BCA试剂盒(上海碧云天生物技术有限公司),UBE2S抗体和Tubulin抗体(Abcam),CD3抗体和AFP抗体(Servicebio)。
1.4 实验方法
1.4.1 免疫组化 HCC组织蜡块连续切片,然后将切片进行脱蜡复水,并在微波炉用柠檬酸盐缓冲液煮沸抗原修复。再通过3% H2O2溶液孵育。然后将切片与UBE2S一抗4 ℃孵育过夜,随后将切片与山羊兔二抗孵育。最后切片用苏木精复染,脱水,封片。
1.4.2 多色免疫荧光 石蜡切片脱蜡至水,抗原修复,H2O2封闭,血清封闭,加AFP一抗,再加对应HRP标记的二抗,加对应的TSA;微波处理,加UBE2S一抗,加对应HRP 标记的二抗,加对应的TSA,微波处理,加CD3一抗,加对应的荧光二抗,DAPI 复染胞核,淬灭组织自发荧光,封片,采集图像。
1.4.3 肝癌细胞培养与转染 肝癌细胞培养于含10%胎牛血清、100 U/mL 青霉素和100 μg/mL 链霉素的RPMI 1640培养基中,于37 ℃、5%CO2温育箱中培养,取对数生长期的细胞用于后续实验与转染[17]。
1.4.4 免疫印迹法 提取总蛋白并通过BCA法对其含量进行测定。利用聚丙烯酰胺变性凝胶电泳对蛋白进行分离处理,再进行转膜,5%的BSA室温封闭2 h。孵育UBE2S及Tubulin一抗,4 ℃孵育过夜,TBST洗膜3次,10 min/次,加入二抗,室温孵育2 h。TBST洗膜3次,10 min/次,ECL化学发光显影并拍照。以Tubulin为内参,使用Image J软件分析各条带平均灰度值。
1.4.5 克隆形成实验 将细胞分散接种于6孔板中(1×103/孔),培养1~2周。PBS洗涤后,4%多聚甲醛固定,结晶紫染色,PBS洗涤。直接观察,计算克隆数。
1.4.6 成球实验 将细胞分散接种于超低吸附六孔板(2×103/孔),使用无血清DMEM/F12培养基,3 d/次添加一次新鲜微球体培养基。培养1~2周后,显微镜下观察并计算肿瘤球数目。
1.5 统计学方法
运用SPSS22.0统计软件分析数据。细胞实均都分别进行3次独立重复实验,计量资料采用均数±标准差表示,两组比较用两样本t检验,多组比较采用单因素方差分析。使用Kaplan-Meier 生存曲线评估UBE2S高、低表达组的预后差异,统计分析基于log-rank 检验。以P<0.05为差异有统计学意义。
2 结果
2.1 鉴定肝癌中UBE2S的表达特征
RNA-seq数据库分析显示,UBE2S的转录水平在肿瘤中升高(图1A、B,P<0.001)。UALCAN数据库分析明确了UBE2S蛋白在肿瘤组织中的高表达(图1C)。UBE2S的表达随着肿瘤分级的增加而逐渐升高(图1D)。UBE2S启动子区的甲基化水平低于正常组织(图1E);UBE2S在TP53突变时的表达水平比正常组高(P<0.001,图1F)。
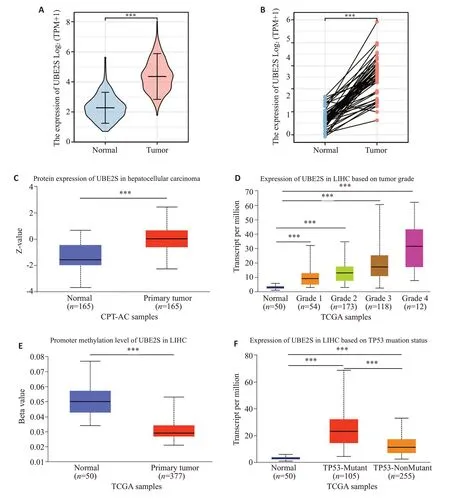
图1 分析UBE2S在肝癌中的表达差异Fig.1 Analysis of UBE2S expression in LIHC.A, B: mRNA expression of UBE2S in unpaired and paired samples. C: Protein expression of UBE2S in tumor and normal tissues in CPATC with UALCAN. D:Correlation of UBE2S expression level with tumor grade in TCGA with UALCAN. E: Promoter methylation levels of UBE2S in tumor and normal tissues in TCGA with UALCAN. F: Correlation of UBE2S expression levels and TP53 mutation in HCC in TCGAwith UALCAN.***P<0.001.
2.2 鉴定肝癌中UBE2S的预后特征
生存分析显示UBE2S高表达组的患者预后更差(图2A~C)。ROC曲线分析UBE2S的临床诊断价值,结果显示曲线下面积高达0.946(图2D)。
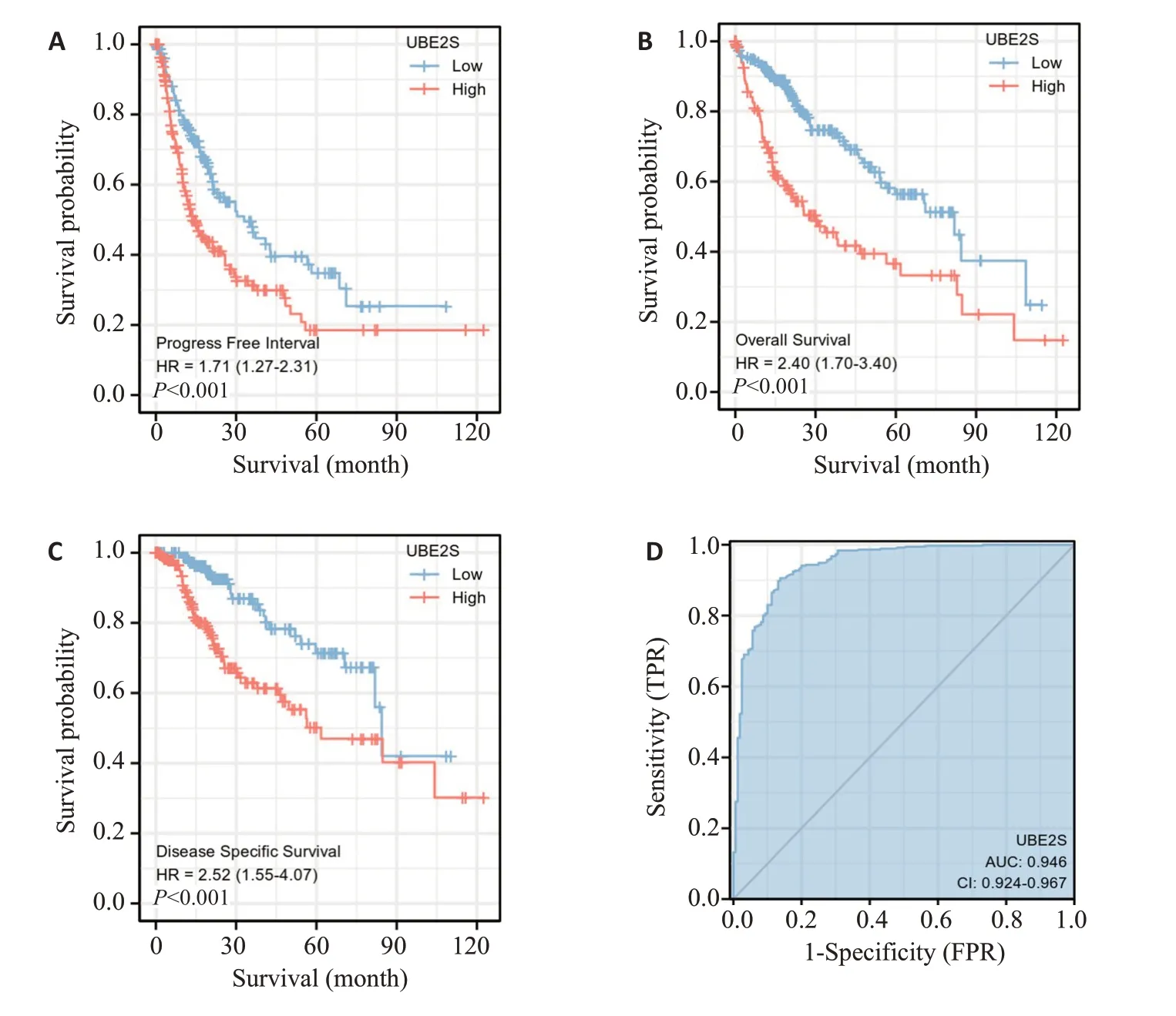
图2 探究UBE2S在肝癌中的预后意义Fig.2 Prognostic value of UBE2S for LIHC.A:Progression-free survival curves of the patients.B:Overall survival curves of the patients.C:Disease-specific survival curves of the patients.D:ROC curve.
2.3 单细胞测序显示UBE2S在增殖性T细胞中特异性高表达
分析单细胞数据GSE166635中UBE2S在肝癌组织微环境的各细胞类群中表达水平。结果显示,经过对数据的降维聚类处理之后,共得到21 个不同的细胞clusters(图3A)。用于注释细胞类型的细胞markers如图3B。在11 个不同的细胞类型,上皮细胞比例最高(图3C、D)。UBE2S在Tprolif细胞中表达丰度相对较高(图4)。
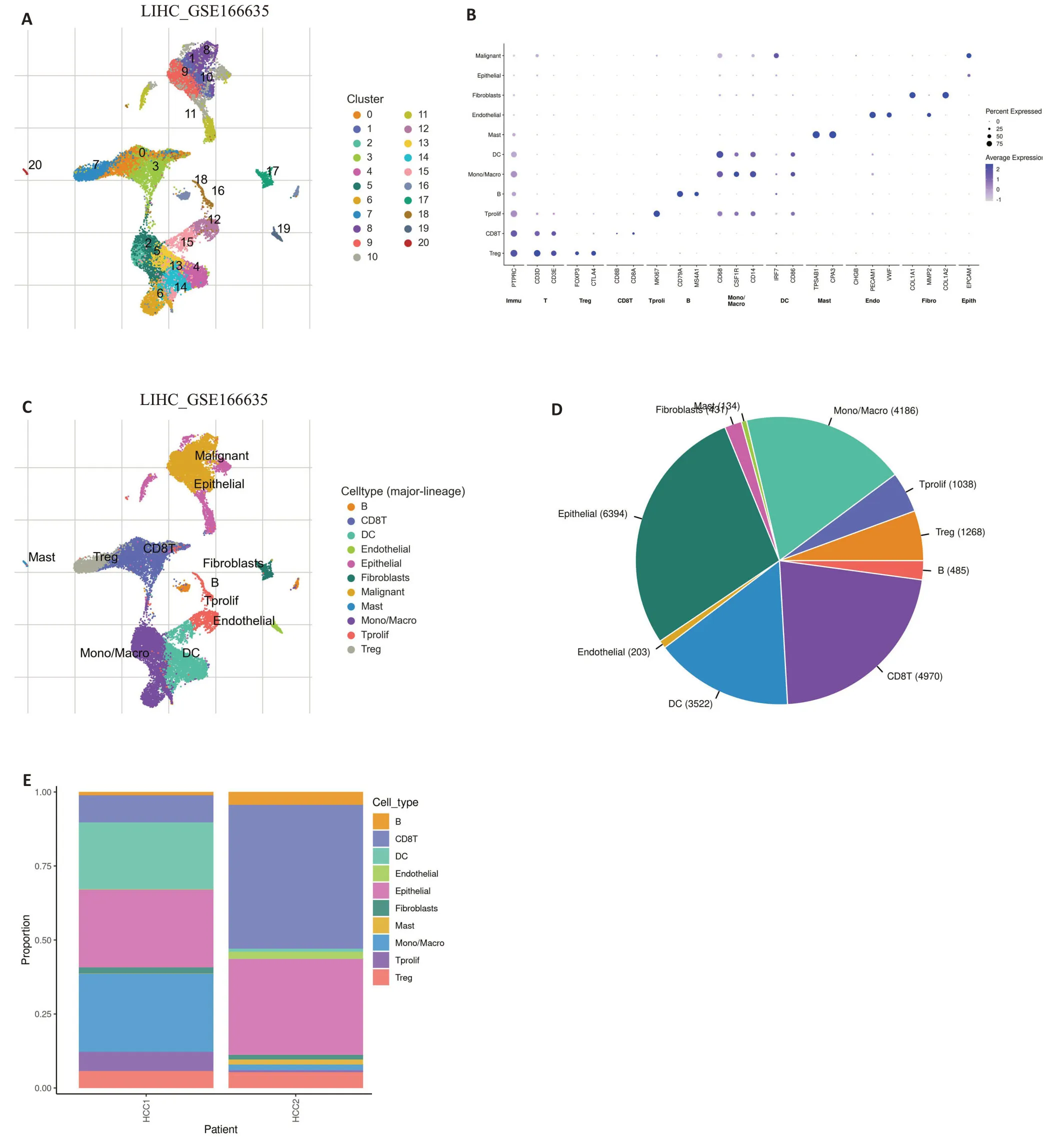
图3 单细胞测序分析肝癌中各细胞类型及比例Fig.3 Single-cell sequencing analysis of the types and proportions of different cells in LIHC. A: UMAP diagram showing 21 different cell clusters. B: Cell marker plot showing cell markers for annotating cell types and their expression levels. C: UMAP diagram showing 11 different cell types annotated. D, E: Proportion and number of different types of cells.

图4 单细胞测序分析肝癌中UBE2S在各细胞类型中的表达情况Fig.4 Single-cell sequencing analysis of UBE2S expression in different cell types in LIHC.A:UMAP map showing UBE2S expression levels in different types of cells. B: Violin diagram showing that the expression of UBE2S is the highest in Tprolif cells.
2.4 单细胞测序揭示细胞间通讯
在肝癌中Epithelial 之间、和Fibroblasts 以及和Endothelial的交互强度强于其他种类的细胞(图5A)。Tprolif 细胞与其他细胞之间的交互强度相对不活跃(图5B、C)。

图5 在不同细胞类型中进行细胞交互分析Fig.5 Cell interaction analysis among different cell types.A:Heat map of the intensity of interactions between different cell types.B,C:Circle diagram showing the intensity of interaction between other types of cells and Tprolif cells.
2.5 单细胞测序揭示调控各种细胞的转录因子
CEBPB、SMAD1、SPI1、IRF1、JMJD1C、CEBPA和STAT1 可以调控Tprolif 细胞的状态(图6A);在Tprolif_C12 中,最显著的转录因子是SPI1;在Tprolif_C18中,最显著的转录因子是FOXM1(图6B、C)。

图6 在不同细胞类型中进行转录因子分析Fig.6 Transcription factor analysis in different cell types. A: Heat map of the transcription factors regulating cell state.B, C: Ranking chart of the top 10 most significant transcription factors.
2.6 UBE2S肝癌组织高表达
免疫组化结果显示,UBE2S确实高表达于肝癌组织(图7A);多色免疫荧光结果显示,UBE2S在肝癌组织中的肝癌细胞和T细胞中均有较高的表达(图7B)。

图7 UBE2S在肝癌组织中表达增加Fig.7 High expressions of UBE2S in HCC tissues detected by immunohistochemistry(A;scale bar=50 μm)and multicolor immunofluorescence staining(B;scale bar=50 μm).
2.7 敲低UBE2S可降低肝癌细胞的干性
免疫印迹分析结果显示,在转染shUBE2S的HCC中UBE2S蛋白表达水平降低(shUBE2S-1,P<0.01、P<0.05;shUBE2S-2,P<0.01、P<0.01,图8A)。克隆形成实验结果显示,UBE2S敲低组HCC细胞克隆形成数与对照组相比减少(shUBE2S-1,P<0.05、P<0.01;shUBE2S-2,P<0.01、P<0.05,图8B)。悬浮成球实验结果显示,UBE2S敲低组HCC细胞形成肿瘤球的数目与对照组相比减少(shUBE2S-1,P<0.05、P<0.01;shUBE2S-2,P<0.01、P<0.01,图8C)。
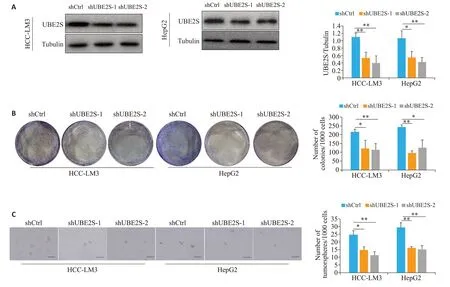
图8 敲低ShUBE2S能减少肝癌细胞的干细胞特性Fig.8 Knockdown of UBE2S inhibits cancer stem cell-like characteristics of HCC cells.A:Western blotting for the expressions of UBE2S proteins in cells with shRNA transfection. B: Colony-forming assay of HCC cells with UBE2S knockdown. C: Tumor sphere formation assay of HCC cells with UBE2S knockdown(scale bar=150 μm).*P<0.05,**P<0.01.
3 讨论
UBE2S是泛素化过程所需的泛素结合酶E2家族的成员之一,可以促进蛋白结合泛素分子,参与细胞信号转导和调节细胞分裂周期等病理生理过程[18-20]。关于UBE2S在肝癌中的作用有部分文献报道,其高表达于肿瘤微环境的各种免疫细胞,但局限于生物信息学分析,未进行实验确认;生物信息学分析依赖于高通量数据,数据质量多种因素的影响,可能会有偏差,需要进一步实验验证以明确生物学意义[21,22]。
UBE2S可以用作各种肿瘤的标志物;如UBE2S在乳腺癌和宫颈癌的表达水平更高,并与预后不良有关[23,24]。通过数据库挖掘分析和多重验证,本研究发现UBE2S表达水平与HCC的进展密切相关。从表观遗传学的角度分析,启动子区甲基化水平与该基因的转录水平呈现负相关。我们发现UBE2S的DNA启动子甲基化在肿瘤组织中显著的下调,这与肿瘤组织中转录水平增加是统一的。UBE2S 在HCC 中高度表达,并与HCC患者相关癌症预后不良是相关的,这为进一步研究癌症生物标志物和靶向治疗提供了新的途径。细胞验证实验结果提示,敲低UBE2S能明显抑制肝癌细胞的干细胞特性。
免疫微环境异质性是肿瘤耐药、复发和预后不良的重要原因之一[25-27]。近年来,免疫疗法和联合治疗给晚期癌症患者带来了希望[28]。系统探索肿瘤免疫微环境的异质性,对治疗选择、疗效预测、方案优化和新免疫治疗靶点的开发具有重要指导作用[29]。先前的研究主要依赖于病理分析或大量转录组测序,其局限性是只能代表组织的平均基因水平,无法准确分析其细胞组成,并且容易忽视含量较低的关键细胞亚群。而单细胞测序则可以挖掘组织异质性,促进了肿瘤免疫领域的探索,以系统地揭示癌症免疫微环境的异质性。TISCH收集了来自GEO和ArrayExpress的高质量肿瘤单细胞转录组数据以及相应的患者信息,数据涵盖了多种癌症类型[30]。本研究从TISCH进一步探索了UBE2S在不同细胞簇中的表达水平,并进行GSEA,细胞通讯和关键转录因子分析。
基于T细胞的免疫疗法的出现显著改变了癌症患者的治疗模式[31];对T细胞活化和抑制的分子机制有更深入的了解,以便调整免疫疗法的靶点。有文献表明,泛素依赖性通路的调节可以显著改变T细胞的功能,UBE2S增加T细胞耗竭标志物的产生促进肿瘤的免疫逃逸[32,33]。本研究首次通过免疫荧光实验明确,UBE2S显著高表达于肝癌组织中的T细胞。T细胞作为免疫治疗的主要执行者,对疗效有重要的影响[34];Tprolif细胞是指具有高增殖能力的细胞,可以进行快速的细胞分裂和增殖。Tprolif细胞增强或抑制其他免疫细胞的功能,从而调节免疫反应的程度和方向。Tprolif细胞的异常增殖和功能障碍与肿瘤发生和发展有关。UBE2S在Tprolif细胞高表达这一发现为肝癌的联合免疫治疗提供了基础[35]。但UBE2S在Tprolif细胞中具体发挥何种作用有待后续进一步研究。同时基于单细胞测序数据,我们探索了细胞通讯和关键转录调控因子在肝癌中的特征。细胞通讯会影响周围的免疫微环境从而影响肿瘤的发生发展[36],本研究发现肝癌肿瘤微环境中内皮与上皮及成纤维细胞之间的细胞交互强度较高。对此的进一步研究将有利于完善肝癌的诊断、治疗与预后评价系统,制定更优化的治疗方案。
综上所述,本研究通过生物信息学挖掘结合细胞实验多重验证,揭示了UBE2S在HCC中的作用。UBE2S是促进肝癌进展的重要调控因子,在增值T细胞呈高表达,能够促进肝癌细胞的干性。UBE2S可能为HCC诊断和治疗方法的发展提供新的思路,并可能成为HCC治疗的新靶点。
