二甲双胍阻断乳腺癌细胞-间质细胞的交互作用:基于抑制肿瘤相关成纤维细胞缺氧诱导因子-1α的表达
2024-04-13白薇超邹鹏程罗敏娜赵新汉雷建军
邵 珊,白薇超,邹鹏程,罗敏娜,赵新汉,雷建军
西安交通大学第一附属医院1肿瘤内科,2血液内科,3肝胆外科,陕西 西安710061
乳腺癌是女性最常见的恶性肿瘤[1]。越来越多的证据表明,肿瘤微环境(TME)中癌细胞和基质细胞之间的双向信号转导和营养交换对支持肿瘤生长至关重要[2,3]。TME由细胞外基质和不同类型的基质细胞组成,包括肿瘤相关成纤维细胞(CAFs)、免疫和炎症细胞、内皮细胞和脂肪细胞等[4]。迄今为止,对TME的研究主要集中在CAFs[5]和脂肪细胞[6]。在乳腺癌中,CAFs呈现一种活化表型,在这种表型中,它们产生促进肿瘤细胞增殖和存活的生长因子和细胞外基质蛋白[7]。在许多人类癌症中,间质中CAFs丰度的增加与肿瘤更具侵袭和转移风险以及较差的临床预后有关[8,9]。
尽管针对TME生物学方面的了解取得了快速进展,但如何将这些发现转化为针对TME的肿瘤治疗进展较为较缓。即使是最有希望的靶向TME药物,从临床研究到临床使用也需要多年的时间。为了加速探索肿瘤治疗方法,既往研究提出了一种药物再利用模式,即使用已经用于非肿瘤适应症的药物,测试其在肿瘤治疗中的疗效[10,11]。例如,流行病学和回顾性临床研究已经表明二甲双胍(Met)降低了肿瘤发生的相对风险,多个Ⅲ期临床试验正在评估将Met 用于肿瘤治疗的潜力[12,13]。Met能够通过不依赖AMP激酶(AMPK)激活的途径抑制脂肪酸氧化,导致乳腺癌细胞内甘油三酯的积累[13]。另外,Met在联合肿瘤免疫治疗方面取得了较好的效果[14],具有较好的应用前景。最近研究表明,Met也参与微生物群的调节,影响肿瘤的进展和治疗[15-17]。尽管如此,Met 的抗癌机制仍不清楚,特别是Met 对TME的影响,对肿瘤中癌细胞与间质细胞之间的双向信号转导的作用及其机制不清;且既往的研究主要关注Met对肿瘤细胞的影响。本研究除关注肿瘤细胞外,还关注Met是否可以用于靶向乳腺癌TME,使其不适合肿瘤细胞生长和侵袭;另外,本研究还确定与Met作用于乳腺癌TME相关的分子途径,以明确Met作为肿瘤治疗的潜在机制。
1 材料和方法
1.1 主要试剂
HIF-1α、AMPK、phospho-AMPK(Thr172)、phospho-SMAD2/3(Ser465/467)、SMAD2/3 抗 体(CST),TGFβ2R抗体(Abcam),β-actin抗体、二甲双胍、5-氨基咪唑-4-羧基酰胺核糖核苷酸(AICAR)、AMPK抑制剂(Compound C)、SDF-1/CXCR4 拮抗剂AMD3100、2-氧化戊二酸加氧酶抑制剂(N-oxalylglycine,OG)和 2-氧化戊二酸(2-oxoglutarate,2-OXO)(Sigma)。重组人IL-8、SDF-1(PeproTech)。重组人TGF-β1(Life Technologies)。TGFβR1 抑制剂LY364947(Tocris Bioscience)。
1.2 乳腺癌细胞株
人乳腺癌细胞MCF-7和MDA-MB-231购自中国科学院典型培养物保藏委员会上海细胞库,由本实验室保存。
1.3 细胞培养
MCF-7和MDA-MB-231细胞培养于含有10%胎牛血清及1%氨苄青霉素和链霉素的DMEM中,37 ℃,5%CO2。
1.4 CAFs提取与鉴定、培养
CAFs是从接受乳腺癌切除患者的乳腺癌组织中提取的。将所有标本的组织切成小块并消化以进一步分离成纤维细胞群。将获得的成纤维细胞接种于10%胎牛血清的DMEM培养基中,并在标准条件下(37 ℃5%CO2的湿化气氛下)培养。将提取的细胞运用形态学检查及免疫荧光检测其α-SMA 的表达情况,用于CAFs的鉴定。
1.5 条件培养基和共培养实验
将乳腺癌细胞接种于10 cm的培养皿中,每个培养皿1×106细胞,并让其生长在标准培养基中培养24 h。然后将培养基替换为低糖DMEM(添加10%胎牛血清及1%氨苄青霉素和链霉素)培养72 h。将培养物离心除去细胞和细胞碎片,将培养上清转移到新的试管中保存于-20 ℃,以后用作乳腺癌细胞条件培养基(CM)。运用乳腺癌细胞培养基培养CAFs细胞,则将每 孔3×105CAFs 细胞接种于6 孔板上,MCF-7 或MDA-MB-231细胞按1×105/孔接种于0.4 μm孔径的Transwell膜片上(图1A),共培养48 h。最后弃除乳腺癌细胞的CM或Transwell插入物,裂解CAFs并准备用于后期实验。

图1 CAFs中的p-AMPK与Met介导的乳腺癌细胞侵袭抑制有关Fig.1 P-AMPK in CAFs is associated with the metformin (Met)-mediated inhibition of breast cancer cell invasion. A:Schematic illustration of coculture of CAFs with breast cancer cells.CAFs were plated in a 6-well plate,and breast cancer cells were added to a Transwell polyester membrane insert(0.4 μm pore size).B:α-SMA expression in CAFs co-cultured with MCF-7 or MDA-MB-231 cells detected by immunofluorescence microscopy analysis(Original magnification:×400).C:Invasion assay in the coculture system,where CAFs were plated in a 6-well plate,and MCF-7 or MDA-MB-231 cells were added to Transwell polyester membrane inserts coated with Matrigel(8 μm pore size).For invasion assay,breast cancer cells were cocultured with CAFs for 24 h.D,E:Western blot analysis of p-AMPK levels in CAFs in the coculture system treated with Met (250 μmol/L),AMPK inhibitor compound C (CompC,250 μmol/L),or AMPK activator AICAR(250 μmol/L) for 72 h(*P<0.05).F:Western blot analysis of AMPK in CAFs with or without treatment with 250 μmol/L metformin for 72 h.G,H:Invasion of breast cancer MCF-7 or MDA-MB-231 cells in the coculture system(24 h)(Crystal violet staining,×100).The CAFs were pretreated with Met(250 μmol/L),CompC(250 μmol/L),orAICAR(250 μmol/L)for 72 h(*P<0.05).
1.6 侵袭实验
用6 孔板Transwell 小室,上层小室内接种1×105MCF-7或MDA-MB-231细胞,下层小室内接种3×105CAFs细胞(图1C)。乳腺癌细胞预先与CAFs细胞共培养24 h(图1A)。在各组干预条件下的Transwell小室共培养24 h后,弃去培养液,将Transwell膜上层细胞用棉签擦去,后置于4%的多聚甲醛中固定。于100×放大镜下观察10个视野计数穿膜细胞,进行统计对比侵袭能力。二甲双胍干预是在侵袭实验开始前干预72 h,然后侵袭实验过程中继续加入250 μmol/L二甲双胍干预24 h。分为对照组和Met组。
1.7 Western blot
用125 μL的RIPA裂解液将细胞充分裂解,收集蛋白,取100 μg蛋白进行转膜,转至PVDF膜上后,用一抗在4 ℃下孵育过夜,再用二抗常温下孵育2 h,后用Millipore ECL发光液显影照相。每组蛋白实验3次。
1.8 Real-time PCR
运用TRIzol试剂裂解提取细胞RNA,运用TaKaRa公司反转录试剂盒反转录为cDNA,依据实时定量PCR操作流程,借助Bio-Rad 公司iQ5 系统进行real-time PCR。使用的引物序列为HIF-1α:5'-AAGTCTAGGG ATGCAGCA-3',5'-CAAGATCACCAGCATCATG-3';IL-8:5'-TTGGCAGCCTTCCTGATTTC-3',5'-AACT TCTCCACAACCCTCCTG-3';IL-6:5'-AGTTCCTGC AGTCCAGCCTGAG-3',5'-TCAAACTGCATAGCCA CTTTCC-3';VEGF-A:5'-TTCTGCTGTCTTGGGTGC AT-3',5'-TGTCCACCAGGGTCTCG ATT-3';SDF-1:5'-GTGTCACTGGCGACACGTAG-3',5'-TCCCATC CC ACAGAGAGAAG-3';PDGF-A:5'-GAGTGAGGATT CTTTGGACACC-3',5'-CTTCTTC CTGACGTATTC CACC-3';GAPDH:5'-ACCACAGTCCATGCCATCA C-3',5'-TCCACCACCCTGTTGCT GAT-3';以GAPDH为内参,用2-ΔΔCt计算靶基因mRNA表达水平。
1.9 ELISA检测SDF-1和IL-8
实验分为3组:对照组(CAFs单独培养组)、共培养组(CAFs+MCF-7 CM 或CAFs+MDA-MB-231 CM组)、共培养+250 μmol/L Met组,收集CAFs的培养上清于1500 r/min(425×g)离心5 min,弃去细胞及细胞碎片,取离心后的上清储存于-80 ℃,以备用做ELISA测定SDF-1和IL-8的分泌量。用ELISA试剂盒(R&D)根据说明检测CAFs分泌的SDF-1和IL-8水平。
1.10 AMPK和HIF-1α表达水平的调控
通过慢病毒感染实现AMPK或HIF-1α的稳定下调。阴性对照shRNA 慢病毒颗粒(sh-control;sc-108080),靶向AMPK mRNA的shRNA(sh-AMPK;sc-29673 v),和靶向HIF-1α mRNA的shRNA(sh-HIF-1α;sc-35561-V)(Santa Cruz)。AMPK和HIF-1α的抑制效率采用Western blot检测蛋白表达水平。HIF-1α的过表达是通过稳定转染HIF-1α(HA-HIF1alpha P402A/P564A-pBabe-puro)质粒实现的。依据说明运用脂质体转染AMPK或HIF-1α干扰慢病毒颗粒或高表达质粒。转染成功后,运用嘌呤霉素筛选稳定转染株。
1.11 统计学分析
采用SPSS18.0对数据进行统计学分析,每组实验至少进行3次,计量资料以均数±标准差表示,组间差异的比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 Met通过上调p-AMPK表达抑制CAFs诱导的乳腺癌细胞侵袭
共培养模型(图1A),α-SMA 免疫荧光染色(图1B),Transwell实验模型(图1C)。与对照组相比,Met组中CAFs细胞的p-AMPK(Thr172)的表达水平升高(P<0.05,图1D~E),AMPK的表达水平无变化(P>0.05,图1F)。与对照组相比,Met组及AMPK激动剂AICAR组中CAFs诱导的MCF-7或MDA-MB-231乳腺癌细胞侵袭能力下降(P<0.05);而与Met组相比,Met+AMPK抑制剂CompC组中CAFs诱导的MCF-7或MDA-MB-231乳腺癌细胞侵袭能力提高(图1G~H)。
2.2 Met通过降低IL-8和SDF-1的表达抑制乳腺癌细胞侵袭
与对照组(CAFs 单独培养组)相比,共培养组(CAFs+MCF-7 CM或CAFs+MDA-MB-231 CM组)中CAFs的IL-8和SDF-1的mRNA的表达水平增高(P<0.05);而与共培养组相比,共培养+Met组中CAFs的IL-8 和SDF-1 的mRNA 的表达水平降低(P<0.05,图2A~C);同样地,各组CAFs中IL-8和SDF-1的分泌量也存在相同趋势(P<0.05,图2B)。
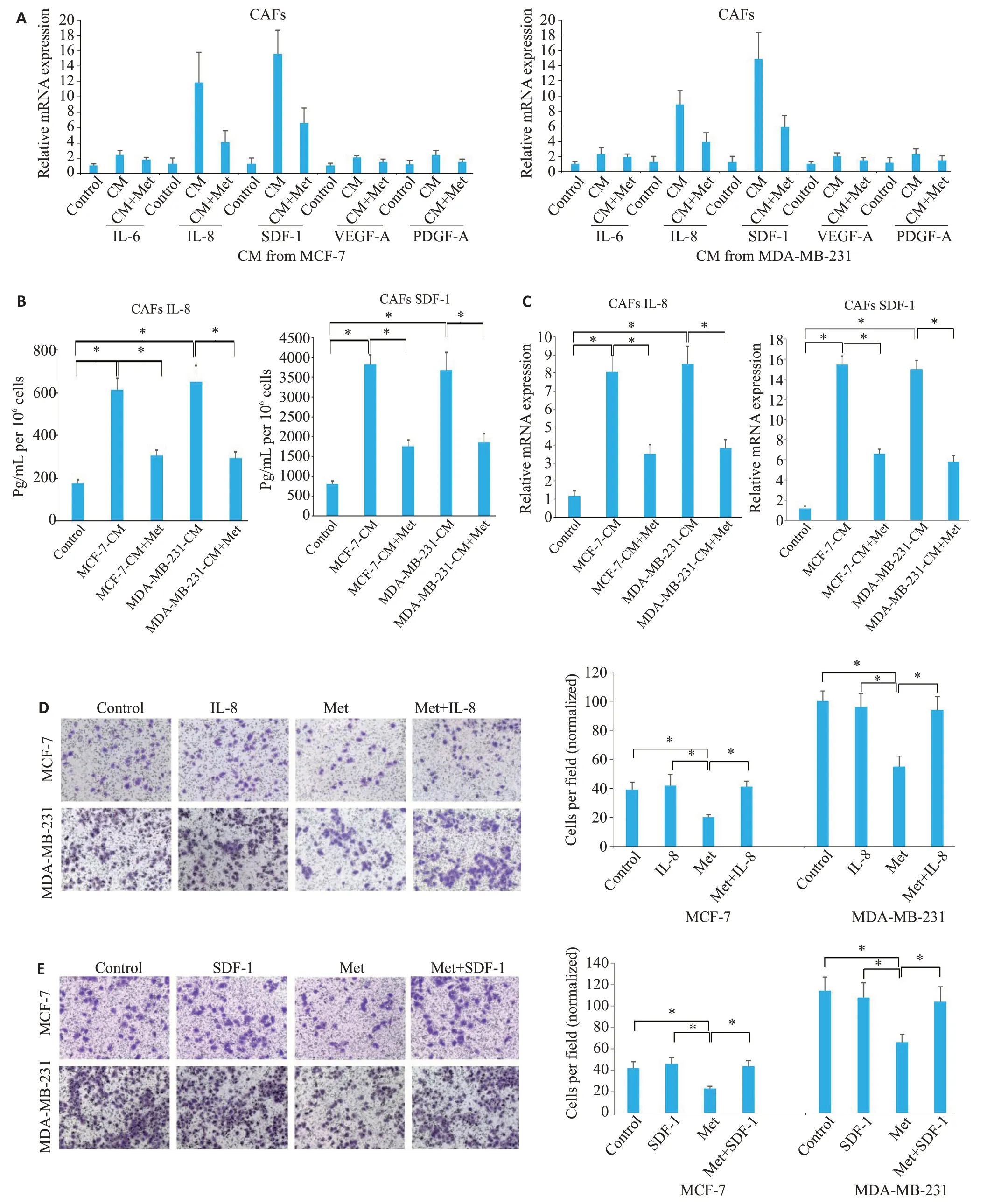
图2 在体外实验中,Met通过抑制CAFs中IL-8和SDF-1的表达来抑制乳腺癌细胞侵袭Fig.2 Metformin inhibits breast cancer cell invasion by inhibiting IL-8 and SDF-1 expressions in the CAFs.A: CAFs were treated with conditioned medium(CM)from MCF-7 or MDA-MB-231 cells with or without 250 μmol/L metformin treatment for 72 h,and IL-6,IL-8,SDF-1,VEGF-A,and PDGF-A mRNA expressions in CAFs were detected with RT-qPCR.B:Detection of IL-8 and SDF-1 production with ELISAin CAFs treated with MCF-7 or MDA-MB-231 cell CM.CAFs were pretreated with 250 μmol/L Met for 72 h before CM exposure(*P<0.05).C:RT-qPCR for detecting IL-8 and SDF-1 mRNAexpressions in CAFs pretreated with 250 μmol/L of Met for 72 h prior to exposure to MCF-7 or MDA-MB-231 cell CM(*P<0.05).D:Invasion of MCF-7 or MDA-MB-231 cells(24 h)cocultured with CAFs with or without Met pretreatment (250 μmol/L for 72 h) or simultaneous treatment and 150 ng/mL recombinant human IL-8 protein (*P<0.05)(Crystal violet staining,×100).E:Invasion of MCF-7 or MDA-MB-231 cells(24 h)cocultured with CAFs with or without Met pretreatment(250 μmol/L for 72 h)or simultaneous treatment with 150 ng/mLrecombinant human SDF-1 protein(*P<0.05)(Crystal violet staining,×100).
与对照组相比,Met 组中CAFs 诱导的MCF-7 或MDA-MB-231乳腺癌细胞侵袭下降(P<0.05),而加入外源性重组IL-8或SDF-1组中CAFs诱导的MCF-7或MDA-MB-231乳腺癌细胞侵袭升高(P<0.05);与Met组相比,Met+IL-8 或Met+SDF-1 组中CAFs 诱导的MCF-7 或MDA-MB-231 乳腺癌细胞侵袭升高(P<0.05);Met可以抑制CAFs诱导的MCF-7或MDA-MB-231乳腺癌细胞侵袭(P<0.05,图2D~E)。
2.3 Met抑制乳腺癌细胞所诱导的CAFs-HIF-1α表达
与对照组相比,共培养+PBS组中CAFs-HIF-1α的表达水平升高;而与共培养+PBS组相比,共培养+Met组中HIF-1α的表达水平下降(图3A)。而当CAFs被转染HIF-1α高表达质粒时,PBS组与Met组间HIF-1α的表达水平差异无统计学意义(图3B)。在过表达HIF-1α的CAFs中,PBS组与Met组IL-8和SDF-1的mRNA表达水平均升高(P<0.05),两组之间的差异无统计学意义(P>0.05,图3C)。
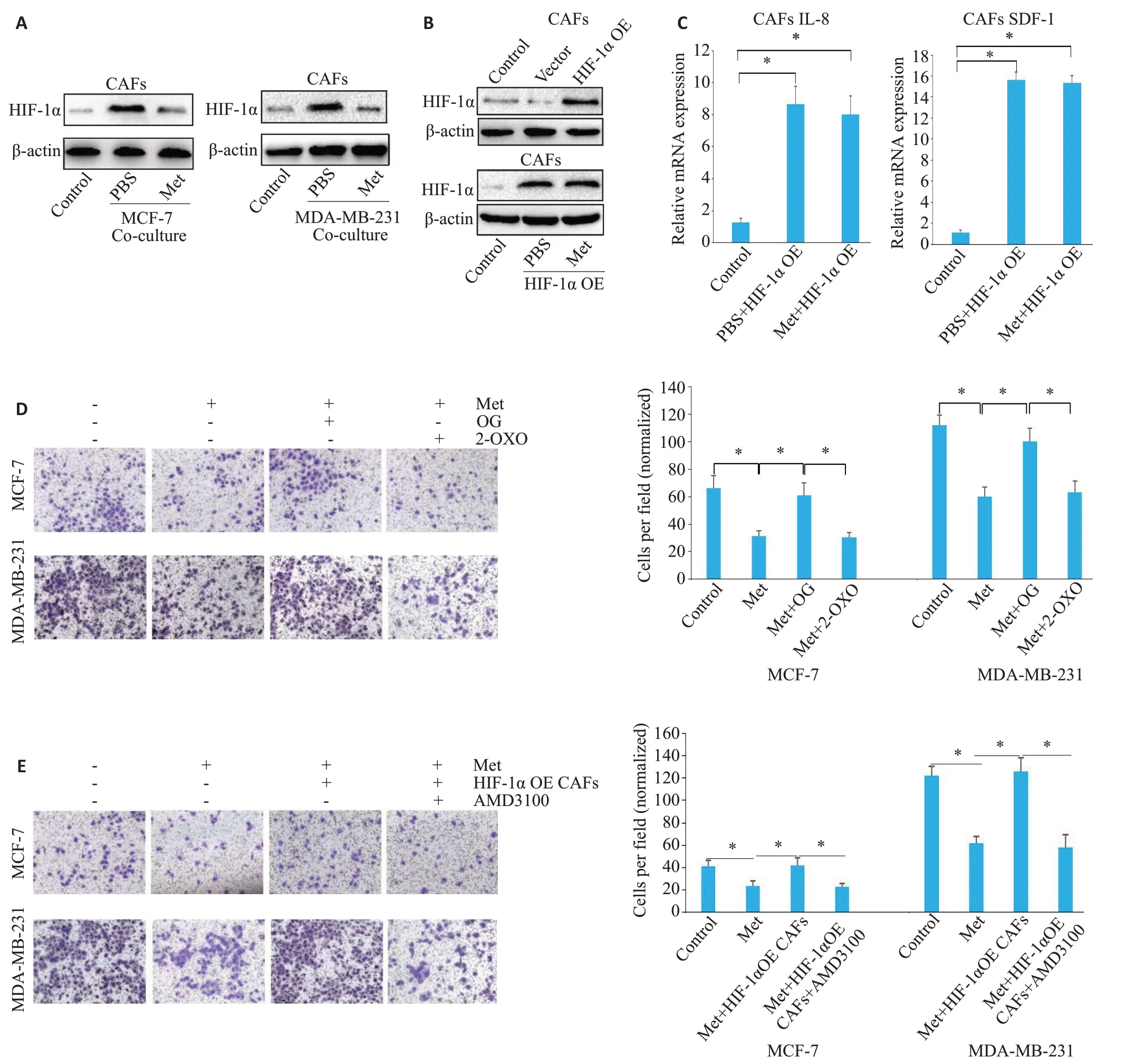
图3 Met抑制人乳腺癌细胞诱导的CAFs中HIF-1α的表达Fig.3 Metformin inhibits HIF-1α expression in CAFs cocultured with breast cancer cell invasion.A:Western blotting of HIF-1α protein in CAFs cocultured with MCF-7(left)or MDA-MB-231(right)cells in the presence of Met(1 mmol/L,48 h).B:Western blotting of HIF-1α in CAFs constitutively expressing a stable form of HIF-1α (P402A/P564A substitutions) (above) and treated with Met (1 mmol/L,48 h)(below); C: RT-qPCR of IL-8 (left) and SDF-1 (right) mRNA expression in CAFs transfected with a HIF-1α overexpression plasmid(P402A/P564A)with or without Met treatment(*P<0.05).D:Invasion of MCF-7 or MDA-MB-231 cells(24 h)in a coculture system with CAFs pretreated with Met (250 μmol/L for 72 h) in the presence of OG (1 mmol/L) and 2-OXO (5 mmol/L) (*P<0.05)(Crystal violet staining,×100). E: Invasion of MCF-7 or MDA-MB-231 cells (24 h) in a coculture system containing control or CAFs constitutively expressing a stable form of HIF-1α(P402A/P564A)treated with Met(pretreatment of CAFs with 250 μmol/L for 72 h),with concurrent exposure to SDF-1/CXCR4 antagonist(2 μg/mL)during the invasion assay(*P<0.05)(Crystal violet staining,×100).
运用OG竞争抑制脯氨酰羟化酶(PHD)的活性进而抑制HIF-1α的降解,从而稳定HIF-1α的表达。与对照组相比,Met组中MCF-7或MDA-MB-231细胞侵袭能力下降(P<0.05);而与Met 组相比,Met+OG 组中MCF-7或MDA-MB-231细胞侵袭能力升高(P<0.05,图3D)。另外,运用2-OXO激活PHD进而促进HIF-1α的降解后,与Met+OG组相比,Met+2-OXO组中MCF-7或MDA-MB-231细胞侵袭能力下降(P<0.05,图3D)。同样地,与Met组相比,Met+HIF-1α过表达组中MCF-7或MDA-MB-231细胞侵袭能力升高(P<0.05);与Met+HIF-1α过表达组相比,Met+HIF-1α过表达+SDF-1受体CXCR4 抑制剂AMD3100 组中MCF-7 或MDA-MB-231细胞侵袭能力下降(P<0.05,图3E)。
2.4 Met通过上调p-AMPK发挥抑制CAFs-HIF-1α表达的作用
AMPK shRNA 和HIF-1α shRNA被分别用于抑制AMPK 和HIF-1α的表达,敲低AMPK 可以抑制p-AMPK的表达(图4A)。与对照组(CAFs单独培养组)相比,共培养组(CAFs+MCF-7 CM 或CAFs+MDAMB-231 CM组)中CAFs-HIF-1α的表达水平升高;与共培养组相比,共培养+Met组中CAFs的HIF-1α的表达水平降低;与共培养+Met组相比,共培养+Met+AMPK shRNA组中CAFs的HIF-1α的表达水平升高(图4B)。
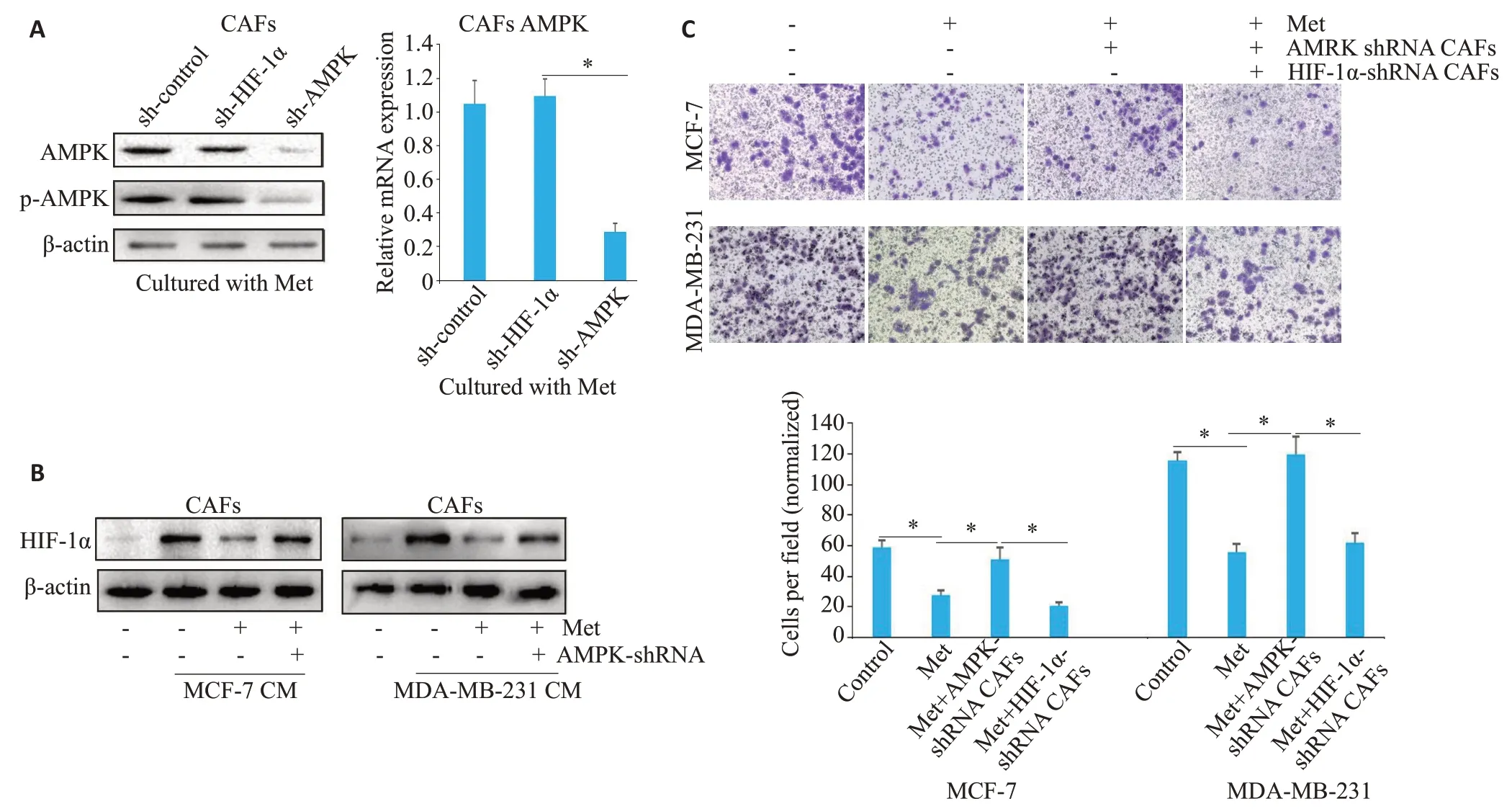
图4 Met通过下调p-AMPK水平抑制CAFs中HIF-1α的表达Fig.4 Metformin inhibits HIF-1α expression in CAFs by downregulating p-AMPK.A: Western blot analysis of AMPK protein expression(left)and RT-qPCR analysis of AMPK mRNA expression(right)in CAFs transfected with AMPK or HIF-1α shRNA in the presence of 1 mmol/L metformin (*P<0.05). B: Western blotting of HIF-1α protein expression in CAFs transfected with sh-AMPK and treated with Met(250 μmol/L,72 h)followed by addition of MCF-7 or MDA-MB-231 cell CM.C:Invasion of MCF-7 or MDA-MB-231 cells(24 h)in a coculture system containing control or CAFs(transfected with AMPK or HIF-1α shRNA)treated with Met(pretreatment of CAFs with 250 μmol/Lfor 72 h),*P<0.05(Crystal violet staining,×100).
在MCF-7或MDA-MB-231侵袭实验中,与对照组相比,Met组中MCF-7或MDA-MB-231侵袭能力下降(P<0.05);与Met 组相比,Met+AMPK shRNA 组中MCF-7 或MDA-MB-231 侵袭能力上调(P<0.05);与Met+AMPK shRNA组相比,Met+HIF-1α shRNA组中MCF-7或MDA-MB-231侵袭能力下降(P<0.05,图4C)。
2.5 Met抑制TGF-β上调的HIF-1α表达
在MCF-7和MDA-MB-231细胞中,与对照组相比,Met组中TGF-β2R的表达显著下降,且TGF-β下游基因p-SMAD2/3表达下调,同样TGF-β1 mRNA水平减少(P<0.05),而SMAD2/3表达水平差异无统计学意义(P>0.05,图5A~B)。在CAFs中,与对照组相比,共培养+PBS组(CAFs+MCF-7 CM或CAFs+MDA-MB-231 CM 组+PBS)中p-SMAD2/3 表达上调;而与共培养+PBS组相比,共培养+Met组和共培养+TGF-βR抑制剂组中p-SMAD2/3表达下调;Met或TGF-βR抑制剂均不影响TGF-βR2和SMAD2/3的表达水平(图5C)。
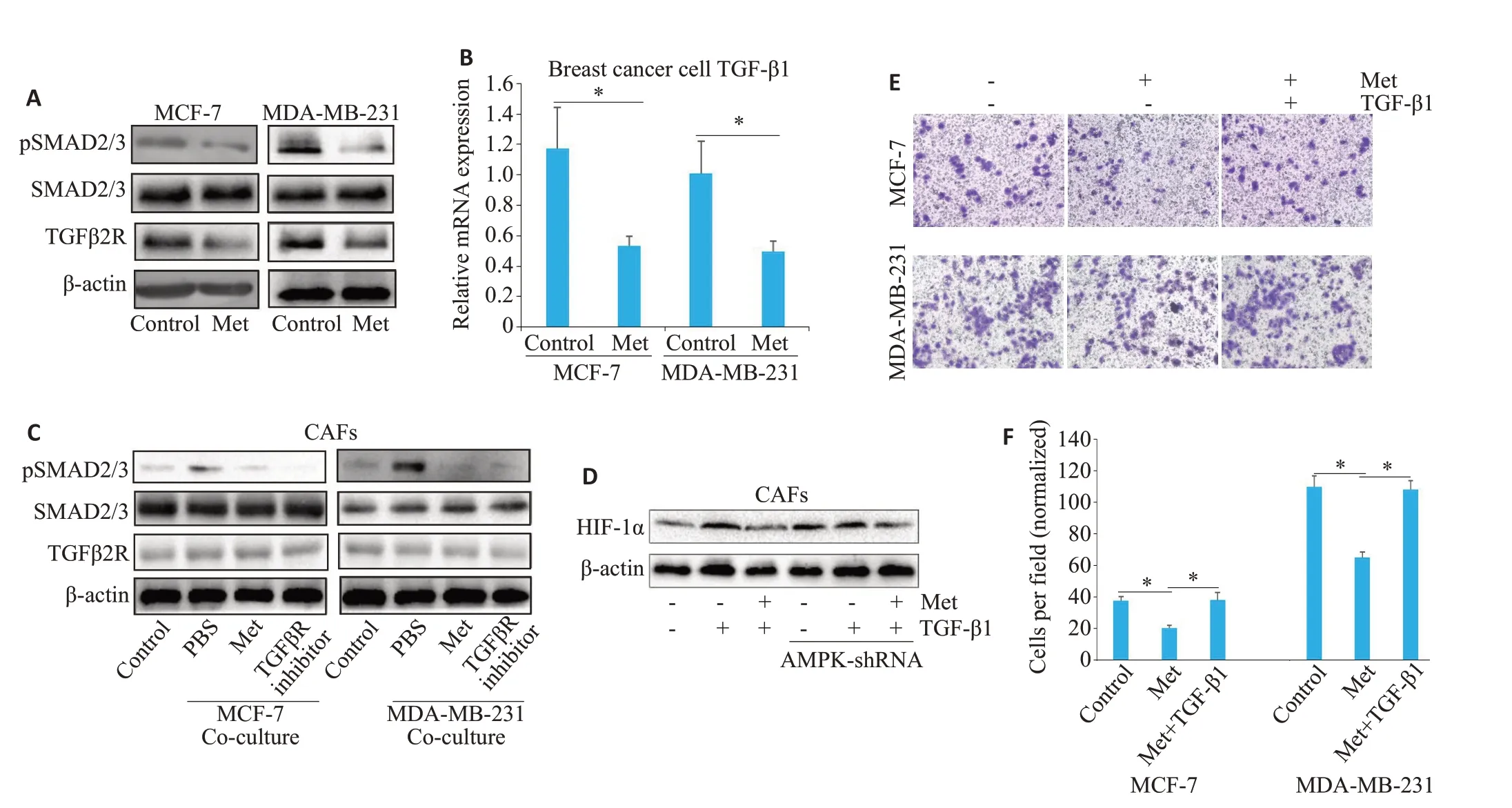
图5 Met靶向乳腺癌TGF-β1信号通路,抑制CAFs中HIF-1α的表达Fig.5 Metformin targets breast cancer TGF-β1 signaling to suppress HIF-1α expression in CAFs.A:Western blotting of TGF-βrelated proteins in MCF-7 or MDA-MB-231 cells treated with Met(1 mmol/L,72 h).B:RT-qPCR of TGF-β1 mRNA expression in MCF-7 or MDA-MB-231 cells with Met treatment (1 mmol/L,72 h; P<0.05). C: Western blotting of TGF-β-related proteins in CAFs cocultured with MCF-7 or MDA-MB-231 cells in the presence of Met (1 mmol/L,48 h). D: Western blotting of HIF-1α expression in CAFs transfected with sh-AMPK and treated with Met(250 μmol/L,72 h)followed by recombinant human TGF-β1 protein(10 ng/mL).E,F:Invasion of MCF-7 or MDA-MB-231 cells(24 h)in cocultured with CAFs pretreated with 250 μmol/L of Met for 72 h followed by TGF-β1(*P<0.05)(Crystal violet staining,×100).
在未敲除AMPK的CAFs中,与对照组相比,TGFβ1组(加入外源性重组TGF-β1蛋白)中CAFs-HIF-1α蛋白的表达水平显著升高;与TGF-β1组相比,Met+TGF-β1组中CAFs-HIF-1α蛋白的表达水平下降;在敲除AMPK的CAFs中,对照组与TGF-β1组间CAFs-HIF-1α蛋白的表达水平差异无统计学意义;与TGF-β1组相比,Met+TGF-β1 组中CAFs-HIF-1α蛋白的表达水平仅轻微下降;(图5D)。在两种乳腺癌细胞中,与对照组相比,Met组中MCF-7或MDA-MB-231侵袭能力下降(P<0.05);与Met 组相比,Met+TGF-β1 组,Met 组中MCF-7 或MDA-MB-231侵袭能力上调(P<0.05,图5E~F)。
3 讨论
越来越多证据表明TME对于肿瘤生长至关重要[18,19],而这也为针对肿瘤细胞和间质细胞之间相互作用的治疗策略提供了机会。本研究提示Met通过抑制间质细胞和肿瘤细胞之间相互作用抑制肿瘤进展,而其中机制可能是Met能够抑制肿瘤所诱导的CAFs重编程,下调CAFs中HIF-1α信号通路的表达,减弱乳腺癌细胞的侵袭能力。
为了明确Met如何靶向乳腺癌TME中促癌基因重编程,本研究使用了几种方法同时关注肿瘤细胞和CAFs。结果表明,将CAFs暴露于乳腺癌细胞上清,抑制了CAFs 中的PHD,导致CAFs 中HIF-1α的表达增加。既往研究指出,Met可以激活PHD抑制间皮细胞的HIF-1α表达,进而抑制HIF-1α诱导的IL-8表达,以此抑制卵巢癌细胞侵袭[2]。与该文献一致,本研究发现Met抑制乳腺癌细胞所诱导的CAFs中HIF-1α表达,从而抑制其下游SDF-1和IL-8的表达,靶向乳腺癌TME中的基质细胞-肿瘤细胞的相互作用;本研究的新发现是Met所诱导的上述过程是由p-AMPK的上调介导的,增加了此领域的研究认识。
通过关注TME,我们确定了SDF-1和IL-8是在这种微环境中作为Met重要靶点的细胞因子。与既往研究结果一致,Met能够抑制成纤维细胞中核因子-κb依赖的IL-6分泌[20],并可抑制间质细胞中琥珀酰辅酶a连接酶依赖的IL-8分泌[2],本研究发现Met可以抑制暴露于乳腺癌细胞的上清的CAFs中SDF-1和IL-8的分泌量,这是通过p-AMPK抑制HIF-1α的表达实现的,这也是对既往认知的拓展。既往研究表明,SDF-1和IL-8受体在几种癌症中表达上调[21,22],本研究所得结果值得在正在进行的Met临床试验中进一步评估这些细胞因子作为预测性生物标志物。IL-8及IL-6均为免疫相关因子,越来越多的研究表明,Met能够改变肿瘤免疫微环境[23-25],进而发挥抗肿瘤作用,如Met激活直肠癌患者CD8+T细胞对抗肿瘤,发挥抗肿瘤作用[26];Met可以增加三阴性乳腺癌肿瘤浸润型淋巴细胞比例[27]。Met对肿瘤微环境的调节作用可能与其能够降低瘤内缺氧有关[25,28]。对此,后续研究将继续关注Met对于乳腺癌肿瘤免疫微环境的影响。
防止间质重编程可能是Met抗肿瘤及治疗其他疾病的重要机制。在腹膜纤维化中,Met可以通过抑制TGF-β阻断腹膜间皮细胞的重编程信号[29]。本研究表明Met可以靶向TGF-β信号依赖的肿瘤-间质交互作用;既往研究表明,TGF-β可通过抑制PHD 表达来稳定HIF-1α[30,31],而本研究表明在Met的背景下,p-AMPK在TGF-β1 稳定HIF-1α的表达中起关键作用。CAFs 中HIF信号的减少可能构成Met阻止癌症进展的机制,在多种肿瘤中HIF-1α的高表达与较短的总生存期有关[32-35],而且HIF-1α高表达的乳腺癌患者。总生存期与无进展生存期均较短。本研究结果显示了CAFs中HIF信号通路在乳腺癌进展中的关键作用,同时它也是Met的关键作用点。
综上,本研究结果表明Met 能够下调CAFs 中HIF-1α信号通路的表达,削弱乳腺癌细胞的侵袭能力,另外,SDF-1和IL-8是肿瘤微环境中Met重要的靶点细胞因子,并且Met可以靶向TGF-β信号依赖的肿瘤-间质交互作用。既往的研究聚焦Met对于肿瘤细胞本身的作用,而本研究则提示未来研究需要关注Met对于肿瘤毗邻的间质细胞及其与肿瘤细胞之间交互作用的影响。进一步了解体内Met对肿瘤间质交互作用的影响需要借助于能够模拟疾病进展的临床前模型,未来仍需前瞻性的随机对照临床研究才能真正证实Met的抗肿瘤作用及其对肿瘤微环境的影响。
